
Жизнь и судьба: визуализируем клеточный состав ткани
26 марта 2021
Жизнь и судьба: визуализируем клеточный состав ткани
- 1905
- 0
- 14
Аденокарцинома легких при многоцветном окрашивании. Изображение получено с помощью имиджинговой системы MACSima компании Miltenyi Biotec.
-
Автор
-
Редакторы
-
Иллюстратор
Методы, которыми пользуются клеточная биология и гистология для визуализации белков в тканях, постоянно совершенствуются, и на сегодняшний день позволяют увидеть локализацию более ста маркеров одновременно. Это помогает решать интересные задачи, в первую очередь, в онкологии, «наблюдая» за опухолевыми клетками в естественной среде обитания. Эта статья — краткий обзор новейших методик визуализации клеток и перспектив, которые они открывают.
Ультрасовременные методы
Методы, которыми оперирует современная наука, постоянно совершенствуются. Некоторые области развиваются настолько стремительно, что порой даже специалистам сложно уследить за новейшими приборами и модификациями методик. Так происходит, например, в геномике. Другие же области (такие как гистология и связанные с ней световая и флуоресцентная микроскопия) развиваются куда медленнее, но всё равно расширяются и обзаводятся более высокопроизводительными методами. В статьях нового спецпроекта (он продолжает наш хит — «12 биологических методов в картинках») мы хотим рассказать, какие методы помогают ученым совершать новые открытия сегодня, и чего нам ждать в будущем.

Партнер публикации — компания ООО «Биокоммерц»: поставщик современного оборудования, реагентов, расходных материалов и сервисной поддержки в сфере клеточных технологий, проточной цитометрии и продукции клинического применения.
Команда квалифицированных и опытных специалистов при работе с клиентами придерживается индивидуального подхода и предоставляет современные решения для реализации смелых научных проектов. Среди клиентов ООО «Биокоммерц» — крупнейшие институты и научные центры страны, ведущие фармацевтические и биотехнологические компании.
Все знают, что тело человека состоит из тканей, а ткани — из клеток. Именно их характеристики, в основном, и определяют ее функциональность. Однако любая ткань — это не просто набор разных клеток, а сложно структурированная система, в которой, порой, важную роль играет не только то, кто именно ее составляет, но и как и с кем взаимодействует. Особенно хорошо это видно, если посмотреть на опухоль.
Опухоль — это тоже ткань, которая вырастает в не предназначенном ей месте, тесня соседей. Ее клетки в результате мутаций приобретают способность неограниченно делиться, и также расползаться по организму, прорастая в соседнюю ткань и путешествуя в отдаленные органы, где они дают начало метастазам. Казалось бы, всё самое главное для роста и развития опухолей заложено непосредственно в самих клетках, но это не так. Для успешного роста опухолевым клеткам необходимо взаимодействовать и с внеклеточным матриксом, и с клетками нормальной ткани, и с иммунными клетками, причем нередко успешность роста напрямую зависит от этих контактов. Опухолевое микроокружение [1] — совокупность клеток и молекул, ими производимых, — важнейшая составляющая успеха роста новообразования. Например, то, какие именно иммунные клетки соседствуют с опухолью, зачастую определяет ее агрессивность и стратегию лечения. «Опухолевые разговоры» могут происходить и более опосредованно, например, через экзосомы — маленькие пузырьки с разнообразным содержимым, которое диктует клетке, что ей делать [2].
Один из основных методов оценки опухоли в клинической практике — иммуногистохимия (ИГХ), применяющийся уже 80 лет, начиная с 1941 года. Он позволяет визуализировать интересный нам белок, находящийся в опухолевой клетке или в клетке микроокружения. По получившемуся изображению можно судить об интенсивности его синтеза или о количестве интересующих нас клеток. Принцип ИГХ прост: кусочек опухолевой ткани тонко нарезают, срезы помещают на стекло и далее окрашивают антителами, специфичными к определенному белку-антигену [3]. В результате под световым микроскопом клетки, несущие антиген, отличаются по цвету от тех, у кого он отсутствует (рис. 1). Важно, что на одном срезе в этом случае можно окрасить клетки только по одному маркеру-антигену . Но что же делать, если нужно рассмотреть несколько маркеров, причем одновременно?
В клинической практике срезы ткани так и называют — «стёкла». — Ред.
В широком смысле маркером называется молекула, количество которой необходимо оценить. В случае ИГХ маркер — это антиген для визуализирующих антител. — Ред.
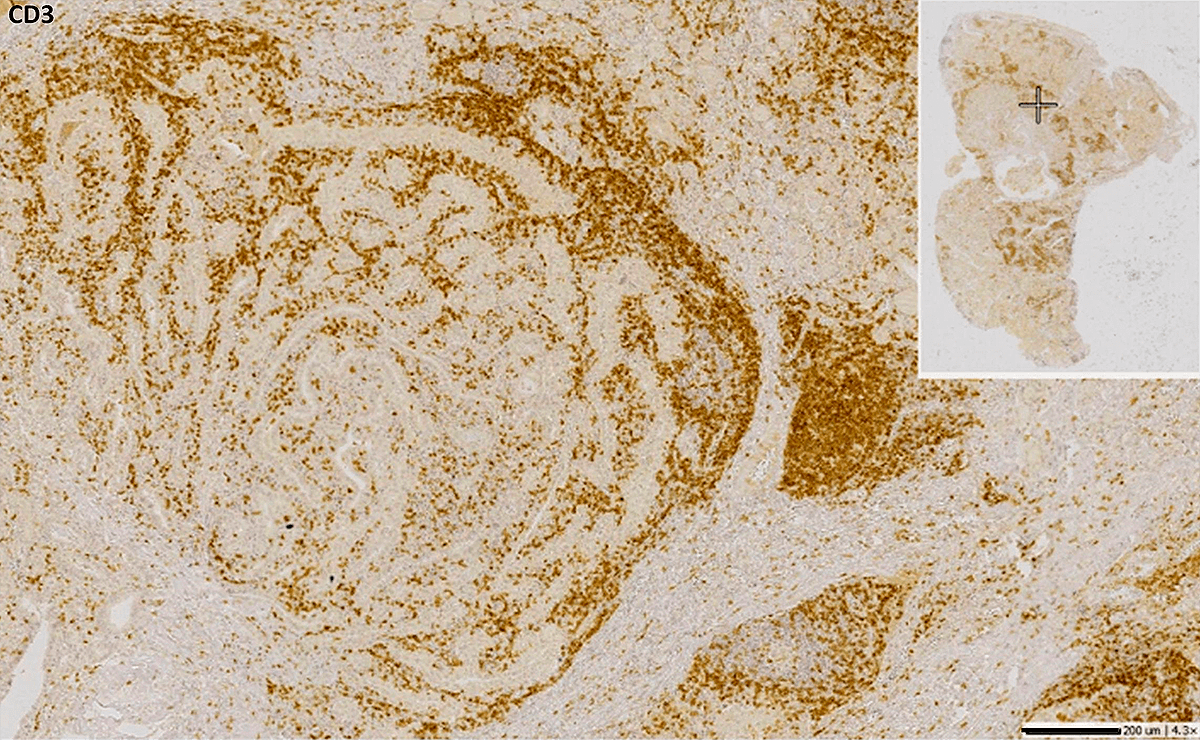
Рисунок 1. Пример традиционного ИГХ-анализа опухолевой ткани щитовидной железы, в котором детектировали CD3 — маркер Т-лимфоцитов. В качестве красителя использовали DAB (диаминобензидин), поэтому Т-лимфоциты, находящиеся среди опухолевых клеток, окрашены в коричневый цвет. Рядом с ними неокрашенные — опухолевые — клетки, которые можно распознать по различным цитологическим особенностям и производству маркеров, которые также можно визуализировать при помощи ИГХ.
экспериментальные данные автора статьи
Такая задача, кстати, нередко стоит перед исследователем. Скажем, необходимо посмотреть колокализацию двух маркеров, рецептора и лиганда, двух типов клеток (например, Т-лимфоцитов и клеток опухоли) или распознать определенный подтип клеток, который никак нельзя выделить по наличию только одного антигена. Так происходит, в том числе, с клетками иммунной системы.
Иммунные клетки — чрезвычайно важные игроки опухолевого микроокружения, поэтому их характеристика важна для понимания прогноза пациента и перспектив его лечения. Особенно в эпоху блокаторов иммунологических чекпоинтов [4], успешно применяющихся в онкологии. Если иммунных клеток в опухоли много и они готовы быть реактивированы для уничтожения опухолевых клеток, то такие препараты могут отлично сработать. Опухоли, которые вызывают сильный иммунный ответ, называются иммуногенными [5]. К ним относятся, например, меланома, рак легких и рак почки.
Самое простое решение — взять несколько срезов, сделанных последовательно, и каждый из них покрасить своим антителом. Так, как правило, и делается в рутинной клинической практике. Понять взаимное расположение маркеров на таких пошаговых срезах легко, но, конечно, с допущением: надо помнить, что срез имеет толщину в несколько микрометров, и каждый последующий, соответственно, проходит по другим, хоть и соседним, клеткам. На рисунке 2 — окрашивание пошаговых срезов лимфоидного фолликула на основные маркеры иммунных клеток. По ним можно увидеть характерное строение и взаимное расположение клеток.
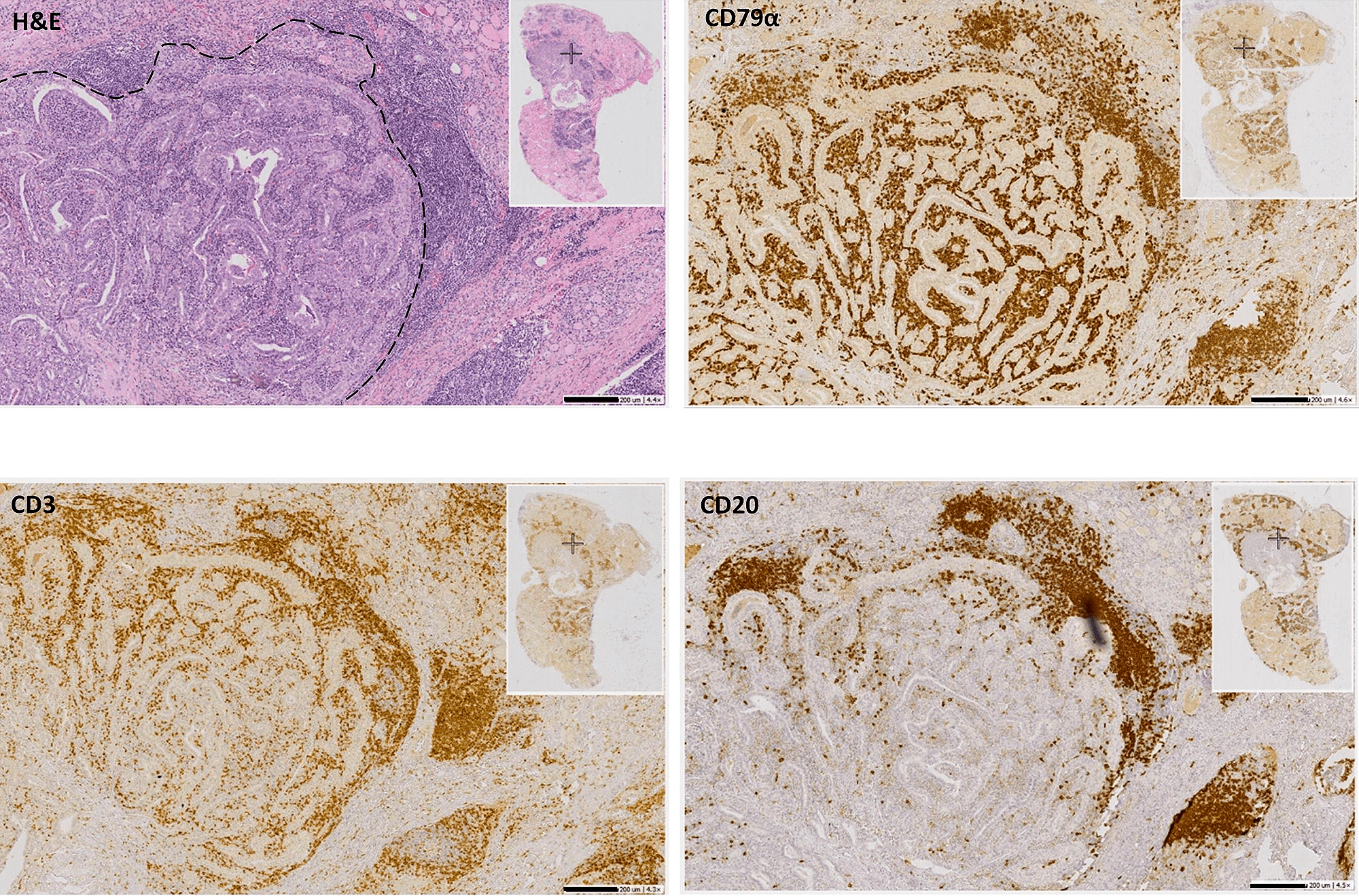
Рисунок 2. Визуализация основных типов иммунных клеток в раке щитовидной железы. H&E — окрашивание гематоксилином-эозином; CD3 — Т-лимфоциты; CD79a — все B-клетки; CD20 — зрелые В-клетки.
экспериментальные данные автора статьи
Второе возможное решение — одновременное окрашивание антителами с двумя разными хромогенами — соединениями, обусловливающими цвет получившегося окрашивания. Тогда на одном и том же срезе можно посмотреть выработку двух маркеров и корректно сравнить их между собой. Но, конечно, для полноценного анализа двумя маркерами не обойдешься.
И тут на помощь приходит флуоресцентная микроскопия! Почему бы не окрашивать срез сразу целым набором из нескольких антител с различными флуоресцентными метками? Тогда картины окрашивания каждого из них можно наложить друг на друга и увидеть «портреты» отдельных клеток по нескольким маркерам (рис. 3)! Кроме того, громадным преимуществом использования флуорофоров является чувствительность: для того, чтобы увидеть свечение, достаточно всего 50 сигналов на кубический микрометр!
Флуорофор [3], [8], или флуоресцентная метка, прикрепленная к визуализирующему антителу, способна при возбуждении лазером определенной длины волны излучать свет определенного спектра. О микроскопии подробно рассказано в одноименной статье цикла «12 методов в картинках» [9]. — Ред.
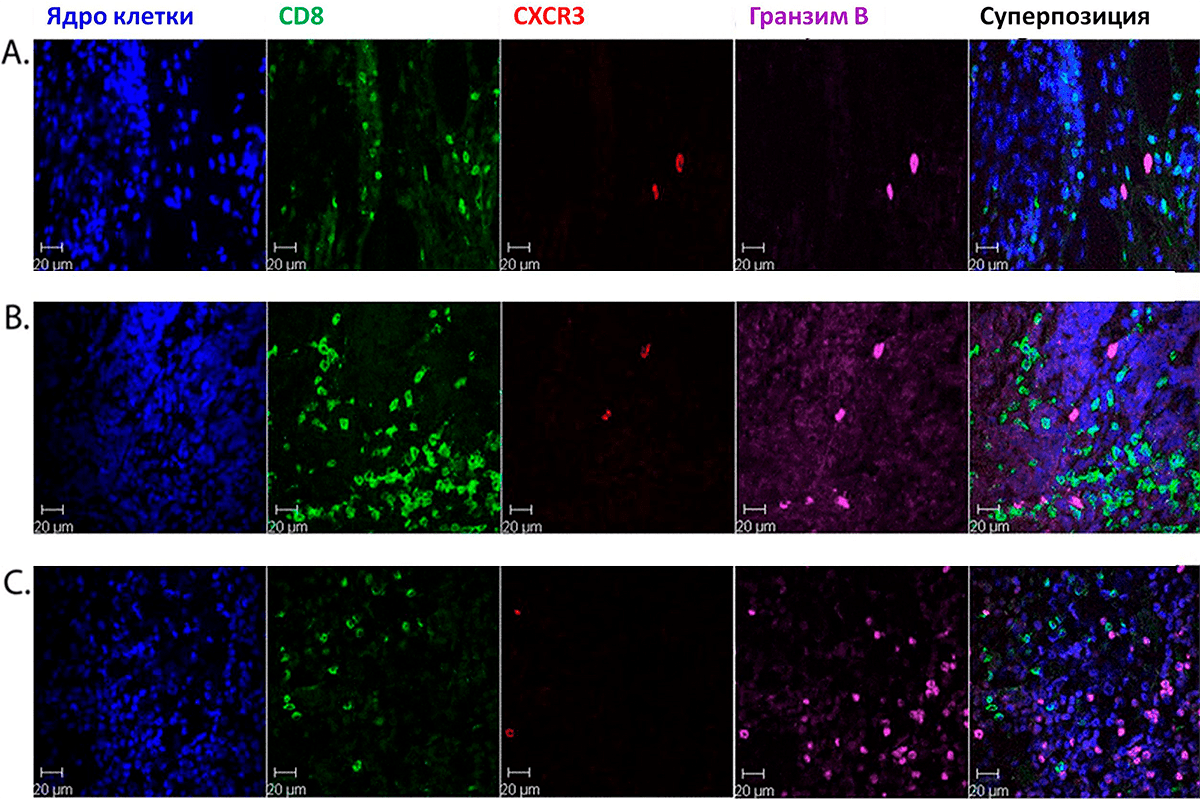
Рисунок 3. Окрашивание четырех ассоциированных с Т-лимфоцитами маркеров в ткани карциномы из клеток Меркеля при помощи флуоресцентно меченных антител. CD8 — рецептор на поверхности Т-киллеров; CXCR3 — хемокин, экспонируемый в первую очередь на активированных Т-лимфоцитах; гранзим Б — важнейший белок, участвующий в процессе контактного цитолиза. По этому изображению можно судить, что в опухолевой ткани есть Т-лимфоциты, способные уничтожить опухоль методом контактного цитолиза.
К сожалению, даже флуоресцентная микроскопия бессильна перед сложными случаями, когда количество маркеров очень велико. Дело в том, что со временем флуоресцентный сигнал затухает, и бесконечно переключать лазеры для того, чтобы «подсвечивать» разные метки, не получится. Кроме того, спектры флуорофоров, в идеале, не должны перекрывать друг друга, чтобы картина, получившаяся при использовании одного, не интерферировала с другим. Это также ограничивает число меток. Поэтому, как правило, при стандартном флуоресцентном окрашивании детектируют лишь 3–4 маркера за эксперимент.
Итак, одновременно визуализировать на срезе ткани множество маркеров не под силу ни традиционной ИГХ с использованием красителей, ни ИГХ с визуализацией при помощи антител с флуорофорами. Что же делать? Использовать современные высокотехнологичные решения! В их основе тоже лежит детекция флуоресцентного сигнала, однако система его генерации здесь устроена намного более хитроумно.
Вариант 1: тирамид-сигнальная амплификация
Тирамид-сигнальная амплификация (TSA) — метод, благодаря которому можно окрасить срез на восемь маркеров одновременно. Процедура предельно проста: это классическая ИГХ с чуть видоизмененными конечными этапами. В качестве вторичных — визуализирующих — антител используются антитела, меченные пероксидазой хрена, после чего добавляется конъюгат тирамида с флуорохромом. Тирамид — органическое вещество, которое в присутствии пероксидазы в силу ее ферментативной активности присоединяется к органическим молекулам вокруг (в данном случае к первичному, вторичному антителу и даже самому маркеру: рис. 4, рис. 7). Циклы окрашивания-детекции повторяются последовательно для каждого из маркеров. В результате системы на основе TSA в 10–100 раз чувствительнее стандартной флуоресцентной микроскопии и позволяют использовать первичные антитела одного видового происхождения, поскольку в этом случае нет перекрестных реакций. На этом принципе основано решение Akoya Phenoptics: комбинация наборов реагентов Opal, платформ Mantra и Vectra 3, а также программного обеспечения для корректного анализа получившихся изображений позволяет решать такие задачи, как оценка эффективности противоопухолевых лекарств по уменьшению количества опухолевых клеток или выделение субпопуляций опухолевых клеток по экспонированию того или иного маркера (рис. 5).
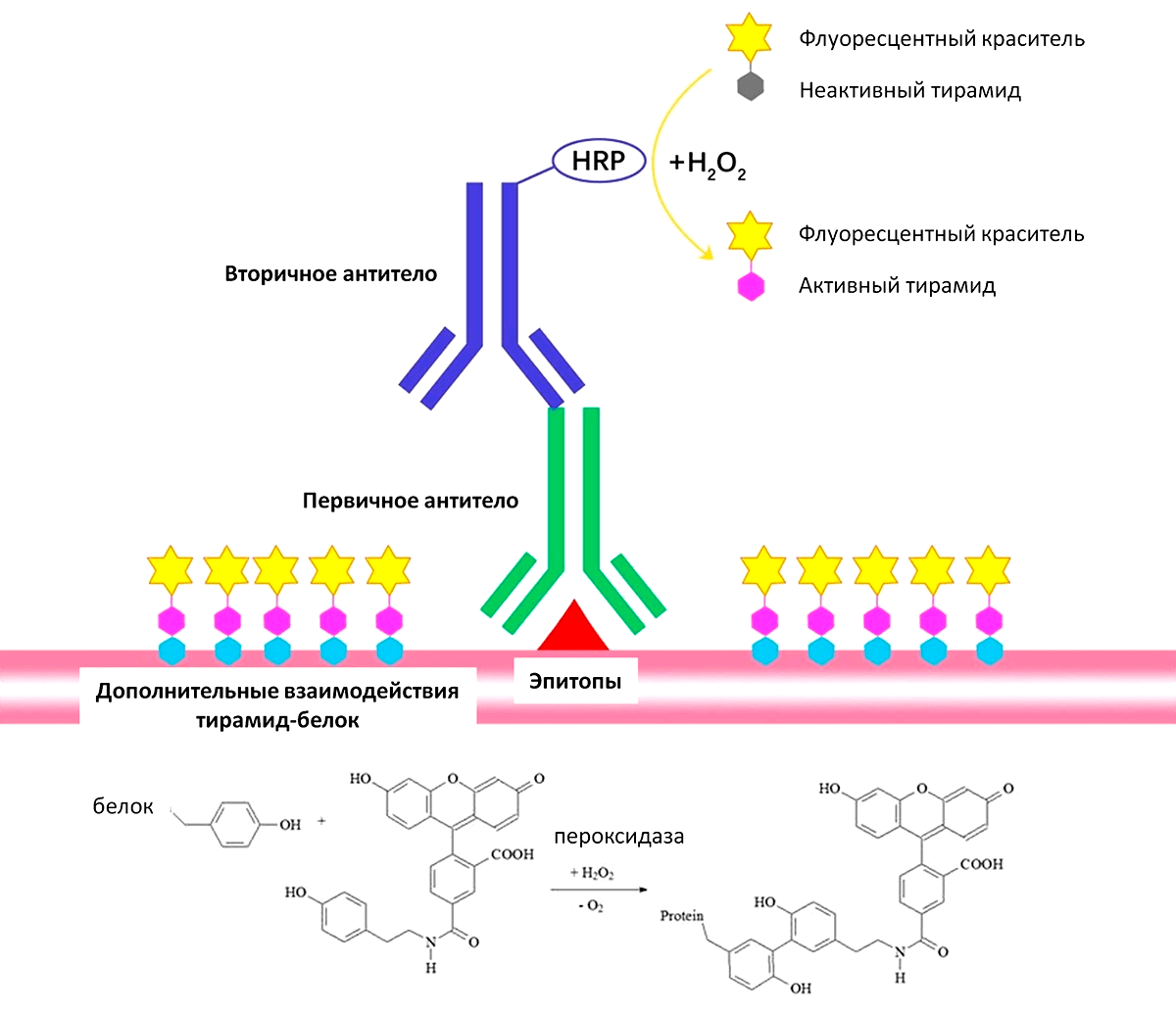
Рисунок 4. Принцип тирамид-сигнальной амплификации. Антиген последовательно инкубируется с первичными и вторичными антителами, конъюгированными с пероксидазой хрена, после чего добавляется тирамид с флуоресцентной меткой. Этот комплекс ковалентно связывается с белковыми молекулами (антигеном и обоими антителами).
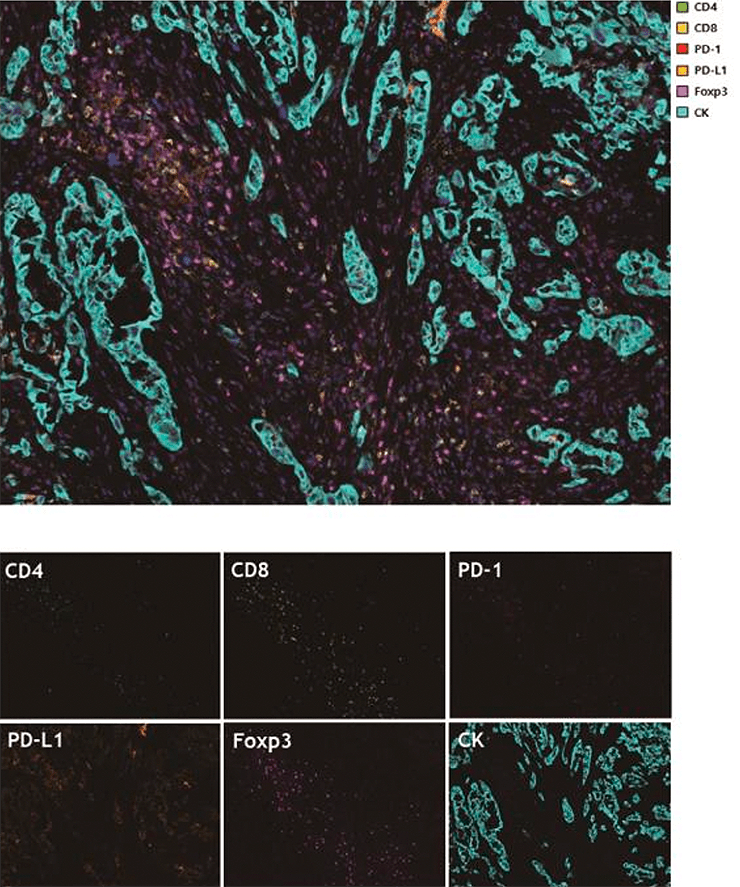
Рисунок 5. Картина мультиспектрального окрашивания иммунных клеток в опухолевой ткани щитовидной железы при помощи TSA. CD4 — маркер Т-хелперов; CD8 — маркер Т-киллеров; PD-1 — иммунологическая контрольная точка; PD-L1 — иммунологическая контрольная точка (лиганд для PD-1); Foxp3 — маркер регуляторных Т-клеток; CK — цитокератин. Таким образом удалось идентифицировать, какие именно Т-клетки экспонируют молекулы — иммунологические чекпоинты.
Вариант 2: баркоды с флуорохромами
Тирамид-сигнальная амплификация требует цикличного повторения окрашивания и детекции сигнала, поскольку для каждого антитела требуется новая порция реагента с тирамидом. Если же первичные антитела к каждому из маркеров сделать уникально детектируемыми, то окрашивание можно производить сразу на несколько маркеров одновременно. Так работает система Akoya Codex: срез ткани инкубируется с первичными антителами, каждое из которых несет на себе уникальный штрих-код — небольшую олигонуклеотидную последовательность (рис. 6, рис. 7). Далее эти антитела визуализируются не вторичными антителами, как это обычно бывает, а реагентом из комплементарного олигонуклеотида, меченого флуорофором. За один раз добавляют три таких реагента, спектры флуоресценции которых не пересекаются. Сигнал детектируется, реактивы удаляют — и цикл повторяется. Производители говорят, что таким образом можно окрасить ткань до 50 раз без потери качества.
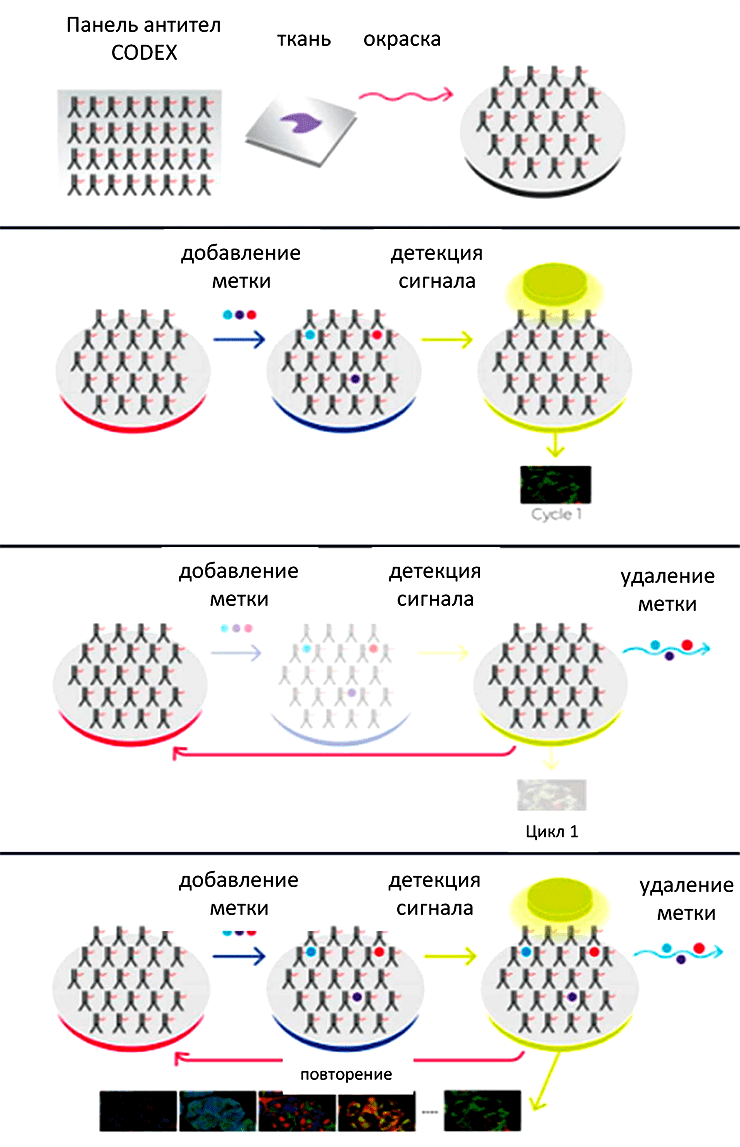
Рисунок 6. Схема эксперимента при использовании системы Akoya Code. Шаг 1: Окрашивание антителами с пришитыми к ним олигонуклеотидами. Шаг 2: Визуализация сигнала при помощи флуорофоров, конъюгированных с олигонуклеотидами. Шаг 3: Отмывка флуорофоров. Шаг 4: Повторение окрашивания.
брошюра Akoya Code
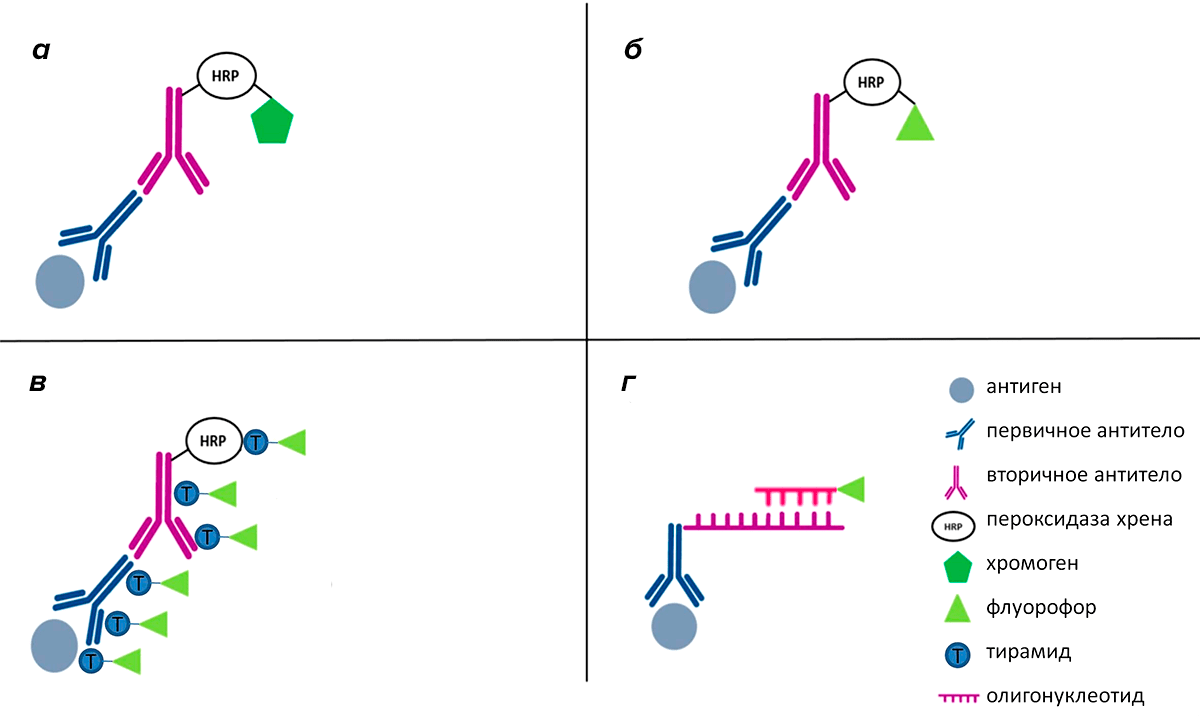
Рисунок 7. Эволюция иммуногистохимической визуализации: от хромогенного окрашивания к использованию флуорофоров, тирамин-сигнальной амплификации и баркодов. а — Стандартная ИГХ с хромогенным окрашиванием. б — ИГХ с флуоресцентным окрашиванием. в — ИГХ с использованием принципа TSA. г — ИГХ с использованием конъюгатов флуорофоров с олигонуклеотидами.
рисунок Аполлинарии Боголюбовой по [13]
Вариант 3: комплекс генноинженерных антител с легко удаляемым флуорохромом
Новейший метод мультиплексного окрашивания ткани, позволяющий визуализировать сотни (!) белков на одном срезе, основан сразу на двух высокотехнологичных решениях — генетической инженерии антител для окрашивания и флуоресцентной микроскопии высокого разрешения. Принцип прост: срез окрашивается антителами, считывается флуоресцентный сигнал, после чего флуорофор удаляется или обесцвечивается, а цикл повторяется практически неограниченное количество раз. Так работает система MICS (MACSima™ Imaging Cyclic Staining) от Miltenyi Biotec (рис. 8). Казалось бы, всё гениальное просто! Дьявол в деталях: как достичь того, чтобы флуорохром удалялся, не повреждая при этом срез и соседние белки, которые могут быть мишенями для последующих циклов окрашивания?
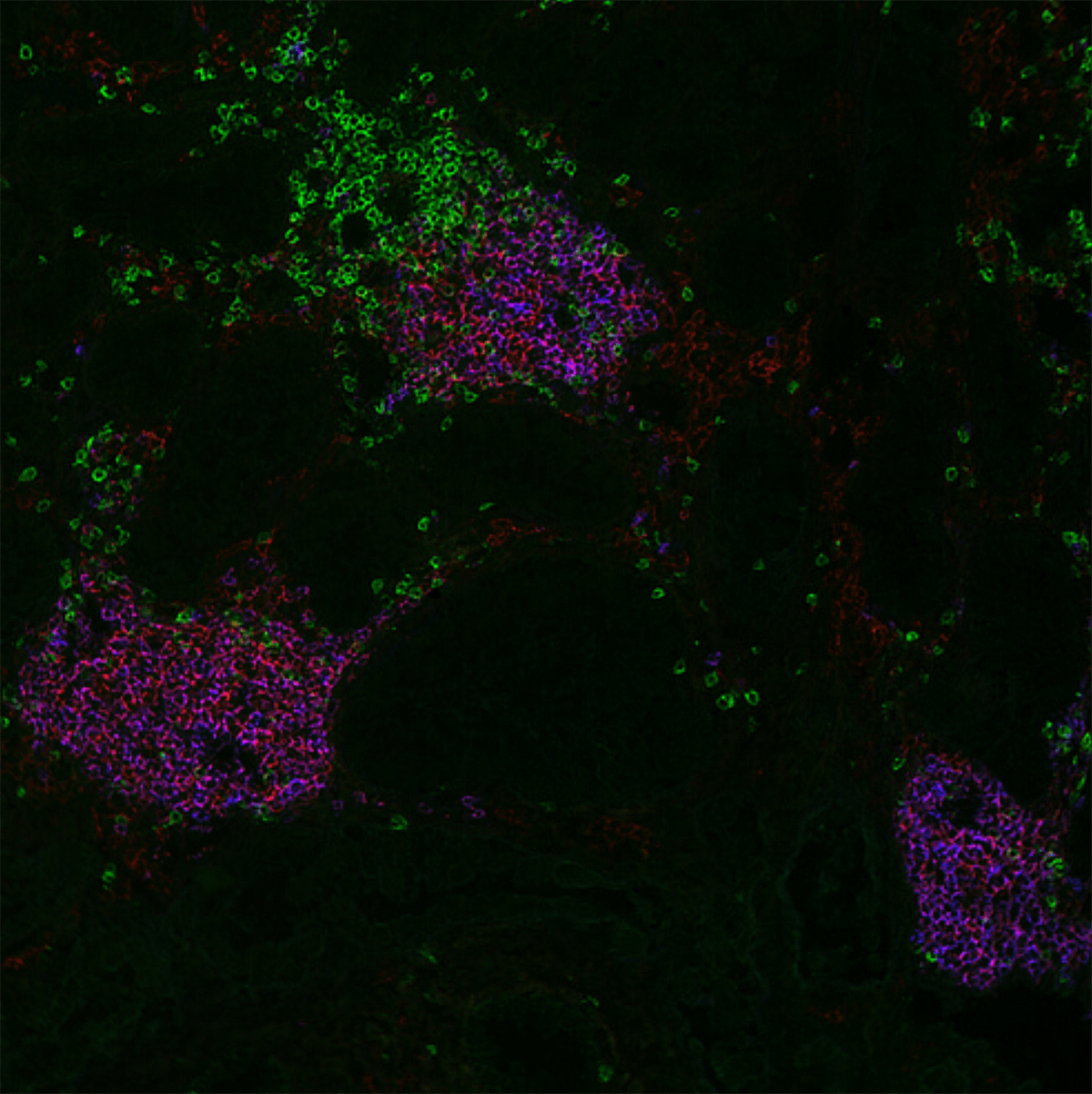
Рисунок 8. Окрашивание лимфоидной ткани антителами к CD3 (Т-лимфоциты, зеленый), CD19 (В-лимфоциты, красный) и IgD (фиолетовый). Сайт MACSima™ Art позволяет представить, как выглядит одновременное окрашивание различными антителами системы MICS.
Miltenyi Biotec предлагает два пути решения.
Первый — удаление антител химическим реагентом (REAlease Release Reagent). Если мы говорим об обычных антителах, то такой подход неминуемо приведет к повреждению ткани. Однако в данном случае этого не происходит. Дело в том, что антитела, окрашивающие срез, связываются с маркерами так слабо, что их можно удалить щадящим составом [10], не нарушающим поверхность среза. Циклы отмывки можно проводить больше ста раз, получая последовательно новые и новые изображения.
Второй вариант — обесцвечивание флуорохрома (reafinity antibodies). То, что является ограничением традиционной флуоресцентной микроскопии, в этом случае сыграло положительную роль: после проявки сигнала срез помещается в специальный модуль, где на короткое время освещается для обесцвечивания уже прикрепленных флуорохромов. Всё! Ткань готова к новому этапу окрашивания. Оператор сам может выбрать, какой из вариантов удаления флуоресцентного сигнала ему использовать. Как правило, для надежности последовательно применяются оба.
Различные пути модификации получения сигнала приводят к тому, что количество маркеров, которые можно одновременно детектировать на одном срезе ткани, увеличивается. Растет и стоимость эксперимента, ведь он требует не только дорогих реагентов, но и оборудования для детекции сигнала с высокой разрешающей способностью, а также сложно устроенных программ для обработки полученных изображений. Доступность методик широкому кругу пользователей — следующий шаг, который должен быть сделан в ближайшее время.
Литература
- Опухолевые разговоры, или Роль микроокружения в развитии рака;
- Маленькие пузырьки и большие проблемы: роль экзосом в раковом метастазировании;
- Флуоресцентные репортеры и их молекулярные репортажи;
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Thomas Blankenstein, Pierre G. Coulie, Eli Gilboa, Elizabeth M. Jaffee. (2012). The determinants of tumour immunogenicity. Nat Rev Cancer. 12, 307-313;
- Иммунитет: борьба с чужими и… своими;
- Charlotte M. Mousset, Willemijn Hobo, Rob Woestenenk, Frank Preijers, Harry Dolstra, Anniek B. van der Waart. (2019). Comprehensive Phenotyping of T Cells Using Flow Cytometry. Cytometry. 95, 647-654;
- Флуоресцирующая Нобелевская премия по химии;
- 12 методов в картинках: микроскопия;
- Jennifer Pankratz, Sabine Schmachtenberg, Nicole Jansen, Marie Hansen, Susanne Krauthäuser, et. al.. (2019). Abstract 4048: REAlease® technology: Controlled release of antibody-fluorochrome conjugates for maximal flexibility in flow sorting and fluorescence microscopy applications. Clinical Research (Excluding Clinical Trials);
- Rachel Wheat, Claudia Roberts, Tim Waterboer, Jane Steele, Jerry Marsden, et. al.. (2014). Inflammatory Cell Distribution in Primary Merkel Cell Carcinoma. Cancers. 6, 1047-1064;
- Jonghwa Ahn, Meihua Jin, Eyun Song, Yeon-mi Ryu, Dong Eun Song, et. al.. (2021). Immune Profiling of Advanced Thyroid Cancers Using Fluorescent Multiplex Immunohistochemistry. Thyroid. 31, 61-67;
- Wei Chang Colin Tan, Sanjna Nilesh Nerurkar, Hai Yun Cai, Harry Ho Man Ng, Duoduo Wu, et. al.. (2020). Overview of multiplex immunohistochemistry/immunofluorescence techniques in the era of cancer immunotherapy. Cancer Communications. 40, 135-153.







