Порог чувствительности зрительного восприятия
27 октября 2012
Порог чувствительности зрительного восприятия
- 1800
- 0
- 2
Протонированное основание Шиффа 11-цис ретиналя обеспечивает зрительное восприятие человека и животных
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Родопсин — зрительный пигмент, находящийся в палочках сетчатки глаза человека и животных и отвечающий за скотопическое (сумеречное) зрение. Он относится к большому семейству G-белоксопряженных рецепторов, за изучение которых в 2012 году присуждена Нобелевская премия. Светочувствительной группой всех зрительных пигментов является альдегид витамина А (ретиналь), находящийся в 11-цис форме. Поглощение фотона приводит к его изомеризации в транс-форму и дальнейшим конформационным изменениям белка. Наряду с фотореакцией, являющейся основой зрительной рецепции, также возможна спонтанная изомеризация, приводящая к поступлению ложного сигнала в мозг и понижению порога чувствительности зрительного восприятия. В работе проводится изучение цис—трансизомеризации ретиналя как под действием света, так и без него.
Конкурс «био/мол/текст»-2012
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2012 в номинации «Своя работа».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific.
В 2012 году Нобелевская премия по химии вручена за исследование G-белоксопряженных рецепторов , одним из которых является зрительный пигмент родопсин. Родопсин (RHO) — наиболее типичный зрительный пигмент, находящийся в палочках сетчатки глаза человека и животных и отвечающий за скотопическое (или сумеречное) зрение . Эта сложная молекула представляет собой хромогликопротеид, содержащий одну хромофорную группу, две олигосахаридные цепочки и водонерастворимый мембранный белок опсин. Кроме родопсина у человека есть еще три «цветных» опсина, устроенных практически так же, но имеющих другие спектральные параметры. Они находятся в клетках-колбочках.
См. «Нобелевская премия по химии (2012): за рецепторы наших первого, третьего и четвертого чувств» [4]. — Ред.
На «биомолекуле» есть очень подробная статья о родопсине: «Зрительный родопсин — рецептор, реагирующий на свет» [5]. О процессе активации GPCR-рецепторов, также важном в контексте этой статьи, см. заметку «Рецепторы в активной форме» [6]. Для более полного понимания всего, что написано дальше, рекомендуется ознакомиться с этими материалами. — Ред.
Хромофорной группой всех без исключения зрительных пигментов человека и животных является альдегид витамина А ретиналь, причем только одна из многих возможных изомерных форм, а именно изогнутая 11-цис форма. Опсин — сравнительно небольшой белок: молекулярная масса составляет около 40 кДа, а полипептидная цепь состоит из 348 аминокислотных остатков, расположенных в семи трансмембранных α-спиралях (рис. 1). Ретиналь образует протонированное основание Шиффа с лизином 296, находящимся в седьмой α-спирали, которое стабилизируется отрицательно заряженным остатком глутаминовой кислоты 113 (рис. 1). β-Иононовое кольцо ретиналя прочно фиксирует хромофор в гидрофобном «кармане» опсина, расположенном между α-спиралями.
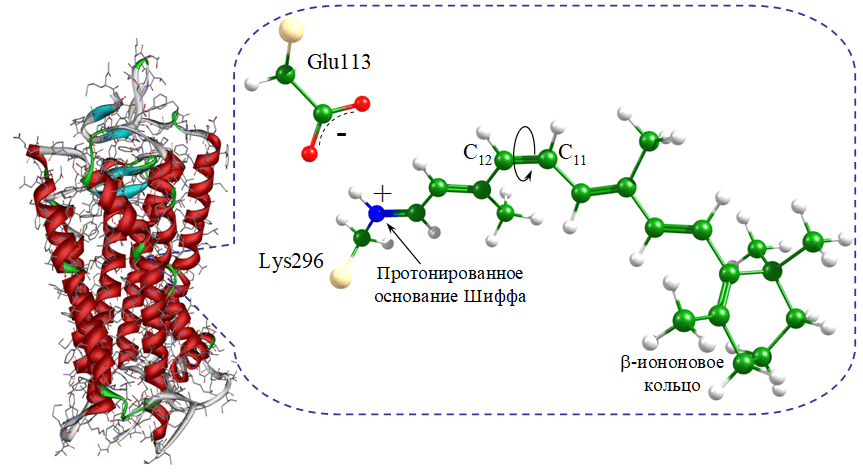
Рисунок 1. Структура родопсина и его хромофора. Слева: структура рецептора, семь α-спиралей которого составляют трансмембранный домен. Ретиналь (справа) не является частью белка; он присоединяется химической связью к остатку лизина-296. Эта связь называется Шиффовым основанием и положительно заряжена. Этот заряд компенсируется недалеко расположенным остатком глутаминовой кислоты-113, имеющим отрицательный заряд. Связь 11–12 изопренового «хвоста» ретиналя, вокруг которой происходит фотоизомеризация, показана кольцевой стрелкой; на рисунке она находится в цис-конформации, соответствующей изогнутой форме молекулы.
В ходе эволюции зрительные клетки (в частности, палочка сетчатки) достигли предела световой чувствительности и могут регистрировать даже единичный (!) поглощенный квант света (скотопическое или сумеречное зрение). 10–15 поглощенных квантов воспринимаются мозгом как еле видимая световая вспышка. Однако не всегда процесс зрительной рецепции возникает при активации светом. Существует также возможность температурной активации. В этом случае сетчатка передает «ложный» сигнал, который, так же как и при фоторецепции, приводит к передаче нервных импульсов в мозг.
Один из первичных продуктов фотоцикла родопсина (RHO) [5] — батородопсин (BATHO) — формируется за времена порядка пикосекунд и может быть зафиксирован и изучен при низких температурах.
Известно, что при переходе RHO → BATHO максимум полосы поглощения в спектре родопсина сдвигается в сторону больших длин волн: 498 → 535–543 нм. Изменения также происходят в колебательных спектрах во всех трех характеристических областях: внеплоскостные колебания атомов водорода, колебания двойных (С=С) и одинарных (С—С) связей. Анализ кристаллической структуры батородопсина указывает на то, что конформация хромофора при переходе RHO → BATHO значительно меняется, в то время как белковая матрица остается практически без изменений. Основное изменение заключается в том, что хромофорная группа переходит из 11-цис в полностью транс форму (ретиналь «распрямляется»). Белок же на стадии BATHO-интермедиата попросту «не успевает» среагировать на практически мгновенную изомеризацию ретиналя.
Спонтанная реакция изомеризации (а значит, и «темновой шум» родопсина) изучена крайне слабо. Известно только то, что ее энергетический барьер довольно высок (20–25 ккал/моль), что означает низкую скорость этой реакции. В то же время батородопсин имеет более высокую потенциальную энергию, нежели родопсин, на ≈34 ккал/моль (по результатам фотокалориметрии и фотоакустических методов). Видно, что эти данные противоречат друг другу, если исходить из предположения, что продуктом первой элементарной стадии реакции цис—транс «темновой» изомеризации является батородопсин, как и в случае фотореакции.
1. Родопсин и батородопсин
Задачей моей работы было с помощью методов теоретического компьютерного моделирования сравнить эти два состояния родопсина, чтобы охарактеризовать реакцию фотоизомеризации ретиналя и «темновую» активацию родопсина. Для этого нужно было получить равновесные структуры обеих молекул и провести гибридные квантово-механические расчеты, чтобы определить спектроскопические параметры обоих состояний и термодинамическую характеристику превращения одного в другое. Далее я опишу эти пункты подробнее.
1.1. Полноатомные структура родопсина и батородопсина
Поглощение фотона двойной связью ретиналя и фотоизомеризация — по сути своей квантово-механический процесс, поэтому описывать такие явления надо при помощи методов квантовой механики. Однако этим методам на современной стадии развития пока «не по зубам» такие большие системы как биологические (содержащие тысячи и миллионы атомов), поэтому разработаны методы гибридной квантовой механики/молекулярной механики (КМ/ММ), комбинирующие точность подхода ab initio («из первых принципов») и высокую скорость алгоритмов «классического» молекулярного моделирования .
О плюсах и минусах квантово-механических и «классических» подходов при расчете свойств молекул см. статью «Торжество компьютерных методов: предсказание строения белков» [7]; про основной метод «классического» молекулярного моделирования можно прочесть в работе «Молекулярная динамика биомолекул. Часть I. История полувековой давности» [8]. — Ред.
В отличие от «темновой» формы родопсина, точное состояние хромофора в фотоактивированном батородопсине неизвестно, в связи с чем его конформационный переход моделировали на компьютере. При этом исходили из предположения, что процесс перехода родопсин → батородонсин очень быстрый (~2 пс; одна пикосекунда = 10−12 с), а значит, белковое окружение не успевает измениться (и остается почти таким же, как в родопсине). Согласно концепции КМ/ММ, сам хромофор и ближайшие к нему фрагменты рецептора образовывали квантово-механическую область, а все остальные атомы системы — классическую (рис. 2).
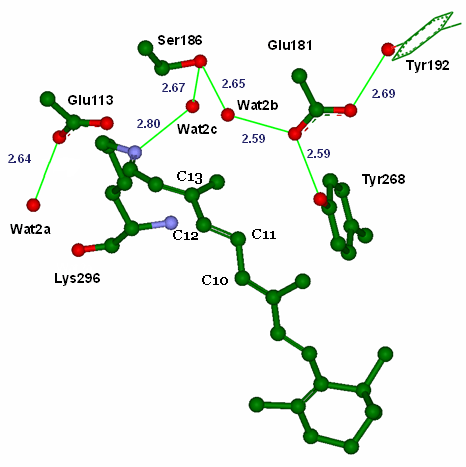
Рисунок 2. Равновесные геометрические параметры ретиналя и хромофорного «кармана» батородопсина. В квантовую область были включены, помимо молекулы хромофора, боковые цепи аминокислотных остатков Glu113, Glu181, Ser186, Tyr268, пептидная связь Ala292—Phe293, гидроксильная группа Tyr192 и три молекулы воды, участвующие в образовании стабилизирующих водородных связей и экранировании заряда на протонированном основании Шиффа.
За исследованный временной промежуток мы наблюдаем только изомеризацию вокруг связи C11=C12, даже положение β-иононового кольца пока остается прежним (рис. 3). Однако даже эти, на первый взгляд, небольшие изменения, могут сказать о многом. Анализ структуры ретиналя в хромофоре показывает, что процесс цис—транс изомеризации в батородопсине еще не завершен (связь не плоская). Но это может также говорить об особенностях влияния белкового окружения на путь прохождения реакции и о возможности стабилизации такой структуры.
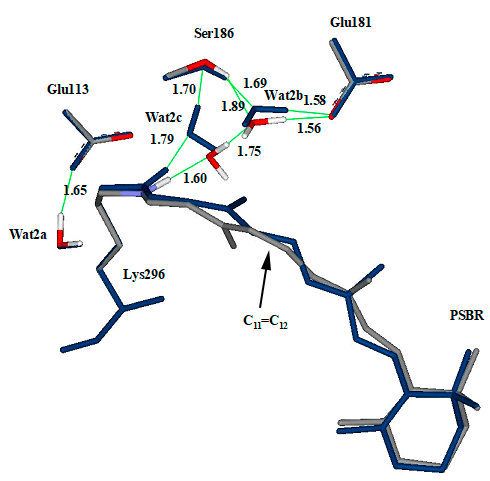
Рисунок 3. Равновесные геометрические конфигурации хромофора и ключевых аминокислотных остатков родопсина (синим) и батородопсина (серым). Положение ключевых аминокислотных остатков (глутаминовой кислоты 113 и 181, серина-186 и тирозина 192 и 268) остается практически неизменным. Стрелкой указана связь C11=C12 в ретинале, вокруг которой происходит фотоизомеризация. Ключевые расстояния показаны в ангстремах (Å).
Анализируя превращения, проходящие в процессе изомеризации, важно обращать внимание не только на структуру самого хромофора, но и на его ближайшее окружение, а именно на ключевые аминокислотные остатки и молекулы воды, находящиеся в непосредственной близости к хромофору.
Результаты расчета показывают, что в процессе перехода родопсин → батородопсин положение ключевых аминокислотных остатков остается практически неизменным (рис. 3). Это вполне понятно, так как процесс проходит за очень короткое время (напомним, это 2 пс). Получается, что главными участниками процесса фотоизомеризации (помимо самого хромофора, конечно) являются две молекулы воды: Wat2b и Wat2c. Если в родопсине молекула Wat2b образует две цепочки водородных связей: ретиналь—Wat2c—Wat2b—Glu181 и Ser186—Wat2b—Glu181, то в батородопсине — только вторую (рис. 3). Значительное изменение положения молекулы Wat2c приводит к разрыву водородной связи с Wat2b и формированию связи с Ser186. Такие изменения структуры сетки водородных связей находят отражение в особенностях колебательного спектра молекул воды, которые также можно изучить с помощью теоретических методов.
1.2. Спектры поглощения
Как фотоактивный белок, родопсин обладает характерным спектром поглощения света видимых длин волн (это обусловливает «цвет» родопсина и его фотоинтермедиатов). Теория строения молекул и методы квантовой механики позволяют рассчитывать параметры основного и возбужденных состояний молекул, а из этого уже можно извлечь энергии переходов и, следовательно, длины волн поглощаемого излучения. Рассчитанная энергия вертикального S0—S1 перехода составила 519 нм, что хорошо согласуется с экспериментальными данными (529–543 нм; рис. 4).
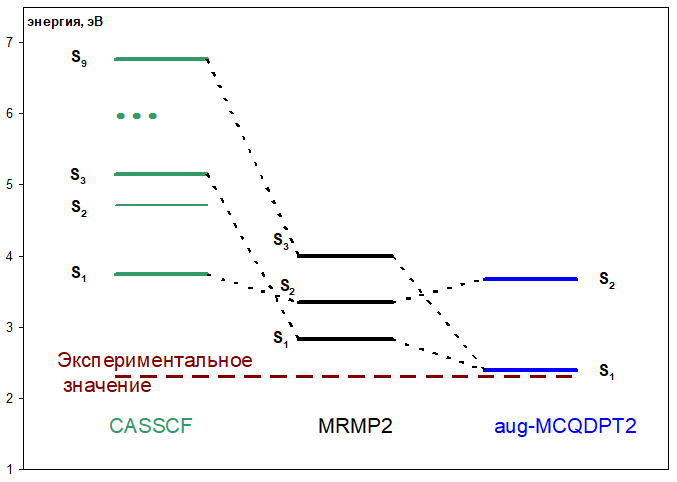
Рисунок 4. Энергии вертикальных переходов с основного на низколежащие синглетные состояния, рассчитанные методами CASSCF, MRMР2, aug-MCQDPT2
1.3. Колебательные спектры родопсина и батородопсина
Важную информацию о строении молекул дает инфракрасная спектроскопия комбинационного рассеяния (КР), в которой для обозначения характеристики излучения (и параметров колеблющихся при его поглощении химических связей) используют не длины волн, а волновые числа, традиционно записываемые в обратных сантиметрах (см−1). По полосам поглощения инфракрасного света в КР-спектре можно говорить о наличии в молекуле определенных химических связей и колебаний атомов, образующих эти связи.
Наиболее представительны в КР-спектре родопсина области колебаний двойных С=С связей волновыми числами 1500–1650 см−1, одинарных С—С связей (1100–1350 см−1), а также внеплоскостных колебаний атомов водорода (900–1100 см−1). Также интерес представляют колебания в низкочастотной области, поскольку по ним можно судить о прохождении процесса изомеризации. В таблице 1 представлены рассчитанные и экспериментальные значения частот, отнесение которых к определенным типам колебаний в ретинале уже было проведено экспериментаторами. В частности, в КР-спектрах различимы пять полос в области колебаний двойных С=С связей как родопсина, так и батородопсина, которые хорошо воспроизводятся и в рассчитанном спектре (см. табл. 1). Область колебаний одинарных С—С связей также представлена в спектре, однако здесь методика расчета дает менее точные результаты.
| Отнесение частот# | Родопсин | Батородопсин | ||
|---|---|---|---|---|
| Эксперимент, см−1 | Расчет$, см−1 | Эксперимент, см−1 | Расчет, см−1 | |
| C12H wag | - | - | 853, 858 RT | 849 |
| C10H wag | - | - | 872 | 859 |
| C11H wag | - | - | 921 | 913 |
| C11—C12 A2 HOOP | 970 | 1059 | - | - |
| C13 Me rock | 997 | 993 | 1006 | 1019 |
| C9 Me rock | 1018 | 991 | 1020 | 991 |
| C10—C11 | 1097 | 1089 | 1166 | 1113 |
| C14—C15 | 1189 | 1119 | 1210 | 1127 |
| C8—C9 | 1216 | 1173 | 1214 | 1204 |
| C12—C13 | 1236 | 1197 | 1240 | 1222 |
| C11H+C12H rock | 1268 | 1197 | 1278 | 1188 |
| C=C | 1543, 1536RT | 1568 | 1536,1533 RT | 1561 |
| C=C | 1551, 1546 RT | 1587 | 1561 RT | 1568 |
| C=C | 1576, 1578 RT | 1604 | 1580, 1578 RT | 1586 |
| C=C | 1606, 1604 RT | 1633 | 1604 | 1605 |
| C=C | 1635, 1631 RT | 1637 | 1624, 1615 RT | 1628 |
| C—NH | 1655 | 1664 | 1654 | 1633 |
| # — Обозначения, используемые для колебательных движений, пояснены на рис. 5. $ — Расчет колебательного спектра в гармоническом приближении дает систематическое завышение частот, поэтому был введен масштабирующий множитель. Его значение рассчитывалось методом наименьших квадратов для всех полос, соотнесенных с экспериментом, и составило 0.953. | ||||
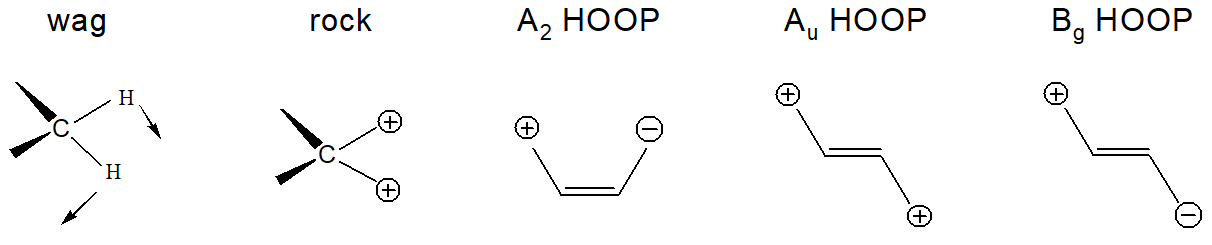
Рисунок 5. Сокращения, используемые для описания различных форм колебаний. wag соответствует внеплоскостным колебаниям атомов водорода; «+» и «−» обозначают колебания в плоскости молекулы (одинаковые знаки соответствуют колебаниям в фазе, разные — в противофазе).
Наиболее значимой и сильно меняющейся в процессе фотоизомеризации является область НООР колебаний, относящихся к атомам, соседим с двойной связью (рис. 5). Наиболее интенсивное колебание НООР с симметрией А2, соответствующее колебаниям атомов водорода при углеродных атомах С11 и С12, переходит в три полосы, соответствующие колебаниям атомов водорода при углеродных атомах С10, С11 и С12 (табл. 1), причем полосы сдвигаются в более низкочастотную область. В рассчитанном спектре удалось воспроизвести сдвиг в длинноволновую область при переходе родопсин → батородопсин, а также симметрию колебаний (рис. 6).
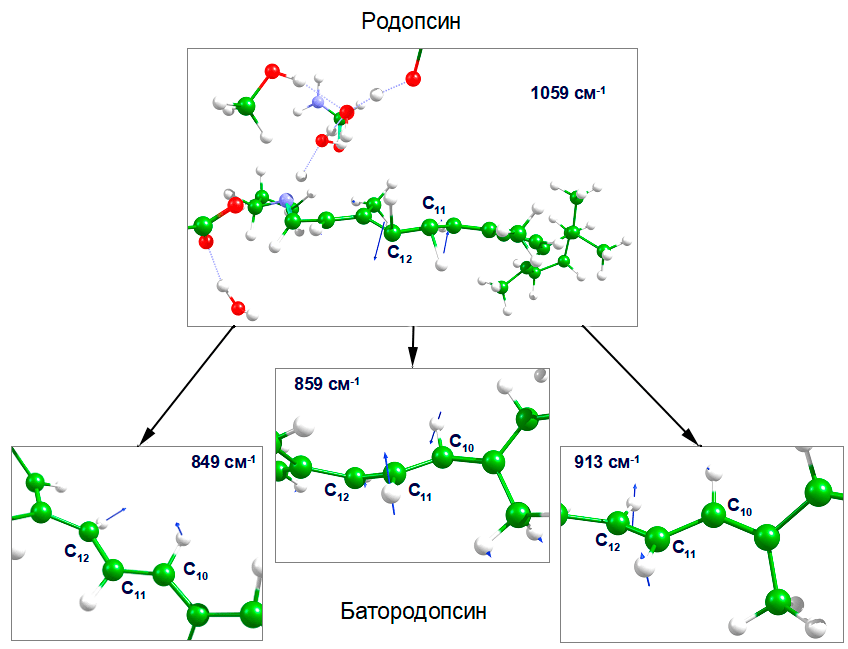
Рисунок 6. Изменение НООР-колебаний в области изомеризующейся связи при переходе родопсин → батородопсин. Пояснение HOOP-колебаний приведено на рис. 5.
В таблице 1 представлены только основные колебательные моды, для которых определены формы колебаний. Однако в спектрах высокого разрешения видны и другие полосы меньшей интенсивности, определение формы которых экспериментально проведено только для родопсина. Поэтому проведенный расчет имел предсказательный характер: зная типы колебаний, характерные для родопсина в этой области, и имея рассчитанный колебательный спектр, становится возможным провести соотнесение частот и определение форм их колебаний для батородопсина. Анализ «тонкой структуры» спектров (в том числе и рассчитанных) позволяет делать заключения о физико-химических превращениях в рассматриваемой системе.
Другим важным аспектом анализа колебательной структуры спектров является область низкочастотных колебаний при переходе родопсин → батородопсин. На рисунке 7 показаны наиболее характерные формы низкочастотных колебаний. Видно, что в родопсине в них вовлечены метильная группа, движущаяся в направлении изомеризации, и таким образом «отталкивающая» молекулу воды Wat2c (как на рис. 3). В батородопсине метильная группа уже заняла новое положение, но связь С11=С12 еще не релаксирована, и характерные низкочастотные моды в этой области соответствуют дальнейшему переведению молекулы в транс-форму.
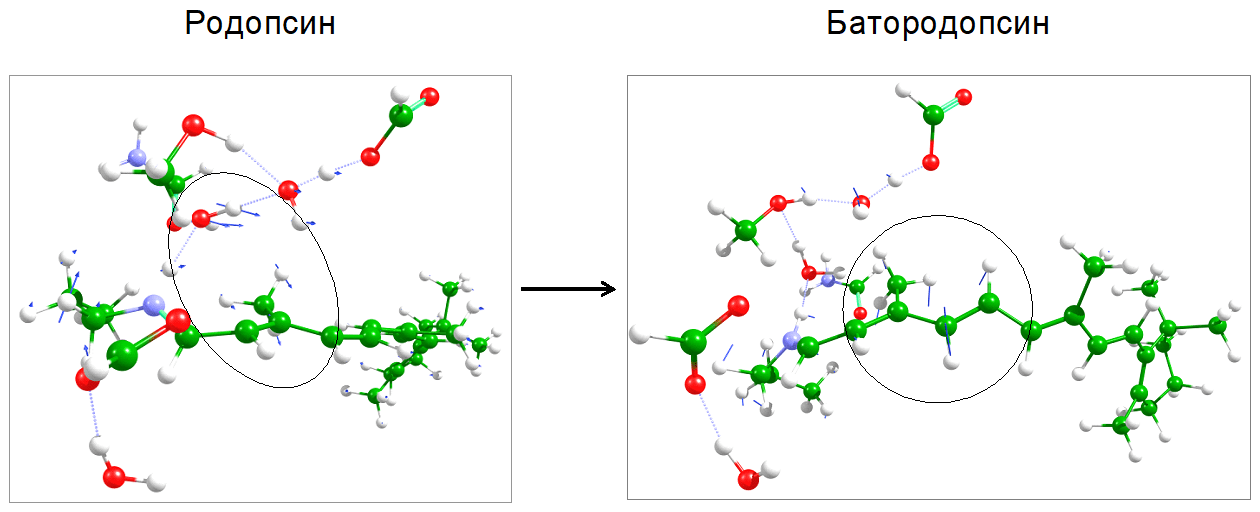
Рисунок 7. Характерные формы низкочастотных колебаний родопсина и батородопсина подпись
1.4. Термодинамические параметры перехода родопсин—батородопсин
Одной из важных характеристик для интермедиата (промежуточного состояния) любого превращения молекулы (в том числе химической реакции) является ее положение на шкале потенциальной энергии относительно родопсина. Эта характеристика показывает, в первую очередь, вероятность наблюдения этого состояния — проще говоря, произойдет ли превращение. Для модельной системы была вычислена разность энергий родопсина и батородопсина с помощью нескольких методов (табл. 2).
| Метод | EBATHO−ERHO, ккал/моль |
|---|---|
| КМ/ММ в варианте механического внедрения (DFT, уменьшенная КМ часть) | 15.8 |
| КМ/ММ в варианте механического внедрения (DFT, расширенная КМ часть) | 16.7 |
| КМ/ММ с потенциалом эффективных фрагментов (MP2, уменьшенная КМ часть) | 14.9 |
| Среднее значение для КМ/ММ расчетов | 15.8 |
| (Без ММ): уменьшенная КМ часть | 10.2 |
| (Без ММ): расширенная КМ часть | 8.6 |
| (Без ММ): протонированное основание Шиффа | 8.5 |
Проведенные расчеты подтвердили, что адекватный учет белкового окружения — совершенно необходимый фактор для правильного расчета термодинамических характеристик, поэтому использование комбинированного КМ/ММ метода по сравнению с маленькой и чисто квантово-механической системой более чем оправдывает себя. При этом, как видно из таблицы 2, метод описания ММ-части, а также выбор размера КМ-части практически не влияют на полученный результат.
Экспериментальное значение энтальпии перехода родопсина в батородопсин составляет более 30 ккал/моль. Поэтому полученное в данной работе значение разности энергий не является удовлетворительным с точки зрения экспериментальных данных. Однако анализ методики эксперимента и сравнение с другими сходными системами указывает на возможный источник неточности в эксперименте. Фотоизомеризация сходного фоторецепторного белка — бактериородопсина — имеет ряд отличий. В частности:
- Энергия, запасенная в процессе изомеризации бактериородопсина, составляет примерно 16 ккал/моль (то есть, вдвое ниже, чем для родопсина).
- В случае родопсина запасенная энергия составляет 60% от энергии фотовозбуждения, тогда как для бактериородопсина это лишь 30%.
- В случае фотоцикла бактериородопсина полученные результаты описываются схемой превращения реагент → продукт, тогда как в родопсине это реагент → интермедиат → продукт.
Таким образом, хоть полученное расчетное значение (16 ккал/моль) и расходится с экспериментом, оно очень близко к параметру для бактериородопсина, что позволяет думать о несовершенстве проведенного эксперимента для фотоцикла родопсина.
Из всех этих результатов следует, что полученная структура хорошо соответствует батородопсину. На это указывает хорошее согласие рассчитанной структуры с кристаллической, а также расчетных и экспериментальных данных электронной и колебательной спектроскопии. Единственным недостатком полученной модели является плохое согласование значения энтальпии перехода из родопсина в батородопсин. Однако это может быть связано не только с недостатком использовавшейся модели (фиксированная белковая матрица), но и с недостатками эксперимента, в котором получили значение энтальпии.
2. Реакция изомеризации при термической активации
В предыдущем разделе рассказывалось об изомеризации ретиналя при поглощении кванта света (то есть, это элементарный акт зрения). А как же с температурной активацией, приводящей к «темновому шуму» родопсина?
Мы попытались применить метод КМ/ММ и для этой задачи, чтобы проследить за элементарным событием активации родопсина не светом, а повышенной температурой. Для этого проводили исследование промежуточного состояния между родопсином и батородопсином. Анализ колебательной структуры спектра показывает, что для неё характерно наличие одной мнимой частоты (283i см−1), соответствующей колебаниям в области изомеризующейся двойной связи (рис. 8).
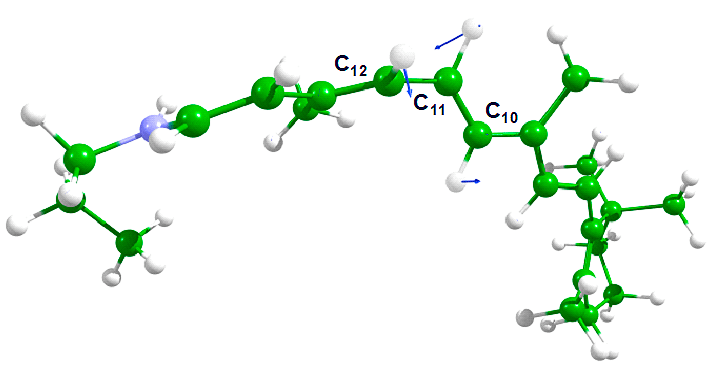
Рисунок 8. Форма колебания, соответствующего мнимой частоте колебаний 283i см−1 в переходном состоянии
Особенностью геометрической конфигурации переходного состояния являются практически прямые двугранные углы С10—С11=С12—С13 и Н—С11=С12—Н и измененный порядок связей (то есть, изомеризующаяся связь фактически можно считать одинарной). Такие признаки указывают на возможность бирадикального характера переходного состояния.
Для изучения изомеризации было построено синглетное бирадикальное решение, в котором два неспаренных электрона находились на пространственно разделенных орбиталях (аналогично рис. 9). Энергетический барьер реакции изомеризации на поверхности основного электронного состояния составляет 26 ккал/моль, а истинная энергия активации, учитывающая разницу энергий нулевых колебаний реагента и активированного комплекса, составляет 23 ккал/моль. Этот результат хорошо согласуется с результатами, полученными в эксперименте (20–25 ккал/моль).
При сравнении рассчитанной и экспериментальной энтальпий перехода родопсин → батородопсин уже говорилось о недостатках эксперимента и его несогласованности с результатами, полученными в схожих системах. Теперь же к этим аргументам добавляются еще и данные, полученные из исследования реакции при термической активации. Если известно, что истинная энергия активации составляет 23 ккал/моль, то продукт, то есть батородопсин, не может лежать выше родопсина на 32 ккал/моль, то есть на 6–9 ккал/моль выше переходного состояния термической реакции (рис. 10).
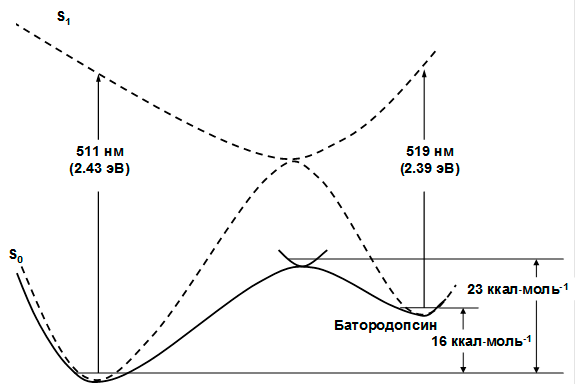
Рисунок 10. Схема фотоиндуцированной реакции (пунктир) и реакции при термической активации в основном электронном состоянии (сплошная линия)
Подводя итог, можно сказать, что была получена детальная информация о структуре и свойствах родопсина и батородопсина. Также была охарактеризована реакция цис—транс изомеризации при термической активации в основном электронном состоянии и впервые установлено, что первичным интермедиатом как фотоиндуцированной, так и реакции c термической активацией является батородопсин. Все эти результаты были получены исходя из анализа структур только в основном электронном состоянии, а также из расчета спектральных свойств и рассмотрения особенностей электронных конфигураций в стационарных точках. Такой способ изучения зарекомендовал себя для такой хорошо изученной системы как родопсин и позволил получить ряд новых результатов, в частности касающихся реакции цис—транс изомеризации, лежащей в основе нашего зрения.
Литература
- M. G. Khrenova, A. V. Bochenkova, A. V. Nemukhin. (2009). Modeling reaction routes from rhodopsin to bathorhodopsin. Proteins. 78, 614–622;
- Фельдман Т.Б., Холмуродов Х.Т., Островский М.А., Хренова М.Г., Немухин А.В. (2009). Изучение конформационного состояния хромофорной группы, 11-цис-ретиналя, в родопсине методами компьютерного молекулярного моделирования. «Биофизика». 54, 660–667;
- Khrenova M.G., Bochenkova A.V., Nemukhin A.V. Theoretical characterization of bathorhodopsin. In: Molecular simulation in material and biological research / ed. by Kh.T. Kholmurodov. Nova Science Publishers, 2009. P. 19–27;
- Нобелевская премия по химии (2012): за рецепторы наших первого, третьего и четвертого чувств;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Рецепторы в активной форме;
- Торжество компьютерных методов: предсказание строения белков;
- Молекулярная динамика биомолекул. Часть I. История полувековой давности.