Рецептор медиатора настроения
07 мая 2013
Рецептор медиатора настроения
- 6933
- 1
- 15
Психонейрофармакологическая важность серотонина столь высока, что его химическая формула даже является узнаваемым образом во многих субкультурах, — в частности, её часто татуируют или исполняют в виде ювелирных украшений.
-
Автор
-
Редакторы
Темы
Серотонин — нейромедиатор, участвующий во множестве нейрофизиологических и психических процессов в центральной нервной системе. Одним из хорошо известных «аналогов» серотонина является галлюциногенный наркотик ЛСД, а серотониновая система в целом — мишень действия лекарств от мигрени, нейролептиков, антидепрессантов и малых транквилизаторов. Американские и китайские исследователи определили пространственную структуру двух рецепторов серотонина в комплексе с эрготамином — алкалоидом спорыньи, применяемым при мигрени. Выявленные тонкие структурные отличия помогут создать новое поколение лекарств, лишённых побочных эффектов.
В 1948 году, когда был открыт серотонин (5-гидрокситриптамин), никто и не думал, что он настолько важен для физиологии человека [1]. Серотониновая система является молекулярной мишенью при лечении мигреней, депрессии, тревожных расстройств, тошноты, слизистого колита и других заболеваний, своим разнообразием подчёркивающих многогранность роли серотонина в работе всего организма [2]. В некотором смысле серотонин можно считать нейрофармакологической основой духовной сферы человека, — в частности, религиозного и мистического чувств [3].
По химической структуре серотонин является моноамином, и действует он на семейство из 15 рецепторов, один из которых (5-HT3) является лиганд-управляемым ионным каналом, а остальные (5-HT1,2,4–7) — G-белоксопряженными рецепторами (см. врезку), известными широкой публике по Нобелевской премии 2012 года [4]. В майском номере журнала Science за 2013 год вышло сразу две статьи, описывающие пространственное строение двух рецепторов серотонина — 5-HT1B и 5-HT2B — в комплексе с алкалоидом спорыньи эрготамином, применяемым при лечении мигреней [5], [6]. Также были проведены биохимические исследования и компьютерное моделирование, которые объясняют различные механизмы передачи сигнала, вызываемого эрготамином, серотонином и наркотиком ЛСД, действующими на одни и те же рецепторы.
Рецепторы серотонина являются интегральными белками мембран нейронов, и экспериментальное их изучение затруднено необходимостью использовать мембраномоделирующие среды, позволяющие сохранить природное строение этих белков. Дополнительной хитростью является генно-инженерное встраивание вместо одной из цитоплазматических петель рецептора термостабильного бактериального белка апоцитохрома b562RIL (BRIL), стабилизирующего пространственную структуру и позволяющего формироваться кристаллам дифракционного качества, но не меняющего активность рецепторов. Структуру β2-адренорецептора получили в 2007 году тем же способом, только там вставляли не апоцитохром, а лизоцим, что произвело революцию в структурной биологии GPCR-рецепторов [7].
Структурная информация и компьютерный докинг показали, что и серотонин, и эрготамин, и ЛСД схожим образом связываются с консервативным «карманом» в рецепторе, объясняя широкий спектр действия самого серотонина. Однако детальное сравнение выявило и различия в связывании с двумя рецепторами (рис. 1): в подтипе рецептора 5-HT1B 5-я трансмембранная α-спираль на 3 Å сдвинута по сравнению с ее положением в 5-HB2B, что образует более «вместительный» сайт связывания и объясняет селективность лигандов к одному из подтипов рецептора.
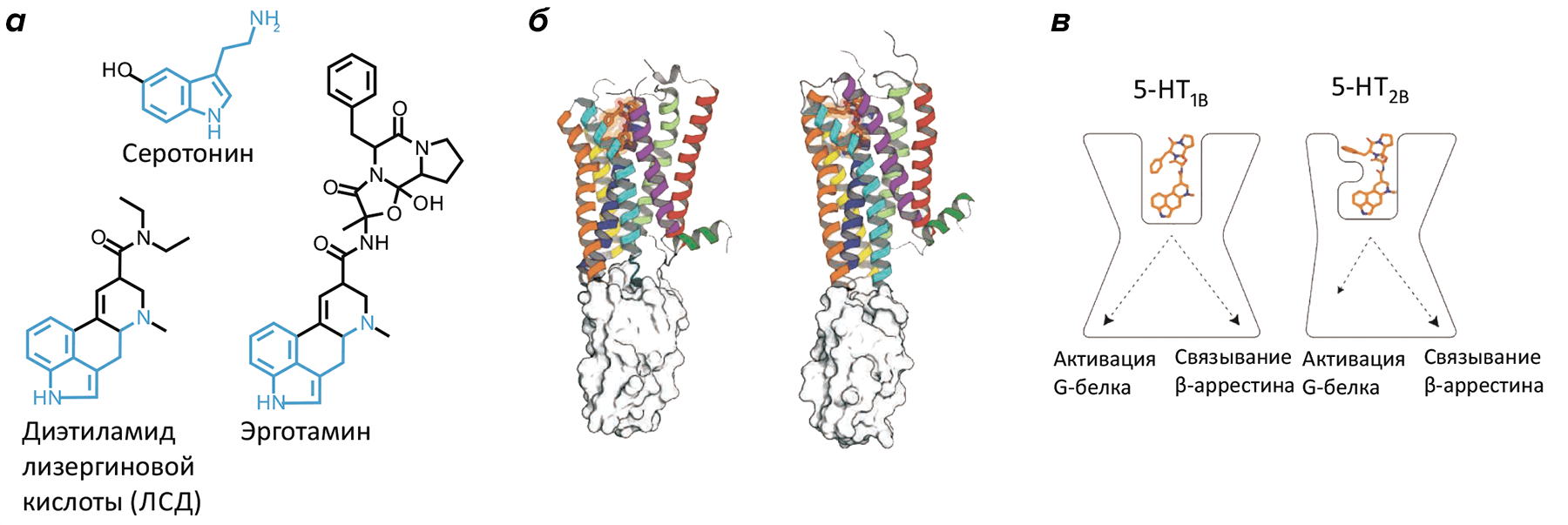
Рисунок 1. Молекулярные основы передачи сигнала серотониновыми рецепторами. а — Природный (серотонин) и синтетические (эрготамин, ЛСД) лиганды с общим индоламинным ядром. б — Кристаллографические структуры рецепторов 5-HT1B (слева) и 5-HT2B (справа) в комплексе с эрготамином. в — Эрготамин стабилизирует различные конформации у двух серотониновых рецепторов, объясняя биохимически установленный феномен «смещенной» рецепторной передачи.
Как уже было сказано, все серотониновые рецепторы, кроме 5-HT3, относятся к GPCR-рецепторам и передают сигнал в клетку либо через активацию G-белка, либо связываясь с альтернативным белком-эффектором — β-аррестином [8]. Близкое химическое строение серотонина и других биологически активных аминов — дофамина и адреналина, — а также высокое сходство рецепторов этих молекул объясняют, почему вещества, действующие на серотониновые рецепторы, могут действовать также на рецепторы других моноаминов, приводя к побочным эффектам. В частности, высокие дозы эрготамина и родственных ему алкалоидов, действующих, предположительно, через 5-HT1B и 5-HT1D рецепторы, могут запустить также α-адренорецепторы, что вызовет нежелательное сосудосуживающее действие [9]. Ещё один довольно скандальный пример связан с фенфлурамином — регулятором аппетита амфетаминовой природы, действующим через рецептор 5-HT2B и приводящим к появлению пороков сердца. Изъятие этого препарата с рынка в 1997 году было крупнейшим в истории фармакологии.
Уже известны примеры рационального дизайна лекарств [10], специфическим образом нацеленных на 5-HT1 рецепторы и используемых для избавления от мигреней [11], однако определение пространственной структуры серотониновых рецепторов обещает сделать процесс этого дизайна более прямолинейным. Детальное сравнение строения двух рецепторов позволит создать вещества, селективно действующие на рецептор 5-HT1B и лишённые кардиотоксического побочного действия, оказываемого через рецепторы 5-HT2B.
На первый взгляд, строение обоих серотониновых рецепторов такое же, как и у наиболее известного представителя семейства А рецепторов GPCR — родопсина [12]. Среднеквадратичное отклонение, используемое в качестве меры схожести двух пространственных структур, здесь составляет всего лишь 2.3–2.7 Å для 80% Cα-атомов любого из серотониновых рецепторов и родопсина, подчеркивая высочайшую похожесть пространственной организации этих рецепторов при совершенно различных функциях и аминокислотных последовательностях. Однако наличие структур двух рецепторов, определенных в комплексе с одним и тем же лигандом, открывает замечательную возможность для тонкого сравнения рецепторных сайтов распознавания и областей, в которых рецептор взаимодействует с цитоплазматическими белками-эффекторами. В частности, удалось объяснить, почему в случае 5-HT2B рецептора эрготамин активирует β-аррестин, в то время как для 5-HT1B это G-белок. Выявление таких тонких молекулярных нюансов — пока редкость для молекулярной биологии, но именно они позволяют предсказывать сигнальный ответ, вызываемый тем или иным соединением, а значит, и прогнозировать и создавать требуемое лекарственное воздействие.
Семейство рецепторов серотонина иногда сравнивают с двуликим Янусом, поскольку одни из них могут быть опасны (5-HT2B называют рецептором смерти из-за его кардиотоксического действия), а другие доставляют нам удовольствие. Например, при поедании шоколада в наш организм поступают предшественник серотонина аминокислота триптофан и некоторые другие серотониноподобные моноамины, и серотониновые рецепторы позволяют нам почувствовать это удовольствие [13].
Знание о деталях строения серотониновых рецепторов, несомненно, найдет применение в дизайне некардиотоксичных аналогов серотонина, которые будут выполнять свою целебную функцию и окажутся приятны во всех отношениях — как шоколад.
По материалам рубрики Perspectives журнала Science [14].
Литература
- M. M. RAPPORT, A. A. GREEN, I. H. PAGE. (1948). Crystalline Serotonin. Science. 108, 329-330;
- Miles Berger, John A. Gray, Bryan L. Roth. (2009). The Expanded Biology of Serotonin. Annu. Rev. Med.. 60, 355-366;
- Абсентис Д. (2004). Христианство и спорынья. Глава 3. Шариков, эпифиз и серотонин;
- Нобелевская премия по химии (2012): за рецепторы наших первого, третьего и четвертого чувств;
- D. Wacker, C. Wang, V. Katritch, G. W. Han, X.-P. Huang, et. al.. (2013). Structural Features for Functional Selectivity at Serotonin Receptors. Science. 340, 615-619;
- C. Wang, Y. Jiang, J. Ma, H. Wu, D. Wacker, et. al.. (2013). Structural Basis for Molecular Recognition at Serotonin Receptors. Science. 340, 610-614;
- Новый рубеж: получена пространственная структура β2-адренорецептора;
- Bryan L. Roth. (2011). Irving Page Lecture: 5-HT2A serotonin receptor biology: Interacting proteins, kinases and paradoxical regulation. Neuropharmacology. 61, 348-354;
- WJ Meyler. (1996). Side Effects of Ergotamine. Cephalalgia. 16, 5-10;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Patrick P.A. Humphrey. (2007). The Discovery of a New Drug Class for the Acute Treatment of Migraine. Headache. 47, S10-S19;
- Зрительный родопсин — рецептор, реагирующий на свет;
- KRISTEN BRUINSMA, DOUGLAS L. TAREN. (1999). Chocolate. Journal of the American Dietetic Association. 99, 1249-1256;
- K. Palczewski, P. D. Kiser. (2013). As Good as Chocolate. Science. 340, 562-563;
- Рецепторы в активной форме;
- Структуры рецепторов GPCR «в копилку».