
Флуоресцентный белок miniSOG убивает клетки светом
18 июля 2013
Флуоресцентный белок miniSOG убивает клетки светом
- 1444
- 0
- 4
Раковая клетка, погибающая путём апоптоза (характерные мембранные пузыри покрывают клетку, она утрачивает свою форму и становится сферической)
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Развитие биологии не стоит на месте, и это ведёт к появлению всё более неожиданных инструментов и методов исследования биоматериала. Одним из таких инструментов являются фототоксические белки — генетически кодируемые молекулы, которые после облучения светом определённой волны производят губительные для клетки вещества. При этом они ещё и флуоресцируют: в ответ на облучение излучают свет с большей длиной волны, что позволяет легко их детектировать. Такие свойства делают фототоксические белки перспективными средствами как для молекулярно-биологических исследований, так и для медицинских разработок, в частности фотодинамической терапии раковых заболеваний.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Развитие современной биологии способствует появлению новых и неожиданных методов исследования — как на молекулярном, так и на клеточном и организменном уровнях. Одним из таких методов является фототоксическое воздействие генетически кодируемых белков. Фототоксические вещества, или фотосенсибилизаторы, известны уже достаточно давно и применяются, например, в противораковой терапии. Однако направленная доставка молекул с такими свойствами в определённые клеточные органеллы открывает новые возможности для исследования клеточных процессов и развития новых способов терапии разнообразных, в том числе раковых, заболеваний.
История разработки фототоксических белков
Изучение и применение флуоресцентных белков давным-давно вышло за рамки специальных исследований. Флуоресценция — это процесс, при котором вещество при облучении светом с определённой длиной волны испускает свет с другой (большей) длиной волны. Флуоресцентные белки семейства GFP в настоящее время являются универсальным инструментом для мечения биологических молекул в живых клетках и даже в целых организмах. Родоначальником этой большой группы является, собственно, зелёный флуоресцентный белок GFP, выделенный из медузы Aequorea Victoria японско-американским учёным Осаму Шимомура, удостоившимся за это открытие в 2008 году Нобелевской премии по химии [1–3]. Именно на основе этого белка учёными из лаборатории молекулярных технологий Института биоорганической химии (Россия, Москва) был разработан фототоксический флуоресцентный белок KillerRed (следует отметить, что флуоресцентные белки изучают здесь и в лаборатории биофотоники, как мало где еще во всем мире). При облучении зелёным светом KillerRed производит перекись водорода, токсичную для клеток. Это делает его объектом не только медицинских прикладных исследований, но и инструментом для исследования внутриклеточных сигнальных путей с участием активных форм кислорода [4].
Совсем другое происхождение имеет фототоксический флуоресцентный белок miniSOG. Этот флуоресцентный белок генно-инженерными методами получен из домена рецептора синего света растений. В отличие от белков семейства GFP он содержит в своём составе молекулу небелкового происхождения (флавинмононуклеотид, постоянно присутствующих в живых клетках; рис. 1). Ещё одно важное отличие состоит в том, что при облучении синим светом miniSOG производит синглетный кислород, чрезвычайно токсичный для клеток [5].
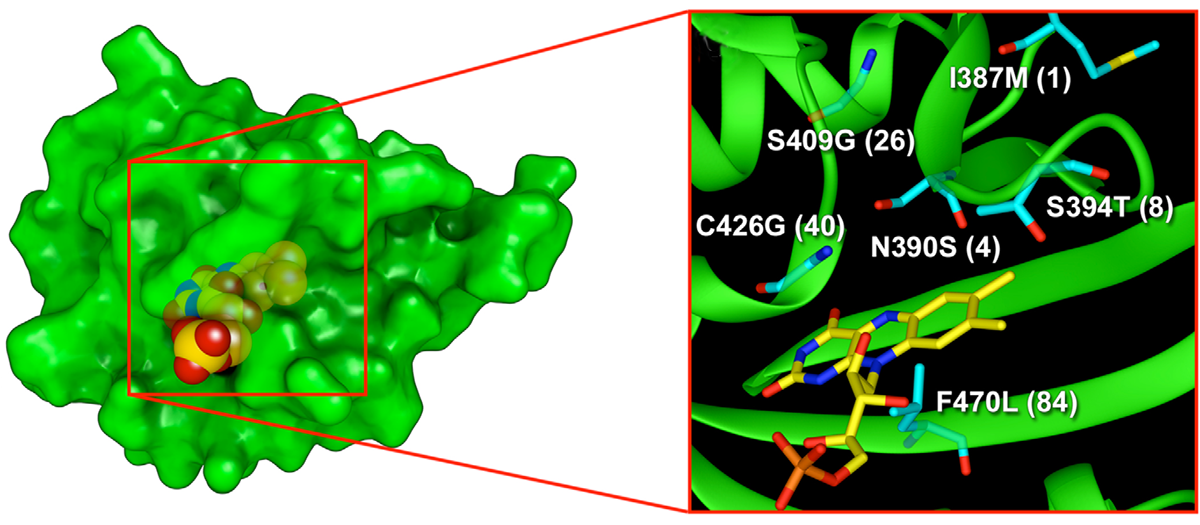
Рисунок 1. Предполагаемые пространственные структуры белка miniSOG и его активного центра
Фототоксическое влияние miniSOG на клетки
Сочетание всех этих свойств делает miniSOG весьма интересным как для молекулярно-биологических манипуляций, так и для прикладных исследований. Его токсичность для клеток может быть использована в противораковой фотодинамической терапии. Фотодинамическая терапия — это способ лечения раковых заболеваний, использующий сочетание молекул фотосенсибилизаторов и видимого света и вызывающий гибель раковых клеток.
Именно поэтому изучение влияния miniSOG в различных органеллах на жизнеспособность клеток представляется весьма перспективным. Такие исследования были проведены в уже упоминавшемся Институте биоорганической химии. В этой работе исследовались клетки, имеющие белок miniSOG в митохондриях, ядре или на мембране (рис. 2). Было показано, что клетки, которые образуют miniSOG, после облучения синим светом погибают. Причём наибольшая вероятность гибели из трёх исследованных органелл была достигнута в случае связанного с мембраной белка и достигала 90%. Кроме того, для разных органелл, содержащих miniSOG, отличался и способ клеточной гибели. Так, например, для «митохондриального» и «ядерного» miniSOG был свойственен апоптоз (запрограммированное клеточное «самоубийство», рис. 3), а для мембранного — некроз (клеточная гибель, приводящая к последующему воспалительному процессу).
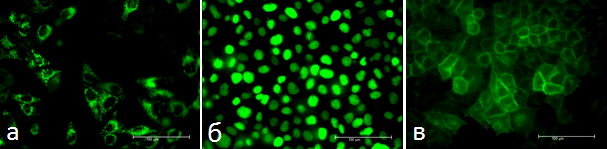
Рисунок 2. Экспрессия фотосенсибилизатора miniSOG в митохондриях (а), ядре (б) и на плазматической мембране (в)
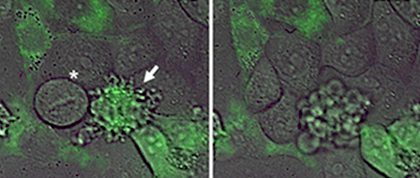
Рисунок 3. Апоптотическая гибель клеток HeLaKyoto, содержащих miniSOG в митохондриях. Видны специфические для апоптоза пузырьковые структуры.
Следует отметить, что miniSOG вызывает достаточно серьёзные повреждения в клетке. Например, было показано, что после облучения синим светом клеток, содержащих miniSOG в ядре, начинается сборка восстанавливающих структуру ДНК комплексов с участием белка XRCC1 (одного из ключевых компонентов в процессе репарации ДНК). Такие комплексы не образуются ни до, ни после облучения, если в клетке отсутствует miniSOG (рис. 4).
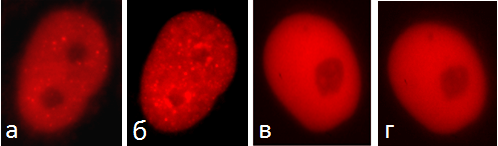
Рисунок 4. Образование репарационных комплексов на ДНК с участием белка XRCC1 после облучения синим светом клеток, содержащих miniSOG в ядре (а — клетка до облучения; б — после облучения). Представлены клетки без miniSOG до (в) и после (г) облучения.
Таким образом, miniSOG является эффективным генетически кодируемым фотосенсибилизатором, вызывающим гибель клеток в ответ на облучение. У клеток появляется новое свойство — «светобоязнь»: уязвимость к излучению видимого спектра, в норме безвредного как для отдельных клеток, так и для целых организмов. Это делает miniSOG незаменимым молекулярно-биологическим инструментом в генно-инженерных исследованиях и медицинских разработках.
Фотодинамическая терапия
Естественно, возникает желание применять miniSOG и в фотодинамической терапии раковых заболеваний. Однако здесь следует упомянуть существенные недостатки уже используемых в настоящее время фотосенсибилизаторов химической природы. Наиболее важным является то, что такие фотосенсибилизаторы невозможно доставить только в опухоль. Они оказываются распространёнными по всему организму, хотя в ряде исследований было показано их преимущественное накопление в опухоли. Поэтому для человека, подвергшегося фотодинамической терапии, в течение длительного времени нахождение на солнце, да и вообще в освещённом месте является вредным и болезненным. Кроме того, накопление химических фотосенсибилизаторов происходит во всех органеллах клетки. Этот фактор делает сложным предсказание способа гибели клеток. А, как уже было сказано выше, гибель клеток путём некроза вызывает серьёзные воспалительные реакции, совсем не нужные пациенту в тяжёлом состоянии.
Безусловно, такие проблемы могут быть решены с использованием генетически направленных фотосенсибилизаторов (miniSOG, KillerRed). Прикрепив к последовательности гена фототоксического белка последовательность, характерную для конкретной органеллы, можно обеспечить накопление фотосенсибилизатора в желаемой органелле. Такой способ позволяет строго контролировать распространение фототоксического белка в клетке.
Другая задача — это обеспечить доставку фотосенсибилизатора именно в раковую клетку и только в неё. В настоящее время этого можно достичь с использованием вирусных частиц направленной доставки. Суть данного метода заключается в следующем. Во-первых, используются вирусные частицы, у которых удалена значительная часть генома, что делает их неспособными к размножению. Это обеспечивает безопасность использования вирусных препаратов. Во-вторых, вирусная частица несёт в своём составе ген фотосенсибилизатора, что и обеспечивает фототоксичность при фотодинамической терапии. И, наконец, в-третьих, такие частицы имеют на своей поверхности молекулы антител к молекулам антигенов, присутствующих на плазматической мембране только раковых клеток. Это обеспечивает направленность.
Однако здесь следует отметить, что в настоящее время не для каждой формы рака известен специфический антиген, и обнаружить его не так просто, поскольку антигенная структура раковой клетки может быть слишком разнородна или, напротив, не отличаться от здоровой клетки. Уже известно, что клетки рака молочной железы и некоторых других типов имеют на своей поверхности молекулы HER2 (human epidermal growth factor receptor 2, человеческий рецептор эпидермального фактора роста 2). Клетки опухоли щитовидной железы имеют рецепторы фактора роста эндотелия сосудов, клетки метастазирующей меланомы — постоянно активированную мутантную форму серин/треониновой киназы BRAF и т.д. Кроме того, на основе имеющихся данных об известных опухолевых антигенах разрабатываются методы направленной доставки к раковым клеткам липосом и полимерных капсул, содержащих цитотоксические вещества [6]. Но такая доставка оказывается недостаточно эффективной, и осуществлять её следует многократно. Предполагается, что данную проблему может помочь решить генетически кодируемый фотосенсибилизатор, доставленный в раковую клетку с помощью направленных вирусных частиц.
Всё это делает применение генетически кодируемых фотосенсибилизаторов в сочетании с вирусными частицами направленной доставки очень привлекательным для противораковой терапии. Однако данный метод должен быть более точно и тонко разработан, прежде чем его можно будет применять для лечения. Но сама по себе возможность такого подхода таит в себе большие перспективы. Ведь вполне возможно, что в недалёком будущем люди научатся лечить раковые заболевания солнечным лучом.
Литература
- Osamu Shimomura. (2009). Discovery of Green Fluorescent Protein (GFP) (Nobel Lecture). Angew. Chem. Int. Ed.. 48, 5590-5602;
- Dmitriy M. Chudakov, Sergey Lukyanov, Konstantin A. Lukyanov. (2005). Fluorescent proteins as a toolkit for in vivo imaging. Trends in Biotechnology. 23, 605-613;
- Флуоресцирующая Нобелевская премия по химии;
- Maria E Bulina, Dmitriy M Chudakov, Olga V Britanova, Yurii G Yanushevich, Dmitry B Staroverov, et. al.. (2006). A genetically encoded photosensitizer. Nat Biotechnol. 24, 95-99;
- Xiaokun Shu, Varda Lev-Ram, Thomas J. Deerinck, Yingchuan Qi, Ericka B. Ramko, et. al.. (2011). A Genetically Encoded Tag for Correlated Light and Electron Microscopy of Intact Cells, Tissues, and Organisms. PLoS Biol. 9, e1001041;
- Angus P. R. Johnston, Marloes M. J. Kamphuis, Georgina K. Such, Andrew M. Scott, Edouard C. Nice, et. al.. (2012). Targeting Cancer Cells: Controlling the Binding and Internalization of Antibody-Functionalized Capsules. ACS Nano. 6, 6667-6674.







