
«Омики» — эпоха большой биологии
22 ноября 2013
«Омики» — эпоха большой биологии
- 10770
- 0
- 18
На молекулярной иллюстрации Дэвида Гудселла изображена иммунная клетка человека (снизу), атакующая бактерию (сверху). Омики помогли нам узнать многое о молекулах, работающих в клетках. Помогут ли они нам разобраться во взаимоотношениях этих молекул?
-
Автор
-
Редакторы
Благодаря нашумевшему проекту «Геном человека» слов с суффиксом «-ом» становится все больше. Появление вслед за генóмом и протеóмом большого количества новых омов — свидетельство важной тенденции в мире современной биологии. Все больше проводится крупномасштабных исследований, результатом которых становится не описание отдельных молекул, а большие массивы сложно организованных данных. О том, какие новые дисциплины появились в эпоху большой биологии и какое развитие получили «классические» омики, рассказывается в этой статье.
В 1920 году ботаник Ганс Винклер (Hans Winkler) не мог и предположить, какая судьба ждет термин «геном», который он предложил для обозначения совокупности хромосом организма. Некоторые «омы» тогда уже существовали: например, биом (совокупность живых организмов) и ризом (корневая система растения). Все они основаны на греческом суффиксе «-ом», означающем «имеющий природу». Но именно популяризация слова «геном» при участии проекта Геном человека [1] привела к появлению моды на омы и омики. Алекса МакКрей (Alexa McCray), специалист по лингвистике и медицинской информации в Гарварде, комментирует: «Используя суффикс „-ом“, вы показываете, что принадлежите к абсолютно новой увлекательной области науки» [2].
В последние годы ученые начали осознавать маркетинговый потенциал этого вдохновляющего суффикса. Джонатан Эйсен (Jonathan Eisen), микробиолог из Университета Калифорнии в Дэвисе, отмечает: «Люди пытаются убедить окружающих, что область их исследований — самостоятельная отрасль науки, и что она заслуживает особого финансирования» [2]. И, несмотря на то, что названия некоторых омик заставляют удивленно приподнять бровь (например, цилиомика — изучение различных выростов на поверхности клеток), исследователи убеждены, что часть из них действительно заслуживает права быть отдельной областью исследований. При этом некоторые омики уже прочно заняли свое место в современной биологии — например, геномика, транскриптомика, протеомика и метаболомика, — названия других все еще звучат непривычно, но все они отражают движение к новой «большой», интегративной биологии. О некоторых из этих новых дисциплин будет рассказано в этой статье.
Инциденталом (incidentalome)

Рисунок 1. «К сожалению, я не могу принять вас на работу, т.к. нам не нравятся последовательности вашей ДНК, отвечающие за характер». Помимо проблемы инциденталома возможность определить последовательность персонального генома таит в себе и другие опасности. Например, как поведет себя ваш начальник, если узнает что-то об особенностях вашей ДНК?
Термин «инциденталом» был впервые применен Исааком Кохане (Isaac Kohane), изучающим проблемы медицинской информации в детском госпитале в Бостоне. Несмотря на то, что тогда еще не было современных технологий, сделавших персональный геном реальностью, в своей статье 2006 года [3] Кохане высказал опасение, что увеличивающаяся доступность генетической информации в скором времени приведет к сложной этической проблеме в медицине.
Необычное название происходит от слэнгового термина врачей — «инциденталóма» (от англ. incident — случайность) — бессимптомная опухоль, обнаружившаяся при обследовании больного в связи с другими жалобами. Что-то похожее происходит и при изучении генома человека — выясняется неожиданная информация, которую никто не искал. Поиск генетических причин проблем со слухом у ребенка, например, может выявить повышенный риск развития сердечных заболеваний или рака в старшем возрасте. Но стоит ли сообщать об этом пациенту, и если стоит — то когда?
Проведенное в 2012-м году исследование [4] показало масштабы этической проблемы. Среди 16 специалистов-генетиков провели опрос о ряде мутаций, вовлеченных в развитие 99 распространенных генетических заболеваний. Эти мутации могут обнаружиться в ходе полномасштабного секвенирования генома независимо от того, нужно это врачу или нет. Примерно в четверти случаев этих заболеваний и связанных с ними мутаций все 16 опрошенных специалистов выразили готовность проинформировать своих взрослых пациентов о результатах секвенирования. Но только 10 сделали бы это для болезни Хантингтона [5] — неизлечимого нейродегенеративного заболевания — и еще меньшее согласие было по поводу некоторых других сложных заболеваний, и того, что стоит говорить родителям, если мутации обнаружены у их ребенка.
Самая большая проблема секвенирования персонального генома — наличие в геноме человека большого количества вариаций, роль которых в поддержании здоровья человека еще неизвестна. Один из возможных путей решения проблемы инциденталома — предоставление пациенту выбора, какую информацию о своем геноме он хотел бы знать, а какую — нет.
Феном (phenome)
С развитием методов секвенирования нового поколения [6] «прочесть» геном человека стало не такой уж трудной задачей. То, чего не хватает, это фенóмы: точное описание фенотипа — т.е. всех физических и поведенческих характеристик человека. Больше всего исследователей интересуют те характеристики, которые связаны с болезнями: патологии внешнего облика, когда и почему был поставлен диагноз. Причем хорошо было бы иметь эти описания в такой форме, которая доступна для восприятия компьютеру, чтобы связать фенотипические параметры с особенностями генома.
Как часто бывает в биологии, исследования в новой области начались с лабораторных организмов. Феномные проекты уже ведутся для мыши, крысы, дрожжей, рыбки данио и растения арабидопсис. Самый лучший подход для этих исследований — последовательное выключение отдельных генов и изучение изменений внешности, поведения и метаболизма, которые последуют за такой мутацией. Такое, разумеется, невозможно применить к человеку, но специалисты надеются получить необходимую информацию, тщательно записывая историю болезни пациентов, хотя тут их ждет немало сложностей.
Даже для «менделевских» заболеваний, которые вызываются мутацией в одном гене, не всегда легко обнаружить ген-причину. Из более чем шести тысяч редких наследственных заболеваний менее чем для половины удалось определить их генетическую основу. Одна из проблем в этой области — найти достаточное количество больных, так как некоторые болезни встречаются у одного человека из миллиона. «Возможно, мы бы разобрались с большинством „менделевских“ заболеваний, если бы у нас был доступ к достаточному количеству хорошо описанных случаев», — говорит Михаэль Бамшад (Michael Bamshad), генетик Университета Вашингтона в Сиэттле.
Для этого нужно обработать записи о пациентах из разных стран и континентов. При этом многие исследовательские и медицинские центры уже давно имеют устоявшуюся систему терминов для описания и характеристики различных отклонений. Из-за этого объединить источники бывает непросто, ведь если один и тот же симптом будет описан одним врачом как «боль в желудке», а другим как «гастроэнтерит», то эти пациенты не могут быть объединены в одну группу, объясняет Ричард Коттон (Richard Cotton), генетик из Университета Мельбурна в Австралии.
В ноябре 2012 года Коттон был одним из участников съезда «Подготовка к проекту фенома человека» [7] в Сан-Франциско (США). Главной задачей съезда было сделать обмен фенотипической информацией между учеными проще и удобнее. Консорциум по изучению редких заболеваний, который называется Orphanet, пытается добиться от врачей и исследователей соглашения об одной-двух тысячах стандартных терминов. Это поможет привести в порядок часто разрозненно оформленные и запутанные электронные медицинские записи для того, чтобы компьютерные программы могли автоматически сортировать и обрабатывать их.
Интерактом (interactome)
Центральная догма молекулярной биологии напрямую выводит нас к трем главным «омам» — геному (ДНК), транскриптому (РНК) и протеому (белки). Но для понимания устройства живых организмов недостаточно описать все компоненты живых систем, нужно еще и разобраться, как они взаимодействуют. Всё в живых организмах — жизнь и смерть отдельных клеток, развитие зародыша из зиготы и работа нейронов — обеспечивается взаимодействием молекул между собой. Термин «интерактом» происходит от английского to interact — взаимодействовать — и описывает все возможные взаимодействия молекул друг с другом. По уровню сложности его можно назвать «королем» омов: рассмотрев только парные взаимодействия для известных 20 тысяч белков, мы получим уже около 200 миллионов вариантов.
Но некоторых ученых не пугает масштаб стоящей перед ними задачи. Марк Видал (Marc Vidal), специалист по системной биологии в Институте изучения рака в Бостоне, надеется еще до своего ухода на пенсию увидеть черновой набросок всех взаимодействий, кодируемых геномом. «Это то, над чем мы работали последние 20 лет, и мы уже вплотную приблизились к нашей цели», — говорит он [2].

Рисунок 2. Интерактом мембранных белков дрожжей. Белки, обозначенные кружками, объединены в несколько групп (белки ЭПС, пероксисом, плазматической мембраны и др.). Линии, соединяющие кружки, показывают взаимодействующую пару белков.
К настоящему времени команда Видала и несколько других лабораторий описали около 10–15% белок-белковых взаимодействий в организме человека. Для этого они использовали особые генетически модифицированные клетки, которые подают сигнал, если изучаемая пара белков взаимодействует. Другие ученые добиваются этого с помощью извлечения белков из искусственно разрушенных клеток и анализа белковых пар, которые при этом можно обнаружить. Третьи — изучают литературу и разрабатывают методы компьютерного предсказания возможных взаимодействий на основе пространственной структуры белков. Важно, что сейчас ученые начинают понимать, как отделить зерна от плевел и вычленить естественные взаимодействия, отбросив ложные результаты. Одним из важных критериев для такого отбора служит возможность получить один и тот же результат при использовании разных техник. Но даже в условиях еще не законченного интерактома ученые уже могут и начинают все активнее обращаться к уже полученным в этой области данным.
Хайюан Ю (Haiyuan Yu), системный биолог из Корнелльского университета, и его коллеги протестировали около 18 миллионов потенциальных белковых пар и просмотрели все доступные базы данных для того, чтобы выделить 20 614 взаимодействий между 7410 человеческими белками. Примерно для пятой части этих белков исследователи могут назвать взаимодействующие участки (домены) белков. Они обнаружили, что связанные с болезнями мутации чаще всего обнаруживаются именно в местах контакта поврежденного белка с другими белками. Например, заболевание крови — синдром Вискотта-Олдрича — возникает при наличии мутации в белке WASP, но только в том случае, если эта мутация попадает в участок, с помощью которого WASP взаимодействует с белком VASP. Как отмечает Ю, генетические различия, не объясняющие нам ничего при исследовании последовательности генов, приобретают особый смысл при исследовании взаимодействий белков.
Видал считает, что вся информация о взаимодействиях белков может быть разложена на два уровня, которые в сумме составят полный интерактом. В основе должно лежать описание всех парных взаимодействий, уровнем выше — описательная характеристика этих контактов (сколько он длится, в каких условиях возникает, и какие части белков взаимодействуют).
В не очень далеком будущем, считает Видал, врач будет привлекать к диагностике не только последовательность генома пациента, но и внимательно анализировать все последствия изменений интерактома, не говоря уже о влиянии этих изменений на феном. Геном, в конце концов, абсолютно статичен, и именно интерактом меняется под действием внешних факторов.
Токсом (toxome)
Томас Хартунг (Thomas Hartung) хочет узнать все о том, как маленькие молекулы могут навредить человеку. Для этого он создал проект токсома человека (Human Toxome Project), который к настоящему моменту существует уже более шести лет. Суффикс «-ом», по словам Хартунга, призван подчеркнуть масштабный характер проекта, цель которого — описать все клеточные процессы, связанные с проявлением токсичности.
Проверка токсичности конкретного вещества с помощью лабораторных животных обходится исследователям и государственным организациям в миллионы долларов, однако даже при этом лабораторные тесты могут неправильно предсказывать реакцию человеческого организма. Каждое шестое лекарство сталкивается с проблемой токсических эффектов на стадии клинических испытаний с участием людей. Хартунг считает, что токсом мог бы помочь в разработке удобных и более дешевых лабораторных тестов, которые будут основаны на человеческих клетках и смогут заменить исследования на животных. Понимание того, какие клеточные пути затрагивает исследуемое вещество, может помочь ученым в разработке менее токсичных аналогов.
Для начала Хартунг планирует подвергнуть клетки действию различных токсических веществ и проследить за изменениями их метаболома и транскриптома. Он надеется обнаружить, в каких местах метаболических или сигнальных каскадов происходят нарушения, приводящие к изменению работы гормонов, отравлению клеток печени, изменению сердечного ритма или другим отклонениям в работе организма человека. По мнению Хартунга, общее количество таких внутриклеточных путей составит всего пару сотен — достаточно небольшое количество для создания токсикологических тестов. Пока проект все еще находится на начальном этапе развития — ученые пробуют разные экспериментальные подходы и ищут те, которые дают одинаковый результат в разных лабораториях.
Конечно, нельзя забывать о том, что даже если вещество выглядит безопасным при тестировании в культуре клеток, при попадании в организм оно может повести себя по-другому, — например, превратиться в токсин в результате обработки печеночными ферментами. Но даже с учетом возможных ошибок, разработка новых токсикологических тестов с помощью токсома человека должна сильно упростить тестирование лекарственных и пищевых веществ и сохранить не только государственные деньги, но и жизни лабораторных животных.
Интегром (integrome)
Путь к разгадке самых сложных загадок биологии лежит, по мнению Юджина Колкера (Eugene Kolker), не в создании новых омов и омик, а в объединении — интеграции — тех, которые уже есть. Поприветствуйте интегром — информация по всем омам в одном котле, которая благодаря обобщающему анализу может открыть много нового и интересного.
Представьте себе Google-карты: несколько карт, показывающих по отдельности расположение улиц, заправок и ресторанов пригодились бы нам гораздо меньше, чем знание о том, что на какой-то конкретной улице рядом с рестораном расположена заправочная станция. Но большинство современных омик останавливается именно на этапе создания списков — генов, белков, РНК. Такой подход исключает изучение взаимодействий и упускает многое — например, то, что изменение двух несвязанных белков может привести к одинаковому результату, т.к. их метаболические пути частично перекрываются.
В лаборатории Трея Идекера (Trey Ideker) был разработан подход, который может сделать создание интегрома реальностью уже в ближайшем будущем. Ученые создали метод автоматизированного анализа и объединения отдельных омик: компьютерная программа изучает несколько баз данных и ищет общие принципы, по которым можно определить функцию гена, а затем использует полученные знания для того, чтобы классифицировать еще не изученные гены (рис. 3) [8]. Таким образом, используется не традиционный поход, при котором теоретически разработанная система понятий используется для объяснения данных, а на основе эмпирических данных создается новая описательная система. Первое тестирование системы было произведено на базах данных по дрожжам-сахаромицетам, и полученные результаты вселили энтузиазм в исследователей. Подобные компьютерные алгоритмы, конечно, не смогут заменить кураторов-людей, но станут хорошим дополнением и помощью в облегчении их работы.
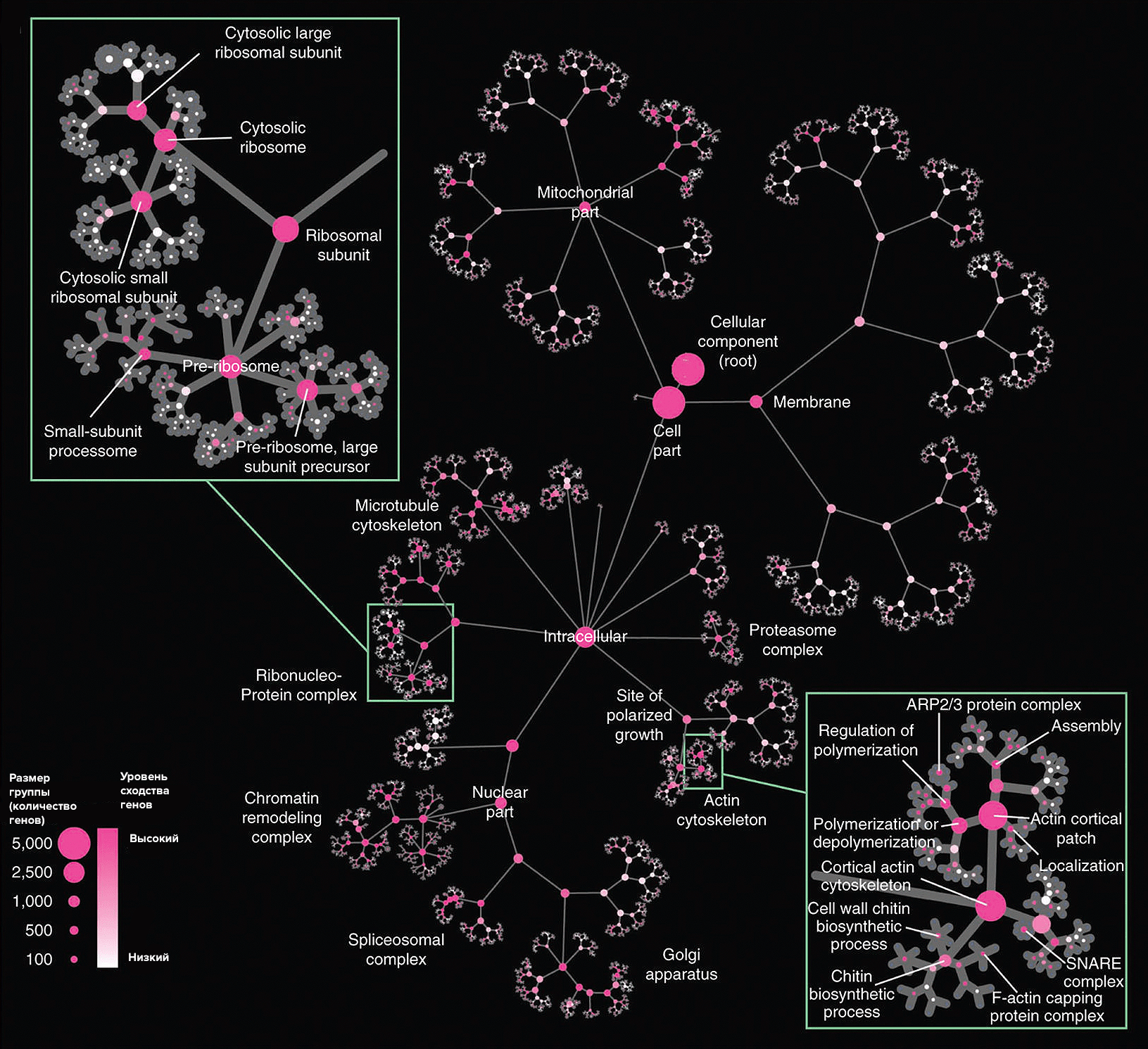
Рисунок 3. Такие красивые деревья получаются при визуализации по методу лаборатории Идекера для компьютерного создания интегрома. Кружки представляют собой группы генов, созданные по определенному признаку, размер кружка определяет размер группы, а насыщенность окраски — степень близости последовательностей генов внутри группы.
В 2012-м году генетик из Стэнфордского университета Михаэль Снайдер (Michael Snyder) опубликовал свой личный интегром (хотя он называет его «обобщенный личный профиль омик», а некоторые другие ученые с немалой долей иронии — «нарциссóм»), объединяющий данные по его геному, транскриптому, протеому и метаболому. Последовательность ДНК генома Снайдера выявила повышенный риск развития диабета, и во время работы над проектом врачи действительно выявили у него повышенный уровень сахара в крови [9]. Интересно, что в интегроме Снайдера были выявлены и некоторые другие биохимические отклонения, которые раньше не связывали с развитием этого заболевания.
Интегративная биология
За последние годы развитие крупномасштабных исследований в биологии стремительно набирает обороты: различные омы создаются не только в области молекулярной биологии, но и в других областях — например, коннектом для описания связи всех нейронов в мозге человека и животных или микробиом для описания сообществ микроорганизмов, обитающих в организме человека. В то же время появляется новая тенденция — объединять уже имеющиеся базы данных для выяснения связи между разными системами в живом организме, создавать проекты, в рамках которых ученые из разных областей биологии дополняют эксперименты друг друга для создания новой интегративной биологии.
Литература
- Геном человека: как это было и как это будет;
- Monya Baker. (2013). Big biology: The ’omes puzzle. Nature. 494, 416-419;
- Isaac S. Kohane, Daniel R. Masys, Russ B. Altman. (2006). The Incidentalome. JAMA. 296, 212;
- Robert C. Green, Jonathan S. Berg, Gerard T. Berry, Leslie G. Biesecker, David P. Dimmock, et. al.. (2012). Exploring concordance and discordance for return of incidental findings from clinical sequencing. Genet Med. 14, 405-410;
- Как спасти Тринадцатую? (Перспективы лечения болезни Хантингтона);
- 454-секвенирование (высокопроизводительное пиросеквенирование ДНК);
- William S. Oetting, Peter N. Robinson, Marc S. Greenblatt, Richard G. Cotton, Tim Beck, et. al.. (2013). Getting Ready for the Human Phenome Project: The 2012 Forum of the Human Variome Project. HUMAN MUTATION. 34, 661–666;
- Janusz Dutkowski, Michael Kramer, Michal A Surma, Rama Balakrishnan, J Michael Cherry, et. al.. (2013). A gene ontology inferred from molecular networks. Nat Biotechnol. 31, 38-45;
- Упреки в нарциссомике;
- Геном человека: как это было и как это будет;
- Erika Check Hayden. (2011). Cells may stray from 'central dogma'. Nature;
- Обо всех РНК на свете, больших и малых;
- Allen Brain Atlas: транскриптом мозга;
- Миллиард на протеомику;
- Gyorgy Marko-Varga, Gilbert S. Omenn, Young-Ki Paik, William S. Hancock. (2013). A First Step Toward Completion of a Genome-Wide Characterization of the Human Proteome. J. Proteome Res.. 12, 1-5;
- Sushil Sharma, Carolyn Seungyoun Moon, Azza Khogali, Ali Haidous, Anthony Chabenne, et. al.. (2013). Biomarkers in Parkinson’s disease (recent update). Neurochemistry International. 63, 201-229;
- Как распознать рак при помощи биомаркеров?;
- Cross-Disorder Group of the Psychiatric Genomics Consortium. (2013). Identification of risk loci with shared effects on five major psychiatric disorders: a genome-wide analysis. The Lancet. 381, 1371-1379;
- Bezprozvanny I.B. (2010). Calcium signaling and neurodegeneration. Acta Naturae. 2, 72–82;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Перевалило за тысячу: третья фаза геномики человека;
- Секвенирование единичных клеток (версия — Metazoa).





