Сводка с генотерапевтических фронтов. Новая стратегия нейтрализации гемофилии
06 февраля 2015
Сводка с генотерапевтических фронтов. Новая стратегия нейтрализации гемофилии
- 1874
- 0
- 3
Лечение гемофилии: эволюция терапевтических агентов. По часовой стрелке: Г.Распутин (до 1916 г.), свежезамороженная плазма крови (до сих пор) и рекомбинантный аденоассоциированный вирус с терапевтическим геном (скоро).
Рисунок в полном размере.
-
Автор
-
Редакторы
Калифорнийские ученые разработали беспромоторную и безнуклеазную стратегию компенсации мутаций гена свертывающего фактора IX, тем самым избавив от повышенной кровоточивости разновозрастных мышей. Остроумный способ конструирования и введения терапевтического вектора предполагает наименьшее количество возможных побочных эффектов этиологического лечения не только гемофилии B, но и других наследственных заболеваний.
Генная терапия — вызов, брошенный человечеством природе, мудрой в целом, но иногда очень несправедливой по отношению к индивиду. Борьба врачей, биологов, физиков и химиков с генетическими дефектами, выливающимися в тяжелые хронические заболевания, начинает приобретать характер войны. Наступление ведется по нескольким фронтам одновременно. И даже конкуренция стратегий идет на пользу общему делу — каждая группа исследователей выискивает недостатки чужих разработок, учитывает их в планировании своих, заимствует у коллег самое остроумное и надежное. Ведь крайне желательно, чтобы как можно меньше мирного населения («подопытных») полегло на этих фронтах: проводятся сотни клинических испытаний разных генотерапевтических подходов, в некоторых наблюдается достойный компенсирующий эффект, однако даже в минимальных выборках встречаются побочные эффекты (особенно часто — канцерогенез).
Возможно, придётся находить баланс между рисками исходного заболевания и побочных эффектов. Например, на чашах весов могут расположиться гемофилия и сбой в работе печени, который можно быстро компенсировать. С другой стороны, технологии развиваются в очень конкурентной среде, и генноинженерные группы разными путями приближаются к «Святому Граалю» — замене дефектного гена на нормальный. Путь должен быть максимально прост (и дёшев), а «вылеченный» генόм не должен содержать ничего лишнего. Идея-то проста, а вот реализовать ее в живом организме сложно. Оригинальную стратегию предложила калифорнийская группа с «костяком» из сотрудников Стэнфордского университета, включая Ади Барцеля и Марка Кея, недавно основавших биотехнологическую компанию LogicBio Therapeutics [1]. Их задача-минимум заключалась в преодолении генетически обусловленного дефицита фактора свертываемости крови IX у страдающих гемофилией B мышей (см. справку по гемофилии), а задача-максимум — сделать это без ущерба для грызунов, ведь на их месте скоро будут люди.
Как перенести терапевтический ген в нужные клетки и обеспечить его поддержание?
В первую очередь калифорнийской команде пришлось поразмыслить именно над этим вопросом. Обычно клонированный терапевтический ген находится в векторе в составе экспрессионной кассеты, содержащей подходящие регуляторные элементы. После введения в клетку все это добро может встроиться в хромосому (специфично или нет) либо жить себе отдельно в виде эписомы. Наиболее эффективными «проводниками» чужеродной ДНК в эукариотические клетки — векторами — считаются предварительно «выпотрошенные» вирусы [6], у которых из родного генома остаются лишь необходимые для трансдукции фрагменты. То есть эти дефективные агенты инфицируют клетку, но не могут ее разрушить и заразить соседние. Чаще всего в генотерапевтических экспериментах участвуют ретровирусы (в том числе лентивирусы) и аденовирусы. Однако выбор Ади Барцеля и его коллег пал на стремительно набирающих популярность «малых, да удалых» аденоассоциированных вирусов. Почему?
На выбор вектора прежде всего влияют тип «целевой» ткани и активность деления ее клеток. Гамма-ретровирусы могут проникать в ядра только делящихся клеток , в то время как ленти- (ВИЧ), адено- и аденоассоциированные вирусы — в любые ядра, однако их серотипы отличаются по тропизму к разным тканям.
О генотерапии онкозаболеваний: «Генная терапия против рака» [7] — Ред.
Ретровирусные системы довольно ёмкие (в капсиды можно утрамбовать 7 тыс. рибонуклеотидов), малоиммуногенные, однако встраиваются в хромосомы чуть избирательнее, чем «от балды». Для повышения специфичности встраивания ученые связывают их интегразу с «навигаторами» типа белковых доменов «цинковые пальцы». Или вовсе лишают вектор интегразы, обрекая его на эписомное существование, очень недолгое в делящихся клетках: вектор-то не реплицируется, и его концентрация (вместе с лечебным эффектом) со временем «разбавляется». Но все-таки в случае с ретровирусами это самый безопасный вариант, поскольку трудно предсказать последствия встраивания вектора, да еще с промоторами и энхансерами, в случайные места. Например, документировано несколько случаев клональной экспансии и лейкемии вследствие инсерции лентивирусной терапевтической конструкции в протоонкогены [7].
Аденовирусы не умеют встраиваться в геном хозяина, чрезвычайно ёмки (можно упаковать ДНК размером до 35 т.п.н.), но очень иммуногенны и способны вызывать сильнейшие воспалительные реакции. Более того, каждый человек имеет антитела к большинству их серотипов, что снижает эффект генотерапии. И как только исследователям не приходится изворачиваться — подбирать редкие серотипы, мутировать поверхностные белки! А вот «разбавления» вектору в любом случае не избежать...
Аденоассоциированные вирусы (AAV), содержащие одноцепочечную ДНК, почти всем хороши: не вызывают болезней у человека (потому и иммунная система их почти игнорирует), обладают тропизмом к разным тканям, могут производить терапевтические продукты как в виде эписом, так и очень быстро и даже специфично рекомбинировав с хромосомной ДНК. Одно плохо: клонировать в такие векторы можно до 4,5 тыс. нуклеотидов — капсиды миниатюрные. И на некоторые серотипы иммунная система таки реагирует, что выяснилось уже в клинических испытаниях.
Для генотерапии создают рекомбинантные, лишенные вирусных генов, AAV-серотипы с тропностью к нужной ткани (rAAV1–rAAV9). Если нужно получить эписому, то лечебный ген с промотором встраивают между оставшимися от вирусной ДНК инвертированными концевыми повторами. В настоящее время проводятся клинические испытания гепатотропной конструкции, содержащей нормальный ген антигемофильного фактора IX [8]. Авторы работы усилили экспрессию фактора упаковкой в вирион самокомплементарного димера вектора и «переодели» иммуногенный AAV2 в более «нейтральный» капсид AAV8. Замещающий эффект —
Но главное, что вызывает опасения, — краткосрочность терапевтического эффекта трансгенов в эписомных векторах, особенно в делящихся клетках (например, у детей или при некоторых болезнях), а повторное введение вряд ли будет эффективным из-за образовавшихся антител. Ну и привнесение чужеродного промотора, конечно. Расследование нескольких случаев карциномы печени у мышей, которым ввели промотор- и энхансер-содержащий rAAV-вектор, установило связь онкогенеза с инсерцией вектора в хромосому 12 [9]. Встраивание произошло благодаря микрогомологиям между rAAV и хромосомой в районе генов Rian и Mirg, кодирующих множество мяРНК и микроРНК. В результате «переэкспрессии» этих генов аномально активировались другие, и происходила клональная экспансия клеток с нелегитимной инсерцией.
Ясно, что для стабильной экспрессии трансгена в любой ткани идеальный вариант — интеграция в хромосому, но интеграция специфичная, в конкретное место. Логичным кажется, например, прямое замещение дефектного участка ДНК нормальным. В этом направлении развиваются терапевтические подходы, основанные на использовании нуклеаз, редактирующих человеческий геном (ZFN, TALEN и CRISPR/Cas9). Это химеры из двух модулей, один из которых распознает определенную олигонуклеотидную последовательность, а другой (у ZFN и TALEN — домен эндонуклеазы FokI) режет обе цепи ДНК [10]. «Распознающий», обеспечивающий специфичность нуклеазы, модуль у ZFN, например, представлен протеиновым доменом «цинковые пальцы». Двухцепочечные разрезы могут репарироваться с образованием небольших инсерций/делеций и смещением рамок считывания, либо в них можно встроить нужные гены: просто «пришить» (негомологичная интеграция) или же «подогнать» фрагмент с участками гомологии (гомологичная интеграция/рекомбинация). Обычно в клетки вводят два вектора: один несет ген нуклеазы под промотором, второй — терапевтический ген с промотором или без. Двухвекторную систему с нуклеазой «цинковые пальцы» уже успешно применили in vivo, сократив время свертывания крови у мышей, страдающих гемофилией B [11].
Несмотря на обеспечение специфичности встраивания, не удаётся полностью избежать нецелевой (off-target) интеграции. Но даже в случае её преодоления никто не даст гарантии, что куда-нибудь не внедрится второй, эндонуклеазный, вектор. Да и как обеспечить лишь кратковременный синтез нуклеазы — ведь она не должна кромсать геном вечно, а лишь открыть «ворота» для лечебного гена? Некоторые предлагают совсем не вводить векторы с геном ZFN, а запускать уже «готовый» фермент, поскольку клеточные мембраны для него проницаемы. Раз нового синтеза не будет, нуклеаза постепенно элиминируется из клеточной популяции, снизив и частоту off-target-мутагенеза. Тем не менее, in situ-редактирование нуклеазами сопряжено с высоким риском развития неконтролируемого клеточного ответа на повреждение ДНК, иммуногенностью, стимуляцией хромосомных аберраций. Не говоря уже об активации соседних генов вносимыми промоторами. И все же у химерных рестриктаз огромное и светлое будущее если не в генной терапии, то в молекулярной биологии, связанной с изучением функций генов и получением изощренных мутаций, — без прецизионной инженерии теперь никуда!
Анализ накопленного опыта применения описанных генотерапевтических подходов побудил группу Ади Барцеля, работающую с мутантными по гену F9 мышами-гемофиликами, сделать ставку на аденоассоциированные вирусы (rAAV) и специфичную интеграцию. Только ещё и беспромоторную, и осуществляемую посредством гомологичной рекомбинации без всяких нуклеаз [1].
Мы свой, мы новый ген построим...
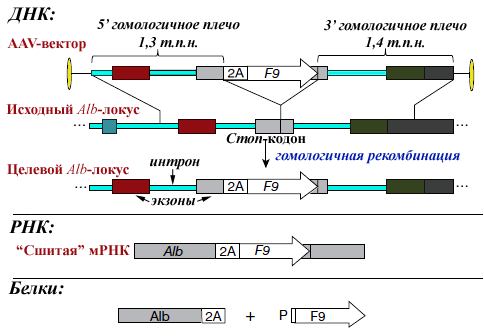
Рисунок 2. Схема конструирования вектора и экспрессии трансгена. Описание приведено в тексте. Темно-серые боксы справа — ДНК за пределами Alb. Конечные продукты: альбумин с «хвостиком» — С-концевыми аминокислотами 2A-пептида, фактор IX с пролином (Р) от 2A-пептида на N-конце.
из [1], с дополнениями
Фактор свертывания крови IX кодируется геном F9 в
Выбранный калифорнийским коллективом для доставки лечебного гена в мышей агент, rAAV8, обладает тропностью именно к гепатоцитам и считается малоиммуногенным. В печени непрерывно синтезируется альбумин (Alb) — доминирующий белок плазмы. Стабильную экспрессию его гена обеспечивает сильный промотор. Ади Барцель и его коллеги посчитали, что промотор альбумина выдюжит и еще один ген. «Приживалкой» должен был стать нормальный вариант человеческого гена F9. Идея интеграции «антигемофильных» кассет в Alb-локус животных не нова, однако реализовывалась она с помощью нуклеаз. Как же создавался «калифорнийский» вектор?
Прежде всего ученые амплифицировали 2,7-т.п.н. участок мышиного гена альбумина, содержащий примерно в середине стоп-кодон (рис. 2), клонировали его между вирусными инвертированными концевыми повторами. А вот дальше авторы использовали новомодный трюк — непосредственно перед альбуминовым стоп-сигналом ввели оптимизированный по кодонам человеческий ген F9, а прямо перед ним — ДНК-фрагмент, кодирующий 2А-пептид (см. справку по 2А-пептидам). В целевой конструкции гены Alb и F9 должны ко-транскрибироваться с единственного Alb-промотора, а трансляция F9 следовать сразу за трансляцией Alb, но полипептиды не будут связаны физически. Специфичность интеграции в геном гепатоцитов должны обеспечивать два (5′ и 3′) плеча гомологии.
Для снижения вероятности экспрессии кассеты в возможных местах нецелевой интеграции вектора AAV8-F9 авторы работы предусмотрели отсутствие старт-кодона ATG перед F9, 2А и предшествующим экзоном Alb. А в качестве отрицательного контроля получили такую же конструкцию, но с инвертированным по отношению к плечам гомологии фрагментом 2A-F9. При целевой интеграции «перевертыша» фактор IX (FIX) синтезироваться не будет, т.к. ген «увернулся» от контроля Alb-промотора, а вот в случае нецелевой встройки фактор в мышиной крови может и появиться.
И стар и млад мышиный рад — их гемостаз пошёл на лад

Рисунок 3. Экспрессия человеческого фактора IX (уровень FIX в плазме по данным ELISA) у взрослых мышей, которым в
Первым делом терапевтический вектор внутрибрюшинно ввели шести двухдневным мышатам в количестве 2,5×1011 молекул на особь, а контрольный — трем. Начиная с четвертой недели, иммуноферментным анализом (ELISA) еженедельно определяли уровни фактора IX в плазме мышат. У экспериментальной группы уже во время первого измерения они вышли на плато
Чтобы исключить зависимость целевой интеграции и высокой экспрессии AAV8-F9 от деления клеток (при развитии новорожденного), терапевтический и контрольный вектор (1×1012 молекулы на особь) ввели взрослым мышам в хвостовую вену (это малоинвазивно, что необходимо соблюдать при гемофилии). Еще одним контролем служила гидродинамически введенная в печень плазмида с геном F9 в «правильной ориентации». Как и в случае с новорожденными грызунами, антигемофильный фактор синтезировался на уровне
Биологическая активность фактора, кодируемого трансгеном, у мышей-пациентов достоверно не отличалась от таковой у здоровых мышей, т.е. время коагуляции нормализовалось. Локализацию терапевтического конструкта в печени подтвердили иммуногистохимически (своими глазами, можно сказать, увидели). Вестерн-блоттингом для верности показали, что в печени синтезируется фактор IX нужного размера, т.е. рибосома честно «прыгает» при трансляции 2А-пептида, и фактор процессируется должным образом.
Доказательств много не бывает
Да, хоть и сложно продумывать все нюансы эксперимента и доказывать его успешность, чтобы потом ни один рецензент не подкопался, но в случае генотерапии на кону стоит не только публикация в Nature, а чье-то здоровье. Потому группа А. Барцеля потрудилась на славу.
С помощью количественной ПЦР (qPCR) было показано, что интеграция AAV8-F9 произошла в среднем в 0,5% аллелей Alb как у новорожденных, так и у взрослых мышей. Кажется, что это ничтожное число, однако авторы работы не рассчитывали и на такое — ведь они даже не использовали специфические нуклеазы, а гепатоциты взрослых мышей почти не делились. Сравнительно высокий процент интеграции ученые пока могут объяснить только высоким уровнем экспрессии в локусе Alb и связанным с ним «гостеприимным» состоянием хроматина. Исключить на 100% возможность клеточной пролиферации, связанной с повреждением хромосом вектором, авторы не могут, однако они не наблюдали ни одного случая повышения активности аланинаминотрансферазы (АЛТ).
Конечно, коллектив больше всего заботила специфичность встраивания терапевтической кассеты, подтверждаемая в том числе и неразрывной связью экспрессии генов Alb и F9. С помощью количественной ОТ-ПЦР (qRT-PCR) удалось показать, что F9 транскрибируется исключительно (или почти) в виде «сшивки» Alb-F9, т.е. из целевой области под Alb-промотором.
Нозерн-блоттинг с зондом к РНК 2А-пептида выявил только «сшитые» транскрипты Alb-2А-F9, а вестерн-блоттинг с антителами к самому пептиду — что он появляется только совместно с альбумином, то есть, опять же, кодируется кассетой в «правильном» месте и рибосомой манипулирует «правильно».
Вроде бы стройно все получается...
Сомнения и перспективы
Настоящий учёный не перестаёт сомневаться, даже если теория железобетонная и результаты экспериментов проверены и перепроверены. А. Барцеля и соавторов статьи [1], в частности, беспокоит следующее:
- Не будут ли цитотоксичными rAAV-векторы вообще и такие, как у них, но с другими активно экспрессирующимися терапевтическими трансгенами, в частности? (Хотя повышения трансаминаз в своем исследовании калифорнийцы не наблюдали).
- Не проявится ли иммуногенность 2A-пептида? (Хотя в клинических испытаниях с использованием лимфотропного вектора, кодирующего такой пептид, иммунных реакций не наблюдали).
- Не повлияет ли такая высокая «доза» вектора на повышение нецелевого встраивания и иммуногенности? (Хотя, опять же, у их мышей АЛТ не повышалась, а нецелевой экспрессии зафиксировано не было). По мнению авторов, в дальнейшем нужно использовать наиболее «тканеизбирательные» AAV-серотипы и/или гиперактивные F9-варианты.
- Не снизится ли эффективность терапии из-за падения гомологии вектора с человеческим целевым локусом в связи с генетическим полиморфизмом последнего? (Хотя в человеческой популяции в Alb-локусе преобладают всего два гаплотипа).
Несмотря на понятную осторожность, Ади Барцель и коллеги считают, что их беспромоторная и безнуклеазная интегративная rAAV-стратегия — идеальный кандидат для проведения клинических испытаний не только с целью терапии гемофилии и иных генетических дефектов, но и для компенсации каких-то состояний секрецией нужных белков. Конечно, этот подход не слишком напоминает идеал — замену бракованной детали, но сулит, возможно, самое маленькое кладбище (как у хорошего врача) по сравнению с ранними и даже зреющими методиками генной терапии.
Литература
- A. Barzel, N. K. Paulk, Y. Shi, Y. Huang, K. Chu, et. al.. (2015). Promoterless gene targeting without nucleases ameliorates haemophilia B in mice. Nature. 517, 360-364;
- Genetics Home Reference — «домашний путеводитель» по генетическим заболеваниям и состояниям человека Национальной медицинской библиотеки (США);
- Как работает свертывание крови?;
- UZRF (портал учреждений здравоохранения РФ): «Болезнь царской крови»;
- «Методическое пособие по гематологии» (сайт Северо-Западного государственного медицинского университета им. И.И. Мечникова);
- Молекулярное клонирование, или как засунуть в клетку чужеродный генетический материал;
- Генная терапия против рака;
- Amit C. Nathwani, Edward G.D. Tuddenham, Savita Rangarajan, Cecilia Rosales, Jenny McIntosh, et. al.. (2011). Adenovirus-Associated Virus Vector–Mediated Gene Transfer in Hemophilia B. N Engl J Med. 365, 2357-2365;
- Anthony Donsante, Daniel G. Miller, Yi Li, Carole Vogler, Elizabeth M. Brunt, et. al.. (2007). AAV Vector Integration Sites in Mouse Hepatocellular Carcinoma. Science. 317, 477-477;
- Thomas Gaj, Charles A. Gersbach, Carlos F. Barbas. (2013). ZFN, TALEN, and CRISPR/Cas-based methods for genome engineering. Trends in Biotechnology. 31, 397-405;
- Hojun Li, Virginia Haurigot, Yannick Doyon, Tianjian Li, Sunnie Y. Wong, et. al.. (2011). In vivo genome editing restores haemostasis in a mouse model of haemophilia. Nature. 475, 217-221;
- Пептид 2A: два в одном;
- ExPASy (биоинформатический портал): Ribosomal skipping..