Истории из жизни Х-хромосомы круглого червя-гермафродита
22 июля 2015
Истории из жизни Х-хромосомы круглого червя-гермафродита
- 688
- 1
- 1
Эмбрион и взрослая особь круглого червя Caenorhabditis elegans (генетически модифицированы, продуцируют два флуоресцентных белка: зеленый и красный).
Рисунок в полном размере.
рисунок с сайта Pinterest
-
Автор
-
Редакторы
У самок млекопитающих две Х-хромосомы, а у самцов одна. У круглых червей C. elegans почти та же история, только представительницы их слабого пола на самом деле гермафродиты. И для того, чтобы у самок (гермафродитов) не было слишком много продуктов генов Х-хромосом, существует дозовая компенсация. На ее механизмы у червей и пролили свет ученые из США, исследуя структуру хроматина.
В эукариотическом ядре ДНК, объединяясь с гистонами, образует хроматин. Хроматин играет ключевую роль в жизни клетки , а его структура регулирует важнейшие молекулярные процессы ядра, такие как транскрипция, репликация, репарация. Регуляция всех этих сложных процессов нередко осуществляется благодаря активно изучаемому сейчас взаимодействию удаленных участков ДНК друг с другом. Современные методы позволяют оценивать, какие участки нашей огромной ДНК сближены, а какие нет, и описывать структуру хроматина полногеномно. Одним из таких подходов является Hi-C — полногеномный вариант 3С-анализа, или метода фиксации конформации хромосом.
Как именно упаковывается ДНК и почему клетки с одним и тем же геномом не похожи друг на друга, увлекательно описано в статье «Катится, катится к ДНК гистон» [1]. Однако такая упаковка и эпигенетические модификации компонентов хроматина создают определенные проблемы. Отважной транскрипционной машине приходится при рутинном считывании наследственной информации постоянно спотыкаться о нуклеосомы: «Транскрипция в хроматине: как проходить сквозь стены» [2]. А эпигеномный «макияж» далеко не всегда служит во благо организму. Для его коррекции создают лекарства со страшными названиями и препарируют вегетарианский рацион в поиске их природных аналогов: «Пилюли для эпигенома» [3]. И ведь находят же... — Ред.
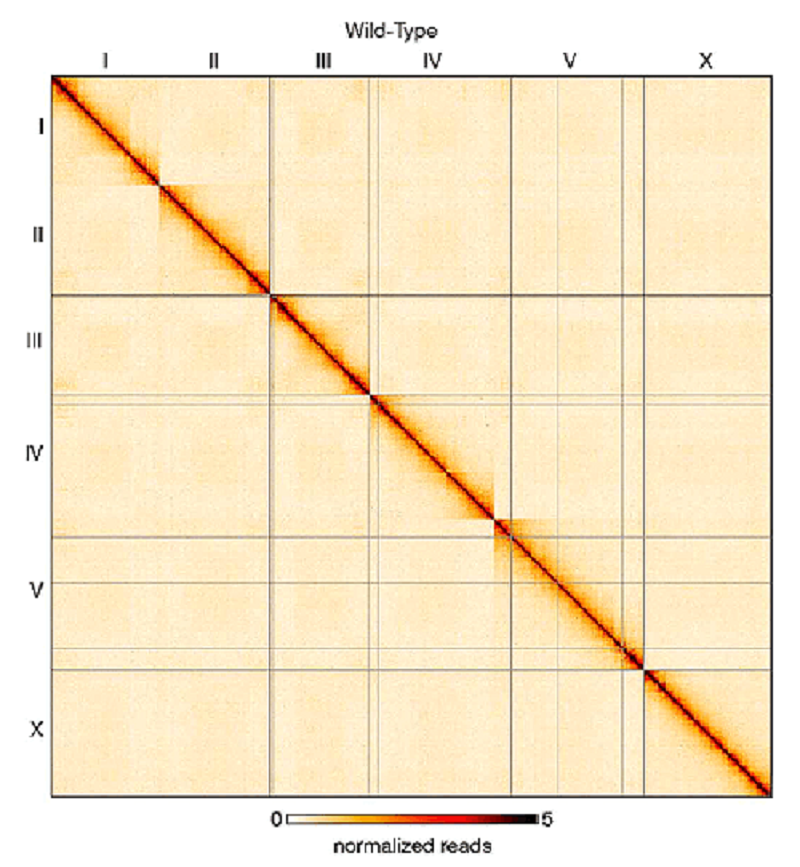
Рисунок 1. Результат картирования структуры хроматина Hi-C, представленный в форме тепловой карты. По осям абсцисс и ординат отложены координаты генома; римскими цифрами обозначены зоны хромосом. Чем темнее точка на карте, тем больше вероятность сближения в пространстве соответствующих участков генома. Видно, что взаимодействия внутри одной хромосомы более вероятны, чем дальние контакты между разными хромосомами.
Принцип метода заключается в следующем. Сначала хроматин «сшивают», то есть намертво фиксируют все ДНК-белковые взаимодействия. Затем ДНК режут на кусочки и полученную взвесь разбавляют. В результате те части хроматина, которые раньше были рядом, в растворе друг от друга отдаляются, а сближенными остаются только скрепленные белками фрагменты ДНК. Их сшивают специальным ферментом — лигазой. Получаются химерные молекулы: цепи, ранее скрепленные белками, сливаются в одну. Дальше их можно по-разному анализировать.
В случае Hi-C, например, секвенируют все полученные молекулы [4], [5]. Результаты Hi-C представляют в виде тепловых карт — таких, как на рисунке 1. По осям откладывают координаты генома. Чем чаще наблюдается взаимодействие между какими-либо частями генома, тем темнее (или цветнее, кому как больше нравится) соответствующая точка на карте. На тепловых картах видно, что чаще всего взаимодействуют фрагменты ДНК, находящиеся на одной хромосоме, что и понятно. Внутри каждой хромосомы видны похожие на ромбы топологически ассоциированные домены (ТАД), между которыми есть границы. Как раз ТАДы и их границы и анализировали ученые из США для изучения дозовой компенсации у круглого червя Caenorhabditis elegans [6].
Процесс дозовой компенсации есть не только у круглых червей, но и у млекопитающих [7]. Главным образом это инактивация одной из Х-хромосом самок, которая достигается за счет изменения ее структуры (не самки, конечно, а хромосомы). Инактивация необходима для того, чтобы у представительниц женского пола гены Х-хромосом не экспрессировались в два раза интенсивнее, чем у самцов. У круглых червей тоже есть половые Х-хромосомы. Когда их две, червь является гермафродитом, когда одна — самцом. По этой причине гермафродитам необходима дозовая компенсация. Механизмы данного процесса не до конца понятны и активно исследуются. Дозовую компенсацию особенно интересно изучать с точки зрения структуры хроматина, потому что именно особая укладка половых хромосом заставляет их гены «молчать».
Для дозовой компенсации C. elegans необходим белковый комплекс дозовой компенсации (DCC, dosage compensation complex), который связывается с Х-хромосомой. У него есть свои точки связывания с ДНК, которые называются rex-сайтами (recruitment elements on X). Ученые провели анализ Hi-C для эмбрионов C. elegans дикого типа и для мутантов по DCC [6]. У этих мутантов был удален белок комплекса, отвечающий за привлечение DCC к хроматину, поэтому связывание DCC с Х-хромосомой было нарушено. Полученные тепловые карты Х-хромосом сравнили и сделали выводы о механизме дозовой компенсации. Оказалось, что DCC укладывает половые хромосомы особым образом, отличным от аутосом (хромосом, одинаковых по качеству и количеству у представителей разных полов).
Ученые показали, что Х-хромосомы C. elegans состоят из топологически ассоциированных доменов, как и ранее исследованные хромосомы млекопитающих. Однако границы между ТАДами у половых хромосом гермафродитов более выраженные, и расположены они более регулярно. Интересно, что многие границы совпадают с rex-сайтами и исчезают у мутантов по DCC. В последнем случае половая хромосома — судя по тепловой карте — становится похожа на аутосому. У мутантов по DCC происходят довольно обширные изменения в хроматине: на Х-хромосоме из семнадцати границ ТАДов пять пропадают полностью, а три — частично. Значит, DCC изменяет топологию Х-хромосомы, создавая новые границы между топологически ассоциированными доменами. Важно отметить, что экспрессия генов Х-хромосомы у мутантов по DCC ожидаемо повысилась, что говорит о нарушениях в процессе дозовой компенсации. Мутация DCC изменила только укладку Х-хромосомы, а аутосомы сохранили прежнюю структуру.
То, что DCC нужен для создания новых границ ТАДов, означает, что без него взаимодействия между rex-сайтами сильнее. Этот факт подтвердили и с помощью микроскопии, визуализируя фрагменты хромосомы методом флуоресцентной гибридизации in situ — FISH (рис. 2). Пролить свет на механизм дозовой компенсации может тот факт, что пространственные взаимодействия на границе ТАДов участились, но внутри ТАДов стали реже.
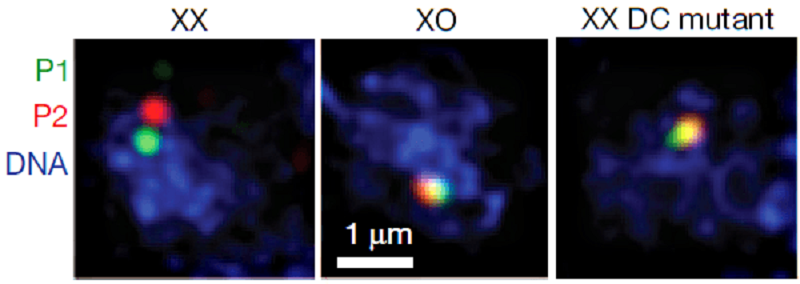
Рисунок 2. Два участка хромосомы (P1 и P2), содержащие rex-сайты. Изображение получено с помощью метода FISH. Видно, что у гермафродита дикого типа (ХХ) участки удалены друг от друга и не пересекаются — это результат процесса дозовой компенсации. У самца дикого типа (ХО) участки сближены и перекрываются, дозовой компенсации у такой особи нет, потому что и второй Х-хромосомы нет. А у гермафродита, мутантного по DCC, исследуемые фрагменты генома сближены так же, как у самца, то есть наблюдаются отклонения от дикого типа.
Полученные данные позволяют объяснить связь между укладкой хроматина высших порядков и экспрессией генов. Ранее было показано, что DCC подавляет экспрессию генов, значит, уникальная, DCC-зависимая структура Х-хромосомы может служить репрессором транскрипции. Остается не до конца понятным, что именно влияет на экспрессию генов: структура отдельных доменов или топология всей хромосомы в целом. Ученые больше склоняются ко второму варианту. Таким образом, всего один комплекс дозовой компенсации способен глобально менять структуру целой хромосомы, что приводит к подавлению экспрессии ее генов.
Литература
- Катится, катится к ДНК гистон;
- Транскрипция в хроматине: как проходить сквозь стены;
- Пилюли для эпигенома;
- 454-секвенирование (высокопроизводительное пиросеквенирование ДНК);
- Секвенирование единичных клеток (версия — Metazoa);
- Emily Crane, Qian Bian, Rachel Patton McCord, Bryan R. Lajoie, Bayly S. Wheeler, et. al.. (2015). Condensin-driven remodelling of X chromosome topology during dosage compensation. Nature. 523, 240-244;
- Загадочное путешествие некодирующей РНК Xist по X-хромосоме.