Всё, что вы всегда хотели знать о взрослом нейрогенезе, но боялись спросить
02 октября 2015
Всё, что вы всегда хотели знать о взрослом нейрогенезе, но боялись спросить
- 18904
- 10
- 15
Картина художника и дипломированного нейрофизиолога Грега Данна, изображающая одну из главных зон взрослого нейрогенеза — гиппокамп.
сайт gregadunn.com
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Выражение «нервные клетки не восстанавливаются» является одним из лидеров среди расхожих в быту утверждений о человеческом мозге. При этом уже 20 лет как доказана его ложность, а количество рассматривающих это самое восстановление статей до сих пор увеличивается чуть ли не по экспоненте. Уже установлены зоны, где оно проходит, его функциональное значение, а также огромное количество влияющих на него факторов. А сколько еще предстоит открыть...
Конкурс «био/мол/текст»-2015
Эта работа опубликована в номинации «Лучшая обзорная статья» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: лаборатория биотехнологических исследований 3D Bioprinting Solutions и студия научной графики, анимации и моделирования Visual Science.
Пошатнуть стереотип оказалось непросто...
Еще в начале прошлого века потеря нейронов в результате травмы или старения считалась фатальной — ведь даже лучшие умы настаивали на невозможности новообразования нейронов (или нейрогенез) у взрослых особей высших позвоночных. Впервые это постулировал гениальный С. Рамон-и-Кахаль [1], у которого на тот момент просто не могло быть инструментов исследования мозга, способных фиксировать малоинтенсивные постнатальные процессы. Авторитет Рамон-и-Кахаля был огромен, к тому же было известно, что с возрастом масса мозга снижается. О наличии малого пула стволовых клеток поводов задуматься не было, а отсутствие знаний о пластичности мозга не позволяло решить проблему интеграции новых нейронов в сложнейшую систему старых.
В результате убежденность в невозможности образования нервных клеток во взрослом состоянии была настолько твердой, что стала причиной ряда драматических историй в науке. Одним из первых, кто говорил о существовании взрослого нейрогенеза, был Джозеф Альтман. Используя новый для того времени метод авторадиографии с меченым тимидином (рис. 1), он и его сотрудники выпустили в 60-х целый ряд работ, утверждавших протекание нейрогенеза в зубчатой фасции гиппокампа, обонятельных луковицах и коре головного мозга у взрослых крыс, морских свинок, а также в новой коре у кошек [2].
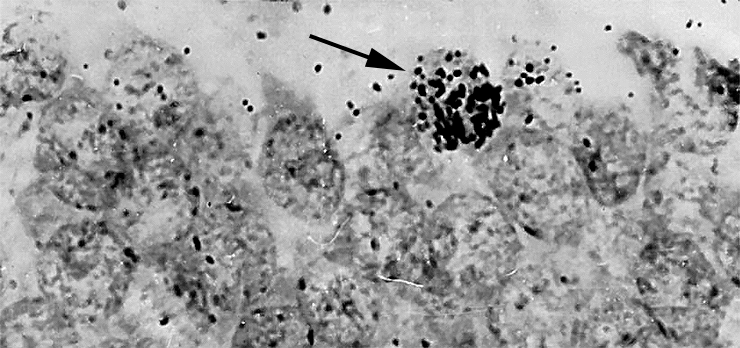
Рисунок 1. Первые признаки взрослого нейрогенеза. Животным вводили 3Н-тимидин — радиоактивный аналог обычного нуклеотида тимидина, — который тоже встраивается в ДНК делящейся клетки, но который потом можно регистрировать методом авторадиографии.
Альтман также предположил, что «взрослорождённые» нейроны имеют ключевое значение в процессах обучения и формирования памяти. Несмотря на то, что работы были выпущены в ведущих научных журналах, ученое сообщество проигнорировало их выводы, противоречившие установившемуся стереотипу. В результате Альтман прекратил работы по этому направлению. В начале 80-х его утверждения дополнились ультраструктурными доказательствами того, что возникающие в мозге взрослых крыс клетки похожи на нейроны. Кроме того, процессы деления были зафиксированы уже в мозге взрослых приматов — макак. Эти результаты получил Майкл Каплан, известный биолог и врач, позднее работавший в Университете Джонса Хопкинса и Национальном институте по проблемам старения (США). В ответ на его статьи некоторые именитые ученые говорили, что подобные результаты, полученные на крысах, не могут быть показательными, так как крысы не прекращают расти в течение жизни, следовательно, не могут когда-либо считаться «взрослыми». А обнаруженные деления в мозге макак сочли недостаточными для доказательства существования у них значительного нейрогенеза. Такие реакции не вдохновляли Каплана на продолжение исследований этой проблемы, и он занялся реабилитационной медициной [3].
...и всё же это удалось!
Одним из поворотных моментов в изучении нейрогенеза стала серия статей Фернандо Ноттебома, вышедшая в 80-х и 90-х годах. Сейчас Ноттебом — глава отдела экологии и этологии Рокфеллеровского университета, а тогда он занимался мозгом птиц, в частности — вокальным центром канареек. В ходе его работы выяснилось, что в отделах их мозга, гомологичных коре и гиппокампу приматов, помимо гибели происходит образование огромного количества новых клеток! При этом многие новые клетки являются нейронами и образуют синапсы, а активность всего этого процесса коррелирует со сложностью окружающей птицу среды. Несмотря на то, что многими эти результаты списывались на некую специфику птиц, они сильно сдвинули общественное мнение [3].
Исследование нейрогенеза продолжилось с новыми силами после введения в научную практику синтетических аналогов тимидина. Такие аналоги куда легче потом обнаружить в тканях, чем радиоактивные, которые использовал Альтман. Кроме того, были открыты маркеры клеток разных типов: нейронов различной степени зрелости, клеток глии, а также любых клеток, находящихся в фазе митоза, то есть делящихся. Это позволило еще увереннее говорить об активном нейрогенезе в зубчатой фасции гиппокампа и в стенках желудочков мозга с проекциями в обонятельные луковицы (рис. 2) [4]. Последние работы демонстрируют нейрогенез и в ряде других структур мозга: в хвостатом ядре, фронтальной коре, первичной и вторичной моторной и соматосенсорной коре (рис. 3) [5], [6]. Но недостаточно высокая активность процесса всё же не позволяет называть эти зоны нейрогенными, в отличие от двух вышеназванных.
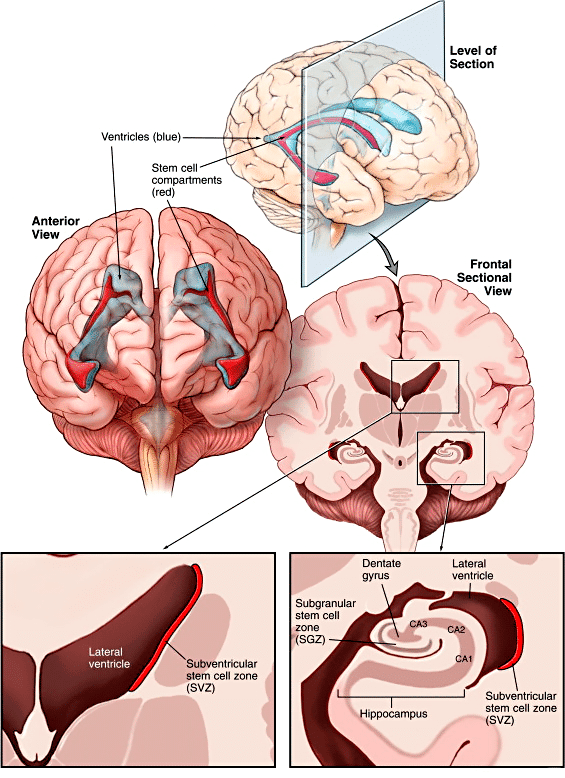
Рисунок 2. Зоны мозга, в которых происходит нейрогенез: субвентрикулярная зона мозга (SVZ) в боковых стенках первых двух желудочков и субгранулярная зона зубчатой фасции гиппокампа (SGZ). У грызунов образующиеся в SVZ клетки потом мигрируют по ростральному миграционному тракту в обонятельные луковицы.
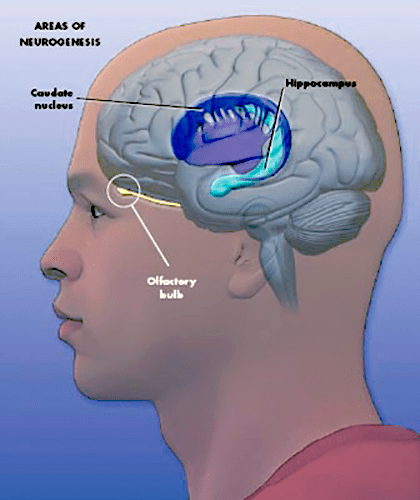
Рисунок 3. Зоны мозга человека, в которых происходит нейрогенез. У приматов клетки, образующиеся в субвентрикулярной области, мигрируют еще и в полосатое тело, которое представляет собой анатомическую структуру мозга, отвечающую за мышечный тонус, формирование условных рефлексов, а также регулирующую некоторые поведенческие реакции.
Нейрогенез в желудочках мозга значительно усиливается при каком-либо обонятельном опыте, а также при беременности у грызунов, так как узнавание детенышей у них сильно связано с обонянием [7], [8]. Результаты работ по исследованию нейрогенеза в этой зоне у человека пока не приводят к окончательным выводам: часть из них свидетельствует о его протекании у человека, другая ставит под сомнение миграцию нейронов в обонятельные луковицы. Недавно было показано, что у приматов новообразованные нейроны из субвентрикулярной зоны могут мигрировать в полосатое тело (или стриатум), отвечающее за сложные двигательные реакции и формирование условных рефлексов [9]. С повреждениями стриатума связан синдром Туретта, а также более серьезные проблемы, такие как болезни Паркинсона и Хантингтона. Поэтому в будущем можно рассчитывать на появление ряда работ по связанному с этой областью нейрогенезу.
Нейрогенез оказался важным инструментом в нашем организме...
Пожалуй, для человека самой важной нейрогенной зоной всё же можно назвать зубчатую фасцию гиппокампа. Гиппокамповая формация является частью лимбической системы и участвует в исполнении таких функций мозга, как интеграция и распределение по мозгу сенсорной информации, ответ на новизну, регуляция настроения и активности организма. Будучи частью круга Пейпеца, гиппокамп удерживает информацию при бодрствовании и участвует в ее переводе в кору больших полушарий во время сна, то есть из кратковременной памяти в долговременную. Нейрогенез вовлечен в осуществление некоторых из этих функций, выполнение которых становится возможным благодаря специфическим характеристикам образующихся клеток — в частности, молодые гранулярные клетки зубчатой фасции имеют более низкий порог долговременной потенциации, чем старшие [10]. Считается, что подобная пластичность играет роль в процессах обучения и памяти [11].
Скорость образования новых нейронов гиппокампа для взрослой крысы оценивается в 9000 клеток в сутки, однако большинство новообразованных клеток погибает между первой и второй неделями после своего рождения, из-за чего число окончательно интегрировавшихся в гиппокамп новых нейронов в месяц равно примерно 25000, что составляет около 3,3% их популяции [12]. Скорость нейрогенеза у человека оценивается в 700 нейронов ежедневно, а в год обновляется около 1,75% всего гиппокампа или же 0,004% нейронов его зубчатой фасции [13]. Половая специфика в этих показателях отсутствует, а с возрастом активность процесса снижается, при этом «качество» предшественников остается прежним, так как in vitro они культивируются так же хорошо, как и в молодом возрасте. Это позволяет предположить, что с возрастом происходит удлинение продолжительности клеточного цикла предшественников нервных клеток in vivo [14].
Стадии нейрогенеза в зубчатой фасции подробно описаны по морфологии клеток и набору специфических клеточных маркеров (рис. 4) [15].

Рисунок 4. Схема дифференцировки нервных стволовых клеток зубчатой фасции со специфическими маркерами разных стадий. Покоящиеся нервные предшественники (quiescent neural progenitors, в ранней классификации называемые радиальной глией) после активации цитокинами, ростовыми или иными факторами начинают делиться асимметричным митозом с образованием в базальной части делящегося нервного предшественника (amplifying neural progenitor, в ранней классификации — нерадиальный предшественник). Он, в свою очередь дважды поделившись, выходит из клеточного цикла и становится постмитотическим нейробластом (neuroblast 1, ранее — промежуточный прогенитор). Именно на этой стадии погибает большинство клеток. Оставшиеся превращаются в нейробласты второго порядка (neuroblasts 2, ранее — нейробласты) и затем в незрелые нейроны, мигрирующие в гранулярный слой, где завершается их созревание. Полное превращение нервной (нейральной) стволовой клетки в функциональный нейрон занимает около месяца.
В настоящее время ведутся споры относительно судьбы QNP (quiescent neural progenitors, покоящихся нервных предшественников) после деления. Согласно «оптимистической» модели, стволовые клетки мозга — по аналогии с гемопоэтическими стволовыми клетками — являются самовозобновляемыми: в результате асимметричного деления они дают клетку, дифференцирующуюся потом в нейрон, а затем возвращаются в покоящееся состояние и могут быть заново активированы. В противоположность этому, согласно «пессимистической» модели, стволовые клетки зубчатой фасции не способны к самовоспроизведению, и их активация в конечном итоге приводит к превращению в астроциты. Предполагают, что сами стволовые клетки используются только единожды в течение взрослой жизни, выходя из этого пула после серии быстрых делений, в результате которых образуются прогениторы. Это объясняет и связывает между собой снижение темпов нейрогенеза и рост количества астроцитов в течение жизни (рис. 5) [16].
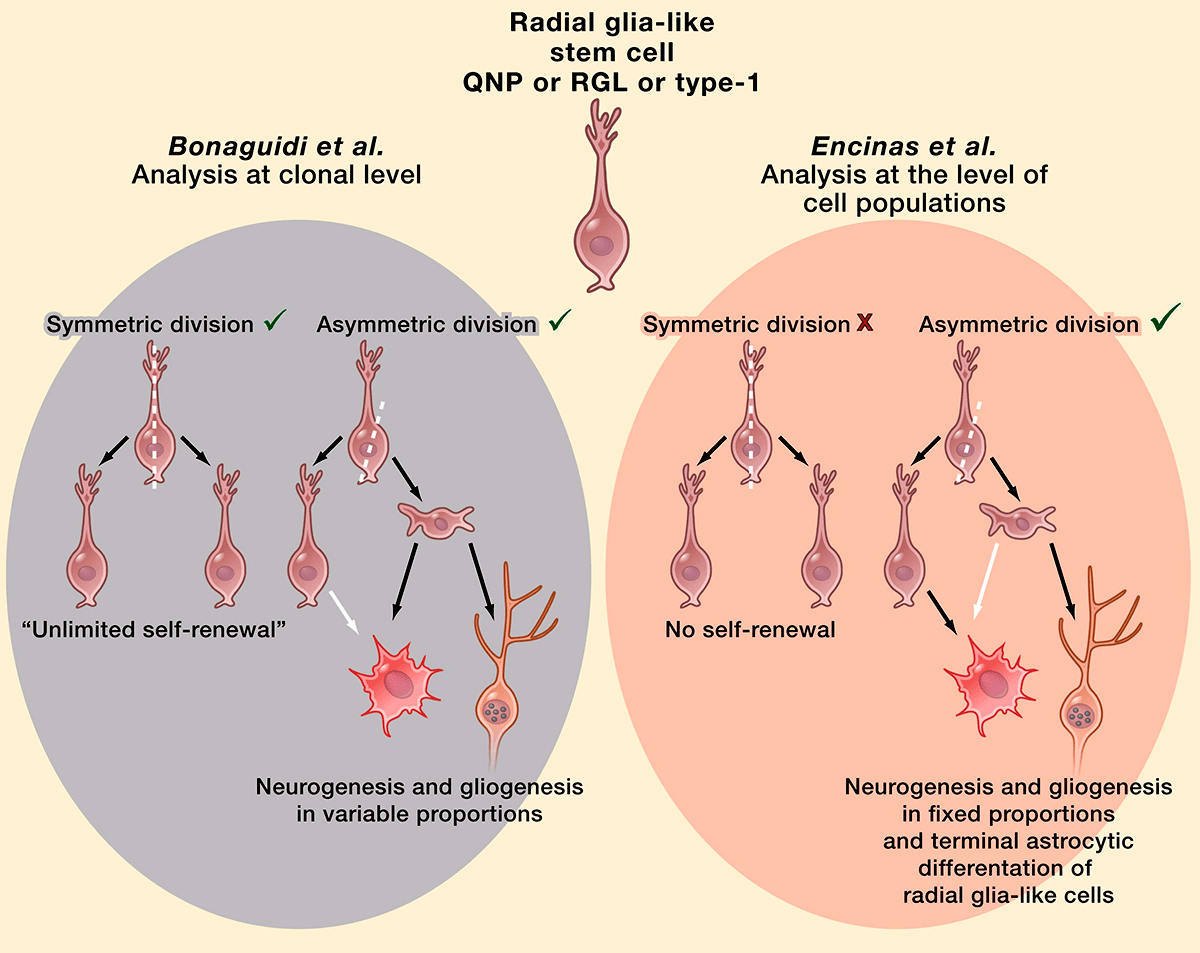
Рисунок 5. «Оптимистическая» (слева) и «пессимистическая» (справа) модели деления стволовых клеток.
В то же время вторая модель не исключает возможности нахождения в зубчатой фасции или малых популяций самовоспроизводящихся стволовых клеток, или клеток с удлиненными G2/M-фазами, или же каких-то специфических клеток, не экспрессирующих нестин. В последнем случае их просто не удалось бы обнаружить при использованном дизайне эксперимента.
...на работу которого многое может повлиять
Уровень новообразования нервных клеток — в частности, в зубчатой фасции — может меняться под воздействием множества факторов. Если принять во внимание «пессимистическую» модель и роль нейрогенеза в осуществлении некоторых функций гиппокампа, а также патогенез ряда нейродегенеративных заболеваний, станет очевидной важность определения мишеней для этих факторов — влияют ли они на молчащие стволовые клетки, расходуя их пул, или же способствуют выживаемости их потомков, или увеличивают количество их делений. Все влияния на нейрогенез в конечном итоге можно подразделить по результату их действия на положительные и отрицательные. К первым относятся как банальные (содержание в обогащенной среде, физическая нагрузка, прием антидепрессантов или мелатонина, социальные взаимодействия), так и специфические — вроде одноночной бессонницы или приема каннабиноидов. Ко вторым — радиация, стресс, хроническое недосыпание, злоупотребление опиатами, алкоголем и множество прочих общенегативных для мозга вещей.
Хотя в целом результат воздействия многих перечисленных факторов можно предугадать, механизм их воздействия, а также влияние их комбинаций требуют изучения — как для выстраивания правильной общей профилактики, так и для лечения конкретных заболеваний. Среди так называемых позитивных факторов особенно эффективным является обогащенная среда, включающая в себя физические упражнения. По различным данным, нахождение в течение небольшого количества времени (примерно от недели до месяца) в такой среде стабильно и значимо повышает уровень нейрогенеза, причем увеличение может быть даже пятикратным — в зависимости от возраста, состояния здоровья и других параметров [17]. Несмотря на активное изучение эффектов обогащенной среды на нейрогенез, на современном этапе исследований остается открытым вопрос о том, какие именно из ее компонентов (физическая или исследовательская активность) оказывают влияние на процесс формирования новых нейронов в мозге, а также на какие этапы нейрогенеза эти эффекты распространяются. Разрешение этих вопросов важно для поиска новых терапевтических и нейропротекторных воздействий и для нахождения эффективных путей регуляции нейрогенеза во взрослом мозге. Именно поэтому интерес к этой теме лишь усиливается, и количество статей по ней будет расти еще долгое время.
Литература
- Сотворивший нейробиологию: Сантьяго Рамон-и-Кахаль;
- Altman J. (1963). Autoradiographic investigation of cell proliferation in the brains of rats and cats. Anat. Rec. 145, 573–591;
- Gross C.G. (2009). Three before their time: neuroscientists whose ideas were ignored by their contemporaries. Exp. Brain Res. 192, 321–34;
- Eriksson P.S., Perfilieva E., Björk-Eriksson T., Alborn A.M., Nordborg C., Peterson D.A., Gage F.H. (1998). Neurogenesis in the adult human hippocampus. Nat. Med. 4, 1313–1317;
- Sachs B.D. and Caron M.G. (2015). Chronic fluoxetine increases extra-hippocampal neurogenesis in adult mice. Int. J. Neuropsychopharmacol. 18;
- Yuan T.-F., Liang Y.-X., So K.-F. (2014). Occurrence of new neurons in the piriform cortex. Front. Neuroanat. 8, 167;
- Shingo T., Gregg C., Enwere E., Fujikawa H., Hassam R., Geary C. et al. (2003). Pregnancy-stimulated neurogenesis in the adult female forebrain mediated by prolactin. Science. 299, 117–120;
- So K., Moriya T., Nishitani S., Takahashi H., Shinohara K. (2008). The olfactory conditioning in the early postnatal period stimulated neural stem/progenitor cells in the subventricular zone and increased neurogenesis in the olfactory bulb of rats. Neuroscience. 151, 120–128;
- Ernst A., Alkass K., Bernard S., Salehpour M., Perl S., Tisdale J. et al. (2014). Neurogenesis in the striatum of the adult human brain. Cell. 156, 1072–1083;
- Deng W., Aimone J.B., Gage F.H. (2010). New neurons and new memories: how does adult hippocampal neurogenesis affect learning and memory? Nat. Rev. Neurosci. 11, 339–350;
- Lledo P.-M., Alonso M., Grubb M.S. (2006). Adult neurogenesis and functional plasticity in neuronal circuits. Nat. Rev. Neurosci. 7, 179–193;
- Cameron H.A. and McKay R.D. (2001). Adult neurogenesis produces a large pool of new granule cells in the dentate gyrus. J. Comp. Neurol. 435 (4), 406–417;
- Spalding K.L., Bergmann O., Alkass K., Bernard S., Salehpour M., Huttner H.B. et al. (2013). Dynamics of hippocampal neurogenesis in adult humans. Cell. 153 (6), 1219–1227;
- Goldman S.A., Kirschenbaum B., Harrison-Restelli C., Thaler H.T. (1997). Neuronal precursors of the adult rat subependymal zone persist into senescence, with no decline in spatial extent or response to BDNF. J. Neurobiol. 32 (6), 554–566;
- Encinas J.M., Michurina T.V., Peunova N., Park J.H., Tordo J., Peterson D.A. et al. (2011). Division-coupled astrocytic differentiation and age-related depletion of neural stem cells in the adult hippocampus. Cell Stem Cell. 8, 566–579;
- Kempermann G. (2011). The pessimist’s and optimist’s views of adult neurogenesis. Cell. 145 (7), 1009–1011;
- Van Praag H., Kempermann G., Gage F.H. (2000). Neural consequences of environmental enrichment. Nat. Rev. Neurosci. 1, 191–198.