Прикладная биотехнология и молекулярная микробиология. Практическое руководство для студентов, или как запатентовать биопрепарат
26 ноября 2015
Прикладная биотехнология и молекулярная микробиология. Практическое руководство для студентов, или как запатентовать биопрепарат
- 2042
- 1
- 6
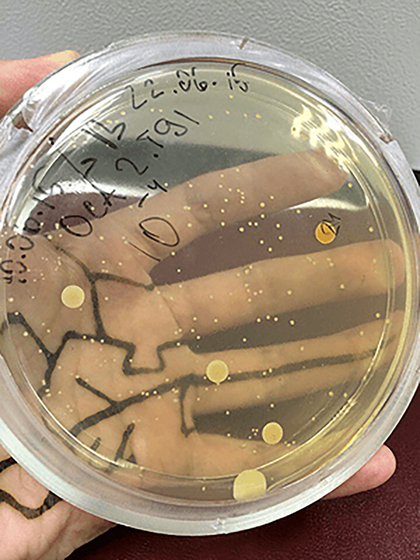
Отдельные колонии бактерий на богатой питательной среде LB.
Рисунок в полном размере.
-
Автор
-
Редактор
Статья на конкурс «био/мол/текст»: Создание микробиологических препаратов для деструкции различных загрязнителей в почве — востребованное и перспективное направление. В данном руководстве рассматриваются основные этапы процесса изготовления биопрепарата и получения разрешения на его промышленное производство и использование в России. В тексте присутствуют конкретные практические указания, теоретическая часть, ссылки на статьи и ГОСТы, а также примеры — результаты, собственноручно полученные на тех или иных этапах создания биопрепарата — биодеструктора инсектицида ДДТ.
Конкурс «Био/Мол/Текст»-2015
Эта работа опубликована в номинации «Своя работа» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Введение. Актуальность проблемы
В 21 веке проблема охраны окружающей среды встаёт в полный рост. Одно из самых страшных последствий научно-технической революции — загрязнение биосферы ксенобиотиками. Стремительное развитие технологий привело к открытию многих полезных веществ, но практика в данном случае опередила теорию — последствия оказались непредсказуемы. Яркий пример тому — дихлордифенилтрихлорэтан (ДДТ): эффективное и простое для получения вещество, инсектицид, оказывающий своё воздействие в малых дозах, нетоксичных для человека. Во время Второй мировой войны соединение поменялось для обработки солдат с целью предотвращения заражения тифом и малярией от насекомых. Также повсеместно обрабатывали поля и зерно от паразитов.
По химическим свойствам ДДТ — липофильное (жирорастворимое) и достаточно устойчивое соединение. Уже позднее выяснилось, что это приводит к его биомагнификации (или умножению) по мере продвижения в пищевой цепи из-за накопления в жировой ткани. Даже если вещество равномерно распределено по поверхности, его концентрация на следующей ступени пищевой пирамиды, вне зависимости от организма, возрастает на порядок. Это особо касается хищников и, тем более, человека [1].
До недавних пор, несмотря на запрет применения в США ещё в 70-х годах, ДДТ использовали по всему миру (в России он был известен под названием «Дуст»). В 2001 году в Стокгольме состоялось заседание ООН, результатом которого стала конвенция о стойких органических загрязнителях. На собрании было дано определение СОЗ — вещества с периодом полураспада в несколько лет, распространяющиеся в окружающей среде с естественными потоками веществ в воде, почве и, особенно, в воздухе, способные к накоплению в жировых тканях и токсичные как для обитателей окружающей среды, так и для человека.
Там же был представлен список из двенадцати веществ, восемь из которых были отнесены в категорию А — прекращение производства и использования; одно в категорию В — ограничение применения; и три в категорию С — создание национальных проектов по прекращению преднамеренного синтеза. ДДТ — единственное вещество из списка, применение которого не прекращено полностью. Всемирная Организация Здравоохранения (ВОЗ) рекомендует этот инсектицид для борьбы с малярией — в Индии и Китае продолжается синтез и применение вещества .
В 2011 году Российская Федерация ратифицировала стокгольмскую конвенцию в первой редакции от 2001 года и приняла на себя соответствующие обязательства, оставив за собой право на вступление в силу поправок после дополнительной ратификации: Федеральный закон от 27.06.2011 № 164-ФЗ «О ратификации Стокгольмской конвенции о стойких органических загрязнителях».
Наиболее дешёвый, эффективный и простой способ уничтожения таких веществ — биодеградация. Выделение из природных источников бактерий-деструкторов — одно из самых перспективных направлений из-за большой вариабельности микроорганизмов, скорости утилизации субстратов и возможности разложения in situ. Один из примеров применения бактерий — утилизация загрязнений нефтью [2–4].
Этап первый. Теоретические изыскания
Постановка задачи, суть актуальность, — это только первый этап. Для начала практической работы необходима теоретическая подготовка — литературный поиск деструкторов, которые могли бы «справиться» с интересующим нас веществом, анализ известных путей метаболизма и промежуточных или конечных метаболитов. Далее, на основании собранной информации, нужно определить место для сбора образцов — будет ли это почва в местах индустриального загрязнения, вода, в которую был совершен сброс или воздух в неблагоприятном регионе. Также в статьях обычно указаны методы культивирования и питательные срéды, необходимое оборудование.
Это не пустая формальность. На деле оказывается, что подавляющее большинство микроорганизмов на Земле являются некультивируемыми в лаборатории — то есть, мы просто не знаем, как их выращивать в искусственных средах. А значит, они остаются и неизученными. Так что по большей части мы даже не можем сказать, что же населяет нашу планету. Подробнее: «Иммуностимулирующие филаментные бактерии: наконец-то они приручены!» [5]. — Ред.
Вот что можно узнать в литературе для ДДТ:
- есть два основных способа метаболизма — аэробный и анаэробный;
- основные метаболиты — дихлордифенилдихлорэтан (ДДД) и дихлордифенилдихлоэтен (ДДЕ); может разлагаться сходным с полихлорированными бифенилами (ПХБ) образом с внесением мета-разрыва [6];
- полностью и достоверно все превращения в организме не установлены [7]; обычно разлагается по пути ДДТ → ДДЕ → ДДД, но возможно и прямое превращение ДДТ → ДДД.
При отборе проб с донных отложений выделение отдельных штаммов деструкторов чаще всего невозможно, поэтому большинство бактерий выделено из почв, подвергавшихся длительному загрязнению инсектицидом. Но есть и исключения — в 2010 году бактерии-деструкторы ДДТ были выделены из тропических почв, не подвергавшихся загрязнению [8].
Этап второй. Сбор образцов
Сбор образцов — основополагающая часть работы. Что собрали, с тем и придётся иметь дело далее. А потому к этому вопросу нужно подойти максимально серьёзно. Первым делом нужно сориентироваться с местом сбора: расположение, путь туда и обратно, целесообразность маршрута. Да и сам процесс отбора проб отличается от «приехали, совочком набрали земли в пакетик, уехали». Далее рассмотрим этот этап подробнее на примере ДДТ.
Критерии выбора места отбора проб. Итак, ищем ближайшие места, где долгое время применяли или синтезировали ДДТ. При длительном воздействии инсектицида в почве происходит естественная селекция: во-первых, появляется новая экологическая ниша, так как новое вещество нетривиально в деструкции и доступно не всем микроорганизмам; во-вторых, в этой нише, как и везде, начинается конкуренция за субстрат, и преимущество получают те, кто извлекает максимум энергии в кратчайшие сроки. В результате имеем разнообразие деструкторов различной степени эффективности.
В нашем случае место отбора проб — ООПТ «Осинская лесная дача» (Пермский край), где в 1968-1970 гг. проводили обработку земель инсектицидными препаратами марок «ДДТ» и «Гексахлоран», а затем захоронили неиспользованные мешки всё тех же соединений.
Практическая часть. Отбор проб. Представим, что мы приехали на место. Выбираем участки непосредственного отбора проб, например, поговорив с местными: «А вот там вот примерно мешки с „Дустом“ и закапывали, ага!». В нашем случае подняли записи лесников с указанием мест внесения и захоронения. Вынимаем из кармана GPS-навигатор и записываем координаты выбранного места с точностью до секунды (градус, минута, секунда). Сами образцы могут быть отобраны различными способами , но, главное, с соблюдением правил асептики, чтобы быть абсолютно уверенным, что в культурах растут именно нужные нам деструкторы, а не родная и близкая микрофлора кожи.
Способы отбора проб описаны в документе ГОСТ 17.4.4.02-84. Другие нормативные документы, касающиеся отбора: ГОСТ 120771-2000, ГОСТ 17.4.3.01-83, ПНД Ф 12.1:2:2.2:.3.2-03.
Не стоит брать два и больше образцов в одном месте, лучше всего выбрать несколько мест с разницей в несколько километров, если такое возможно. Или варьировать условия мест отбора проб, например, с поверхности (0–10 см) и с подлежащих слоёв почвы.
Транспортировка и хранение образцов. После отбора транспортируем образцы в лабораторию. Необходимо заранее продумать хранение образцов, так как в дальнейшем они могут нам понадобиться не раз, а поехать на сбор снова вряд ли будет так просто. Асептические условия после транспортировки не нарушают, кроме случаев, когда образец уже всесторонне изучен и больше не нужен совсем.
Работают с почвой обязательно в перчатках и под вытяжкой: на данном этапе неизвестно, сколько и каких веществ содержится в почве. И потом, зачастую образцы весьма своеобразно пахнут. Для подготовки к следующему этапу необходимо перебрать около 100 г почвы (с запасом) — избавиться от мелких корешков и прочих включений, а также нормализовать влажность.
Этап третий. Обработка отобранных проб
Первым делом из почвы делают прямой высев методом разведений (рис. 1 и 2) [9]. Это нужно для подсчёта колониеобразующих единиц (КОЕ) в определённом объёме и описания видового разнообразия микроорганизмов, что служит качественным показателем. Итоговый расчет осуществляют на 1 г сухой почвы, что отображает количественный показатель разнообразия микроорганизмов.

Рисунок 1. Из-за того, что бактерии распространяются в том числе и с токами воздуха, исследователи при работе с ними вынуждены свято блюсти стерильность. На фотографии ламинар — рабочее место микробиолога. Перед работой вся жизнь внутри выжигается ультрафиолетом. Во время работы поддерживаются асептические условия. Пламя горелки служит для дополнительной стерилизации (горелка в центре, не зажжена).

Рисунок 2. Посуду перед использованием стерилизуют. Для внесения среды и образцов пробирки (и любую другую посуду) открывают только в ламинаре в стерильных условиях. На фотографии штатив стерильных пробирок для приготовления разведений. Результат прямого высева на среду после термостатирования можно наблюдать на заглавной иллюстрации.
Далее часть образца используют для изготовления накопительных культур (НК). Обычно 10 грамм почвы вносят в 100 миллилитров минеральной среды (например, К1) и вносят субстрат. Концентрация подбирается по статьям, либо можно спросить у более опытных коллег (в нашем случае это было 1 г/л). В таких условиях ДДТ остаётся для микроорганизмов единственным источником углерода и энергии, что в результате ведёт к увеличению численности деструкторов в заданном объёме.
Последовательные пересевы НК — внесение малого объёма инокулята из старой колбы в новую, со свежей средой и субстратом в исходной концентрации — метод лабораторной (искусственной) селекции. Например, по полученным результатам измерения оптической плотности (рис. 3) двух поколений НК на разных стадиях развития (сутки роста) видно, что в последующих культурах набор биомассы и достижение фазы роста «плато» происходит быстрей.

Рисунок 3. Спектрофотометр — прибор для измерения оптической плотности. Сквозь кювету с образцом пропускается пучок света заданной длины волны. С другой стороны свет фиксирует датчик. Оптическая плотность высчитывается на основании разницы прохождения света сквозь кювету с дистиллированной водой (пучок света доходит в полном объеме, не рассеиваясь) и кювету с образцом. Во втором случае часть света рассеивается взвесью бактерий. Чем выше оптическая плотность, тем больше света рассеялось при прохождении через образец (тем больше разница между испускаемым и фиксируемыми пучками света). Визуально — чем мутнее образец, тем выше его оптическая плотность.
Параллельно с постановкой накопительных культур проводят химический и токсикологический анализ отобранных почвенных образцов. Концентрацию ДДТ измеряют хроматографически ; токсичность исследуют на модельных организмах (часто это рачки — дафнии), чтобы оценить влияние присутствующих загрязнителей на биоценоз. Если ДДТ там нет и в помине, а дафнии чувствуют себя великолепно — нужно искать другое место и собирать образцы заново. Если концентрация ДДТ превышает предельно допустимую концентрацию (ПДК), то за время этих исследований в НК как раз пройдёт селекция. На данном этапе можно даже не пересевать, ибо сначала изменение соотношения микроорганизмов идёт медленно, и первые НК стоят месяцами. Главное — следить за наличием субстрата .
Нормативный документ для проведения хроматографии — РД 52.18.180-2011. Методики определения токсичности, зарегистрированные в реестре природоохранной нормативной документации: ПНД Ф 14.1:2:4.16-09 16.1:2.3.3.14-09; ФР.1.31.2012.12372; ФР.1.39.2007.03222; ПНД Ф Т14.1:2:3:4.10-04 Т16.1:2.3:3.7-04. — Авт.
Кстати, «хроматография» — от слова «цвет», а это, в свою очередь, от фамилии Михаила Семеновича Цвета, изобретателя этого метода исследований: «Возвращение Цвета» [10]. — Ред.
И, наконец, то, ради чего и нужны образцы почвы — выделение чистых культур. После первичной селекции методом разведений делают высев на богатую питательную среду. Так же это делают и в процессе дальнейшей селекции; при этом состав и численное соотношение микроорганизмов меняются. После термостатирования описывают колонии, подсчитывают их количество и пересевают на другие чашки для получения в чистом виде. Часто каждый морфотип берут в 2–3-х повторностях, формируя морфогруппу, а затем, по результатам Box-PCR (рис. 4) уже определяют штаммы (потому что надежно это можно определить только молекулярными методами).
Box-PCR — один из видов ПЦР повторяющихся внегенных палиндромов (repetitive extragenic palindromic PCR — rep-PCR), использующий праймер Box-A1R. Данный метод прост в работе, эффективен и достаточно недорог. Основан на амплификации случайным образом расположенных в геноме бактерий повторов Box-мотива, впервые обнаруженного у Streptococcus pneumoniae. Метод показал бóльшую разрешающую способность, чем RFLP (полиморфизм длины рестрикционных фрагментов), AFLP (полиморфизм длины амплифицированных фрагментов), RAPD (случайно амплифицированная полиморфная ДНК) и др. [11]. — Ред.
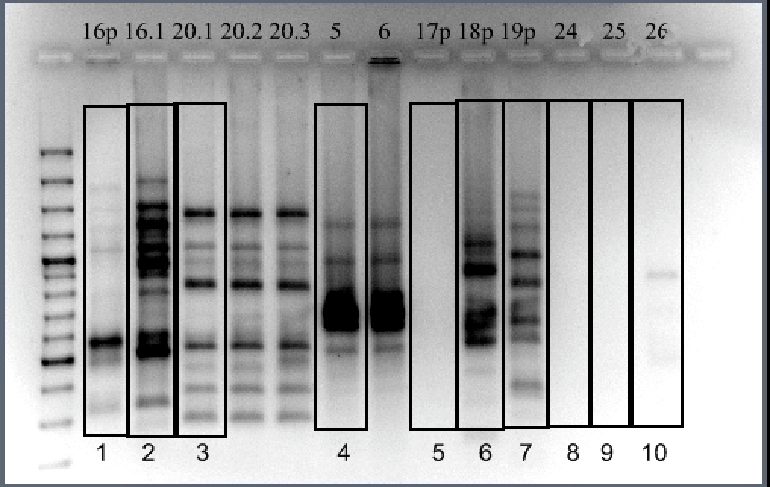
Рисунок 4. Пример электрофореграммы продуктов Box-PCR. Штаммы (номера указаны сверху) 16р и 16.1 изначально брались как один представитель в двукратной повторности. Штаммы 5 и 6, наоборот, были отнесены к различным морфогруппам.
Собственно, после выделения чистых штаммов (рис. 5), их ещё и описывают. Кроме морфологии колоний и описания макропризнаков учитываются морфологические признаки на уровне клетки (микропризнаки). Для этих целей обычно изготавливают препарат «раздавленная капля» и микроскопируют его в фазовом контрасте с применением иммерсии (рис. 6). Далее проводят тест на Грам-принадлежность. Ставят амплификацию на ген, кодирующий 16S субъединицу рРНК, чтобы убедиться, что это бактерии и определить их принадлежность до рода. И Box-PCR, так называемое ДНК-типирование (или «паспорт штамма») с использованием праймеров, комплементарных консервативным повторяющимся внегенным полиндромным последовательностям бактериальной ДНК (рис. 4).
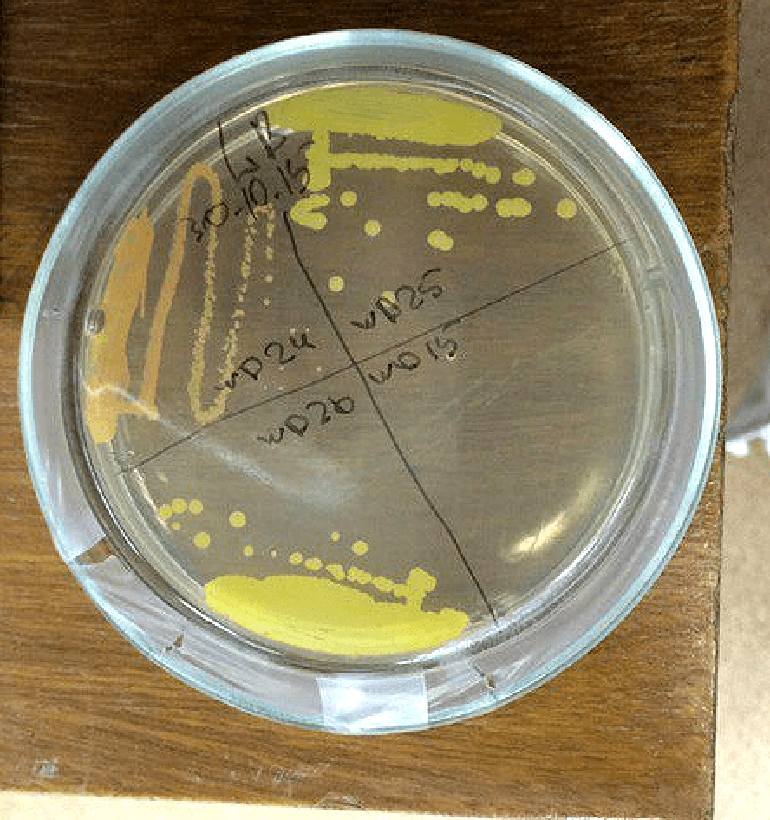
Рисунок 5. Чистые культуры деструкторов. Правда, поддержание их всех в жизнеспособном состоянии — сродни жонглированию бензопилой. Совершенно неожиданно штамм может перестать расти, или в чашку залетит плесень, или ничего не вырастет при пересеве. Штамм WD 15, кстати, потерян безвозвратно. Остаётся только надеяться на чудо: иногда требуется больше времени на культивирование, иногда — меньше.

Рисунок 6. Микроскоп, подключенный к компьютеру. Туда можно смотреть.
Этап четвёртый. Постановка экспериментов
Применительно к исследованию бактерий-деструкторов самый распространённый метод получения данных — качественный и количественный анализ активности по отношению к различным соединениям. На основании этих данных далее отбираются штаммы, они же нужны для добавления в коллекцию, для сертификации и патентования (см. далее).
Теоретическая часть. Планирование эксперимента. В небольшие флакончики вносится определённое количество минеральной среды (рис. 7). Затем в каждый флакончик инокулируется один штамм (конструированием сообществ лучше заняться после определения индивидуальной активности штаммов). И мы снова ставим бактерий в жёсткие условия, ограничивая источники углерода и энергии одним, интересующим нас, субстратом.

Рисунок 7. Пенициллинки — сервиз на 12 персон. На фотографиях изображён круговорот пенициллинок в лаборатории: а — чистые, б — стерильные, в — непосредственно в эксперименте, г — с результатами эксперимента. Далее их моют. И так в цикле.
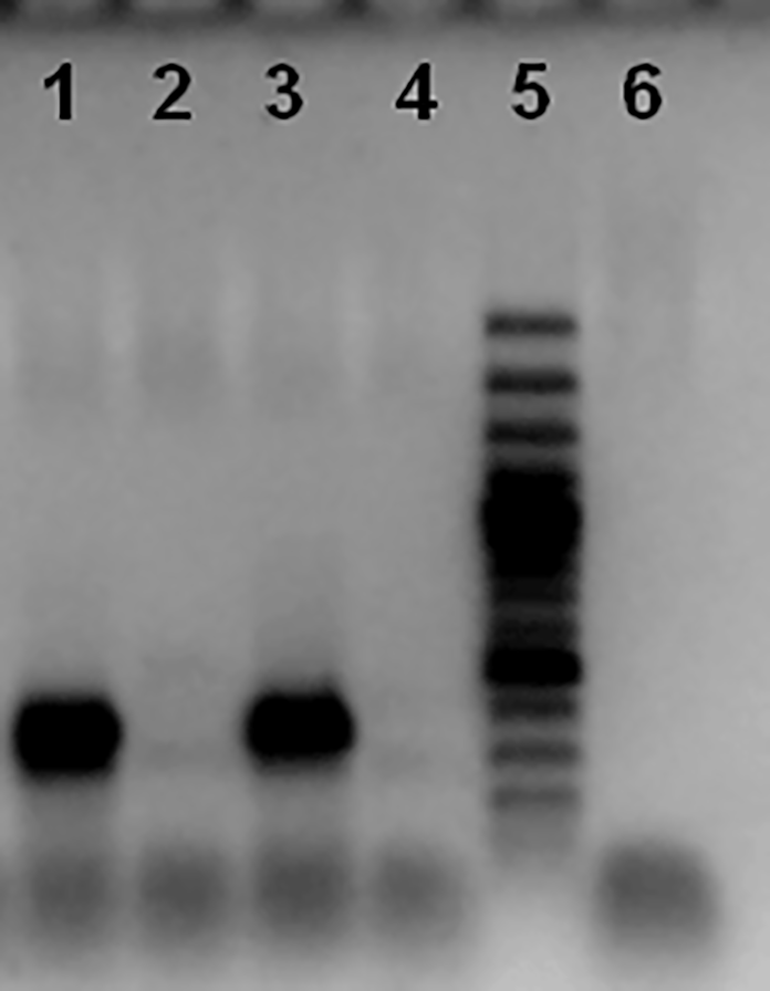
Рисунок 8. Электрофореграмма продуктов амплификации гена fcbA (кодирует начальный этап деструкции 4-ХБК). 1 — образец 3.1; 2 — образец 3; 3 — образец 2; 4 — образец 1; 5 — маркер; 6 — отрицательный контроль. Для реакции выделяли тотальную ДНК из НК каждого образца.
Также есть вариант с постановкой этого эксперимента в чашках Петри. Главное отличие: используется агаризованная минеральная среда. Главный минус такого подхода — некоторые микроорганизмы способны расти на агаре, а потому эксперимент необходимо ставить с контролем (без внесения субстрата). Источник углерода и энергии здесь добавляется с учётом специфики вещества: бифенил в кристаллической форме насыпают на крышку чашки, откуда он испаряется; жидкий субстрат можно либо добавить в лунку в центре (предварительно её изготовив), либо растворить и перемешать со средой на этапе заливки чашек.
Субстратная специфичность ставится сериями с использованием различных субстратов для определения спектра загрязнителей, в отношении которого штамм проявляет активность, с количественной оценкой последней.
В различных статьях, особенно зарубежных, распространён подход к изучению деструкторов с точки зрения ингибирования метаболизма интересующего нас вещества и, наоборот, увеличения скорости деструкции путём внесения различных веществ [12] и ко-субстратов [13]. Часто ингибирование наблюдается и при повышении концентрации субстрата [14]. Для сертификации штамма необходимо подобрать оптимальные условия наработки биомассы и деструкции (pH, T, солёность и т.д.) [15].
Практическая часть эксперимента. Если штамм растёт — можно пересевать на меньшие и большие концентрации субстрата. Если нет — переводить реагенты бессмысленно. Если не растёт, а должно — можно проверить наличие функциональных генов методом ПЦР (рис. 8). При положительной амплификации делаем вывод, что что-то пошло не так. Можно продлить сроки эксперимента, изменить концентрацию субстрата, вносить больше биомассы или просто переделать с другой средой и чистыми флакончиками (на этот раз стоит проконтролировать этап очистки и стерилизации).
Для определения влияния ко-субстратов на деградацию можно использовать косвенный метод — набор биомассы, но тогда необходим контроль без внесения основного субстрата. Или обращаемся к химикам для анализа содержания ДДТ (или любого другого соединения) и его метаболитов.
Подготовка необходимого оборудования. «А тебе ламинар надолго нужен?», «А куда делись стерильные наконечники на 5 миллилитров? А на 200 микролитров?», «А стерильные пенициллинки ещё есть?», «А когда из автоклавной принесут?», «А чья это среда тут стоит?» и прочие лабораторные радости (рис. 9). Всё нужно готовить и согласовывать с коллегами по лаборатории заранее. Случай со свободной посудой особо тяжкий. Самый выигрышный вариант — мыть самостоятельно, заворачивать в бумагу и сверху подписывать «Не трогать. Для эксперимента» до и после стерилизации.

Рисунок 9. Плавление агаризованной богатой питательной среды LB. Как правило, среды изготавливают заранее, а затем автоклавируют (процесс стерилизации с повышенным давлением пара, что позволяет добиться температуры пара больше 100 °С). Хранят стерильно. Плотные (агаризованные) среды нагревают до разжижения и заливают в чашки Петри. При комнатной температуре агар затвердевает.
Этап пятый. Обработка полученных результатов
В большинстве случаев обработка результатов — это некий отчёт, где данные суммированы, прокомментированы, и либо сделан вывод (или представлен конечный результат), либо намечено дальнейшее направление работ. Этот документ может быть неофициальным, например, для непосредственного руководителя. Может быть полным — для предоставления информации о проделанной работе по гранту. Или кратким литературным произведением — статья для публикации. Данные лучше стараться приводить в форме таблиц и графиков, оси подписывать, а рисункам давать расширенные подписи. И вообще, в оформлении отчета много общего с удачным устным выступлением: «Как сделать хороший научный доклад» [16].
Практическая часть. Описание статистики и методов для публикаций. Статистика — это то, про что нельзя забывать. Иначе путь к публикации через рецензентов будет тернист и долог . Первые «примерочные» эксперименты на субстратную специфичность ставили в однократной повторности исключительно для того, чтобы определить принципиальное наличие деструкторов. Дальнейшие эксперименты уже ставят минимум в трёхкратной повторности, т.к. эти данные, опять же, понадобятся для сертификации.
Нет, ну правда. Вы только посмотрите, каких глупых ошибок можно наделать, если не осмысливать как следует, что за информацию получаешь: «Статистика: наглядное пособие» [17]! — Ред.
Чтобы определить скорость биодеградации (после выбора самых перспективных штаммов) уже не используют только визуальные методы. Теперь в ход идут более чувствительные способы исследования, такие как упомянутая выше хроматография .
Справедливости ради, у нас в лаборатории тоже есть хроматограф. Вот только он жидкостный, а последний «писк» — газовая хроматография. Дружите с химиками. Если у вас нет друзей с химического факультета — немедленно идите знакомиться.
Для определения pH и температуры при подборе оптимальных условий набора биомассы необходимо использовать высокочувствительные приборы в соответствии с принятыми методиками.
Установление таксономического положения требует расшифровки последовательности нуклеотидов всего генома, или, чаще, гена 16S субъединицы РНК . Для каждого образца деструкторов указывают ближайший типовой штамм, процент схожести, количество взятых для сравнения пар нуклеотидов и базу, по которой осуществлялся поиск гомологичных последовательностей .
Ген, кодирующий 16S (S от Седенберг, единицы седиментации или осаждения) субъединицу рибосомы, является очень консервативным. И, хотя результаты не абсолютные (даже если по этому гену сходство 100%, полногеномное секвенирование может показать, что это единственное место в геноме, где наблюдается сходство), лучше пока что ничего не придумали. — Авт.
Кстати, именно по 16S-РНК Карл Вёзе установил в свое время, что микроорганизмы делятся на два принципиально разных домена — бактерий и архей [18]. — Ред.
Методики могут разниться в силу наличия альтернатив или традиций, сложившихся в той или иной лаборатории. Для предотвращения разночтений всё тщательнейшим образом прописывается в разделе «Материалы и методы» в любой статье. Вплоть до номера партии реагентов и фирм-производителей оборудования. Всё это необходимо для независимого повторения экспериментов другими исследователями в ходе своих работ или для проверки результатов при наличии сомнений.
Идеальные представления о научном исследовании включают в себя принцип воспроизводимости — когда эксперимент можно независимо повторить в другом месте, используя только текстовое описание опыта. В действительности большинство биологических экспериментов воспроизводимо, увы, с трудом: «Мечты о воспроизводимости» [19]. — Ред.
Этап шестой. Выбор штаммов для создания препарата

Рисунок 10. Два штамма-деструктора во флаконах. Слева — активный деструктор бифенила, справа — штамм, не способный к утилизации субстрата 4-хлорбензойной кислоты (4-ХБК — промежуточный метаболит при разложении бифенила в клетке).
В зависимости от целей выбирают либо штаммы, активные в отношении наибольшего числа загрязнителей, либо наиболее активные в отношении какого-то определённого вещества (рис. 10). Для наших целей мы будем отбирать деструкторов ДДТ.
Следующий критерий отбора — скорость набора биомассы. Не стоит брать слишком медленно растущие штаммы, так как это усложнит разработку технологии производства. И приоритет лучше отдавать самым неприхотливым в плане среды деструкторам по тем же причинам. Никто не станет покупать биопрепарат, который культивируют на дорогих или требующих специфического обращения средах.
Если вы уже определили таксономическое положение хотя бы до рода, то не стоит выбирать и те штаммы, которые с большой вероятностью могут оказаться патогенными. В том числе и фито- или зоопатогенными (возбудителями заболеваний растений и животных). По вполне понятным причинам сертификацию такой препарат не пройдёт.
Этап седьмой. Внесение в коллекцию
Добавление штамма в коллекцию (депонирование) необходимо по ряду причин. Первое — в коллекции присланные образцы биомассы пройдут независимую проверку заявленных свойств. Второе — штамм гарантированно будет поддерживаться в жизнеспособном состоянии. Случаи утраты жизнеспособности штамма в коллекции редки, но если это произошло — вы обязаны восстановить образец из своих запасов. И третье — из коллекции и будут брать образцы для исследований при сертификации и патентовании.
Обычно для предотвращения полной утраты штамма (гибель всех образцов) в лабораториях практикуют заморозку в глицерине и/или лиофилизацию. В первом случае небольшое количество биомассы вносится в 30–40% глицерин и хранится при температуре −80 °С. Все реакции в клетке замедляются до почти полной остановки, а глицерин выступает как криопротектор (не даёт воде образовывать кристаллы, способные порвать мембрану клетки). Во втором случае образец замораживают в вакууме с одновременным испарением воды, переводя её из твёрдого агрегатного состояния сразу в газообразное, минуя жидкую фазу. При этом биологические образцы не теряют своих свойств и восстанавливают их при увлажнении. Из-за заморозки жидким азотом время кристаллизации получается очень коротким, а размер кристаллов очень малым, что позволяет избежать повреждения клеток. После сушки ампулы с образцами герметично запаивают и также хранят при температуре −80 °C.
Теоретическая часть. Документация. При осуществлении патентного депонирования коллекция выдаёт соответствующую справку, что является гарантом существования штамма и наличия у него заявленных свойств. Это проверяется как самой коллекцией, так и патентным агентством (при направлении запроса, коллекция представляет агентству образцы для проверки). До успешного патентования, или отказа агентства в выдаче патента, все сведения о штамме, в том числе и сам факт депонирования, являются конфиденциальными. Но любые проверяющие (или «разрешающие») организации, выдающие сертификаты и заключения, могут запросить из коллекции образцы штамма для исследования (с вашего разрешения и с приложением вашей заявки на патент или сертификацию).
Практическая часть. Исследование штамма. При приёме в коллекцию необходимо предоставить информацию о штамме.
- Данные, на основе которых определено таксономическое положение (расшифрованную последовательность нуклеотидов).
- Способ выделения (где, когда и кем), а также наименование организации, где культура была идентифицирована.
- Культурально-морфологические свойства с указанием среды (поскольку от среды культивирования эти признаки могут существенно зависеть).
- Область применения штамма. Для промышленных микроорганизмов это обычно либо деструкция, либо синтез какого-либо соединения.
- Производственные показатели и способ их проверки. Здесь указывается скорость синтеза или деструкции соединений.
- Способ и условия длительного хранения, а также состав сред. Грубо говоря, стоит указать уже опробованный вами способ хранения. Смогли восстановить культуру из глицерина — пусть в коллекции хранят так же. То же самое и с лиофилизацией. Есть вариант хранения в жидкой минеральной среде с субстратом в холодильнике (уже не такая экстремальная температура, как −80 °C).
- То же, но для размножения (набора биомассы) и ферментации (проявления активности — синтез или деструкция).
- Генетические особенности штамма и сведения о его безопасности (патогенности).
Этап восьмой. Получение патента
Патентование — защита прав интеллектуальной собственности. Результатом данной процедуры является законодательное закрепление результатов вашей работы за вами, присвоение вам права собственности на ваше изобретение, подтверждении научной новизны и практической полезности. Патент сам по себе — бумага, подтверждающая ваши права на ваше открытие, или какой-либо результат деятельности (например, создание нового прибора). Патентованию подлежит либо сам штамм, либо изобретение с его использованием.
Патентное агентство РФ — главный орган, регистрирующий права интеллектуальной собственности в России . Депонированный в коллекции штамм является подтверждением осуществимости изобретения. В России есть всего несколько коллекций, которым разрешено предоставлять услугу «патентного депонирования». Всероссийская коллекция промышленных микроорганизмов (ВКПМ) — одна из них . Патентное агентство может запросить образцы штамма из коллекции для проверки заявленных свойств.
После регистрации штамма в качестве вашей интеллектуальной собственности любое использование этого микроорганизма с целью получения прибыли даёт вам право на пересечение подобной деятельности или на часть прибыли.
Для подачи в патентное агентство необходим документ о депонировании штамма (Приказ Роспатента от 25.07.2011 № 87 «О введении в действие Руководства по экспертизе заявок на изобретения»), включающий в себя:
— наименование штамма с таксономическими характеристиками;
— авторское обозначение штамма, с которым он поступает в коллекцию;
— полное наименование организации, осуществляющей депонирование;
— регистрационный номер штамма, присвоенный коллекцией;
— дату депонирования штамма;
— официальные подпись и печать.
Всероссийская коллекция промышленных микроорганизмов предоставляет услугу «патентное депонирование».
Этап девятый. Получение сертификата
Сертификация штамма — долгий бюрократический процесс. Результатом этой процедуры для биопрепарата является разрешение на производство и использование на территории России.
Первым делом необходимо получить гигиенический сертификат. Разрабатываются предельно допустимые концентрации (ПДК) живых клеток, мёртвых клеток и концентрация клеток для биопрепарата. Определяется патогенность для человека (на данном этапе проверяются в основном параметры для производства, фито- и зоопатогенность поверят позже). Патогенность и ПДК тесно связаны: чем выше токсичность, тем ниже ПДК, и наоборот. Токсичность определяют путём введения суспензии клеток в желудок модельного организма (например, мыши) и наблюдаются развивающиеся эффекты с учётом скорости проявления. ПДК определяют как ту концентрацию, при которой не развиваются патогенные эффекты. Обычно различают токсичность и токсикогенность. Первое — патологическое влияние самих клеток, второе — выделение токсинов, которые и оказывают патогенный эффект. Выделяют четыре категории токсичности, первая — самая опасная. К использованию в биопрепаратах разрешены штаммы, относящиеся к третьей и четвёртой категории.
Второй этап — получение санитарно-эпидемиологического заключения. Для этого нужно предоставить гигиенический сертификат, разработанную инструкцию по применению препарата (в зависимости от свойств деструктора) и технологический регламент производства (условия культивирования с учётом ПДК). Разрешающая организация проверяет соответствие документации нормативным документам. Также проводится токсикологическая экспертиза — оценка влияния вашего штамма на окружающую среду. Если всё в порядке — организация выдаёт санитарно-эпидемиологическое заключение.
Теперь со всеми собранными бумагами можно получить разрешение на производство и использование.
Та-дам! Теперь ваша группа исследователей является счастливыми обладателями патента. Надбавка к зарплате включена. Получение этого разрешения — конечный результат сертификации биопрепарата . Подробнее в источнике [20].
Порядок выдачи регламентирован приказом Роспотребнадзора «О санитарно-эпидемиологических экспертизах, обследованиях, исследованиях, испытаниях и токсикологических, гигиенических и иных видах оценок» от 19.06.2007. Самый главный регламентирующий документ — Федеральный Закон «Об охране окружающей среды» от 10.01.2002 с изменениями от 13.07.2015. Комплексная санитарно-гигиеническая оценка (№ 5789/1-91 от 11.06.1991) экологотоксикологическая оценка (влияние препарата на окружающую среду) на основании стандартов ЕЭС 87/153 от 16.02.1987 и ЮНЕП от 1987.
Заключение
Проходить практику в лабораториях сложно, сопряжено с ответственностью, но интересно. Попав в лабораторию в первый раз, я не думала, что мне дадут заниматься чем-то важным. Трогать реактивы было страшно, хотя вот перед глазами состав сред, и перепутать что-то довольно сложно. И даже при мытье посуды в первые разы я много чего разбила (ладно, всего-то воронку, чашку Петри и ещё раз чашку, да). За время прохождения производственной практики, а это около трёх месяцев, я полностью привыкла к лаборатории. Освоила как молекулярные, так и генетические методы исследований (биотехнология — вполне себе междисциплинарная область) на практике и в теории. Задала всем кучу вопросов «А почему так?» и «А как оно работает?». Завершила несколько экспериментов, в т.ч. и проверила некоторые теоретические выкладки — непроницаемость химического стекла для УФЛ и подсчёт микробной нагрузки в воздухе. Съездила в другой город для передачи образцов, побывала в институте у химиков, спросила «А как оно работает?» и там.
Все встреченные мною учёные с удовольствием отвечали на мои вопросы так подробно, как могли, и поддерживали мою инициативу (если нет — то подробно объясняли где в моих рассуждениях ошибка и почему так делать не стоит). Неожиданно, но заниматься научной деятельностью действительно может каждый !
При наличии высшего образования с хорошими знаниями и навыками (не «ради диплома») и приложением усилий в изучении специальной теории и применении её на практике. Да-да, не по щелчку пальцев. Но, на самом деле, вполне посильно.
Из плюсов разработки и сертификации биопрепарата:
- Наработка материала для исследований (культуры штаммов);
- Получение опыта и навыков работы;
- Разнообразие полученных умений;
- Сопоставление теории с практикой;
- Опыт работы с соответствующим оборудованием;
- Установка связей с исследователями в других областях;
- Опыт работы в научно-исследовательском коллективе;
- Надбавка к заработной плате за счёт патентных выплат (если препарат будет востребован).
За время обучения запатентовать биопрепарат очень маловероятно. Но со всеми сопутствующими материалами можно публиковаться, что послужит хорошим заделом для дальнейшего обучения.
Данное руководство написано студентом и для студентов. Преподаватели и научные руководители частично смогут использовать его как ответы на некоторые «почему?» и «зачем?» своих подопечных.
Все предоставленные для примера материалы (кроме фотографий) будут опубликованы в сборнике «V Информационной школы молодого ученого» (Всероссийская междисциплинарная молодежная научная конференция 30 ноября — 3 декабря 2015 г., г. Екатеринбург).
Работа поддержана грантом РФФИ-Урал № 14-04-96021р_урал_а.
Литература
- Barry C. Kelly, Michael G. Ikonomou, Joel D. Blair, Anne E. Morin, Frank A. P. C. Gobas. (2007). Food WebSpecific Biomagnification of Persistent Organic Pollutants. Science. 317, 236-239;
- Бактерии-нефтедеструкторы для биоремедиации супесчаных почв Воронежской области;
- Пределы биодоступности углеводородов в грунтах;
- «Зеленые» революционеры;
- Иммуностимулирующие филаментные бактерии: наконец-то они приручены!;
- Harichandra Z. Ninnekar, Chandrappa M. Kamanavalli. (2004). Biodegradation of DDT by a Pseudomonas Species. Current Microbiology. 48, 10-13;
- John F. Quensen, Sherry A. Mueller, Mahendra K. Jain, James M. Tiedje. (1998). Reductive Dechlorination of DDE to DDMU in Marine Sediment Microcosms. Science. 280, 722-724;
- Kinuthia M., Hamadi I.B., Anne W.M., Ciira K., Muniru K.T. (2010). Degradation of dichlorodiphenyltrichloroethane (DDT) by bacterial isolates from cultivated and uncultivated soil. Afr. J. Microbiol. Res. 4, 185-196;
- Нетрусов А.И. и Егорова М.А. Практикум по микробиологии. М.: Издательский центр «Академия», 2005.— 608 c.;
- Возвращение Цвета;
- Lorenzo Brusetti, Iana Malkhazova, Maher Gtari, Isabella Tamagnini, Sara Borin, et. al.. (2008). Fluorescent-BOX-PCR for resolving bacterial genetic diversity, endemism and biogeography. BMC Microbiol. 8;
- Rajiv Ahuja, Ashwani Kumar. (2003). Metabolism of DDT [1,1,1-Trichloro-2,2-bis(4-chlorophenyl)ethane] by Alcaligenes denitrificans ITRC-4 Under Aerobic and Anaerobic Conditions. Current Microbiology. 46, 65-69;
- N. Deepthi ., H.K. Manonmani .. (2007). Co-Metabolic Degradation of Dichloro Diphenyl Trichloroethane by a Defined Microbial Consortium. Research J. of Environmental Toxicology. 1, 85-91;
- Bo Gao, Wen-Bin Liu, Ling-Yun Jia, Li Xu, Jian Xie. (2011). Isolation and characterization of an Alcaligenes sp. strain DG-5 capable of degrading DDTs under aerobic conditions. J. of Env. Sc. & Hlth., Part B. 46, 257-263;
- Geetika Pant, Sandeep Kumar Mistry, G. Sibi. (2013). Isolation, Identification and Characterization of p, p’-DDT Degrading Bacteria from Soil. J. of Environmental Science and Technology. 6, 130-137;
- Как сделать хороший научный доклад;
- Статистика: наглядное пособие;
- Карл Вёзе (1928–2012);
- Мечты о воспроизводимости;
- Кузнецов А.Е. Прикладная экобиотехнология (том 2). Москва: БИНОМ. Лаборатория знаний, 2012.— 485 c..