Сон и старение I: «Часы в мозге» и влияние генов на ритм жизни
25 февраля 2016
Сон и старение I: «Часы в мозге» и влияние генов на ритм жизни
- 20775
- 4
- 27
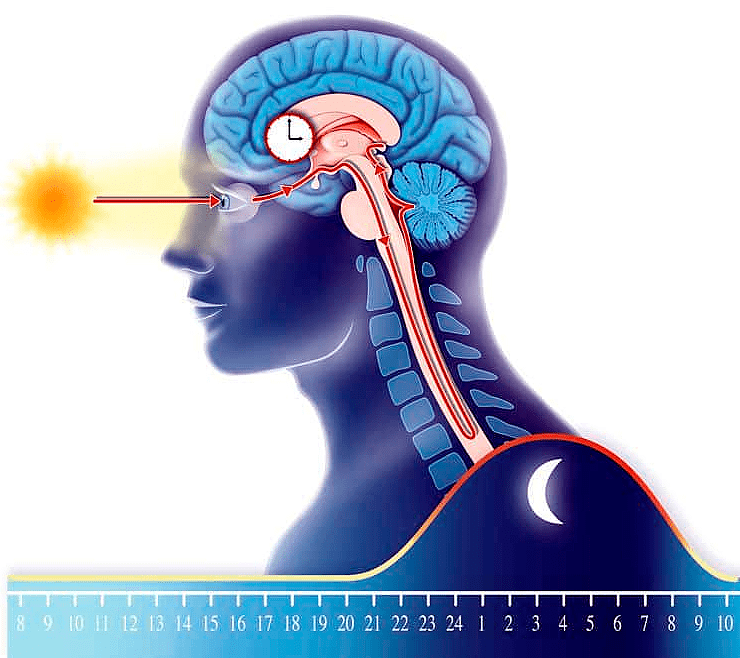
Эпифиз вырабатывает «гормон сна» мелатонин ночью, а солнечный свет тормозит его образование. Мелатонин — главный регулятор циркадных ритмов, управляющих распорядком дня человека.
рисунок Sophie Jacopin
-
Автор
-
Редакторы
Новая неделя, новый день, новый год. Время жизни разбито на отрывки разной длительности, и все эти отрывки повторяются. Каждые несколько часов нам хочется есть. Каждый вечер мы ложимся спать. Каждые четыре недели организм женщины вырабатывает яйцеклетку. Большинство процессов, происходящих с нашим телом, циклично, и одни циклы завязаны на другие. И хотя старение организма периодическим процессом не назовёшь (ведь никто не молодеет!), его ход напрямую зависит от биоритмов человека, в частности, от цикла сна и бодрствования. Доказательства этому находятся и на уровне поведения, и на уровне отдельных органов, клеток и генов.
Старение и долголетие
Цикл статей, задуманных в рамках спецпроекта «биомолекулы» для фонда «Наука за продление жизни».

В этом цикле рассмотрим общие проблемы старения клеток и организмов, научные подходы к долголетию и продлению здоровой жизни, связь сна и старения, питания и продолжительности жизни (обратимся к нутригеномике), расскажем про организмы с пренебрежимым старением, осветим темы (эпи)генетики старения и анабиоза.
Конечно, феномен старения настолько сложен, что пока рано говорить о радикальных успехах в борьбе с ним и даже о четком понимании его причин и механизмов. Но мы постараемся подобрать наиболее интересную и серьёзную информацию о нащупанных связях, модельных объектах, разрабатываемых и уже доступных технологиях коррекции возрастзависимых нарушений.
Краткое содержание спецпроекта освещено в видеоролике «Стареть или не стареть? // Всё как у зверей». Подробности же узнаете из наших статей.
Следите за обновлениями!
Часы в мозге
Наиболее заметный и один из самых важных в жизни человека биоритмов — циркадный, он же циркадианный (от слов circa — около, приблизительно и dias — день). Более простое название циркадных ритмов — ритмы сна и бодрствования . Это из-за них мы не можем работать сутками (а хотелось бы!) . Конечно, у циркадных ритмов существует и обратная, светлая, сторона: есть подозрение, что регулярная смена сна и бодрствования помогает организмам некоторое время не стареть . По крайней мере, доподлинно известно, что мозговые структуры, обеспечивающие работу «внутренних часов», у человека и мышей с возрастом проявляют явные признаки дегенерации. В число таких структур входят супрахиазматическое ядро (suprachiasmatic nucleus, SCN) гипоталамуса и голубое пятно (locus coeruleus, LC) — регион ствола мозга. Супрахиазматическое ядро — главный регулятор, управляющий работой других участков мозга и внутренних органов (рис. 1). Оно распространяет свое влияние на голубое пятно, а то, в свою очередь, посылает сигналы в кору больших полушарий, которая, как мы знаем, руководит направленным вниманием. От эффективности работы коры зависит и производительность человека.
Как показывает практика, механизмы смены сна и бодрствования можно объяснить даже детям — «„Проснись!“ — „Усни...“ — „Проснись!“ — „Усни...“ — „Проснись!“» [1]. — Ред.
У дрозофил нашли подобие «гена сна», что описано в статье «Бессонные ночи дрозофилы» [2]. Чисто теоретически это может привести к тому, что потребностью во сне можно будет управлять, но вряд ли мы это когда-то увидим. — Ред.
Есть предположение, что изначально (много миллионов лет назад) циркадные ритмы помогали организмам не умирать от кислорода, которого в тот момент в атмосфере стало аномально много для тогдашних обитателей планеты — «Прообраз биологических часов» [3]. — Ред.
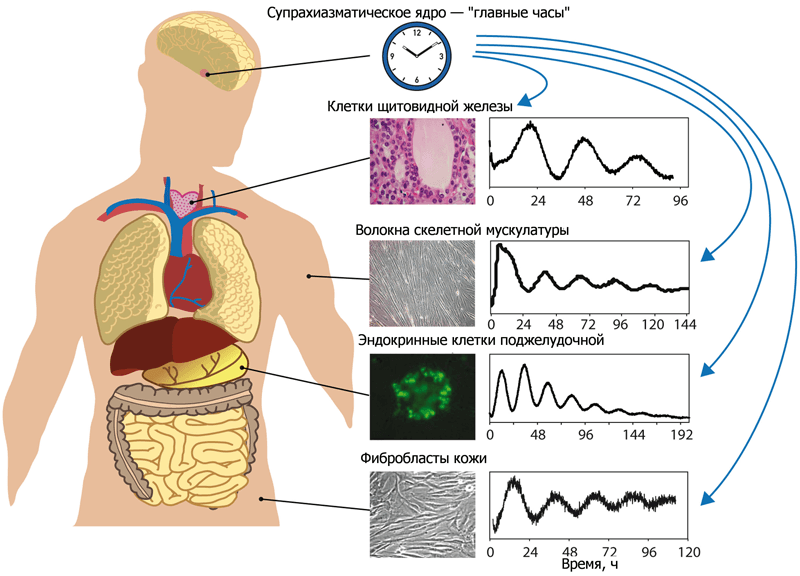
Рисунок 1. Влияние супрахиазматического ядра гипоталамуса на работу различных клеток организма. Функционирование клеток всех типов тканей подчиняется центральному ритму, который задаёт супрахиазматическое ядро гипоталамуса. Оно «следит» за тем, чтобы сигналы от нервной и эндокринной систем приходили к клеткам в одно и то же время — фактически, синхронизирует их. Кстати, то же можно сделать и вне организма: выращивая в культурах несколько образцов различных тканей человека, можно эти культуры синхронизировать, если имитировать сигналы SCN. Такая синхронизация активности культур различных типов клеток одного и того же человека представлена на графиках.
В ходе исследований посмертных срезов мозга здоровых пожилых людей выяснилось, что с возрастом нейроны SCN дегенерируют. Изменяется и структура LC. Кроме того, активность лобных долей коры значительно падает с возрастом (и степень снижения этой активности напрямую отражается на интеллекте), что показано в исследованиях фМРТ [4]. Всё это приводит к тому, что со временем у людей исчезают острые пики активности при бодрствовании. То есть пожилые, конечно, бодрствуют, но внимательность и скорость мышления у них не так хороши, как раньше. Вероятно, причина этого — постепенное ухудшение работы мозговых регуляторов сна и бодрствования.
У пожилых по сравнению с молодыми эффективность сна снижена. С этим может быть связана старческая сонливость, возникающая даже тогда, когда человек определённо выспался. Судя по всему, возрастное падение качества сна не вызвано какими-то конкретными патологиями, это просто часть обычного процесса старения. Впрочем, так ли неизбежно само старение, вопрос.
Кроме того, старые хуже переносят вынужденный пропуск сна. Это показали эксперименты, в ходе которых 12 мужчин возрастом 21–31 год и 11 мужчин возрастом 61–70 лет не спали 40 часов (рис. 2). У пожилых субъективное ощущение сонливости было сильнее, чем у молодых, да и внимание из-за недосыпа падало заметнее [5].
Другой эксперимент с такой же длительностью провели в 2005 году [6]. Его результаты тоже представлены на рисунке 2 (закрашенные серым области). В нём двум группам участников-мужчин (опять пожилым и молодым) нужно было в течение 40 часов то спать по 75 минут, то бодрствовать по 150 минут, притом делать это по расписанию. Такой искусственный режим должен был выявить, насколько сон у людей одной возрастной группы более эффективен, чем у испытуемых из другой группы. Нетрудно догадаться, что молодые во время эксперимента и после него чувствовали себя лучше, чем пожилые, потому что лучше высыпались.
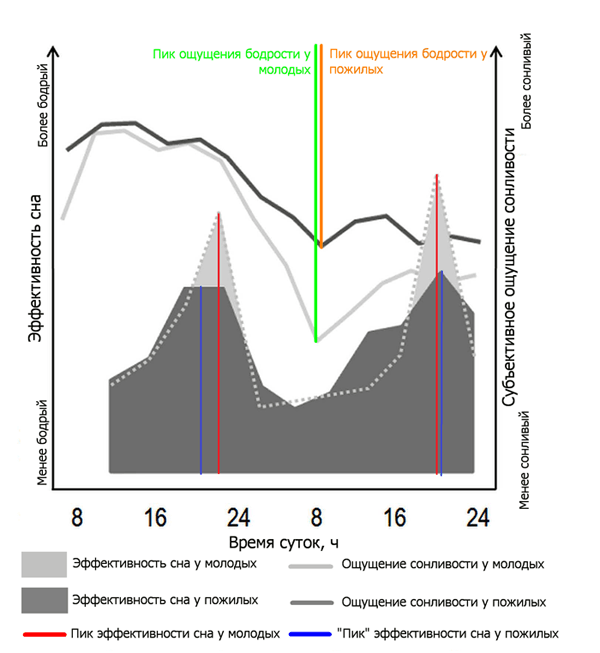
Рисунок 2. Субъективное восприятие качества сна и бодрствования у молодых и пожилых мужчин во время 40-часового эксперимента по лишению сна [5], а также эффективность сна во время эксперимента с множеством эпизодов сна [6]. Пожилые раньше начинают чувствовать сонливость, и субъективно она проявляется сильнее (тёмно-серая линия). Молодые более устойчивы к депривации сна (светло-серая линия). Кроме того, субъективно сон молодых (светло-серые закрашенные области) более эффективен, чем сон пожилых (тёмно-серые закрашенные области).
[4], рисунок адаптирован
«Гены циркадных ритмов» и старение
Работа любого органа — это, в конечном счёте, работа его генов. Наши «внутренние часы» — не исключение. В супрахиазматическом ядре экспрессируется ряд генов, малоактивных в других частях мозга и тела вообще. Среди таких генов BMAL1 (он же MOP3 и ARNT3), CLOCK и NPAS2 [7], [8]. Эти гены были выявлены в исследованиях с помощью нокаутных мышей — таких, которым методами генной инженерии нарушили работу одного или нескольких генов.
Как правило, продолжительность жизни у грызунов с одним или несколькими выключенными «генами периодичности» снижена. В частности, мыши с неработающим BMAL1 живут меньше своих собратьев. Под конец жизни у них проявляются все характерные признаки старения: их органы уменьшаются в размерах, теряется мышечная масса и подкожный жир, развивается старческая катаракта, повышается содержание активных форм кислорода в тканях [9]. При постоянной нехватке белков BMAL1 и CLOCK ухудшается память, снижается интеллект: животные хуже обучаются и быстрее забывают новую информацию [10].
BMAL1 и CLOCK действуют по-разному: если «выключить» работу гена CLOCK, не затрагивая BMAL1, жизнь мышей претерпевает менее глобальные изменения. Средний срок жизни грызунов без CLOCK на 15% короче, чем у животных дикого типа, а преждевременное старение проявляется у них только в изменении структуры кожи и развитии катаракты [11].
Изменения, описанные выше, происходят на уровне отдельных органов. Но ведь органы состоят из клеток, и настоящий экшен всегда в первую очередь разворачивается там. Поэтому имеет смысл посмотреть на то, что делают «гены циркадных ритмов» на клеточном уровне . Большинство их эффектов можно причислить к одной из нескольких категорий (рис. 3).
Вот один из примеров связи циркадных ритмов с обменом веществ в целом: «Найдена связь между обменом веществ и циркадным ритмом» [12].
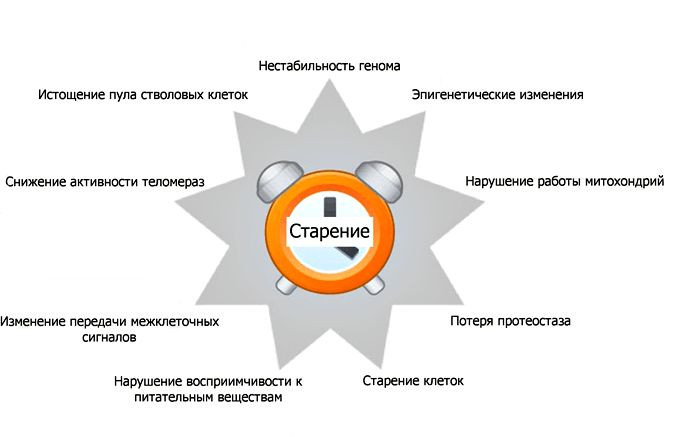
Рисунок 3. Примеры проявлений старения на клеточном уровне. Подробное объяснение этих проявлений дано ниже в тексте в виде нумерованного списка.
- Изменение клеточного цикла. Клеточный цикл — чередование стадий роста и деления клетки. Разные типы клеток делятся с неодинаковой частотой, и эта частота не случайна. Распорядок жизни клеток подчиняется циркадным ритмам. Если последние по какой-то причине (например, из-за ненормированного рабочего дня или в результате старения) сбиваются, вероятность несвоевременного деления клеток возрастает, а с ней растёт и вероятность образования опухолей [13]. Биохимические процессы, контролирующие смену стадий клеточного цикла, зависят от ферментативных реакций, обеспечивающих проявление циркадных ритмов. Поэтому если будут нарушены последние, то пострадают и первые. Например, клетка может начать делиться, хотя ей уже не стоит это делать. А ведь бесконтрольное деление — признак раковой клетки.
- Нестабильность генома. Непостоянный состав ДНК в клетке ничего хорошего не сулит. Нестабильность генома означает повышенное число мутаций и повышенную вероятность злокачественного перерождения клетки. Конечно, существует ряд механизмов, которые геномной нестабильности противостоят. Это, например, действие белка SIRT6 [9] (по роду деятельности это NAD-зависимая деацетилаза). Он руководит в том числе работой белков BMAL1 и CLOCK [10]. В свою очередь, изменения их активности оказывают прямое воздействие на SIRT6, а значит, и на стабильность генома.
Мыши с недостатком SIRT6 умирают очень быстро — в возрасте четырёх недель. Выглядят они при этом неважно: теряют мышечную массу, их спинки горбятся, число лимфоцитов в крови снижается, а вместе с этим ухудшается иммунитет. Вновь мы видим признаки, характерные для старых животных. - Снижение активности теломераз. Теломеразы — это ферменты, которые не дают укорачиваться теломерам — бессмысленным фрагментам ДНК, находящимся на концах хромосом и защищающим «осмысленные» гены ближе к центру этих хромосом от исчезновения. Перед тем как клетке приходит пора поделиться, её хромосомы должны удвоиться. Но из-за особенностей механизма такого удвоения хромосомы каждый раз немного укорачиваются на концах. До поры до времени их гены от повреждения защищают теломеры. Приблизительно после 50 делений теломеры сокращаются настолько, что фактически исчезают. После этого начинается повреждение генов, а с ним мутации клеток и их старение.
Активность комплексов теломераз и их составляющих, в частности белка под названием TERT, зависит от циркадных ритмов. Экспрессия мРНК теломеразного комплекса напрямую регулируется белками CLOCK и BMAL (они соединяются в единую молекулу, называемую гетеродимером) [14]. Видимо, поэтому мыши с дефицитом белка CLOCK имеют более короткие теломеры и, как следствие, более короткую продолжительность жизни: у них хуже работают теломеразы. - Эпигенетические модификации различных генов. Важен не только состав генов, но и то, где, когда и насколько интенсивно образуются кодируемые ими белки. Чтобы сделать ген более или менее доступным для транскрипции (считывания информации, то есть её перевода в форму РНК), нужно либо метилировать его, либо деацетилировать гистоны вокруг него. Как правило, метилирование подавляет экспрессию гена (т.е. кодируемых этим геном белков в итоге вырабатывается меньше), а деацетилирование гистонов, наоборот, усиливает (ДНК намотана вокруг гистонов, и когда плотность этой «обмотки» ослабевает, становится проще считывать последовательность нуклеотидов). Деацетилаза гистонов SIRT1 усиливает экспрессию генов BMAL1 и CLOCK. А они, как мы помним, участвуют в регуляции циркадных ритмов. Их активность с возрастом снижается. Возможно, это даёт обратную связь SIRT1, в результате чего меняется и его экспрессия. Итог: с возрастом изменяется доступность многих генов, а это не может не сказаться на функциях организма [15].
- Потеря протеостаза. Постоянство внутренней среды организма (гомеостаз) — один из признаков того, что этот организм ещё жив. Внутренняя среда включает в себя и белки тоже. Каждый белок должен присутствовать в некой определённой концентрации, а его молекулы должны быть «свёрнуты» определённым образом. Идеальное состояние белков в теле называется протеостаз.
С возрастом способность клеток обезвреживать чужеродные вещества и продукты обмена и нейтрализовать последствия неправильной укладки белков снижается. Часть процессов детоксикации, которые проходят в клетках печени, регулируется циркадными транскрипционными факторами (контролёрами синтеза РНК) PAR-bZip [16]. То есть с возрастом, когда нарушаются циркадные ритмы, снижается и способность к протеостазу, потому что её контролируют циркадные транскрипционные факторы. - Распознавание питательных веществ. Понять, есть ли в окружении клетки что-то пригодное в пищу, помогает метаболический путь TOR (target of rapamycin). Биохимические реакции в составе этого пути идут слишком интенсивно при диабете и других нарушениях метаболизма, а также... да, вы догадались: у мышей, лишённых гена BMAL1. Продолжительность их жизни снижена, но её можно повысить на 50%, вводя ингибитор пути TOR — рапамицин [17].
- Работа митохондрий. В митохондриях постоянно проходят реакции окисления и восстановления, и именно они служат основным источником энергии для большинства клеток. Одну из главных ролей в этих процессах играет метаболический путь NAD+. Его работа напрямую зависит от циркадных ритмов. В частности, у мышей, лишённых гена BMAL1, энергетический обмен в митохондриях нарушен [18].
- Истощение пула стволовых клеток. Циркадные ритмы поддерживают баланс самообновления множества стволовых клеток. Они же регулируют, будут ли стволовые клетки дифференцироваться в другие типы клеток. Баланс этот весьма важен. Если стволовые клетки дают начало себе подобным слишком редко, организм медленно восстанавливается после повреждений. Если же стволовые клетки делятся очень часто, их способности могут преждевременно исчерпаться. Ткани различных органов перестанут эффективно обновляться, и тогда старение проявит себя.
Интересно, что работа разных генов воздействует на деление стволовых клеток неодинаково. У мышей, лишённых гена BMAL1, увеличено число покоящихся стволовых клеток (плюс рано начинается старение эпидермиса), а у мышей, лишённых генов Period1/Period2, наоборот: количество неделящихся стволовых клеток снижено [19]. - Межклеточная коммуникация. Надо признать, что в этой области известно ещё немного. Правда, уже сейчас из экспериментов с очень старыми мышами ясно, что с возрастом синхронизация работы нейронов супрахиазматического ядра нарушается. Нарушение происходит на уровне нервных контактов [20]. Клетки не могут работать согласованно, потому что теряют способность передавать или воспринимать сигналы своих соседей (а может, и то, и другое). Поскольку речь идёт о «центре сна», то понятно, почему сон ухудшается в старости: нейроны SCN просто больше не могут между собой договориться.
- Солевой обмен и артериальное давление. Мыши, у которых отсутствует ген Cry2 (криптохром-2), имеют аномально высокое артериальное давление. Оно особенно сильно зависит от содержания соли в организме, т.к. у таких грызунов вырабатываются огромные количества альдостерона — гормона, вызывающего задержку воды и ионов натрия в жидкостях организма [21]. Это бы не имело значения для повествования о сне, если бы не тот факт, что Cry2 — ген, влияющий на циркадные ритмы [22].
Исследования обычно проводятся на больших группах животных, и данные по этим животным усредняются. Но мы-то помним, что каждый организм имеет свой уникальный геном, и от того, как гены в его составе взаимодействуют между собой, зависит очень многое. У двух мышей может быть нарушена работа одного и того же CLOCK, но на уровне отдельных органов и организма в целом это нарушение проявится у них совершенно по-разному. Да даже если с вариантами генов всё в порядке, два организма не будут стариться одинаково. Дело в том, что роль в силе и характере изменений сна с возрастом играет и генотип конкретного организма. Это было подтверждено исследованиями на мышах [23], [24], в которых качество сна грызунов оценивали по элетроэнцефалограммам, а также смотрели, как с возрастом у этих грызунов ухудшается зрение.
Лабораторные мыши бывают нескольких линий (это понятие довольно близко по смыслу к термину «порода»), притом каждая линия имеет своё обозначение из цифр и букв . Грызуны одной линии появились на свет в результате скрещиваний близких родственников. Они похожи друг на друга как внешне, так и внутренне — и по генотипу, и по фенотипу. Чаще всего используют мышей линий C57BL/6, DBA/2J, AKR/J и некоторых других.
Для крыс это тоже верно: «Грызун особого назначения» [25].
У грызунов линии C57BL/6 чаще других с возрастом развивается катаракта, а значит, почти пропадает зрение. Видимо, поэтому под старость (в возрасте примерно год) эти сумеречные животные всё более активны в светлое время суток и всё менее активны в темноте. Кроме того, пожилые C57BL/6 бодрствуют дольше остальных, а AKR/J дольше всех спят. Больше всего времени в стадии REM-сна проводят мыши линии DBA/2J, а меньше всего — AKR/J. Если годовалым мышам этих трёх линий некоторое время мешать спать, а потом дать им возможность выспаться, то быстрее всех к своему обычному режиму возвращаются грызуны C57BL/6.
Сон и метаболизм
Мы выяснили, как нарушение работы «генов циркадных ритмов» влияет на состояние отдельных клеток. А как на них действует нарушения сна, столь частые в преклонном возрасте?
Хотя сон считается временем покоя, во время сна очищение нейронов от «отработанных» продуктов обмена веществ происходит быстрее, чем при бодрствовании [26]. Кстати, ночью очищается не только нервная система. Во время сна также усиливается или ослабевает экспрессия ряда генов. В тканях лёгких экспрессия 3% генов различается во сне и при бодрствовании. В тканях сердца таких «сон-зависимых» генов 6%. Во время сна содержание маркеров клеточного стресса в тканях лёгких, сердца и мозга снижено [27].
Возможно, одна из функций сна — избавление организма от отработанных метаболитов и общее восстановление клеток после стресса. Если это предположение окажется верным, оно сможет объяснить некоторые факты. Например, известно, что независимо от национальности у женщин 46–57 лет, имеющих частые жалобы на качество сна, особенно высок риск метаболического синдрома [28]. Впрочем, последнее может быть связано с тем, что в дополнительные часы бодрствования эти женщины едят [29]. А значит, они потребляют больше калорий в сутки, чем женщины без проблем со сном. В пользу этой гипотезы свидетельствует то, что экспериментальное нарушение сна не вызывало у крыс метаболического синдрома [30].
По данным эпидемиологических исследований, депривация (ограничение времени) сна повышает вероятность дислипидемии, диабета 2 типа и нетолерантности к глюкозе (таб. 1).
| Первый автор статьи, ссылка | Год | Число участников | Продолжительность исследования | Результаты |
|---|---|---|---|---|
| Chaput et al. [32] | 2007 | 740 | 3 года | Регулярный сон длительностью менее 6 часов вызывает нарушение толерантности к глюкозе. |
| Mallon et al. [33] | 2005 | 2663 | 12 лет | У мужчин частые пробуждения и короткий сон связаны с повышенной вероятностью диабета. |
| Nilsson et al. [34] | 2004 | 6599 | 14,8 ± 2,4 года | Нарушения сна повышают риск развития диабета. |
| Tuomilehto et al. [35] | 2008 | 2800 | 2 года | Слишком короткий (≤6 ч) или слишком длинный (≥8ч) сон повышают вероятность развития диабета 2 типа у женщин среднего возраста. У мужчин аналогичного эффекта не нашли. |
| Meisinger et al. [36] | 2005 | 8300 | 11 лет | У людей обоих полов сложности с поддержанием сна (частые просыпания и т.п.) повышают риск развития диабета 2 типа. |
| Hayashino et al. [37] | 2007 | 6509 | 6 лет | У взрослых без серьёзных проблем со здоровьем нарушения засыпания связаны с повышенным риском диабета. |
| Kawakami et al. [38] | 2004 | 2649 | 8 лет | Нарушения сна связаны с повышением риска диабета в 2-3 раза. |
| Choi et al. [39] | 2008 | 4222 | 1 год | И слишком короткий, и слишком длинный сон ассоциируются с повышенным риском метаболического синдрома. |
| Gangwisch et al. [40] | 2007 | 8992 | 10 лет | Кратковременный сон может быть важным фактором риска диабета. |
| Xu et al. [41] | 2010 | 10143 | 10 лет | Короткий ночной сон и частый дневной сон связаны с проявлением диабета. |
| Rafalson et al. [42] | 2010 | 1455 | 6 лет | Короткий ночной сон связан с нарушением содержания глюкозы в крови натощак, вызванным резистентностью к инсулину. |
| Yaggi et al. [43] | 2006 | 1709 | 18 лет | И слишком короткий, и слишком длинный сон повышают риск развития диабета. |
| Hall et al. [44] | 2008 | 1214 | Одномоментное исследование | Продолжительность сна связана со степенью риска метаболического синдрома. |
| Facco et al. [45] | 2010 | 189 | В течение беременности | Малая продолжительность сна связана с нарушением толерантности к глюкозе во время беременности. |
| Qui et al. [46] | 2010 | 1290 | В течение беременности | Гестационный диабет (диабет беременных) и нарушение толерантности к глюкозе чаще развиваются у тех, кто мало спит. |
Помимо нарушений метаболизма, ошибок репликации и повышенным по сравнению с нормой процентом гибнущих клеток [30], депривация сна может повлечь за собой негативные последствия для иммунной системы. У пациентов с постоянным недосыпом днём в крови повышается содержание маркеров воспаления — фактора некроза опухолей (TNF), интерлейкинов 1 и 6, а также кортизола [31], [47]. А ведь воспаление идёт рука об руку с повышенным риском множества заболеваний, начиная от инсульта и заканчивая болезнью Альцгеймера. Например, при последней клетки микроглии (это макрофаги в мозге) выделяют заметные количества интерлейкинов 12 и 23 — одних из важнейших сигналов воспаления. В норме этого, разумеется, не происходит, ведь ни болезни Альцгеймера, ни воспаления нет. Судя по всему, команду микроглии вырабатывать факторы воспаления даёт сам бета-амилоид. Далее, при болезни Альцгеймера астроциты (разновидность глиальных клеток, питают и поддерживают нейроны, направляют их рост у зародышей) становятся восприимчивыми к IL-12 и IL-23 (опять же, в норме такого не наблюдается.) Отложения бета-амилоида увеличиваются в размерах, клеток астроглии становится всё больше, а нейронов рядом с ними — всё меньше [48]. Если снизить выработку IL-12 и IL-23 в клетках глии, патология замедлит своё развитие.
Во взаимосвязях воспаления, выделения интерлейкинов и работы астроцитов при болезни Альцгеймера ещё предстоит разобраться, но уже сейчас ясно, что такие взаимосвязи существуют. На самом деле, подобных корреляций выявили уже немало. А о связи нарушений сна и различных заболеваний (нервных, и не только) будет отдельная статья.
Литература
- «Проснись!» — «Усни...» — «Проснись!» — «Усни...» — «Проснись!»;
- Бессонные ночи дрозофилы;
- Прообраз биологических часов;
- Schmidt C., Peigneux P., Cajochen C. (2012). Age-related changes in sleep and circadian rhythms: impact on cognitive performance and underlying neuroanatomical networks. Front. Neurol. 3, 118;
- Adam M., Rétey J.V., Khatami R., Landolt H.P. (2006). Age-related changes in the time course of vigilant attention during 40 hours without sleep in men. Sleep. 29, 55–57;
- Mirjam Münch, Vera Knoblauch, Katharina Blatter, Carmen Schröder, Corina Schnitzler, et. al.. (2005). Age-related attenuation of the evening circadian arousal signal in humans. Neurobiology of Aging. 26, 1307-1319;
- Fonseca Costa S.S. and Ripperger J.A. (2015). Impact of the circadian clock on the aging process. Front. Neurol. 6, 43;
- Elizabeth A. Yu, David R. Weaver. (2011). Disrupting the circadian clock: Gene-specific effects on aging, cancer, and other phenotypes. aging. 3, 479-493;
- Raul Mostoslavsky, Katrin F. Chua, David B. Lombard, Wendy W. Pang, Miriam R. Fischer, et. al.. (2006). Genomic Instability and Aging-like Phenotype in the Absence of Mammalian SIRT6. Cell. 124, 315-329;
- Selma Masri, Paul Rigor, Marlene Cervantes, Nicholas Ceglia, Carlos Sebastian, et. al.. (2014). Partitioning Circadian Transcription by SIRT6 Leads to Segregated Control of Cellular Metabolism. Cell. 158, 659-672;
- Wei-Dar Chen, Ming-Shien Wen, Shian-Sen Shie, Yu-Lun Lo, Hung-Ta Wo, et. al.. (2014). The circadian rhythm controls telomeres and telomerase activity. Biochemical and Biophysical Research Communications. 451, 408-414;
- Найдена связь между обменом веществ и циркадным ритмом;
- Feillet C., van der Horst G.T., Levi F., Rand D.A., Delaunay F. (2015). Coupling between the circadian clock and cell cycle oscillators: implication for healthy cells and malignant growth. Front. Neurol. 6, 1–7;
- Yuliya V. Dubrovsky, William E. Samsa, Roman V. Kondratov. (2010). Deficiency of circadian protein CLOCK reduces lifespan and increases age-related cataract development in mice. aging. 2, 936-944;
- Gad Asher, David Gatfield, Markus Stratmann, Hans Reinke, Charna Dibner, et. al.. (2008). SIRT1 Regulates Circadian Clock Gene Expression through PER2 Deacetylation. Cell. 134, 317-328;
- Frédéric Gachon, Fabienne Fleury Olela, Olivier Schaad, Patrick Descombes, Ueli Schibler. (2006). The circadian PAR-domain basic leucine zipper transcription factors DBP, TEF, and HLF modulate basal and inducible xenobiotic detoxification. Cell Metabolism. 4, 25-36;
- Rohini V. Khapre, Anna A. Kondratova, Sonal Patel, Yuliya Dubrovsky, Michelle Wrobel, et. al.. (2014). BMAL1-dependent regulation of the mTOR signaling pathway delays aging. aging. 6, 48-57;
- K. M. Ramsey, J. Yoshino, C. S. Brace, D. Abrassart, Y. Kobayashi, et. al.. (2009). Circadian Clock Feedback Cycle Through NAMPT-Mediated NAD+ Biosynthesis. Science. 324, 651-654;
- S. A. Brown. (2014). Circadian clock-mediated control of stem cell division and differentiation: beyond night and day. Development. 141, 3105-3111;
- S. Farajnia, S. Michel, T. Deboer, H. T. vanderLeest, T. Houben, et. al.. (2012). Evidence for Neuronal Desynchrony in the Aged Suprachiasmatic Nucleus Clock. Journal of Neuroscience. 32, 5891-5899;
- Masao Doi, Yukari Takahashi, Rie Komatsu, Fumiyoshi Yamazaki, Hiroyuki Yamada, et. al.. (2010). Salt-sensitive hypertension in circadian clock–deficient Cry-null mice involves dysregulated adrenal Hsd3b6. Nat Med. 16, 67-74;
- Kristin Eckel-Mahan, Paolo Sassone-Corsi. (2010). Blood Pressure AsSAuLTed by the Circadian Clock. Cell Metabolism. 11, 97-99;
- Sibah Hasan, Yves Dauvilliers, Valérie Mongrain, Paul Franken, Mehdi Tafti. (2012). Age-related changes in sleep in inbred mice are genotype dependent. Neurobiology of Aging. 33, 195.e13-195.e26;
- Gareth Banks, Ines Heise, Becky Starbuck, Tamzin Osborne, Laura Wisby, et. al.. (2015). Genetic background influences age-related decline in visual and nonvisual retinal responses, circadian rhythms, and sleep. Neurobiology of Aging. 36, 380-393;
- Грызун особого назначения;
- L. Xie, H. Kang, Q. Xu, M. J. Chen, Y. Liao, et. al.. (2013). Sleep Drives Metabolite Clearance from the Adult Brain. Science. 342, 373-377;
- Ron C Anafi, Renata Pellegrino, Keith R Shockley, Micah Romer, Sergio Tufik, Allan I Pack. (2013). Sleep is not just for the brain: transcriptional responses to sleep in peripheral tissues. BMC Genomics. 14, 362;
- Hall M.H., Okun M.L., Sowers M., Matthews K.A., Kravitz H.M., Hardin K. et al. (2012). Sleep is associated with the metabolic syndrome in a multi-ethnic cohort of midlife women: the SWAN Sleep Study. Sleep. 35, 783–790;
- Найдена связь между обменом веществ и циркадным ритмом;
- Vetrivelan R., Fuller P.M., Yokota S., Lu J., Saper C.B. (2012). Metabolic effects of chronic sleep restriction in rats. Sleep. 35, 1511–1520;
- Laila AlDabal. (2011). Metabolic, Endocrine, and Immune Consequences of Sleep Deprivation. TORMJ. 5, 31-43;
- J.-P. Chaput, J.-P. Després, C. Bouchard, A. Tremblay. (2007). Association of sleep duration with type 2 diabetes and impaired glucose tolerance. Diabetologia. 50, 2298-2304;
- L. Mallon, J.-E. Broman, J. Hetta. (2005). High Incidence of Diabetes in Men With Sleep Complaints or Short Sleep Duration: A 12-year follow-up study of a middle-aged population. Diabetes Care. 28, 2762-2767;
- P. M. Nilsson, M. Roost, G. Engstrom, B. Hedblad, G. Berglund. (2004). Incidence of Diabetes in Middle-Aged Men Is Related to Sleep Disturbances. Diabetes Care. 27, 2464-2469;
- Henri Tuomilehto, Markku Peltonen, Markku Partinen, Juha Seppä, Timo Saaristo, et. al.. (2008). Sleep duration is associated with an increased risk for the prevalence of type 2 diabetes in middle-aged women – The FIN-D2D survey. Sleep Medicine. 9, 221-227;
- Meisinger C., Heier M., Loewel H.; MONICA/KORA Augsburg Cohort Study. (2005). Sleep disturbance as a predictor of type 2 diabetes mellitus in men and women from the general population. Diabetologia. 48, 235–241;
- Hayashino Y., Fukuhara S., Suzukamo Y., Okamura T., Tanaka T., Ueshima H.; HIPOP-OHP Research group. (2007). Relation between sleep quality and quantity, quality of life, and risk of developing diabetes in healthy workers in Japan: the High-risk and Population Strategy for Occupational Health Promotion (HIPOP-OHP) Study. BMC Public Health. 7, 129;
- N. Kawakami, N. Takatsuka, H. Shimizu. (2004). Sleep Disturbance and Onset of Type 2 Diabetes. Diabetes Care. 27, 282-283;
- K M Choi, J S Lee, H S Park, S H Baik, D S Choi, S M Kim. (2008). Relationship between sleep duration and the metabolic syndrome: Korean National Health and Nutrition Survey 2001. Int J Obes Relat Metab Disord. 32, 1091-1097;
- Gangwisch J.E., Heymsfield S.B., Boden-Albala B., Buijs R.M., Kreier F., Pickering T.G. et al. (2007). Sleep duration as a risk factor for diabetes incidence in a large U.S. sample. Sleep. 30, 1667–1673;
- Q. Xu, Y. Song, A. Hollenbeck, A. Blair, A. Schatzkin, H. Chen. (2010). Day Napping and Short Night Sleeping Are Associated With Higher Risk of Diabetes in Older Adults. Diabetes Care. 33, 78-83;
- Lisa Rafalson, Richard P. Donahue, Saverio Stranges, Michael J. Lamonte, Jacek Dmochowski, et. al.. (2010). Short Sleep Duration is Associated with the Development of Impaired Fasting Glucose: The Western New York Health Study. Annals of Epidemiology. 20, 883-889;
- H. K. Yaggi, A. B. Araujo, J. B. McKinlay. (2006). Sleep Duration as a Risk Factor for the Development of Type 2 Diabetes. Diabetes Care. 29, 657-661;
- Hall M.H., Muldoon M.F., Jennings J.R., Buysse D.J., Flory J.D., Manuck S.B. (2008). Self-reported sleep duration is associated with the metabolic syndrome in midlife adults. Sleep. 31, 635–643;
- Francesca L. Facco, Jamie Kramer, Kim H. Ho, Phyllis C. Zee, William A. Grobman. (2010). Sleep Disturbances in Pregnancy. Obstetrics & Gynecology. 115, 77-83;
- Qiu C., Enquobahrie D., Frederick I.O., Abetew D., Williams M.A. (2010). Glucose intolerance and gestational diabetes risk in relation to sleep duration and snoring during pregnancy: a pilot study. BMC Womens Health. 10, 17;
- Luciana Besedovsky, Tanja Lange, Jan Born. (2012). Sleep and immune function. Pflugers Arch - Eur J Physiol. 463, 121-137;
- Frank L. Heppner, Richard M. Ransohoff, Burkhard Becher. (2015). Immune attack: the role of inflammation in Alzheimer disease. Nat Rev Neurosci. 16, 358-372.