
Грызун особого назначения
14 апреля 2015
Грызун особого назначения
- 3398
- 0
- 3
Диабет, слепота, рак, старость... Да что там — мы Cмерть сделаем!
Рисунок в полном размере.
кадр из м/ф «Рататуй»
-
Автор
-
Редакторы
Темы
Профилактика и лечение заболеваний человека — основные задачи современной биомедицины. Незаменимыми помощниками ученых для их решения являются лабораторные животные, в особенности крысы. Крысы очень схожи с человеком по составу крови, структуре тканей, физиологическим реакциям в ответ на различные воздействия и т.д. Это делает лабораторных крыс прекрасным объектом для моделирования большого количества заболеваний человека, изучения патологических процессов, создания лекарств и разработки профилактических мероприятий. В статье речь пойдет именно об этих «тружениках» науки, которые ценою жизни способствуют прогрессу в науке и медицине.
Для маленьких детей крысы — это милые герои мультфильмов, которые не занимаются ничем другим, кроме как исполнением веселых песенок и танцев. Для взрослых крысы — злостные вредители, уничтожающие посевы и запасы, повреждающие электрические сети и имущество. К тому же они могут переносить опасные инфекционные болезни, в том числе холеру, бубонную чуму, сыпной тиф. Отдельно стоит заметить, что многие женщины панически боятся крыс вообще без особой на то причины, копируя запечатленную в детстве реакцию матери. Все эти факты подчеркивают только негативные моменты, выпавшие на долю крыс. Однако, как это ни парадоксально, нельзя недооценивать роль крысы в современной науке.
За последнее столетие роль крысы в медицине трансформировалась из разносчика инфекционных болезней в незаменимый инструмент экспериментальной медицины. Сейчас крыс используют в апробации новых приемов хирургии и трансплантологии, а также в исследованиях раковых заболеваний, диабета, психологических расстройств, регенерации нейронов и еще во многих областях медицины. Эти грызуны также являются ценными подопытными животными при оценке терапевтической эффективности и токсичности новых лекарственных соединений перед клиническими исследованиями на человеке.
Почему же именно крысы обрели такую популярность? Во-первых, они относительно недороги в содержании. Во-вторых, они быстро размножаются, что позволяет биологам изучать генетические эффекты через несколько поколений потомков в течение разумного периода времени. В-третьих, геном крысы имеет более 90% сходства с геномом человека [1]. Кроме того, по сравнению с другим удобным лабораторным объектом — мышью — на крысах проще проводить операции за счет их большего размера; к тому же они более устойчивы к различным заболеваниям.
О программе «Геном человека» мы рассказывали в статье «Геном человека: как это было и как это будет» [2]. — Ред.
Существует множество видов крыс, но в качестве лабораторного объекта в основном используется Rattus norvegicus. Это первый вид млекопитающих , который стал объектом научных исследований — начиная с 1828 года. Со временем наука развивалась, и появились вопросы, требующие повышения точности и воспроизводимости экспериментов за счет уменьшения влияния генетических различий между особями. Озадачившись этой проблемой, ученые с помощью методов селекции начали выводить генетически однородных животных — так называемые чистые линии. Уже в 1909 году сотрудницей Вистаровского института (Пенсильвания, США) — доктором Хелен Кинг — была получена первая чистая линия крыс King Albino, которую затем переименовали в линию РА [3]. Это были обычные альбиносы. На сегодняшний день создано около пятисот линий крыс для различных исследований.
С мышами тоже начали работать еще в XIX веке, но официальным годом «рождения» лабораторной мыши считается 1909-й, т.к. именно в этом году была получена первая чистая линия [4]. В новосибирском Академгородке в 2013 году поставлен памятник в благодарность этому животному (рис. 1). — Ред.

Рисунок 1. Памятник лабораторной мыши в новосибирском Академгородке.
рисунок из «Википедии»
С развитием генетики и молекулярной биологии крысы стали объектами изучения генетических болезней и молекулярных процессов, лежащих в их основе. Известно, что более 1000 наследственных заболеваний человека связано с мутациями в определенных генах. А поскольку крысы имеют большое генетическое сходство с человеком, учеными созданы линии крыс, моделирующие генетические заболевания человека. Сейчас выведено огромное число таких линий, однако мы остановимся лишь на некоторых, наиболее интересных для современной медицины.
Много есть — есть нехорошо
Крысы линии Zucker — классическая модель для исследования ожирения, гипертонии, сахарного диабета II типа и нарушений функции сердца (рис. 2). Они так названы, как ни странно, не в честь сахарного диабета, а в честь патологов Луиса и Теодора Цукеров из Колумбийского университета, впервые обнаруживших у крыс ген, ответственный за ожирение. У представителей линии 13M в 1961 году Цукеры выявили спонтанную рецессивную мутацию fa (от англ. fatty — жирный) в гене Lepr, кодирующем рецептор гормона насыщения — лептина. Эта мутация приводит к замене аминокислоты глутамина на пролин в рецепторе. Каскад событий, ведущий к ожирению, выглядит так: синтез мутантного рецептора, который встраивается в мембрану клеток гипоталамуса → лептин не может связаться со своим «пунктом назначения», т.к. изменена конформация рецептора → в мозг не поступают сигналы насыщения → животное ест весь период бодрствования [5]. При весе в один килограмм эти крысы — настоящие гиганты по сравнению со своими «обычными» 500-граммовыми братьями и сестрами. Однако до развития диабета дело обычно не доходит — инсулинорезистентность компенсируется повышенным синтезом гормона.
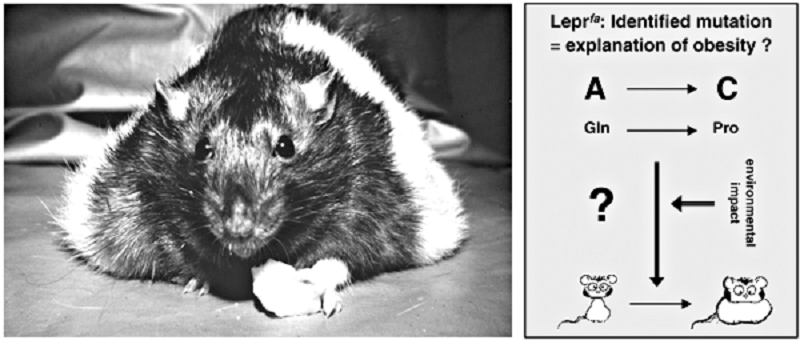
Рисунок 2. Крыса линии Zucker.
Интересно, что у крыс Zucker подавлено физиологическое состояние «бей или беги». В норме симпатическая нервная система активирует это состояние, в частности отвечает за учащение пульса. При стимуляции сердца крысы линии Zucker гормоном симпатической нервной системы норадреналином частота сердцебиения не изменяется. Это может говорить о нарушении во взаимодействии норадреналина с его рецептором. Следовательно, крыс Zucker можно использовать не только для изучения влияния различных гормонов и препаратов на частоту и силу сердечных сокращений, но и для исследования заболеваний, вызванных нарушениями на уровне взаимодействия «гормон—рецептор».
Что стоишь, качаясь, тощая дивчина? В мозге нет рилина — вот и вся причина
Дрожащая крыса Кавасаки (shaking rat Kawasaki, SRK) впервые была описана в 1988 году в Стране восходящего солнца [6]. Дрожание крысы обусловлено мутацией в гене, кодирующем белок рилин. Этот белок отвечает за миграцию нервных стволовых клеток — будущих нейронов — в период созревания плода, а также некоторое время после рождения. Во взрослом мозге рилин играет большую роль в формировании памяти.
У крыс Кавасаки вследствие мутации понижен уровень рилина. Его недостаток приводит к нарушениям строения мозга, аномальному поведению и дрожащей походке (рис. 3). Интересно, что у человека есть гомологичный белок, выполняющий те же функции, что и у крыс. Поэтому грызуны с описанной мутацией являются хорошей моделью для изучения роли рилина в патогенезе различных пороков развития мозга из-за нарушения миграции нейронов. Так, уже показано, что шизофрения и аутизм связаны с недостатком рилина; болезнь Альцгеймера же, наоборот, сопровождается его избытком. Это позволяет уже на ранних стадиях развития предсказать будущие патологии человека и начать профилактику болезней.
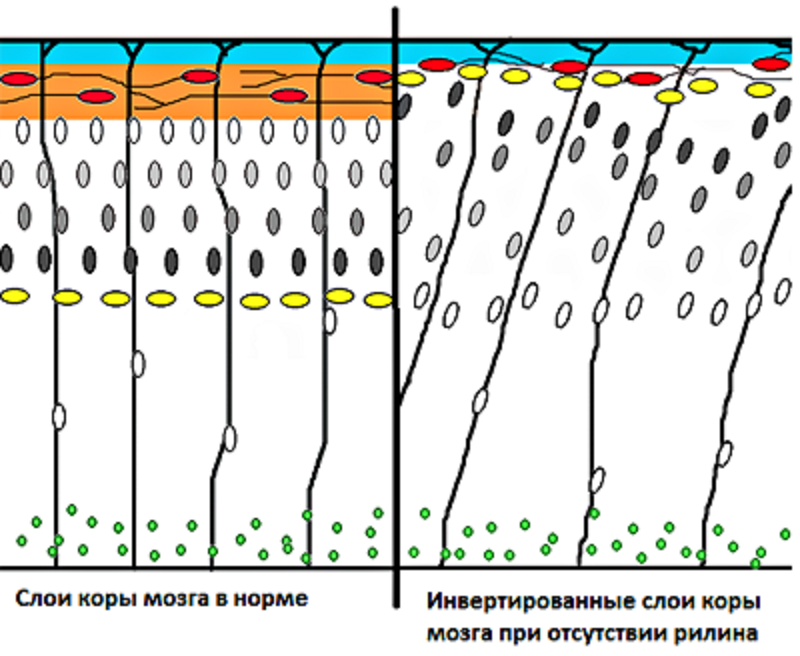
Рисунок 3. Сравнение организации слоев коры головного мозга в норме и при патологии.
рисунок из «Википедии»
Слепые помощники
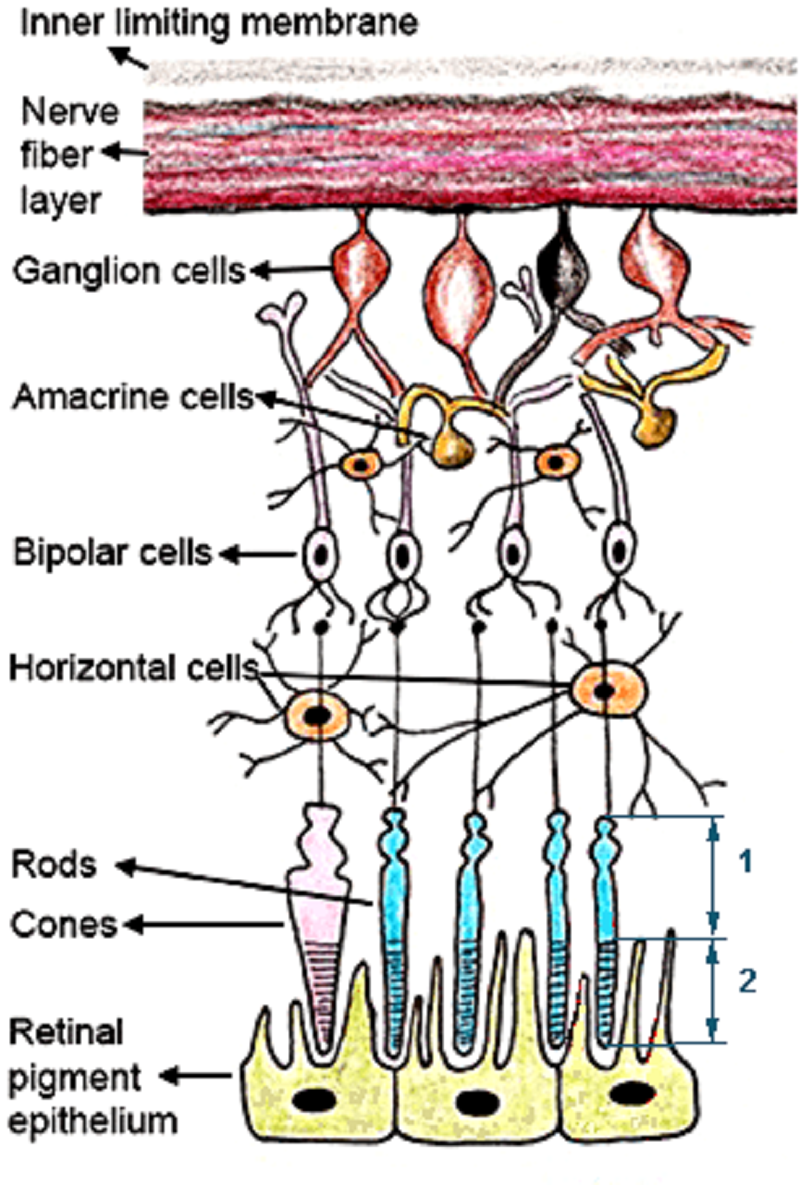
Рисунок 4. Строение сетчатки глаза млекопитающих. Сones, rods — колбочки и палочки; RPE (Retinal Pigment Epithelium) — клетки пигментного эпителия; 1 — внутренний сегмент фоторецептора; 2 — наружный сегмент фоторецептора.
Крыса RCS (от Royal College of Surgeons) — первое известное животное с наследственной дегенерацией сетчатки. Эта линия была выведена более шестидесяти лет назад в Королевском колледже хирургии в Эдинбурге. Впервые в 2000 году был установлен генетический дефект, вызывающий это заболевание. Ученым удалось выявить у крыс RCS мутацию в гене Mertk, в результате которой погибают фоторецепторы [7]. Уже к трехмесячному возрасту животные абсолютно слепы [8].
Известно, что внешние сегменты фоторецепторных клеток постепенно отмирают, а на их место по типу конвейера приходят новые сегменты (рис. 4). Отмершие сегменты поглощаются клетками пигментного эпителия. Для того чтобы эти клетки смогли «съесть» сегменты, требуется запуск молекулярного каскада, главным активатором которого является тирозинкиназный рецептор Mertk. У крыс RCS из-за мутации не запускается вышеупомянутый каскад, в сетчатке накапливаются «мусорные» сегменты, которые способствуют отмиранию фоторецепторов.
В 2001 году группе американских ученых удалось исправить мутантный фенотип крыс с помощью инъекции рекомбинантных аденовирусов со здоровым геном Mertk непосредственно в сетчатку. В результате исследователям удалось остановить деградацию сетчатки больных крыс. Это говорит о том, что здоровый ген Mertk встроился в геном крысы и нормально экспрессировался [10]. В 2010 году было установлено, что гомологичный мутантный ген обнаружен и у пациентов (людей) с похожим заболеванием сетчатки — пигментным ретинитом [11]. Все эти результаты подчеркивают важность крыс линии RCS в качестве модели для анализа молекулярных процессов при дегенерации сетчатки и генной терапии заболеваний сетчатки.
О кибернетических протезах сетчатки читайте в статье «Оптогенетика + голография = прозрение?» [12]. — Ред.
Старость не в радость
Первой моделью для изучения болезней старости [13, 14] стали крысы «отечественного производства» линии OXYS, полученные в 1975 году в Институте цитологии и генетики СО РАН. Изначально ученые хотели получить линию с наследственной катарактой. Для этого они использовали методы селекции и нагрузку галактозой, которая обладает катарактогенными свойствами. Однако помимо катаракты у крыс развивались и другие патологии: эмфиземы, кардиомиопатии, нарушение памяти, снижение иммунитета, остеопороз, предраковые состояния, — а также снижались рождаемость и продолжительность жизни. Следует подчеркнуть, что эти признаки анализировались или на фоне нагрузки галактозой, или же в ближайших последующих поколениях. Так у этих животных была получена наследственная галактоземия (неспособность усваивать галактозу). В дальнейшем отбор проводился по ранней спонтанной катаракте. Первые признаки катаракты наблюдаются ко второму месяцу жизни животного, а к шести месяцам катаракта развивается уже у 100% особей (и лишь у 5% «нормальных» крыс). К году жизни катарактой поражаются оба глаза крысы OXYS (рис. 5).
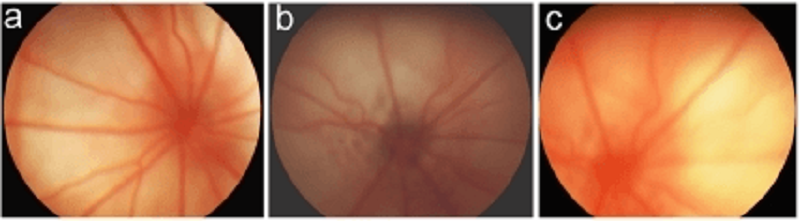
Рисунок 5. Фотографии глазного дна крыс. a — нормальное кровоснабжение сетчатки здоровых крыс; b — кровоснабжение сетчатки 3-месячных крыс OXYS; c — редуцированное кровоснабжение сетчатки крыс OXYS в возрасте 12 месяцев.
С помощью офтальмологических и других исследований было показано, что катаракта крыс OXYS по характеру и молекулярным процессам соответствует возрастной катаракте у человека. Остальные болезни старости грызунов также имели общую природу с соответствующими патологиями человека. Эти животные могут помочь исследовать механизмы развития сенильных болезней, разработать способы их профилактики и лечения и, вероятно, создать препараты, которые позволят продлить жизнь. К тому же крыс OXYS можно рассматривать как универсальную модель для исследования процесса старения глаза [16].
Диабет не от конфет
В начале 1961 года ассистент научной лаборатории Западного Браттлборо (штат Вермонт, США) заметил, что бутылка-поилка была почти всегда пуста только в одной крысиной клетке из нескольких сотен. В этой клетке проживала самка крысы с семнадцатью детенышами. Затем было обнаружено, что некоторые детеныши пили очень много воды, а при введении им вазопрессина — антидиуретического гормона — потребление воды приходило в норму. В результате было показано, что эти крысята были больны несахарным гипоталамическим диабетом, вызванным спонтанно произошедшей мутацией — потерей одного нуклеотида (гуанина) — в последовательности гена вазопрессина (рис. 6) [17]. Эта мутация является рецессивной и обозначается di (сокращение латинского названия заболевания — diabetes insipidus). Вазопрессин синтезируется определенными клетками гипоталамуса, а секретируется уже из гипофиза. При недостатке воды в организме или при повышении концентрации солей в плазме крови он стимулирует обратное всасывание воды в почках. Кроме того, он повышает кровяное давление за счет способности вызывать сокращение кровеносных сосудов [18].
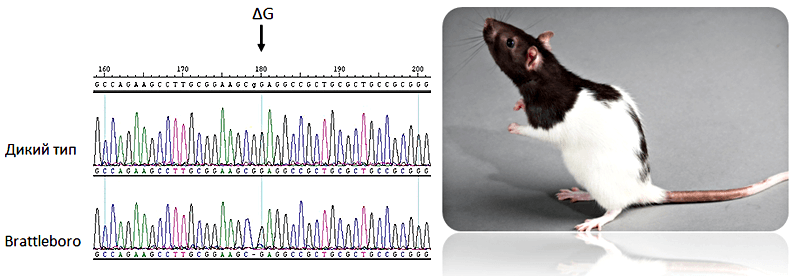
Рисунок 6. Участок нуклеотидной последовательности гена вазопрессина с мутацией у крыс линии Brattleboro.
картинка предоставлена лабораторией эпигенетики развития ИЦиГ СО РАН
Крысы Brattleboro — рекордсмены среди животных по объему воды, который могут выпить, из расчета на массу тела. Отсутствие вазопрессина в крови приводит к постоянному мочеизнурению и потреблению воды, достигающему уровня 25–100% массы тела в сутки. Также у них нарушена общая сопротивляемость к инфекциям. Поведенческие тесты показали, что крысы линии Brattleboro проявляют ускоренное развитие двигательной активности, негибкое, стереотипное поведение, поэтому в некоторых работах предлагается использовать этих крыс в качестве модельного объекта при изучении шизофрении [19]. Кроме того, у крыс Brattleboro при введении раковых клеток наблюдается стабильное замедление опухолевого роста по сравнению с нормальными крысами. В отличие от непрерывного роста опухоли, типичного для обычных крыс, у мутантных в эксперименте он был незначительным и наблюдался лишь в течение первых 15–18 дней после пересадки, затем опухоль уменьшалась и полностью исчезала. При инъекциях вазопрессина рост опухоли временно усиливался, но в дальнейшем всё равно происходило ее уменьшение и рассасывание [20].
Крысы линии Brattleboro — незаменимая модель для изучения всех процессов, происходящих в почках, лишенных регуляции вазопрессином. Сейчас этих грызунов используют и в качестве модельных животных для отработки методик коррекции наследственных заболеваний.
Таким образом, крысы являются незаменимыми помощниками исследователей в борьбе за спасение человечества от всевозможных недугов. Они плечом к плечу с учеными бьются над решением задач, поставленных природой перед людьми. В статье была представлена лишь малая часть существующих линий.
Уже достигнуто немало, а с использованием технологий получения плюрипотентных клеток и новейших инструментов геномной инженерии — TALEN [21] и CRISPR/Cas9 [22] — будут разрабатываться революционные подходы к коррекции наследственных заболеваний человека, которые в дальнейшем можно будет безбоязненно внедрить в систему здравоохранения. Но «первый удар», конечно же, примут на себя лабораторные животные...
Литература
- Rat Genome Sequencing Project Consortium, DNA sequencing: Baylor College of Medicine, Richard A. Gibbs, George M. Weinstock, Michael L. Metzker, et. al.. (2004). Genome sequence of the Brown Norway rat yields insights into mammalian evolution. Nature. 428, 493-521;
- Геном человека: как это было и как это будет;
- Marilyn Bailey Ogilvie. (2007). Inbreeding, eugenics, and Helen Dean King (1869–1955). J Hist Biol. 40, 467-507;
- Руссо М. 100 лет лабораторной мыши. Сайт «Медпортал»;
- Ingrid Schmidt. (2002). Metabolic Diseases: the Environment Determines the Odds, Even for Genes. Physiology. 17, 115-121;
- H. Aikawa, I. Nonaka, M. Woo, T. Tsugane, K. Esaki. (1988). Shaking rat Kawasaki (SRK): a new neurological mutant rat in the Wistar strain. Acta Neuropathol. 76, 366-372;
- Зрительный родопсин — рецептор, реагирующий на свет;
- P. M. D'Cruz. (2000). Mutation of the receptor tyrosine kinase gene Mertk in the retinal dystrophic RCS rat. Human Molecular Genetics. 9, 645-651;
- Delu Song, Joshua L. Dunaief. (2013). Retinal iron homeostasis in health and disease. Front. Aging Neurosci.. 5;
- Douglas Vollrath, Wei Feng, Jacque L. Duncan, Douglas Yasumura, Patricia M. D'Cruz, et. al.. (2001). Correction of the retinal dystrophy phenotype of the RCS rat by viral gene transfer of Mertk. Proc. Natl. Acad. Sci. U.S.A.. 98, 12584-12589;
- Douglas Vollrath, Wei Feng, Jacque L. Duncan, Douglas Yasumura, Patricia M. D'Cruz, et. al.. (2001). Correction of the retinal dystrophy phenotype of the RCS rat by viral gene transfer of Mertk. Proc. Natl. Acad. Sci. U.S.A.. 98, 12584-12589;
- Оптогенетика + голография = прозрение?;
- Старение — плата за подавление раковых опухолей?;
- Часы старения: обнулить, замедлить, обратить вспять?;
- Anton M. Markovets, Anzhella Z. Fursova, Natalia G. Kolosova. (2011). Therapeutic Action of the Mitochondria-Targeted Antioxidant SkQ1 on Retinopathy in OXYS Rats Linked with Improvement of VEGF and PEDF Gene Expression. PLoS ONE. 6, e21682;
- Колосова Н.Г., Лебедев П.А., Фурсова А.Ж., Мороскова Т.С., Гусаревич О.Г. (2003). Преждевременно стареющие крысы OXYS как модель сенильной катаракты человека. Успехи геронтологии. 12, 143–148;
- HEINZ VALTIN, WILBUR H. SAWYER, HILDA W. SOKOL. (1965). Neurohypophysial Principles in Rats Homozygous and Heterozygous for Hypothalamic Diabetes Insipidus (Brattleboro Strain). Endocrinology. 77, 701-706;
- Junichi Ideno, Hiroaki Mizukami, Kazufumi Honda, Takashi Okada, Yutaka Hanazono, et. al.. (2003). Persistent phenotypic correction of central diabetes insipidus using adeno-associated virus vector expressing Arginine–Vasopressin in brattleboro rats. Molecular Therapy. 8, 895-902;
- D Feifel, PD Shilling, G Melendez. (2011). Further characterization of the predictive validity of the Brattleboro rat model for antipsychotic efficacy. J Psychopharmacol. 25, 836-841;
- M. A. Afanasyeva, L. A. Zakharova, I. I. Khegai, N. P. Sharova, N. A. Popova, et. al.. (2010). Restoration of expression of MHC class I molecule in Walker 256 tumor in growth dynamics in Brattleboro rats. Dokl Biochem Biophys. 430, 11-13;
- А не замахнуться ли нам на... изменение генома?;
- CRISPR-системы: иммунизация прокариот.






