А кто живет у вас во рту?
16 марта 2018
А кто живет у вас во рту?
- 8964
- 2
- 11
Во рту может жить много интересного...
Tom and Jerry © WB cartoon
-
Автор
-
Редакторы
О составе и роли кишечной микробиоты известно многое. А вот до других частей тела перо научного популяризатора доходит нечасто. Сегодня мы сломаем печать молчания и расскажем про микробов полости рта: какие археи там живут, кто вызывает кариес и можно ли переусердствовать с гигиеной?
Биология, медицина и косметология ротовой полости

Партнер цикла — компания SPLAT: ведущий разработчик и производитель профессиональных средств ухода за полостью рта.
О необходимости ухода за ротовой полостью знает каждый с детства, и, казалось бы, это не та область науки, где читатель ждет захватывающих новостей. Однако ошибочно думать, что исследования по здоровью зубов и десен не ведутся. Как выяснила «Биомолекула», дела обстоят совсем по-другому. Ведется переклассификация некоторых заболеваний. Болезни ротовой полости оказываются связаны с такими «раскрученными» темами как диабет, сердечно-сосудистые заболевания и даже рак. Ведутся споры о том, какие компоненты должны входить в состав зубных паст. Разрабатываются пре- и пробиотики для нормализации состава микробиоты ротовой полости. Наконец, даже в обычной жизни пользователь сталкивается с огромным арсеналом средств по уходу за ротовой полостью: это специализированные ополаскиватели, пенки, ершики, нити и огромное разнообразие зубных щеток и паст.
Для того чтобы разобраться, какие темы касательно здоровья и косметологии зубов и десен сейчас наиболее активно изучаются, что изменилось с исторической точки зрения в гигиене ротовой полости и на что в средствах ухода стоит обращать внимание, «Биомолекула» объединила усилия с одним из ведущих производителей и разработчиков в этой области — компанией SPLAT. Результатом сотрудничества стали четыре статьи, которые и представлены в этом спецпроекте.
«В моем рту их живет, наверное, больше, чем людей во всём Соединенном королевстве», — писал Лондонскому королевскому научному обществу один странный человек из небольшого голландского городка Делфта. Хотя этот человек был выбившимся из низов успешным торговцем с высоким чином в городской администрации, у него была одна странность: он часами не выходил из подсобки магазина и постоянно твердил о какой-то невидимой жизни, о существах столь малых, что никакие глаза не могли разглядеть их, и столь вездесущих, что невозможно найти ни одного камня, ни одного листа дерева, ни одной жидкости, где они не обитали бы в превеликом множестве, кроме разве что дождевой воды, где он не мог их отыскать (сейчас мы знаем, что они есть и там [1]). Звали этого эксцентричного лавочника Антони ван Левенгук, а открыл он одноклеточные микроорганизмы с помощью прибора, называемого микроскопом (рис. 1).
Микроскопии посвящена отдельная статья на «Биомолекуле»: «12 методов в картинках: микроскопия» [2].

Рисунок 1. Микроскоп Левенгука — простейшая конструкция, столь сильно отличающаяся от современных нам оптических микроскопов. Он не имел ни объектива, ни предметного стола. Линза была одна — по сути, микроскопический стеклянный шарик, застывшая капля, филигранно отшлифованная создателем. Объект тем или иным способом помещался перед наблюдателем, за ним — источник света. Наблюдатель прикладывал микроскоп дырочкой к глазу и сквозь линзу смотрел на объект.
Микроскопы были известны и до Левенгука, однако ранее их не очень активно применяли для биологических исследований. Физик Роберт Гук, занимавшийся оптикой, незадолго до этого открыл клетки, но особого значения этому открытию не придавал никто, включая самого исследователя. Левенгук же не только подтвердил и расширил данные Гука, но и открыл совершенно новый мир — одноклеточных организмов. Его первоначальные сообщения, в силу своей неожиданности и эксцентричности самого исследователя, вызвали недоверие в научном сообществе, однако несколько блестящих демонстраций привели к быстрому всеобщему признанию [3].
Он рассмотрел кровь — и открыл эритроциты, микроскопировал сперму — и подтвердил существование обнаруженных Гуком сперматозоидов. Но самую совершенную из своих непревзойденных линз, способную более чем к 300-кратному увеличению, он направил на смывы со своих зубов. И обнаружил, что там живут существа, в разы меньше сперматозоидов или эритроцитов, — спирали, палочки, шарики суетились в капле дождевой воды, которую он использовал для приготовления препарата (рис. 2). Так, начиная с ротовой полости, была открыта микробиота человеческого тела.
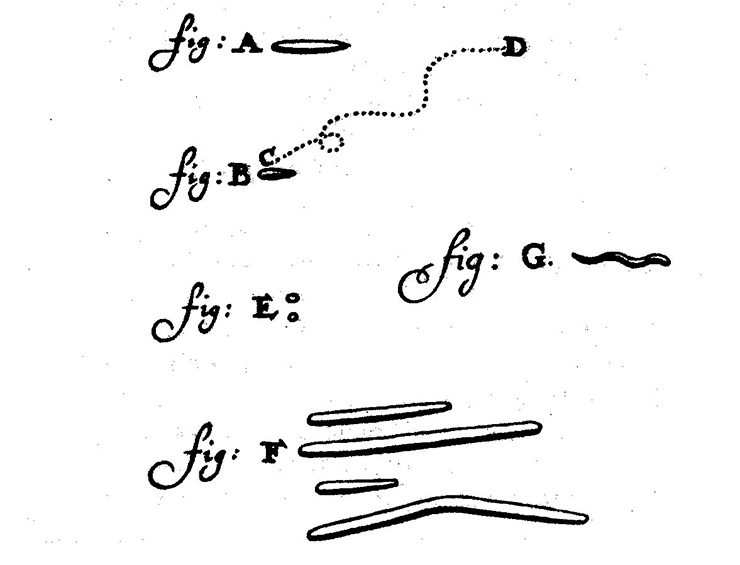
Рисунок 2. Зарисовка микробов ротовой полости, обнаруженных Антони ван Левенгуком. Несмотря на использование лишь одной линзы и примитивную конструкцию микроскопа, исследователю удалось достигнуть предела разрешающей способности оптической линзы и обнаружить бактерий.
Довольно скоро стало ясно, что открытые Левенгуком существа не просто живут в окружающем мире, но и оказывают на него существенное влияние. Открытия сыпались одно за другим: именно эти миниатюрные живые капельки, а вовсе не химические реакции, как до того думало большинство ученых, сбраживают виноградный сок и делают из него вино. Они же ответственны за болезни человека и животных, причем самые заразные — чуму, холеру, тиф. Не все они опасны — в кишечнике они живут килограммами, но не наносят никакого вреда, за что первооткрыватели назвали их комменсалами, подчеркивая, что они безвредны для организма, но и пользы не приносят . А с опасными можно бороться их же собственным оружием — антибиотиками.
Теперь мы знаем, что это не так — от микробов в организме зависит множество важных процессов, от усвоения витаминов до развития иммунной системы. Но термин «комменсалы», пусть и не очень корректный, по старой памяти остался.
Во всем этом вихре новостей исследователи быстро забыли первые открытия. Куда интереснее разрабатывать способы борьбы с чумной палочкой, чем изучать многообразие «бесполезных» сожителей. Однако со временем мы поняли, как сильно зависим от всей этой разношерстной компании. Они защищают нас от болезней, но и являются их источником, помогают нам усваивать пищу или пытаются съесть нас.
Теперь не обязательно пристально разглядывать каплю дождевой воды для изучения состава и роли микробиоты в нормальном функционировании организма и при заболеваниях — со времен Левенгука нам стало доступно множество новых методов. Благодаря им мы каждый день узнаем много нового о составе, жизни и функциях микробиологических сообществ различных областей тела. В этой статье мы вернемся к основам и рассмотрим микробиоту ротовой полости во всех доступных деталях.
Уникальное сообщество
Первая черта микробного сообщества рта, которая сразу обращает на себя внимание, — потенциальная патогенность, требующая постоянного активного контроля. Речь в данном случае идет о гигиене. В норме микробы кишечника, кожи, легких, поверхности глаз и так далее не оказывают на наш организм никакого повреждающего воздействия (и про некоторых из них можно почитать на «Биомолекуле» [4]). Гипотетически мы можем сосуществовать с ними неопределенно долго (хотя мыться всё же приходится, чтобы смыть с кожи попавших туда патогенных микроорганизмов, пока они не закрепились и не нарушили баланс уже сложившейся микробиоты).
А во рту всё совершенно не так. Абсолютно нормальные, присутствующие практически у каждого в ротовой полости микроорганизмы вызывают постепенное разрушение зубов (кариес) или воспаление десен (пародонтит и гингивит, о которых мы писали в статье «Дареному коню в десны не смотрят» [5]), если их не контролировать регулярной чисткой зубов.
Ученые пока бьются над загадкой, как же так вышло. Одна из самых правдоподобных гипотез — избыток высокоуглеводной и размягченной пищи, появившийся в нашем рационе с развитием сельского хозяйства. Углеводы являются субстратом многих видов брожения, в результате которого выделяются различные органические кислоты, расщепляющие эмаль зубов [6]. А отсутствие в рационе жесткой волокнистой пищи не позволяет в рутинном режиме разрушать микробные биопленки по мере их созревания, о чем еще пойдет речь дальше. Современная пища кажется нам намного вкуснее пищи предков — необработанной, собранной буквально под ногами. Сегодняшняя еда содержит больше питательных веществ, ее легче и дешевле получить в больших количествах, но, похоже, именно она вредит состоянию ротовой полости. Так что, вполне возможно, что целью всего прогресса человечества является создание и финансирование стоматологической отрасли.
Вторая важнейшая черта флоры ротовой полости — ее разнообразие. По видовому составу микробиоты ротовая полость человека уступает только толстой кишке [7]. Тут представлены все царства микроорганизмов: бактерии, грибы, протисты, археи, а также вирусы всех видов, — есть, где развернуться микробиологу. Такое разнообразие обусловлено большим выбором «мест обитания» во рту. Тут есть и мягкие ткани, вроде десен, языка, щек или нёба. Есть твердая ткань зубов. Есть области, недоступные атмосферному кислороду, вроде протоков слюнных желез. Наконец, есть собственно жидкая фаза — слюна, в которой могут жить неприкрепляющиеся планктонные микроорганизмы.
Кроме разнообразия условий в ротовой полости, стоит еще учесть то многообразие, которое вносят сами микроорганизмы. Если поверхность чистых зубов постоянно подвергается действию кислорода, то после 2–3 дней без зубной щетки она покроется бактериальной биопленкой, в недрах которой спокойно будут жить даже строгие кислородоненавистники — например, Porphyromonas gingivalis. Такие «старые» пленки ассоциированы с основными заболеваниями ротовой полости: кариесом или гингивитом. На формирование зрелой пленки уходит от 24 до 48 часов, так что чистка зубов чаще двух раз в день, как порой советуют недобросовестные врачи или производители паст, будет лишней [8].
Люди совпадают по составу микробиома ротовой полости всего на 40–50% — это пересечение гораздо меньше, чем во всех других частях тела. Зато такая небольшая фракция довольно стабильна географически: ее микробы более-менее одинаковы у австралийского аборигена и британского лорда. Остальные микроорганизмы уникальны для каждого человека, причем их состав постоянно меняется [9]. Когда люди долго живут вместе, то и микробиомы у них «выравниваются», особенно у супругов [10], [11].
Последней выдающейся чертой микробиоты полости рта является ее переменчивость во времени. Если упомянутые ранее 40–50% — более-менее постоянные жители ротовой полости, — то оставшиеся 50–60% меняются в зависимости от пищи, времени суток, здоровья организма и так далее. Для ротовой полости — и только для нее — применяют термин «псевдокомменсалы». Так называют бактерии и другие микроорганизмы, которые попадают в тело человека с пищей, водой, воздухом и так далее. Как правило, это обычные сапрофиты , которые не могут выжить в новой среде и быстро погибают. Их число огромно: по некоторым оценкам, каждый человек потребляет до 3–5 граммов микробов в день. Так что их влиянием на иммунную и другие системы организма просто невозможно пренебречь [12].
Микроорганизмы, свободно живущие в окружающей природе и не нуждающиеся в заселении в чей-то организм.
Кто живет у меня во рту?
Так кто же живет в этом странном, постоянно меняющемся мире ротовой полости? Очень много кто. Тут есть представители всех доменов жизни — археи, бактерии, эукариоты. Есть и большое разнообразие вирусов, причем отнюдь не только вредных. Разберемся по порядку со всеми действующими лицами.
Археи
Представители домена Archaea — нечастые гости в организмах многоклеточных животных, предпочитающие жить в окружающей среде. Однако в ротовой полости сумели обнаружить несколько резидентных видов, относящихся к группе метаногенов. Все они относятся к роду Methanobrevibacter — архей, захватывающих из окружающей среды углекислый газ и превращающих его в метан [16]. Они являются анаэробами, то есть живут только в местах без доступа кислорода, например, в бактериальных биопленках между десной и зубом.
Об их роли в микробиоте ротовой полости известно мало. Отмечено, что количество метаногенов возрастает в области воспаления десен, однако что тут является причиной, а что следствием, установить сложно [17]. С учетом того, что причины гингивита нам более-менее известны, можно предположить, что эти археи в данном случае являются лишь удачливыми бенефициарами сложившихся обстоятельств.
Грибы
Как и археи, грибы нечасто встречаются в составе нормальной микробиоты, хотя это и не исключено. У человека их присутствие оценивали считанные группы исследователей, однако они обнаружили, что в ротовой полости каждого здорового индивида проживают представители 70 родов данного таксона. Наиболее представлены роды Candida, Cladosporium и Saccharomycetales.
Интересно, что многие из обнаруженных видов являются частой причиной микозов — грибковых поражений организма, — хотя обследованные добровольцы от микозов не страдали. Этому есть два возможных объяснения. Первое заключается в том, что эти заболевания являются следствием не оппортунистического заражения, как считалось ранее, а выхода грибковой микрофлоры из-под контроля вследствие иммунодефицита либо хронического стресса. При этом потенциальный источник болезни мы носим с собой постоянно. Второе возможное объяснение, которое признают и сами исследователи, — это то, что использованные методы не исключают детектирования спор грибов, которые распространяются по воздуху. В любом случае, согласно этим данным, от повышенной вероятности болезни до самой болезни — один шаг [18]. Все мы постоянно сталкиваемся с грибами или их спорами, но заболевание они вызывают лишь у людей с ослабленным здоровьем.
Вирусы
В ротовой полости можно обнаружить и впечатляющую коллекцию вирусов. Бóльшая часть из них имеет отношение к той или иной болезни. К примеру, во рту можно найти вирус бешенства (Rabies lyssavirus) или эпидемического паротита (Mumps rubulavirus), если человек ими инфицирован. Одна из их мишеней — слюнные железы, благодаря заражению которых вирус выделяется в слюну. Также часто тут можно обнаружить вирусы, не способные проникнуть в клетки ротовой полости, но попадающие сюда благодаря обильному кровоснабжению — ВИЧ или вирусы гепатита, опять-таки если человек ими заражен [19].
Специфическими для ротовой полости являются такие вирусы человека, как грипп или обширная группа, вызывающая острые респираторные вирусные инфекции (ОРВИ). Они тоже не нацелены непосредственно на ротовую полость, но постоянно поступают в нее при кашле и распространяются дальше воздушно-капельным путем.
Среди тех, кто всё же проникает в клетки ротовой полости, стоит отметить вирус простого герпеса (Herpes simplex virus). При определенных обстоятельствах он может вызвать характерное высыпание на губах, которое довольно быстро проходит и легко лечится. Этим вирусом заражены, по разным данным, от 6 до 9 человек из десяти, так что его можно считать чуть ли не компонентом нормальной микрофлоры. Обычно бóльшую часть времени он проводит в «спящем режиме», никак себя не проявляя. Однако в случае глобального (как при СПИДе) или локального (например, при сужении сосудов губ на холоде) снижения иммунной защиты, он может реактивироваться и вызвать характерные высыпания [20], [21].
Если последствия активации вируса герпеса неприятны, но не опасны, то совсем другая ситуация у папилломавирусов. Они также часто встречаются в тканях ротовой полости и могут не только вызвать кандиломы, но и повысить риск возникновения рака шеи и головы [22], [23].
Но все эти эукариотические вирусы количественно меркнут рядом с другой группой, широко представленной во рту, — фагами (рис. 4). Эти вирусы бактерий находят в ротовой полости благоприятную почву для жизни и размножения. В слюне обнаружены сотни фаговых геномов. Состав этой части микрофлоры очень сильно определяется внешними условиями: если два никак не связанных между собой человека проживают в одном помещении, больше всего у них будет пересекаться именно фаговый метагеном. Это довольно важно в свете того, что фаги способны переносить между бактериями разных видов гены [24], ответственные за выживание и кодирующие различные белки и другие вещества, позволяющие им избежать иммунного надзора, уничтожения антибиотиками и так далее [25].
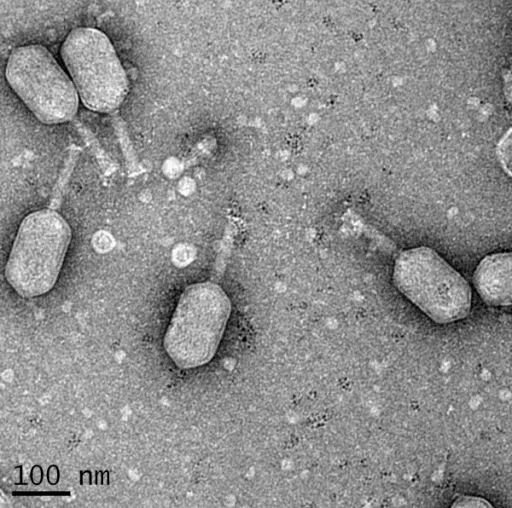
Рисунок 4. Бактериофаги на поверхности бактерии. Электронная микрофотография.
Бактерии (наконец-то!)
Я не случайно вынес этот раздел в конец. Влияние архей, грибов и вирусов на состояние полости рта, несомненно, может быть довольно значительным, но они представляют лишь минорную часть того зоопарка, который живет на этой территории. Основную же массу микробиоты составляют разнообразные бактерии. Кого тут только нет: аэробы и анаэробы, кокки и палочки, со жгутиками и без, питающиеся сахарами и белками.
Ткани ротовой полости не являются чем-то однородным. По разнообразию условий они дадут фору всему остальному организму. В исследовании 2012 года ученые попытались оценить, как распределены бактерии между всеми тканями желудочно-кишечного тракта [26]. Затем они разделили исследованные области на группы по схожести бактериального микробиома. Получилось, что ткани рта можно разделить аж на три таких группы, когда весь толстый кишечник представляет собой всего одну. Эти три группы включают в себя:
- слизистую оболочку щек, нёбо и часть десны, непосредственно примыкающую к зубам;
- язык, миндалины, заднюю часть гортани и слюну;
- биопленку на зубной эмали.
Начнем с зубов. Зубная эмаль является самой прочной структурой в организме. Это гладкая ровная поверхность, состоящая на 97% из щелочных фосфатов кальция. Она сохраняет структуру и плотность в щелочной или нейтральной среде и постепенно разрушается в кислой. Как и любая твердая поверхность, имеющая доступ к растворенным вокруг нутриентам, эмаль — хорошая подложка для формирования биопленок, которые представляют собой упорядоченные сообщества бактерий, запечатанных в выделяемые ими вещества [27]. Благодаря этому тут могут жить анаэробные бактерии — пленка защищает их от кислорода. Антибиотики, детергенты и прочие химические вещества тоже не могут сюда проникнуть.
Бактериальные биопленки на зубах имеют большое значение для медицины. Благодаря им во рту могут поселиться виды, изначально не приспособленные для такой жизни. Например, Porphyromonas gingivalis — анаэробная бактерия, то есть не способная существовать в присутствии кислорода. Однако биопленка позволяет ей жить на поверхности зубов и вызывать гингивит и пародонтит. С момента формирования бактериального сообщества должно пройти некоторое время, прежде чем там смогут обосноваться анаэробы [28]. Чистка зубов разрушает биопленки и не допускает размножения патогенов в ротовой полости (про чистку зубов и компоненты зубной пасты мы писали в статье «Зубная крепость: как пасты делают наши зубы лучше» [29]).
Если для возникновения пародонтита нужны искусственно созданные анаэробные условия, то для такой болезни, как кариес, этого не требуется. Вызывающие его микроорганизмы относятся к классу факультативных анаэробов, то есть они могут жить как в присутствии кислорода, так и без него. Кариес — это постепенное разрушение зубной эмали под влиянием кислой среды, создаваемой микроорганизмами (рис. 5). Наиболее изученной бактерией, вызывающей это неприятное состояние, является Streptococcus mutans. От прочей микробиоты его отличает важная особенность — способность питаться едой человека. Дело в том, что обычно бактерии, несмотря на обилие поступающих в рот продуктов, питаются не ими, а белками слюны, остатками погибших клеток и так далее. Стрептококки же способны улавливать углеводы из прожевываемой пищи. В процессе метаболизма они выделяют молочную кислоту, которая закисляет биопленку и разрушает эмаль зуба [6].
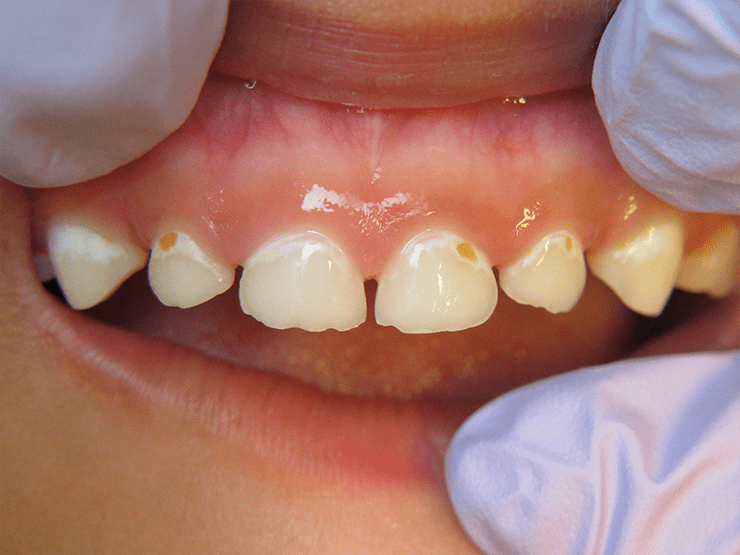
Рисунок 5. Повреждения зубной эмали у детей при кариесе. Оно вызвано медленным растворением эмали под воздействием среды и вышележащей бактериальной биопленки. Визуально можно определить кариес по возникновению областей измененного цвета (стадия мелового пятна), на месте которых впоследствии формируется кариозное дупло.
Интересно, что оба эти фактора — наличие в пище легкодоступных сахаров и присутствие бактерий, способных их усваивать, — являются необходимыми для развития кариеса. Если человек не ест сладкую пищу, то стрептококки не смогут самостоятельно вызвать у него кариес. Верно и обратное: по составу микробиоты ученые заранее могут предсказать риск развития кариеса, если человек будет злоупотреблять сладким [30].
Теперь обратимся к мягким тканям ротовой полости. По видовому составу микробов можно выделить две их подгруппы — жесткие (нёбо, кератинизированная десна и слизистая щек) и мягкие (некератинизированная десна, язык, гортань, миндалины и слюна). Разница между населяющими их бактериями довольно велика. На тканях первой подгруппы проживают, в основном, бактерии, относящиеся к типу Firmicutes с небольшой представленностью типов Proteobacteria (в основном речь идет о стрептококках), Bacteroidetes и либо Actinobacteria, либо Fusobacteria. Последние два типа, похоже, взаимоисключают друг друга в этой области — если есть один, то второго не будет (рис. 6).
На второй подгруппе тканей обнаруживается меньше Firmicutes, больше Bacteroidetes и Fusobacteria. Это особенно интересно в свете того, что нёбо, щеки и десны, входящие в первую группу, часто непосредственно контактируют с языком — тканью второй группы. Несмотря на это, микробиомы этих областей сохраняют значимое различие.
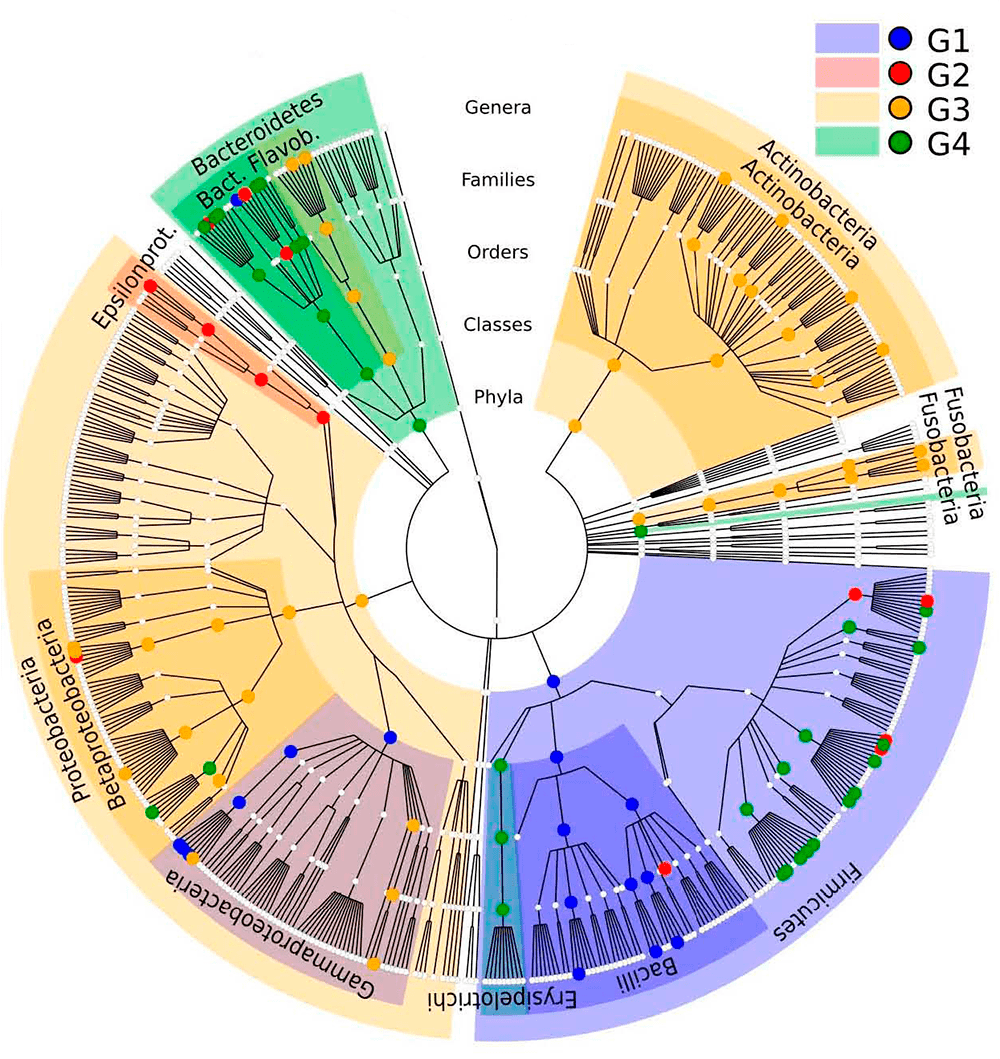
Рисунок 6. Кладограмма обнаруженных в ЖКТ видов микробов. Поверхности тела разделены на четыре группы, значительно различающиеся по микробиоте. Цветом закрашены таксоны, наиболее ярко представленные в соответствующей группе, точки показывают наиболее обильную представленность. G1 (синий) — внутренняя поверхность щек, нёбо и кератинизированная часть десны. G2 (красный) — глотка, миндалины, язык и слюна. G3 (желтый) — зубы и зубной налет. G4 (зеленый) — кишечник. Главный вывод из этой картинки — разнообразие видов микроорганизмов в ротовой полости необычайно высоко, причем даже между различными ее поверхностями.
Хотя микробиом ротовой полости потенциально крайне нестабилен, в нем довольно редко обнаруживают нехарактерные для него микроорганизмы. Например, в норме во рту отсутствуют кишечные варианты Escherichia coli, Enterococcus faecalis и так далее. По-видимому, причиной этому является активный контроль видового состава со стороны иммунной системы. Это предположение подтверждают исследования, в ходе которых кишечные микроорганизмы были обнаружены во рту пациентов с различными формами временных и постоянных иммунодефицитов [31–33]. Таким образом, видовое разнообразие микробиоты рта вполне можно использовать как маркер различных заболеваний.
На бактерии полости рта также довольно сильно влияют различные искусственные конструкции, применяемые в стоматологии. Например, зубные протезы создают весьма специфические условия вокруг десен и нёба, при которых кислород продолжает поступать, но обмена слюны не происходит. В этих условиях разрастается аэробная флора — резко возрастает число стрептококков и стафилококков. По неподтвержденным данным, это может способствовать провоспалительным явлениям в организме и опосредованно усиливать гипертоническую болезнь у лиц пожилого возраста [34].
Установка имплантов довольно часто сопровождается воспалением окружающей десны — периимплантитом. Отмечается, что на имплантах формируется биопленка, однако по своим свойствам и видовому составу она сильно отличается от зубной. Разнообразие представленных видов куда меньше, но среди них чаще попадаются те, которые мы считаем патогенными. Как и в случае с гингивитом, для возникновения заболевания требуется формирование специфического сообщества микроорганизмов, однако устроено оно проще, чем на живых зубах. Исследования периимплантита пока находятся в начальной стадии, но одно ясно точно: искусственные зубы — не повод их не чистить [35].
Не только в болезни, но и в здравии...
Больше сотни лет прошло с тех пор, как в микробе увидели главного врага человечества, — и теперь наше представление о нем изменилось. Мы многое поняли о постоянном взаимодействии с микроскопической флорой и фауной окружающего мира, о формировании иммунной системы, о защитной роли микроорганизмов. Не обошли эти исследования и ротовую полость.
Здоровая микробиота является важной частью защиты от патогенов. Любому микроорганизму необходимо куда-то прикрепиться, чтобы поселиться в нашем теле. Для этого они обычно используют белки и углеводы, расположенные на поверхности клеток. Иммунная система слизистых оболочек обычно не препятствует этому процессу, если поселенцы ведут себя прилично — не вызывают разрушения клеток и воспаления. Если же вызывают, то быстро уничтожаются иммунитетом, освобождая место для новых. Таким образом формируется здоровая микробиота — все точки, где мог бы присоединиться микроорганизм, оказываются заняты, причем непатогенными видами. Если в этой ситуации в ротовую полость попадет патоген, он просто не найдет места, где мог бы поселиться. Это явление называется колонизационной резистентностью. Она спасает нас от множества инфекционных заболеваний, однако часто нарушается при приеме антибиотиков или использовании антисептиков. Потому более «чистый» рот, как ни странно, больше склонен к различным заболеваниям [49].
Также раннее поселение микроорганизмов в нашем теле способствует правильному формированию иммунной системы, которая у детей изначально находится в незрелом состоянии. Однако в этом отношении чаще говорят о влиянии кишечных микробов, а микробы полости рта исследуют намного меньше [50].
Всё это свойства, характерные для любой области тела. Но у микробов полости рта есть и уникальная способность, причем напрямую влияющая на здоровье. И лежит она в области фармакокинетики .
Фармакокинетика — раздел фармакологии, изучающий перемещения и превращения лекарственного препарата в организме от поступления до выведения. Отвечает на вопрос «что организм делает с лекарством?»
Все знают, что один из лучших препаратов для экстренной помощи при сердечном приступе — нитроглицерин. Он содержит нитрогруппы (—NO2), которые в течение считанных секунд метаболизируются в организме до газа NO — сигнальной молекулы, расслабляющей сосуды. При этом в блокированной области сердца, как правило, восстанавливается нормальный кровоток, и стенокардический припадок прекращается.
Однако следить за избыточным тонусом сосудов стоит не только во время сердечного приступа. Артериальная гипертония — одно из главных заболеваний 21 века. Согласно данным Всемирной организации здравоохранения, ей страдают до 40% людей старше 25 лет. Гипертония достоверно увеличивает вероятность преждевременной смерти от инфаркта или инсульта — лидирующих причин смерти людей по всему миру.
Прием пищи, богатой нитратами, способен снизить давление, увеличив в организме производство оксида азота . В первом приближении это вполне понятно — все в школе писали химические реакции по получению чего угодно из азотной кислоты. Но в случае с организмом это ставит в тупик. Все химические реакции в теле происходят с участием ферментов — и получение оксида азота тут не исключение. Оно происходит в две стадии: сначала нитрат превращается в нитрит, затем уже нитрит превращается в оксид азота.
Стоит, однако, отметить, что избыточный прием такой пищи, особенно во младенчестве, может привести к отравлению нитратами и связанным с ним проблемам — метгемоглобинемие, нитрозилированию поверхностных сахаров клеток и даже раку, вызванному образующимися из нитратов и нитритов нитрозаминами.
Со второй стадией проблем не возникает, ее выполняют NO-синтазы «на местах» (рис. 7). Но первая в организме проходит с большими затруднениями. В принципе, эксперименты показали, что у нас есть какие-то ферменты, которые могут превратить нитрат в нитрит, но их активность неравномерна и довольно слаба [51]. И тут на помощь к нам приходит микробиота. Некоторые бактерии ротовой полости, особенно из рода Veilonella, способны очень эффективно восстанавливать нитрат до нитрита [52]. Именно они являются основным источником физиологически активного нитрита в крови после приема богатой нитратами пищи.

Рисунок 7. Превращение нитрита в NO в сосудистой стенке. Стенка сосуда состоит из эндотелиальных клеток и примыкающих к ним гладких мышц. Эндотелий, непосредственно контактирующий с кровью, в случае необходимости подает сигнал к расслаблению гладких мышц, синтезируя NO при помощи различных вариантов эндотелиальной NO-синтазы (eNOS). Субстратом ее в данном случае является нитрит-анион, захватываемый эндотелием из крови.
Этот симбиоз, очевидно, возник давно, и наш организм успел к нему адаптироваться в ходе эволюции. Лишь около 20% попавших в ротовую полость нитратов превращается в нитрит. Однако система устроена так, что прошедшие дальше нитраты будут возвращаться в рот вновь и вновь до тех пор, пока полностью не станут нитритами. Слюнные железы умеют улавливать их из крови и выделять в слюну с большой эффективностью, увеличивая концентрацию нитрита в крови. В сочетании со способностью кожи запасать нитраты и выделять их в нужный момент в кровоток, мы получаем постоянный источник нитрита, столь нужного для поддержания правильного давления крови (рис.8).
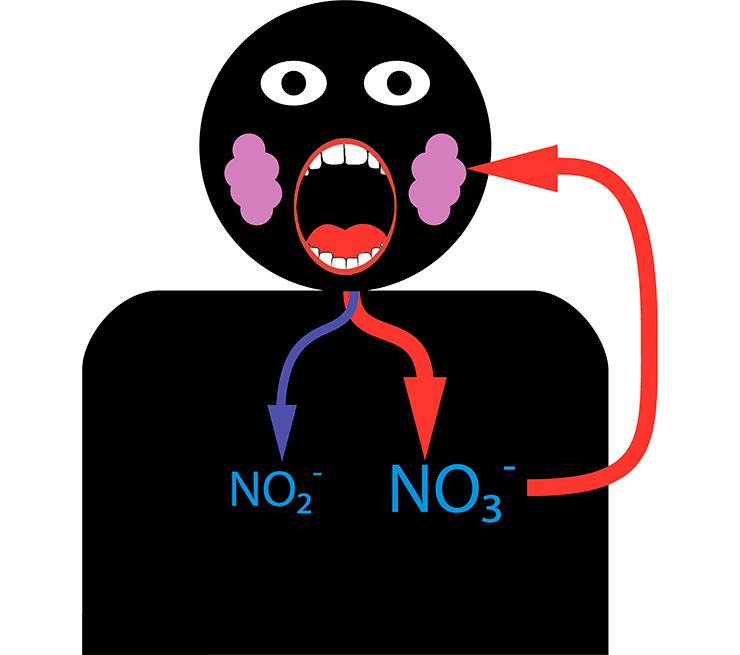
Рисунок 8. Нитратный цикл в организме человека. Почти все попавшие в кровь из пищи нитраты выбрасываются в ротовую полость слюнными железами. Во рту они частично (примерно на 20%) превращаются в пригодные к усвоению нитриты. Оставшиеся нитраты вступают в следующий цикл.
рисунок автора статьи
Показано, что нитрат-редуцирующая активность действительно очень важна. У людей, использующих для гигиены ротовой полости полоскания с антисептиком, прием богатой нитратами пищи не приводил к столь же значимому снижению давления крови, как у людей, таким полосканием не пользующихся [53]. Наличие в организме таких механизмов позволяет считать микробиоту ротовой полости полноценным метаболически активным органом нашего тела.
Заключение
Удивительно всё же закручивается история. Направив микроскоп на собственные зубы, Левенгук не только открыл бактерии, но и обнаружил одно из самых интересных микробных сообществ, которое только можно отыскать.
Несмотря на небольшие размеры ротовой полости, ее микробиологические жильцы отличаются потрясающим разнообразием форм и таксонов. При этом они не просто живут с нами и питаются нашей пищей, а полноценно влияют на развитие нашего организма и наличие или отсутствие некоторых заболеваний. Разнообразие и переменчивость микробиома ротовой полости представляют собой большую сложность для исследователя, но усилия ученых уже принесли впечатляющие плоды. А сколько еще ждет нас впереди!
Эта статья завершает цикл, посвященный здоровью ротовой полости. Мы рассмотрели особенности микробов рта, состав зубной пасты [29] и обратились к основным известным заболеваниям — кариесу, гингивиту, пародонтиту [5] и галитозу [54]. Мы рассмотрели их причины, развитие, лечение и некоторые неожиданные последствия. Теперь читатель сможет подходить к гигиене рта и медицинским процедурам более осознанно. Будьте здоровы!
Литература
- О, этот благодатный дождь из бактерий!;
- 12 методов в картинках: микроскопия;
- де Крайф П.Г. Охотники за микробами. М., 1957. — 301 с.;
- Микробиом кишечника: мир внутри нас;
- Дареному коню в дёсны не смотрят;
- Dogan Ozdemir. (2013). Dental Caries : The Most Common Disease Worldwide and Preventive Strategies. IJB. 5;
- Curtis Huttenhower, Dirk Gevers, Rob Knight, Sahar Abubucker, Jonathan H. Badger, et. al.. (2012). Structure, function and diversity of the healthy human microbiome. Nature. 486, 207-214;
- Jacob M. ten Cate. (2006). Biofilms, a new approach to the microbiology of dental plaque. Odontology. 94, 1-9;
- Egija Zaura, Bart JF Keijser, Susan M Huse, Wim Crielaard. (2009). Defining the healthy "core microbiome" of oral microbial communities. BMC Microbiology. 9, 259;
- Se Jin Song, Christian Lauber, Elizabeth K Costello, Catherine A Lozupone, Gregory Humphrey, et. al.. (2013). Cohabiting family members share microbiota with one another and with their dogs. eLife. 2;
- Remco Kort, Martien Caspers, Astrid van de Graaf, Wim van Egmond, Bart Keijser, Guus Roeselers. (2014). Shaping the oral microbiota through intimate kissing. Microbiome. 2, 41;
- Graham A. W. Rook. (2009). Review series on helminths, immune modulation and the hygiene hypothesis: The broader implications of the hygiene hypothesis. Immunology. 126, 3-11;
- 12 методов в картинках: протеомика;
- D. Nichols, N. Cahoon, E. M. Trakhtenberg, L. Pham, A. Mehta, et. al.. (2010). Use of Ichip for High-Throughput In Situ Cultivation of "Uncultivable" Microbial Species. Applied and Environmental Microbiology. 76, 2445-2450;
- Антибиотикорезистентность: How to make antibiotics great again*?;
- P. W. Lepp, M. M. Brinig, C. C. Ouverney, K. Palm, G. C. Armitage, D. A. Relman. (2004). Methanogenic Archaea and human periodontal disease. Proceedings of the National Academy of Sciences. 101, 6176-6181;
- Flavia Matarazzo, Adriana Costa Ribeiro, Magda Feres, Marcelo Faveri, Marcia Pinto Alves Mayer. (2011). Diversity and quantitative analysis of Archaea in aggressive periodontitis and periodontally healthy subjects. Journal of Clinical Periodontology. 38, 621-627;
- Mahmoud A. Ghannoum, Richard J. Jurevic, Pranab K. Mukherjee, Fan Cui, Masoumeh Sikaroodi, et. al.. (2010). Characterization of the Oral Fungal Microbiome (Mycobiome) in Healthy Individuals. PLoS Pathog. 6, e1000713;
- William G. Wade. (2013). The oral microbiome in health and disease. Pharmacological Research. 69, 137-143;
- Bjørn Grinde. (2013). Herpesviruses: latency and reactivation – viral strategies and host response. Journal of Oral Microbiology. 5, 22766;
- P. Chayavichitsilp, J. V Buckwalter, A. C. Krakowski, S. F. Friedlander. (2009). Herpes Simplex. Pediatrics in Review. 30, 119-130;
- KL Kumaraswamy, M Vidhya. (2011). Human papilloma virus and oral infections: An update. J Can Res Ther. 7, 120;
- Vidya Ajila, Harish Shetty, Subhas Babu, Veena Shetty, Shruthi Hegde. (2015). Human Papilloma Virus Associated Squamous Cell Carcinoma of the Head and Neck. Journal of Sexually Transmitted Diseases. 2015, 1-5;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- David T Pride, Julia Salzman, Matthew Haynes, Forest Rohwer, Clara Davis-Long, et. al.. (2012). Evidence of a robust resident bacteriophage population revealed through analysis of the human salivary virome. ISME J. 6, 915-926;
- Nicola Segata, Susan Haake, Peter Mannon, Katherine P Lemon, Levi Waldron, et. al.. (2012). Composition of the adult digestive tract bacterial microbiome based on seven mouth surfaces, tonsils, throat and stool samples. Genome Biology. 13, R42;
- Rajiv Saini, Santosh Saini, Sugandha Sharma. (2011). Biofilm: A dental microbial infection. J Nat Sc Biol Med. 2, 71;
- Evelien Gerits, Natalie Verstraeten, Jan Michiels. (2017). New approaches to combat Porphyromonas gingivalis biofilms. Journal of Oral Microbiology. 9, 1300366;
- Зубная крепость: как пасты делают наши зубы лучше?;
- Fang Yang, Xiaowei Zeng, Kang Ning, Kuan-Liang Liu, Chien-Chi Lo, et. al.. (2012). Saliva microbiomes distinguish caries-active from healthy human populations. ISME J. 6, 1-10;
- L. P. Samaranayake, A. B. Lamb, P.-J. Lamey, T. W. MacFarlane. (1989). Oral carriage of Candida species and coliforms in patients with burning mouth syndrome. J Oral Pathol Med. 18, 233-235;
- Joseph J. Zambon, Homer S. Reynolds, Robert J. Genco. (1990). Studies of the Subgingival Microflora in Patients With Acquired Immunodeficiency Syndrome. Journal of Periodontology. 61, 699-704;
- C. S. P. Tsang, L. P. Samaranayake. (2000). Oral yeasts and coliforms in HIV-infected individuals in Hong Kong. Mycoses. 43, 303-308;
- Leila Maria Marchi-Alves, Dayana Freitas, Denise de Andrade, Simone de Godoy, Adrielle Naiara Toneti, Isabel Amélia Costa Mendes. (2017). Characterization of Oral Microbiota in Removable Dental Prosthesis Users: Influence of Arterial Hypertension. BioMed Research International. 2017, 1-7;
- Purnima S. Kumar, Matthew R. Mason, Michael R. Brooker, Kelly O'Brien. (2012). Pyrosequencing reveals unique microbial signatures associated with healthy and failing dental implants. J Clin Periodontol. 39, 425-433;
- Ekaterina V. Khokhlova, Vladimir V. Smeianov, Boris A. Efimov, Lyudmila I. Kafarskaia, Svetlana I. Pavlova, Andrei N. Shkoporov. (2012). Anti-inflammatory properties of intestinal Bifidobacterium strains isolated from healthy infants. Microbiology and Immunology. 56, 27-39;
- Julia B. Ewaschuk, Hugo Diaz, Liisa Meddings, Brendan Diederichs, Andrea Dmytrash, et. al.. (2008). Secreted bioactive factors from Bifidobacterium infantis enhance epithelial cell barrier function. American Journal of Physiology-Gastrointestinal and Liver Physiology. 295, G1025-G1034;
- Takemi Kinouchi, Keiko Kataoka, Shan Ruo Bing, Haruyuki Nakayama, Motoo Uejima, et. al.. (1998). Culture Supernatants ofLactobacillus acidophilusandBifidobacterium adolescentisRepress Ileal Ulcer Formation in Rats Treated with a Nonsteroidal Antiinflammatory Drug by Suppressing Unbalanced Growth of Aerobic Bacteria and Lipid Peroxidation. Microbiology and Immunology. 42, 347-355;
- Marianna Roselli, Alberto Finamore, Silvia Nuccitelli, Paola Carnevali, Patrizia Brigidi, et. al.. (2009). Prevention of TNBS-induced colitis by different Lactobacillus and Bifidobacterium strains is associated with an expansion of γδT and regulatory T cells of intestinal intraepithelial lymphocytes. Inflammatory Bowel Diseases. 15, 1526-1536;
- Soichi Tanabe. (1998). Bifidobacterium infantis suppresses proinflammatory interleukin-17 production in murine splenocytes and dextran sodium sulfate-induced intestinal inflammation. Int J Mol Med;
- Eiji Miyauchi, Tasuku Ogita, Junki Miyamoto, Seiji Kawamoto, Hidetoshi Morita, et. al.. (2013). Bifidobacterium longum Alleviates Dextran Sulfate Sodium-Induced Colitis by Suppressing IL-17A Response: Involvement of Intestinal Epithelial Costimulatory Molecules. PLoS ONE. 8, e79735;
- P Sansonetti. (2002). Host-pathogen interactions: the seduction of molecular cross talk. Gut. 50, iii2-iii8;
- Darab Ghadimi, Michael de Vrese, Knut J. Heller, Juergen Schrezenmeir. (2010). Effect of natural commensal-origin DNA on toll-like receptor 9 (TLR9) signaling cascade, chemokine IL-8 expression, and barrier integritiy of polarized intestinal epithelial cells. Inflammatory Bowel Diseases. 16, 410-427;
- Ludmila Khailova, Sarah K. Mount Patrick, Kelly M. Arganbright, Melissa D. Halpern, Toshi Kinouchi, Bohuslav Dvorak. (2010). Bifidobacterium bifidum reduces apoptosis in the intestinal epithelium in necrotizing enterocolitis. American Journal of Physiology-Gastrointestinal and Liver Physiology. 299, G1118-G1127;
- Elke Cario, Guido Gerken, Daniel K. Podolsky. (2004). Toll-like receptor 2 enhances ZO-1-associated intestinal epithelial barrier integrity via protein kinase C. Gastroenterology. 127, 224-238;
- E. Cario, G. Gerken, D.K. Podolsky. (2007). Toll-Like Receptor 2 Controls Mucosal Inflammation by Regulating Epithelial Barrier Function. Gastroenterology. 132, 1359-1374;
- Daniel K. Podolsky, Guido Gerken, Annette Eyking, Elke Cario. (2009). Colitis-Associated Variant of TLR2 Causes Impaired Mucosal Repair Because of TFF3 Deficiency. Gastroenterology. 137, 209-220;
- James W. Hegarty, Caitriona M. Guinane, R. Paul Ross, Colin Hill, Paul D. Cotter. (2016). Bacteriocin production: a relatively unharnessed probiotic trait?. F1000Res. 5, 2587;
- Martina Sassone-Corsi, Manuela Raffatellu. (2015). No Vacancy: How Beneficial Microbes Cooperate with Immunity To Provide Colonization Resistance to Pathogens. J.I.. 194, 4081-4087;
- Thomas Gensollen, Shankar S. Iyer, Dennis L. Kasper, Richard S. Blumberg. (2016). How colonization by microbiota in early life shapes the immune system. Science. 352, 539-544;
- Emmelie Å Jansson, Liyue Huang, Ronny Malkey, Mirco Govoni, Carina Nihlén, et. al.. (2008). A mammalian functional nitrate reductase that regulates nitrite and nitric oxide homeostasis. Nat Chem Biol. 4, 411-417;
- Embriette R. Hyde, Fernando Andrade, Zalman Vaksman, Kavitha Parthasarathy, Hong Jiang, et. al.. (2014). Metagenomic Analysis of Nitrate-Reducing Bacteria in the Oral Cavity: Implications for Nitric Oxide Homeostasis. PLoS ONE. 9, e88645;
- Mirco Govoni, Emmelie Å. Jansson, Eddie Weitzberg, Jon O. Lundberg. (2008). The increase in plasma nitrite after a dietary nitrate load is markedly attenuated by an antibacterial mouthwash. Nitric Oxide. 19, 333-337;
- Дыхание природы: как возник галитоз;
- Porter J.R. (1976). Antony van Leeuwenhoek: tercentenary of his discovery of bacteria. Bacteriol. Rev. 40, 260–269;
- Ying-Rong Lin, Chan-Shing Lin. (2012). Genome-wide characterization of vibrio phage ϕpp2 with unique arrangements of the mob-like genes. BMC Genomics. 13, 224;
- Wei Chih Ling, Yeh Siang Lau, Dharmani Devi Murugan, Paul M. Vanhoutte, Mohd Rais Mustafa. (2015). Sodium nitrite causes relaxation of the isolated rat aorta: By stimulating both endothelial NO synthase and activating soluble guanylyl cyclase in vascular smooth muscle. Vascular Pharmacology. 74, 87-92.