Антиоксиданты против пиелонефрита
11 сентября 2014
Антиоксиданты против пиелонефрита
- 2109
- 2
- 2
Острый пиелонефрит без должного лечения может привести к летальному исходу. Но что такое это должное лечение?
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Более полувека назад учёные усмотрели связь между процессом клеточного дыхания и старением. Сегодня известно как факт, что при окислении органики в клетке выделяются потенциально опасные метаболиты, играющие важную роль в развитии целого ряда заболеваний. Митохондриально адресованные антиоксиданты, также известные как ионы Скулачёва, предоставляют новые возможности в борьбе с такими патологиями, как инфаркт и инсульт. А в 2013 году лаборатория структуры и функций митохондрии под руководством Д. Б. Зорова из НИИ ФХБ им. Белозерского показала, что ионы Скулачёва могут помочь и больным острым пиелонефритом.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучшее новостное сообщение».
Главный спонсор конкурса — дальновидная компания Генотек.
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Антибиотики, или агрессивная терапия
Принцип лечения бактериальных инфекций не претерпел никаких изменений со времён открытия пенициллина в первой половине прошлого века: больной использует антибиотики в той или иной лекарственной форме в надежде, что бактерии умрут быстрее, чем у них появится устойчивость к прописанному лекарству. При этом антибиотики могут вызывать у больного ряд побочных эффектов, как например дисбактериоз и проблемы с пищеварением, а некоторым категориям пациентов (дети, беременные женщины, аллергики) антибиотики могут быть вообще противопоказаны.
Здесь уместно провести параллель между борьбой с бактериальной инфекцией и боевыми искусствами. В основу философии айкидо — известного во всём мире японского боевого искусства — положена идея противостояния силе не силой, но мягкостью. Почти любая философия боя предполагает логичным сопротивление силе противника своей собственной агрессией. В айкидо же этот метод ведения боя считается тупиковым: необходимо умерить свой пыл, ведь преумножение агрессии приводит лишь к нарушению гармонии, что, в свою очередь, ведёт к поражению.
Как ни странно, идея удержания собственной агрессии в бою нашла применение и в клеточной биологии, а в частности — в разработке нового подхода к лечению острых инфекционных заболеваний. Этот подход основывается на осуществлении контроля над клеточным дыханием в тканях больного, роль которого при борьбе с инфекцией крайне важна.
Дыхание смерти подобно
Клеточным дыханием называют получение энергии при помощи контролируемого окисления питательных веществ в структурах, называемых митохондриями. Иногда в процессе дыхания кислород по ещё не вполне ясным причинам может образовывать ряд короткоживущих, но крайне активных соединений: супероксид О2·−, гидроксильный радикал ОН·, перекись водорода H2O2. Эти вещества, называемые активными формами кислорода (АФК), будто выжигают клетку изнутри и могут даже приводить к её смерти [1]. В митохондриях существует семь источников АФК, причём два из них устроены так, что образовавшиеся АФК легко покидают место синтеза и, как огонь, перекидываются на другие клеточные структуры [2]. Но даже та часть АФК, что остаётся внутри митохондрии, способна разрушить митохондриальную ДНК и другие части этой органеллы, необходимые для контроля клеточного дыхания.
В 50-х годах прошлого века возникла свободнорадикальная теория старения за авторством Денэма Хармэна. К 1980 году она развилась в митохондриальную теорию старения, согласно которой именно производимые этими структурами АФК и являются причиной дегенеративных возрастных изменений [3]. В наше время, хотя и доказана корреляция между уровнем АФК и возрастом, накопленные данные не позволяют заключить, являются ли они причиной или лишь следствием старения [4].
Ложка мёда в бочке дёгтя
Выходит, АФК — это плохо? Не совсем так, даже совсем не так. АФК вовлечены во множество сигнальных путей в клетке [5], некоторые из которых направлены на повышение устойчивости к стрессовым ситуациям (голодание, гипоксия).
Помимо прочего, перекись, образуемая митохондриями или ферментом NADPH-оксидазой (NADPH-Oxydase, NOX) [6], применяется иммунными клетками в качестве оружия в борьбе с инфекцией. Такое сознательное производство АФК при бактериальных инфекциях осуществляется подтипом белых кровяных телец — нейтрофилами, — а также макрофагами. Перекись может либо продуцироваться во внутриклеточный резервуар — фагосому, захватившую бактерии, — либо же выделяться в межклеточное пространство — наружу. В любом случае бактерии не выдерживают окислительного стресса, их количество уменьшается, и заражение сходит на нет. По крайней мере так должно быть, но к сожалению, на практике редко встретишь столь идеальный ход событий.
Как уже упоминалось выше, высокие концентрации АФК в состоянии нанести ущерб не только бактериям, но и клеткам больного. Вообще говоря, в митохондриях переплетается множество сигнальных путей, одни из которых ведут к выживанию клетки, а другие — к её апоптозу, смерти. И в этих путях уровень АФК часто играет главную роль. Тут мы как раз и возвращаемся к затронутой в самом начале статьи теме сопротивления силой агрессии. Чрезмерное образование АФК в качестве защитной реакции на инфекцию зачастую нарушает баланс между сигналами жизни и сигналами смерти. Научиться управлять ими — заветная мечта учёных.
Растительные антиоксиданты на страже здоровья
В митохондриях энергия, полученная при окислении питательных веществ, используется для создания электрохимической разности потенциалов ионов водорода на внутренней мембране митохондрий. Эта разность потенциалов, или напряжение, впоследствии позволяет митохондриальным ферментам запасать энергию в виде молекул аденозинтрифосфата (АТФ).
Образование АФК клеткой тоже напрямую зависит от электрохимических характеристик митохондрий. Так, снижение напряжения на внутренних мембранах митохондрий всего на 10% снижает образование АФК в десять раз [7]! Это действительно впечатляющая цифра. Вопрос только один: какое вещество способно накапливаться и снижать генерацию АФК в митохондриях?
В 1970-х годах академик В. П. Скулачёв, ныне декан факультета биоинженерии и биоинформатики МГУ, показал, что липофильные катионы с высокой селективностью проникают в митохондрии, влекомые разницей потенциалов (внутри митохондрий — отрицательный заряд, а сами катионы заряжены положительно). Сейчас такие вещества с подачи американского биохимика Дэвида Грина в 1974 году называют ионами Скулачёва. При сращивании этих катионов с антиоксидантами можно получить мощное средство в борьбе с окислительным стрессом.
В 2005–2006 годах начался проект по поиску нового типа лекарств на базе ионов Скулачёва, который был оформлен как компания «Митотех». Первые попытки создать такой биотехнологический препарат были не совсем успешны. Однако уже в 2007 появились многообещающие результаты по отечественным митохондриально-адресованным антиоксидантам (МАА): ионы Скулачёва замедляют развитие возрастных заболеваний, снижают область поражения при инфарктах и инсультах, помогают при лечении некоторых форм рака [8], [9]. Тем не менее годом позже, по причине мирового экономического кризиса, проект лишился своего инвестора — Олега Дерипаски. Но вскоре «Митотех» обрела новых инвесторов: Росток и РОСНАНО. Сейчас исследования продолжаются, и даже создано полноценное лекарство от целого комплекса глазных заболеваний — Визомитин. В планах — создание препарата системного действия и выход на мировой рынок лекарств.
Сейчас одним из самых перспективных веществ данного класса является SkQR1 (рис. 1), антиоксидант в котором представлен пластохиноном — переносчиком электронов из хлоропластов растений. Это вещество эффективно снижает электрохимическое напряжение даже в очень маленьких концентрациях. Это явление объясняется тем, что SkQR1 за счёт взаимодействия с белками митохондрий возвращается в исходную форму, готовую принять на себя удар АФК.
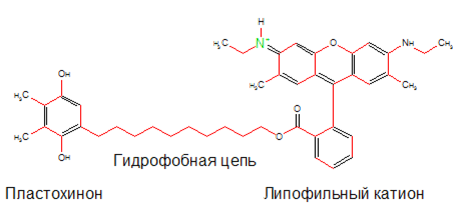
Рисунок 1. Строение митохондриально адресованного антиоксиданта SkQR1: пластохинон нейтрализует активные формы кислорода, а липофильный катион обеспечивает попадание этого препарата в место их образования.
Последний писк
В июле 2013 года ведущее американское научное издание Proceedings of National Academy of Sciences опубликовало крайне интересную работу «Защитный эффект митохондриально адресованных антиоксидантов при острой бактериальной инфекции» [10], в которой описывается результат использования МАА в качестве единственного лекарства при острых бактериальных заболеваниях на примере пиелонефрита. Далее об этой работе, выполненной на базе НИИ ФХБ им. Белозерского, рассказывается более подробно.
Пиелонефрит — воспаление почек и верхних мочепроводящих путей, вызванное размножением в них бактерий. При этом заболевании образуются карманы с гноем, сами почки увеличивается в размерах из-за плохого оттока мочи и крови. Даже после успешного лечения в них остаются множественные рубцы. В худшем случае пиелонефрит может привести к заражению крови и сепсису — распространению заражения по всему организму. Причём острый пиелонефрит развивается стремительно (в течение нескольких дней), именно поэтому так важно быстро его диагностировать и начать лечить.
Традиционно для этих целей применяют антибиотики и противовоспалительные препараты. Однако ни то, ни другое не способно снизить окислительный стресс, с которым сталкиваются ткани больного при выбросе АФК нейтрофилами. Тем более в некоторых случаях антибиотики могут оказаться малоэффективными или быть просто противопоказаны пациенту. МАА — совсем иной класс веществ, на который возлагаются большие надежды.
Возвращаясь к параллели с айкидо, можно сказать, что стратегия «мягкости» — умеренной регуляции окислительного стресса и нормализации воспалительного и антибактериального ответа самого организма — способна в длительной перспективе принести больший успех в борьбе с инфекционными болезнями. Тогда как «сила» — то есть, безудержное наращивание арсенала антибиотиков — всё чаще оборачивается поражением, порождая все больше штаммов устойчивых бактерий и вызывая серьезные побочные явления у пациентов.
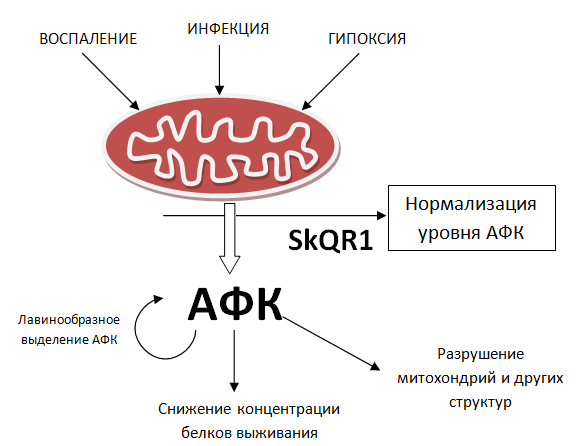
Рисунок 2. Митохондрии при стрессовых условиях выделяют чрезмерное количество активных форм кислорода (АФК), наносящих ущерб здоровым тканям. Митохондриальные антиоксиданты способны нейтрализовать их негативный эффект.
Эффективность МАА проверялась по множеству параметров на двух моделях: in vivo (на крысах) и in vitro (букв. «в пробирке»). В первом случае в мочевой пузырь крыс вводилась разведённая на питательной среде культура бактерий, в течение двух суток некоторым подопытным проводилось четыре инъекции SkQR1. К концу определённого срока (два дня или неделя) ткани их почек забирали на анализы. Во втором случае культуру почечных клеток (Renal Tubular Cells, RTC) два дня культивировали вместе с выделенными из крови лейкоцитами на питательной среде, содержащей бактериальный эндотоксин липополисахарид (LPS) или оболочки самих бактерий (эти добавки распознаются иммунными клетками как живые возбудители и запускают соответствующие реакции). В питательную среду также добавлялись различные МАА.
За открытие механизмов распознавания иммунными клетками чужеродных агентов в 2011 была вручена Нобелевская премия по физиологии и медицине [11], [12].
Эффективность SkQR1 в борьбе с пиелонефритом
Доказано: активация лейкоцитов приводит к скачку уровня АФК в пять раз и значительному увеличению косвенных показателей окислительного стресса. Однако простое наличие контакта между неактивированными лейкоцитами и RTC тоже приводит к повышению АФК, но в два раза меньше, по сравнению с активированными.
Помимо этого контакт RTC и лейкоцитов приводит к повышению TNFα — белка, провоцирующего апоптоз и являющегося ключевым элементом в процессе воспаления. Чтобы проверить взаимосвязь TNFα и АФК, культуру RTC вырастили в среде, богатой этим белком. Уровень активных форм кислорода повышался прямо пропорционально содержанию TNFα, который выделялся и самими клетками культуры (преимущественно лейкоцитами). Действие TNFα на почку может спровоцировать лавинообразный процесс, при котором выделившиеся АФК создают благоприятные условия для образования новых молекул АФК [13].
В процессах воспаления кроме TNFα участвуют и многие другие белки, в том числе Bcl-2 и pGSK-3β. Эти белки отвечают за выживаемость клетки и её устойчивость к АФК. Обычно при пиелонефрите содержание этих белков падает, однако МАА в некоторой степени восстанавливают их количество.
Таким образом, МАА — и SkQR1 в частности — при своевременном применении напрямую снижают концентрацию АФК, сдерживают их лавинообразный выброс и обеспечивают преобладание сигналов выживания (рис. 3). Всё это достигается лишь восстановлением нормального функционирования митохондрий в RTC и лейкоцитах.
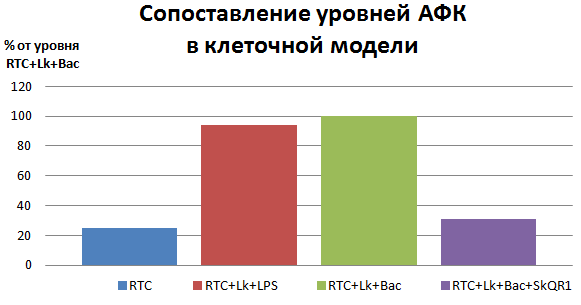
Рисунок 3. SkQR1 снижает уровень окислительного стресса в воспалённых клетках почек. Воспаление в почках вызывали добавлением в клеточную культуру активированных бактериальным лизатом или липополисахаридом (компонентом бактериальных клеточных стенок) лейкоцитов. Индикатором воспаления служит уровень АФК, который падает практически до уровня здоровых почек в присутствии SkQR1. Обозначения: RTC — здоровые клетки почек. RTC+Lk+LPS — выращенные вместе RTC и лейкоциты в присутствии LPS. RTC+Lk+Bac — выращенные вместе RTC и лейкоциты в присутствии оболочек бактерий. RTC+Lk+Bac+SkQR1 — то же, с добавлением SkQR1.
Насколько же эффективен SkQR1 не в далекой от жизни модели in vitro, но при лечении живых крыс? Прежде всего, стоит сказать, что этот препарат, не являясь антибиотиком, понизил уровень патогенных микроорганизмов в моче крыс. Но что гораздо более волнующе: смертность крыс, которым проводили инъекции SkQR1, резко снизилась (рис. 4)!
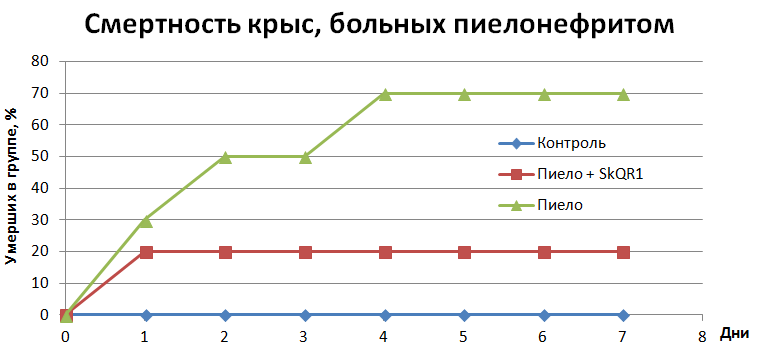
Рисунок 4. Использование SkQR1 значительно снижает смертность крыс при пиелонефрите. Во всех трёх группах было по двенадцать крыс.
Подобные результаты заставляют задуматься: митохондрии появились в клетках более миллиарда лет назад и в ходе эволюции должны были превратиться в непогрешимый механизм. Тем не менее, проведённые с МАА исследования указывают на чудовищные неполадки в этом на первый взгляд идеальном элементе клеточной структуры. Неужели учёным удалось исправить ошибки матери-природы, или же их близорукость мешает заметить какую-то помарку в своих расчётах?
Согласно теории симбиогенеза, митохондрии произошли от бактерий, которые стали жить внутри других одноклеточных организмов. Может быть, подобная несогласованность действий — остатки автономии бактериальных предков?
Как бы то ни было, препараты на базе ионов Скулачёва предоставляют надежду, что в скором будущем человечество будет готово противопоставить бактериальным инфекциям и сердечно-сосудистым заболеваниям нечто более эффективное, чем то, что у них есть сейчас.
Литература
- Скулачев В.П. (1996). Кислород в живой клетке: добро и зло. «Соросовский образовательный журнал». 3, 4–10;
- Martin D. Brand. (2010). The sites and topology of mitochondrial superoxide production. Experimental Gerontology. 45, 466-472;
- J. Miquel, A.C. Economos, J. Fleming, J.E. Johnson. (1980). Mitochondrial role in cell aging. Experimental Gerontology. 15, 575-591;
- Helena M. Cochemé, Caroline Quin, Stephen J. McQuaker, Filipe Cabreiro, Angela Logan, et. al.. (2011). Measurement of H2O2 within Living Drosophila during Aging Using a Ratiometric Mass Spectrometry Probe Targeted to the Mitochondrial Matrix. Cell Metabolism. 13, 340-350;
- Активный кислород: друг или враг, или О пользе и вреде антиоксидантов;
- Duangmanee Sanmun, Erika Witasp, Siriporn Jitkaew, Yulia Y. Tyurina, Valerian E. Kagan, et. al.. (2009). Involvement of a functional NADPH oxidase in neutrophils and macrophages during programmed cell clearance: implications for chronic granulomatous disease. American Journal of Physiology-Cell Physiology. 297, C621-C631;
- F. F. Severin, I. I. Severina, Y. N. Antonenko, T. I. Rokitskaya, D. A. Cherepanov, et. al.. (2010). Penetrating cation/fatty acid anion pair as a mitochondria-targeted protonophore. Proceedings of the National Academy of Sciences. 107, 663-668;
- V. P. Skulachev. (2007). A biochemical approach to the problem of aging: “Megaproject” on membrane-penetrating ions. The first results and prospects. Biochemistry Moscow. 72, 1385-1396;
- Vladimir P. Skulachev, Vladimir N. Anisimov, Yuri N. Antonenko, Lora E. Bakeeva, Boris V. Chernyak, et. al.. (2009). An attempt to prevent senescence: A mitochondrial approach. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1787, 437-461;
- E. Y. Plotnikov, M. A. Morosanova, I. B. Pevzner, L. D. Zorova, V. N. Manskikh, et. al.. (2013). Protective effect of mitochondria-targeted antioxidants in an acute bacterial infection. Proceedings of the National Academy of Sciences. 110, E3100-E3108;
- Иммунологическая Нобелевская премия (2011);
- Толл-подобные рецепторы: от революционной идеи Чарльза Джейнуэя до Нобелевской премии 2011 года;
- Dmitry B. Zorov, Magdalena Juhaszova, Steven J. Sollott. (2006). Mitochondrial ROS-induced ROS release: An update and review. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1757, 509-517;
- Laura A. Sena, Navdeep S. Chandel. (2012). Physiological Roles of Mitochondrial Reactive Oxygen Species. Molecular Cell. 48, 158-167.