
BDNF: почему спорт — это жизнь?
21 февраля 2023
BDNF: почему спорт — это жизнь?
- 5662
- 0
- 10
BDNF — это жизнь!
Рисунок в полном размере.
рисунок Дарьи Куприяновой
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Нам с самого детства твердят, что спорт — это жизнь, а какая это жизнь и почему именно спорт является чем-то очень важным, так никто и не объяснил. Забегая вперед, скажу, что нам кое-что удалось узнать о влиянии ежедневных умеренных физических нагрузок на работу головного мозга — и даже о том, как работа наших мышц во время спортивных тренировок связана с профилактикой нейродегенерации. Может быть, поэтому спорт важен не только для жизни отдельного человека, но и для общественного здравоохранения в целом. Речь пойдет о впечатляющем «суперсемействе» нейротрофинов — белках, участие которых так важно в развитии и работе нейронов на протяжении всей человеческой жизни. Но в этой статье из всего обширного разнообразия нейротрофинов хотелось бы выделить и более подробно рассказать о нейротрофине BDNF (brain-derived neurotrophic factor) , который и является связующим звеном между нейронами и спортом.
Оценка «Биомолекулы»
Эта работа опубликована в номинации «Нейробиология» конкурса «Био/Мол/Текст»-2022/2023.
Партнер номинации — компания «Сесана»: — один из ведущих поставщиков оборудования и реагентов для полного цикла научного исследования.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Структура и функции BDNF
В 1982 году исследователями из Института психиатрии Макса Планка Ивом-Аленом Барде и Хансом Тоененом при проведении опытов на мозге свиньи был получен нейротрофический фактор мозга — brain-derived neurotrophic factor (BDNF) (рис. 1), — который поддерживал выживание и рост нервных клеток из культивируемых эмбриональных сенсорных нейронов цыплят (рис. 2) [1]. Немного позже Джеймс Лейброк определил биохимическую структуру белка BDNF уже у человека [2]. В течение последующих нескольких лет открытие нейротрофинов происходило каждый год, и на сегодняшний день описано около 20 нейротрофических факторов, различающихся по строению и функциям.
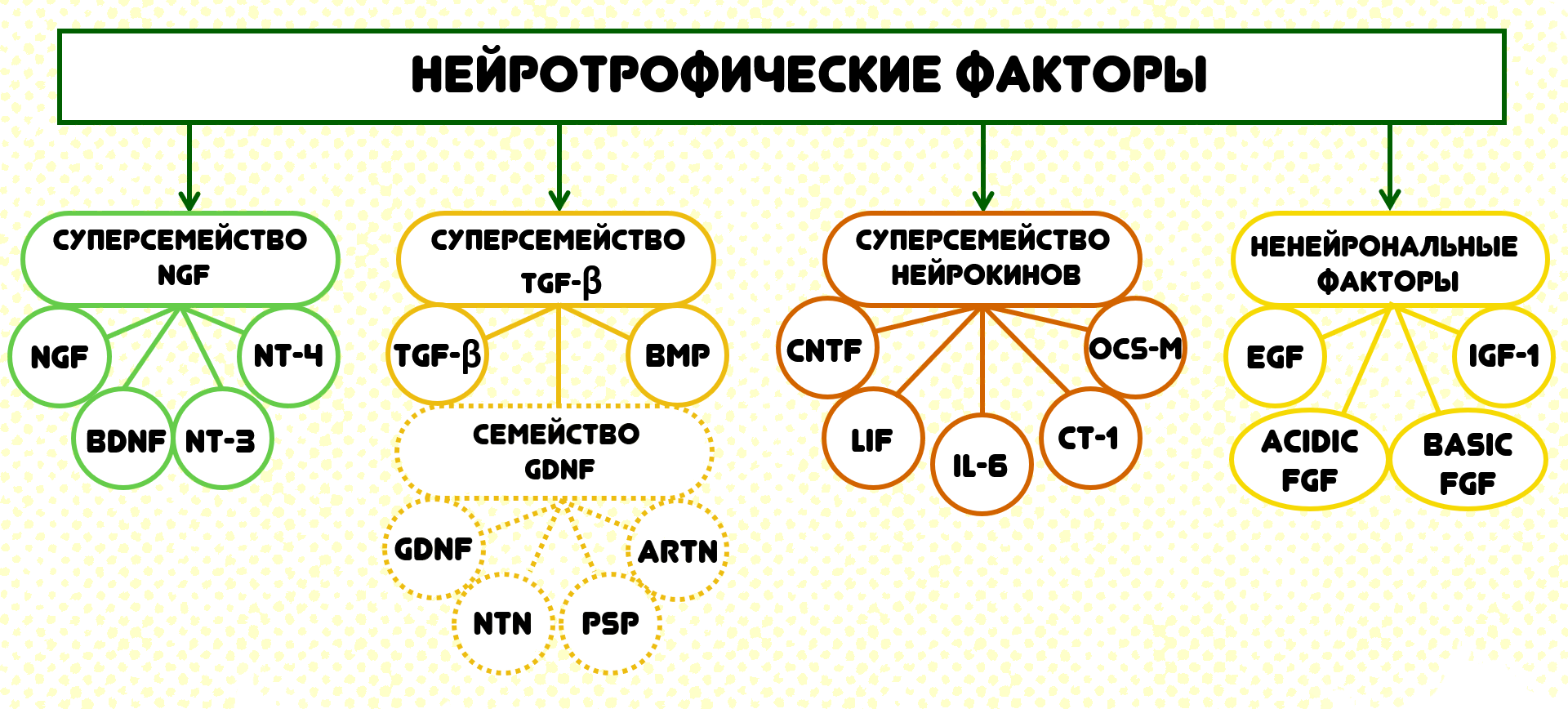
Рисунок 1. Классификация нейротрофических факторов.
рисунок Дарьи Куприяновой по Wikipedia

Рисунок 2. Первооткрыватели BDNF Ив-Ален Барде (слева) и Ханс Теонен (справа).
рисунок Дарьи Куприяновой по Wikipedia и Hans Thoenen
Однако мы заострим наше внимание на BDNF. Чем же он все-таки так интересен? При ответе на этот вопрос попробуем обратиться к его структуре и функциям. BDNF является широко распространенным в центральной нервной системе (ЦНС) нейротрофином и принадлежит к семье нейротрофинов, включающей также фактор роста нервов (NGF), нейротрофины NT-3 и NT-4. Эти четыре нейротрофина имеют схожую структуру белковых цепей и осуществляют свои функции, активируя рецепторы двух типов: тропомиозин-киназу B (TrkB) и рецептор фактора роста нервов (p75) [3]. BDNF представляет из себя димер с общей молекулярной массой 27,2 кДа, каждый мономер которого состоит из 120 аминокислот. BDNF высококонсервативен по своей структуре. Другими словами, в этом белке присутствуют схожие или идентичные последовательности аминокислот. Кроме того, этот белок на 50% идентичен по своей структуре с другими нейротрофинами: NGF, NT-3, NT-4 [4].
TrkB, основной рецептор BDNF, который обладает специфичностью к BDNF и нейротрофину-4, подходит к ним, как ключ к замку. Взаимодействие BDNF с TrkB запускает целый каскад событий, активируя сигнальные пути, участвующие в сохранении структуры нейронов и восстановительных эффектах. Рецептор p75 связывается со всеми нейротрофинами и обладает проапоптотическим эффектом, то есть в отсутствие рецептора TrkB может запускать запрограммированную клеточную гибель [5].
Как показали исследования структуры и функций BDNF, он имеет тесную связь с нормальной деятельностью нервной системы и познавательными процессами, такими как память, внимание, мышление и др. BDNF является одним из ключевых звеньев в работе головного мозга взрослого человека. Поддержание жизнеспособности и обмена веществ нейронов, а также участие в процессах образования новых нервных клеток осуществляется благодаря работе нейротрофического фактора головного мозга [6].
Нейротрофический фактор головного мозга играет важную роль в образовании миелиновой оболочки нейронов ЦНС, которая участвует в проведении нервного импульса и выполняет защитную функцию. Недавние исследования с участием мутантных мышей с нокаутом BDNF в сравнении с мышами, у которых нарушена функция выработки миелина, продемонстрировали, что BDNF усиливает образование миелина в центральной нервной системе в процессе развития и ускоряет процесс восстановления при повреждении миелиновой оболочки. Так, BDNF, участвуя в сохранении целостности нейронов, выполняет свою нейропротекторную функцию для нейронов ЦНС [7].
В головном мозге BDNF активен в гиппокампе, коре и отделах переднего мозга — областях, являющихся основой процессов запоминания и хранения информации, включая обучение и поведение. Группа китайских ученых оценила влияние BDNF на нейроны головного мозга у животных. В эксперименте крыс сравнивали по содержанию BDNF в ЦНС в зависимости от степени выполняемой физической нагрузки, такой как упражнение на беговой дорожке. По результату сравнения уровень BDNF у крыс, занимающихся на беговой дорожке, был выше по сравнению с группой крыс, не подвергавшихся физической нагрузке. Как следствие, высокий уровень нейротрофина в группе физических упражнений привел к образованию большего количества дендритных шипиков на нейронах гиппокампа, что является основным механизмом процесса запоминания, в связи с чем крысы лучше справлялись с тестом водного лабиринта [8].
В ЦНС нейроны являются основным источником BDNF, другим потенциальным источником могут быть вспомогательные клетки нервной ткани — клетки нейроглии. Однако как же нам добраться до BDNF, если он находится в головном мозге? Неужели придется сверлить кости черепа, чтобы добраться до тканей мозга? К счастью, нет, так как этот нейротрофин присутствует не только в мозге, но также его можно обнаружить и в крови человека. Циркулирующий в крови BDNF существует в двух разных формах: связанный с тромбоцитами и свободный. И содержание BDNF в сыворотке крови в сравнении с плазмой превышает более чем в 50 раз. Это объясняется тем, что в сыворотке за счет высвобождения BDNF при распаде тромбоцитов и свертывании крови он определяется в бóльших количествах. Также стоит отметить, что уровень BDNF в сыворотке крови имеет взаимосвязь с целостностью коры головного мозга, что подтверждает значимость нейротрофина для нормальной работы ЦНС [9].
Выработка и выделение BDNF происходит строго «по требованию» — другими словами, в условиях возбуждения нейрона. Раздражитель (фактор внутренней или внешней среды, например, окислительный и метаболический стресс, физическая активность), действуя на рецепторы, вызывает возбуждение нейронов, что может привести к активации рецептора NMDA, вызывая приток ионов кальция. NMDA-рецептор запускает высвобождение регуляторных белков, которые, в свою очередь, запускают транскрипцию генов BDNF в ответ на приток кальция. Это показано в экспериментах европейских и американских ученых, где при воздействии стресса или физической нагрузки наблюдалось немедленное увеличение белка BDNF в плазме крови [10], [11].
- Метаболический стресс
- истощение питательных веществ, вызывающее ряд адаптивных реакций для восстановления динамического гомеостаза и поддержания клеточной функции [12].
- Окислительный стресс
- это резкое усиление окислительных процессов в организме, которое вызывает повреждения клетки.
Роль BDNF при болезнях головного мозга
Как уже говорилось ранее, синтез BDNF происходит «по требованию» и потому чувствителен к таким воздействиям, как стресс, травма, гипогликемия, ишемия и повреждения мозга [13]. В 2016 году американские ученые обнаружили уменьшение концентрации BDNF в сыворотке и плазме крови у пациентов с болезнью Альцгеймера (БА) по сравнению со здоровыми людьми [14]. Впрочем, все оказалось не так однозначно. Группа ученых из Китая описала интересное явление: у людей с умеренными когнитивными расстройствами концентрация BDNF в крови оказалась значительно ниже, чем у людей, больных Альцгеймером. По результатам исследования стало ясно, что концентрация BDNF напрямую зависит от тяжести деменции — на ранних стадиях болезни Альцгеймера наличие BDNF в крови может увеличиваться, а уменьшение происходит только на поздних стадиях болезни. Одной из причин уменьшения концентрации BDNF является подавление выработки этого нейротрофина дендритными клетками мозга под влиянием белка бета-амилоида. Этот белок вызывает разрушительное действие на нервные клетки головного мозга за счет выработки свободных радикалов — частиц, являющихся токсичными для организма [15].
Развитие другого нейродегенеративного заболевания — Болезни Паркинсона (БП), известного еще как дрожательный паралич, также зависит от концентрации BDNF в крови. Болезнь Паркинсона вызвана гибелью специализированных нервных клеток черной субстанции среднего мозга, производящих дофамин; вместе с тем, в этой области наблюдается значительное уменьшение выработки BDNF при паркинсонизме [16]. В исследовании, проводившемся на пациентах с БП, обратили внимание на взаимосвязь уровня BDNF с длительным течением заболевания и степенью его тяжести, аналогично исследованиям на больных с Альцгеймером, но у людей с паркинсонизмом все с точностью до наоборот. На ранних стадиях паркинсонизма концентрация BDNF в крови уменьшалась, и предполагается, что более низкие уровни BDNF на ранних стадиях заболевания связаны с патологическим течением БП, а увеличение концентрации BDNF на более поздних стадиях болезни, вероятно, связано с попытками мозга восполнить утраченные нейроны [17].
- Нейродегенеративные заболевания
- группа в основном медленно прогрессирующих, наследственных или приобретенных заболеваний нервной системы. Общим для этих заболеваний является прогрессирующая гибель нервных клеток (нейродегенерация), ведущая к различным неврологическим симптомам — прежде всего, к деменции и нарушению движений.
С болезнями дегенерации нервной системы понятно, а как же обстоят дела с сердечно-сосудистыми заболеваниями? Упомянутые выше нейродегенеративные заболевания отличаются медленной и постепенной гибелью нервных клеток, ведь между ранней и поздней стадией может пройти несколько лет. Инсульт, в свою очередь, чаще всего возникает внезапно, а по масштабам повреждения тканей мозга совершенно не уступает деменции. Пораженный инсультом участок головного мозга перестает кровоснабжаться из-за разрыва стенок сосуда или его закупорки, следовательно, происходит отмирание нервных клеток поврежденного участка. Недостаток кислорода в клетках мозга при инсульте запускает многие патологические процессы. Например, эксайтотоксичность, когда в поврежденных клетках накапливается большое количество глутамата, что повышает активацию NMDA-рецепторов и приток кальция. Увеличение концентрации кальция в местах повреждения приводит к незамедлительной гибели нейронов. Ученые задумались об использовании BDNF в качестве биомаркера для диагностики восстановления функций мозга, чтобы проследить за выздоровлением пациентов после инсульта. Им удалось обнаружить увеличение уровня BDNF в поврежденных тканях мозга в течение первой недели после приступа, что может быть связано с процессами нейрогенеза, образования новых нервных клеток в пораженных инсультом местах. А низкая концентрация сывороточного BDNF, наоборот, считается показателем долгого и тяжелого восстановления поврежденных участков, что может сказаться на поправке больного в будущем [18].
Другое острое состояние нервной системы — черепно-мозговая травма (ЧМТ). Вспомним, что ЧМТ представляет собой сильное механическое повреждение костей черепа, мозга и его оболочек. ЧМТ впоследствии приводит к нарушению памяти, мышления, восприятия, резким перепадам настроения, ухудшению мелкой моторики — и даже к дрожанию конечностей. Согласно литературным данным, после ЧМТ в иммунных клетках нервной системы — микроглии — увеличивается экспрессия генов про- и противовоспалительных цитокинов, белковых молекул, стимулирующих иммунный ответ. А также увеличивается образование нейротрофических факторов, способствующих нейропротекции и восстановлению после повреждения [19]. В исследовании российских ученых показано сравнение уровня BDNF до лечения лекарственными препаратами и после. У больных с ЧМТ изучили уровень сывороточного BDNF, который значительно не отличался от группы здоровых людей. После лечения у пациентов с ЧМТ значения BDNF увеличились, что соответствовало улучшению их общего состояния после перенесенной травмы [20].
И, наконец, рассмотрим последний пример необычного нейродегенеративного заболевания — болезнь Хантингтона (БХ). Это наследственное прогрессирующее нейродегенеративное заболевание, характеризующееся хаотичными непроизвольными движениями рук и ног, нарушением походки, невнятностью речи, проблемами с памятью и абстрактным мышлением [21]. Экзотичность заболевания, не побоимся этого слова, заключается в проявлении психиатрических симптомов: тревога, социальная замкнутость, депрессия и импульсивность, — они часто могут присутствовать уже на ранних стадиях заболевания. В ранней диагностике болезни Хантингтона BDNF может являться одним из маркеров. В исследовании Gutierrez сравнивались пробы на BDNF в группе больных БХ и группе здоровых людей. Ученым удалось выявить уменьшение количества нейротрофина в полосатом теле головного мозга у людей, страдающих от этого заболевания, и сделать вывод, что малые концентрации BDNF играют решающую роль в течении болезни Хантингтона [22].
BDNF и физический тренинг
BDNF, будучи вовлеченным в механизм возникновения и развития нейродегенеративных заболеваний, вследствие его нейропротекторного действия стал одним из кандидатов для разработки лекарственных средств, поскольку BDNF способен проникать через гематоэнцефалический барьер [23]. Однако стоит заметить, что на создание лекарственных препаратов порой уходят годы, и последующие их испытания тоже требуют много времени. Тогда, может, существуют другие способы лечения, например, доставка BDNF прямо в нарушенные участки мозга может быть выходом из ситуации? К сожалению, пока нет достоверных сведений об эффективности и безопасности такой терапии при борьбе с нейродегенеративными заболеваниями [24]. Вместе с тем, в настоящий момент физические упражнения широко применяются как простой и проверенный способ восстановления здоровья пациентов, однако в большей степени используются для пациентов с сердечно-сосудистыми заболеваниями.
Сведения о том, что физические упражнения способны быстро (недели—месяцы) увеличивать экспрессию нейротрофических генов, в ходе которой наследственная информация преобразуется в конечный продукт — белок BDNF, как раз-таки смогли заинтересовать исследователей. В связи с чем начали активно проводиться эксперименты на животных, где американские и европейские ученые дали успешный старт работам по взаимосвязи физического тренинга и уровня BDNF.
Для подтверждения зависимости физической нагрузки и уровня BDNF дальнейшие исследования проводились на животных с заболеваниями головного мозга. Так, в исследовании корейских ученых, у крыс, выполняющих упражнение на беговой дорожке, до того, как им вызывали постоянную ишемию головного мозга, очевидно выражается нейропротекторный эффект против ишемического повреждения головного мозга, который проявляется в сохранении нейронов гиппокампа и последующем быстром восстановлении двигательной функции [25].
Впечатляющие результаты в экспериментах на крысах с ишемией мозга смогли дать толчок исследованиям по влиянию физических нагрузок на уровень BDNF уже у человека. Так, в работе российских ученых с участием пациентов, перенесших хирургическое вмешательство на сердце, рассматривалось влияние короткого предоперационного курса физической реабилитации на мозговые функции. Об эффективности курса судили с помощью ряда нейропсихологических тестов для оценки внимания, памяти и мышления. Еще до проведения операции, после окончания курса физической реабилитации сывороточный BDNF значимо увеличился. Однако после проведения операции уровень снизился в течение первых 24 ч и немного увеличился на 7–10 день после операции. По результатам исследования было обнаружено снижение частоты послеоперационных нарушений мозговых функций на треть, что говорит о важности физической нагрузки не только после операции, но и до хирургического вмешательства [26].
Неужели простая физическая нагрузка может решить все проблемы с нарушенными мозговыми функциями? К сожалению, не все так просто. В первую очередь, не вся физическая нагрузка будет нам полезна. В частности, нас интересует аэробная нагрузка. А что значит «аэробная» и почему она имеет такое важное значение? Не поленимся и обратимся к терминологии. Аэробная нагрузка — это те физические упражнения, где кислород используется как основной источник энергии для поддержания мышечной двигательной активности. Отлично, с терминологией разобрались, но какие же упражнения входят в список «аэробные»? Бег, плаванье, большинство командных видов спорта, таких как баскетбол, футбол, волейбол. Также сюда же можно отнести танцы и греблю. Другими словами, все, что подходит под характеристики «ритмичность» и «длительность», будет относиться к аэробной нагрузке. Раз мы упомянули спорт, то стоит рассмотреть исследования, посвященные изучению уровня BDNF у спортсменов. В работе итальянских ученых сравнивали уровни BDNF у профессиональных спортсменов и здоровых нетренированных людей. Выяснилось, что BDNF в сыворотке крови у неспортсменов был значимо ниже, чем у профессиональных спортсменов. В том же исследовании спортсменов разделяли на тех, которые готовились к соревнованиям и тех, кто находился вне соревновательного режима. При сравнении двух групп наблюдались различия в концентрациях BDNF. Как оказалось, группа, готовившаяся к соревнованиям, имела более высокие значения белка [27]. Аналогичные результаты были получены в исследовании ученых из Копенгагенского университета: здоровые испытуемые были случайным образом распределены две группы. В первую группу входили участники, выполнявшие высокоинтенсивные упражнения, вторая группа была контрольной. Перед выполнением упражнений и после них были взяты пробы крови на BDNF. По результатам исследования у первой группы, проходившей комплекс высокоинтенсивных упражнений, концентрации BDNF была выше, чем у контрольной группы [28].
Несомненно, физические нагрузки часто ассоциируется со стройным телом и крепким здоровьем. Однако и тут не стоит забывать, что у всего должна быть норма, и спорт не исключение. Поэтому, чтобы не нанести вред своему здоровью, следует придерживаться некоторых рекомендаций по выполнению физических упражнений. За этот вопрос как раз-таки решила взяться группа ученых из университета Квинсленда. Изучив многочисленные исследования по взаимосвязи уровня BDNF и аэробной нагрузки, им удалось выделить общие рекомендации по выполнению физических упражнений для пациентов с хроническими заболеваниями: сеансы физического тренинга должны проводиться в среднем четыре раза в неделю с продолжительностью занятия не менее 30 минут, при этом интенсивность соответствует 60–70% от максимальной частоты сердечных сокращений. По итогу, эта методика хорошо себя показала у пациентов с инсультом [29]. Однако можно ли утверждать, что такая программа будет действительно эффективной и безопасной для людей с заболеваниями сердца, сказать трудно.
Заключение
Итак, подведем итоги нашего мини-исследования роли нейротрофического фактора BDNF в нервной системе и его связи с физической нагрузкой. Нейротрофин BDNF является своего рода посредником, барьером между нормой и патологией. Его нейропротективные свойства помогают восстановиться поврежденным нейронам при повреждениях или заболеваниях головного мозга. Кроме того, непосредственное участие в процессе миелинизации подтверждает защитную функцию белка. Соотношение BDNF на разных этапах нейродегенеративных заболеваний можно использовать как маркер нормальной деятельности головного мозга, что важно при постановке диагноза и назначении лечения. Связь BDNF и физической нагрузки позволяет нам взглянуть с другой стороны на физические тренинг и реабилитацию.
Прочитав об особенностях BDNF, можно однозначно ответить на вопрос, почему спорт — это жизнь. В первую очередь, конечно, стоит понять, что спорт может и должен быть неотъемлемой частью нашей жизни и, возможно, для кого-то он уже оказывается повседневной привычкой, как чистить зубы по утрам. Поэтому, чтобы ощутить эффект «чудодейственных» возможностей спорта, не забывайте уделять ему время.
Литература
- Y.A. Barde, D. Edgar, H. Thoenen. (1982). Purification of a new neurotrophic factor from mammalian brain.. The EMBO Journal. 1, 549-553;
- Joachim Leibrock, Friedrich Lottspeich, Andreas Hohn, Magdalena Hofer, Bastian Hengerer, et. al.. (1989). Molecular cloning and expression of brain-derived neurotrophic factor. Nature. 341, 149-152;
- Ardem Patapoutian, Louis F Reichardt. (2001). Trk receptors: mediators of neurotrophin action. Current Opinion in Neurobiology. 11, 272-280;
- Фоминова У. Н. (2018). Нейротрофический фактор головного мозга: структура и взаимодействие с рецепторами. Российский психиатрический журнал. 4, 64–72;
- P Roux. (2002). Neurotrophin signaling through the p75 neurotrophin receptor. Progress in Neurobiology. 67, 203-233;
- Devin K. Binder, Helen E. Scharfman. (2004). Mini Review. Growth Factors. 22, 123-131;
- Jessica Fletcher, Simon Murray, Junhua Xiao. (2018). Brain-Derived Neurotrophic Factor in Central Nervous System Myelination: A New Mechanism to Promote Myelin Plasticity and Repair. IJMS. 19, 4131;
- Pei-Cheng Shih, Yea-Ru Yang, Ray-Yau Wang. (2013). Effects of Exercise Intensity on Spatial Memory Performance and Hippocampal Synaptic Plasticity in Transient Brain Ischemic Rats. PLoS ONE. 8, e78163;
- Швайковская А. А. (2020). Нейротрофический фактор мозга (BDNF) и его диагностическая значимость при измерении в крови: аналитический обзор. Якутский медицинский журнал. 3, 105–110;
- Regina L. Leckie, Lauren E. Oberlin, Michelle W. Voss, Ruchika S. Prakash, Amanda Szabo-Reed, et. al.. (2014). BDNF mediates improvements in executive function following a 1-year exercise intervention. Front. Hum. Neurosci.. 8;
- Tanja Novkovic, Thomas Mittmann, Denise Manahan‐Vaughan. (2015). BDNF contributes to the facilitation of hippocampal synaptic plasticity and learning enabled by environmental enrichment. Hippocampus. 25, 1-15;
- Preetha Balakrishnan, Theresa Liebe, Elias Amro, Lajwanti Dhaka, Thorsten Heinzel, Regine Heller. (2019). Metabolic Stress—Signaling and Metabolic Adaptation. The Science of Hormesis in Health and Longevity. 139-148;
- C. Lanni, S. Stanga, M. Racchi, S. Govoni. (2010). The Expanding Universe of Neurotrophic Factors: Therapeutic Potential in Aging and Age-Associated Disorders. CPD. 16, 698-717;
- Aron S. Buchman, Lei Yu, Patricia A. Boyle, Julie A. Schneider, Philip L. De Jager, David A. Bennett. (2016). Higher brain BDNF gene expression is associated with slower cognitive decline in older adults. Neurology. 86, 735-741;
- Bo Yi Kim, Seon Heui Lee, Petra L. Graham, Francesco Angelucci, Alejandro Lucia, et. al.. (2017). Peripheral Brain-Derived Neurotrophic Factor Levels in Alzheimer’s Disease and Mild Cognitive Impairment: a Comprehensive Systematic Review and Meta-analysis. Mol Neurobiol. 54, 7297-7311;
- Лечение болезни Паркинсона нейротрофическими факторами: есть ли свет в конце туннеля?;
- Paula Scalzo, Arthur Kümmer, Thales Lage Bretas, Francisco Cardoso, Antônio Lúcio Teixeira. (2010). Serum levels of brain-derived neurotrophic factor correlate with motor impairment in Parkinson’s disease. J Neurol. 257, 540-545;
- Рославцева В. В. (2015). Возможности применения нейротрофического фактора головного мозга в качестве маркера эффективности терапии при дегенеративном, травматическом и ишемическом поражении головного мозга. Неврологический журнал. 2, 38–36;
- Lucia Schwyzer, José María Mateos, Mathias Abegg, Lotty Rietschin, Lucette Heeb, et. al.. (2002). Physiological and morphological plasticity induced by chronic treatment with NT‐3 or NT‐4/5 in hippocampal slice cultures. Eur J of Neuroscience. 16, 1939-1948;
- Селянина Н. В., Каракулова Ю. В. (2012). Активация репаративных процессов в остром периоде черепно-мозговой травмы под влиянием нейротрофической терапии. Журнал неврологии и психиатрии им. С.С. Корсакова. 112, 46–49;
- Болезнь Хантингтона;
- Ashley Gutierrez, Jody Corey-Bloom, Elizabeth A. Thomas, Paula Desplats. (2020). Evaluation of Biochemical and Epigenetic Measures of Peripheral Brain-Derived Neurotrophic Factor (BDNF) as a Biomarker in Huntington’s Disease Patients. Front. Mol. Neurosci.. 12;
- Weihong Pan, William A Banks, Melita B Fasold, Jonathan Bluth, Abba J Kastin. (1998). Transport of brain-derived neurotrophic factor across the blood–brain barrier. Neuropharmacology. 37, 1553-1561;
- Прямо в мозг: препятствия и способы их преодолеть;
- Kim G., Kim E. (2013). The Effects of Antecedent Exercise on Motor Function Recovery and Brain-derived Neurotrophic Factor Expression after Focal Cerebral Ischemia in Rats. J Phys Ther Sci. 25, 553–556;
- Olga A. Trubnikova, Irina V. Tarasova, Evgeniy G. Moskin, Darya S. Kupriyanova, Yuliya A. Argunova, et. al.. (2021). Beneficial Effects of a Short Course of Physical Prehabilitation on Neurophysiological Functioning and Neurovascular Biomarkers in Patients Undergoing Coronary Artery Bypass Grafting. Front. Aging Neurosci.. 13;
- Kasper Skriver, Marc Roig, Jesper Lundbye-Jensen, Jessica Pingel, Jørn Wulff Helge, et. al.. (2014). Acute exercise improves motor memory: Exploring potential biomarkers. Neurobiology of Learning and Memory. 116, 46-58;
- Christopher P. Mackay, Suzanne S. Kuys, Sandra G. Brauer. (2017). The Effect of Aerobic Exercise on Brain-Derived Neurotrophic Factor in People with Neurological Disorders: A Systematic Review and Meta-Analysis. Neural Plasticity. 2017, 1-9;
- Francesco Donati, Veronica Sian, Giorgia Morgan Biasini, Xavier de la Torre, Fabrizia Folchitto, Francesco Botrè. (2021). Serum Levels of Brain-Derived Neurotrophic Factor and Other Neurotrophins in Elite Athletes: Potential Markers of the Use of Transcranial Direct Current Stimulation in Sport. Front. Sports Act. Living. 3.







