
Часы старения: обнулить, замедлить, обратить вспять?
11 ноября 2014
Часы старения: обнулить, замедлить, обратить вспять?
- 9150
- 1
- 5
Образное представление «часов старения» человека
Статья на конкурс «био/мол/текст»: Организм человека подобен часам. Стрелки постоянно бегут вперед, мы стареем. Устройство часового механизма этих часов очень сложное. Но, несмотря на это, ученым удалось разобраться хотя бы в некоторых принципах его работы. Например, сегодня мы уже научились замедлять процесс старения организма и возвращать старые клетки в «младенческое состояние», хотя платить за это приходится потерей клеточной специализации. Можно ли перевести стрелки часов назад, то есть «омолодить» клетки, сохранив их функции? А как насчет того, чтобы омолодить целый организм? Недавние эксперименты дают ответы на эти вопросы.
Конкурс «био/мол/текст»-2014
 Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор» и отмечена спецпризом Фонда содействия развитию передовых биотехнологий.
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор» и отмечена спецпризом Фонда содействия развитию передовых биотехнологий.
Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Что такое старение
Прежде чем разобраться в процессе омоложения, попытаемся сначала понять, что такое старение . Обычно под старением понимают процесс, при котором постепенно нарушаются и теряются важные функции организма, в том числе способности к размножению и регенерации. Относительно причин старения выдвигались и выдвигаются различные гипотезы, которые делятся на две принципиально отличающиеся смысловые группы. Ученые, приверженцы первой группы, утверждают: процесс старения обусловлен некой (неизвестной) программой, заложенной эволюцией, причем программу эту можно замедлить или сломать. Приверженцы второй группы возражают: никакой специальной программы не существует, однако со временем накапливаются повреждения и поломки во всех структурах организма, что и приводит к старению.
Чуть более подробный разговор на эту тему идет в статье «Старение — плата за подавление раковых опухолей?» [1]. — Ред.
Вне зависимости от правоты тех или других, процессы старения, происходящие на всех уровнях (от молекулярного до организменного), одинаковы для всех. Так, со временем в ДНК возникают мутации, начинает хуже регулироваться экспрессия генов, в клетках накапливаются агрегаты поврежденных белков и липидов. Кроме того, деление клеток происходит реже, и клетки выполняют свои функции менее эффективно, что, в свою очередь, ведет к замедлению регенерации органов, уменьшению мышечной массы, ослаблению иммунитета, снижению умственных способностей и пр. Изменения, перечисленные выше — всего лишь малая толика всех не слишком приятных процессов, которые происходят в стареющем организме. Перечень этих физиологических проблем наводит на невеселые размышления о том, что «прекрасное далеко», несмотря на мольбы, будет жестоко. И ты с тоской смотришь на толстые тома молекулярной биологии, сознавая, как постарел за время их прочтения. Но, дорогой читатель, не спеши отчаиваться! Сотни ученых по всему миру, уже благополучно прошедшие этот путь, теперь трудятся, чтобы вернуть упущенные годы. И надо сказать, они достигли некоторых успехов в своем деле.
«Обнуление» и замедление часов
Одним из немаловажных успехов ученых было увеличение продолжительности жизни их лабораторных любимцев — круглого червя Caernorhabditis elegans, мушки Drosophila melanogaster и лабораторной мыши Mus musculus с помощью индуцированных мутаций в определенных генах или подбором диеты, ограничивающей калории [2].
Исследователи давно экспериментально находят гены, влияющие на продолжительность жизни, и пытаются понять механизм их действия. К настоящему моменту таких генов найдено уже несколько десятков (как в модельных организмах, так и в человеке). Например, продлевают продолжительность жизни лабораторных животных мутации, сделанные в следующих сигнальных путях:
- И/ИФР (сигнальный путь инсулин/инсулиноподобного фактора роста). Каскад реакций, запускающий ингибирование факторов трансляции. Вероятно, эти факторы трансляции регулируют экспрессию генов, увеличивающих продолжительность жизни.
- Путь трансляции белков, включающий mTOR (mammalian target of rapamycin). mTOR регулирует рост клеток, их подвижность, пролиферацию и выживание, а также транскрипцию и синтез белков. Ингибирование mTOR продлевает жизнь.
- Путь с участием AMPK (5′ AMP-activated protein kinase). AMPK — это фермент, который играет роль в поддержании энергетического гомеостаза клетки.
Знаменательно то, что использование подобных приемов продлевало не только жизнь, но и молодость подопытных. Получается, что мы способны экспериментально замедлить ход «часов старения». Но возможно ли часы остановить или, более того, повернуть их стрелки вспять? Следует заметить, что в природе «обнуление» этих часов происходит каждый раз вслед за моментом оплодотворения. Фактический возраст яйцеклетки человека равен возрасту женщины.
Сперматозоид, конечно, возрастом моложе, однако и он успел пройти через ряд клеточных делений. В клетке же, образованной в результате оплодотворения, «возрастной след» родителей отсутствует полностью! Механизмы «обнуления» до сих пор неясны. Но все же понятно, что этот процесс проходит под действием определенных веществ, находящихся в цитоплазме яйцеклетки. Для выживания вида вышеописанный процесс чрезвычайно важен.
Процесс «обнуления» использовал в ранних экспериментах по клонированию Джон Гёрдон. Он извлекал ядро из яйцеклетки шпорцевой лягушки и вместо него помещал ядро мышечной (или кишечной) клетки головастика (рис. 1). Ядро это перепрограммировалось (как и слившиеся ядра яйцеклетки и сперматозоида после оплодотворения) под действием тех же факторов, находящихся в цитоплазме яйцеклетки, что инициируют «обнуление». Такая гибридная клетка развивалась, в итоге, в нормальный организм, без видимых признаков преждевременного старения. Данный эксперимент опроверг гипотезу о том, что процесс взросления и дифференцировки клеток сопровождается потерей генетического материала. К тому же он доказал, что возраст ядра-донора может быть «обнулен» [2].
Широко известны эксперименты лауреата нобелевской премии Синъи Яманаки по получению индуцированных плюрипотентных стволовых клеток (ИПСК). Клетки эти были получены из фибробластов взрослого организма с использованием всего лишь четырех транскрипционных факторов, что стало прорывом в области получения стволовых клеток [2], [5] (рис.1). Прогнозировалась новая эра в области индивидуальной регенерационной медицины. Однако, увы. По ряду причин ИПСК пока не могут быть широко использованы [5–7]:
- ИПСК способны образовывать опухоли из-за своей высокой пролиферативной активности;
- при прохождении через цикл «взрослая клетка — дедифференцировка — ИПСК — дифференцировка — взрослая клетка» иногда проявляются некоторые генетические и эпигенетические нарушения;
- цикл этот занимает около трех недель, и при том процент успешно перепрограммировавшихся клеток невелик (максимальная эффективность — около 0, 01%) [8].
Эксперимент Яманаки также подтвердил гипотезу о том, что часы старения взрослых дифференцированных клеток могут быть «обнулены».
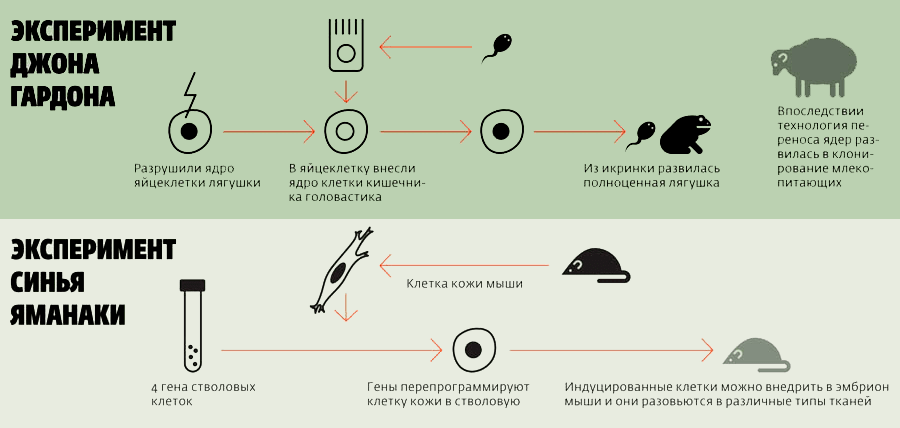
Рисунок 1. Схема уже классических экспериментов: клонирование лягушки Джоном Гёрдоном и получение ИПСК методом Синъя Яманаки
Во всех приведенных выше экспериментах омоложение протекает только совместно с дедифференцировкой (то есть с потерей клеточной специализации). Но возможно ли обратить процесс старения вспять, сохранив при этом специфические клеточные функции?
Омоложение без дедифференцировки
Разными группами ученых были проведены эксперименты, доказавшие возможность омоложения клетки без утраты её специфичности. Более того, к настоящему моменту описано уже три основных способа заставить клетку «вспомнить молодость» [2]:
- Создание «молодого окружения».
- Воздействие на определенные гены.
- Фармакологическое воздействие на клетки.
Первый способ: создание «молодого окружения»
Чтобы понять, способны ли клетки и ткани старой мыши омолодиться под воздействием внешних биологических факторов, был использован гетерохронический парабиоз (ГП) — метод, при котором две мыши — молодая и старая — сшиваются боками (как сиамские близнецы; рис. 2). При этом у мышей создают общую кровеносную систему и пул крови. Супруги Конбой (Irina Conboy и Michael Conboy) еще в 2005 году продемонстрировали, что при ГП к клеткам мышц и печени старой мыши возвращается юность. Они приобретают фенотип молодых клеток, а молекулярные метки старения пропадают [2], [9]. Восстанавливают свой потенциал и тканеспецифичные стволовые клетки мышц. Конбой сообщают, что даже очень старые стволовые клетки не теряют своих способностей восстанавливать и поддерживать ткань, просто надо обеспечить им молодое окружение [10].
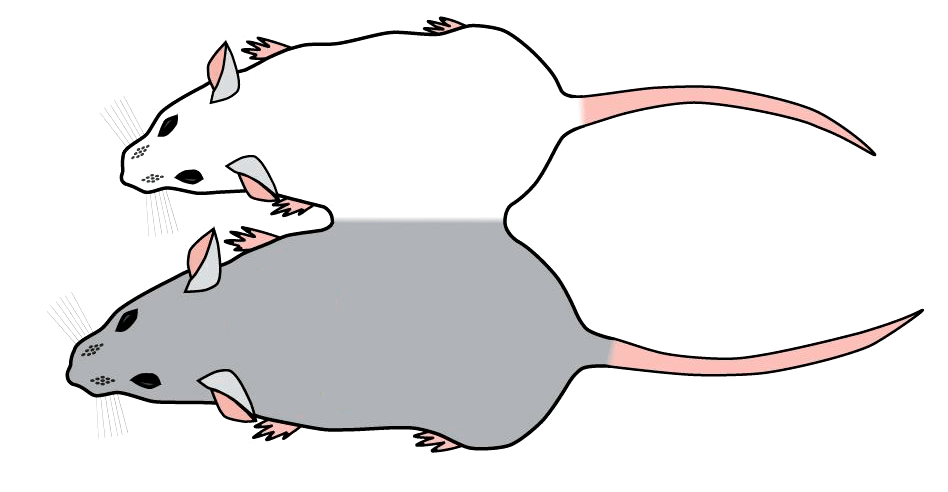
Рисунок 2. Модель гетерохронического парабиоза. Мышей сшивают, создавая единую кровеносную систему.
В 2014 году Гарвардские биологи, используя ГП, выявили ростовой фактор дифференцировки 11 (grow differentiation factor 11, или GDF 11). Журнал Science назвал эту работу первой демонстрацией фактора омоложения, так как GDF11 обладает всеми необходимыми характеристиками: он синтезируется в организме, обращает старение вспять в большинстве тканей и его уровень снижается с возрастом [11].
Биологи из Стэнфорда тоже исследовали модель ГП. Они сосредоточились на эффектах, возникающих при воздействии молодой крови на мозг. Выяснилось, что в определенных областях мозга мыши повысился нейрогенез и уровень пролиферации стволовых клеток, то есть стали появляться новые нейроны, которые в норме появляются только у молодых особей [11], [12]. Интересно, что во всех экспериментах с ГП молодые мыши стареют.
Механизмы описанных выше эффектов на сегодняшний день до конца не ясны. Ученые предполагают, что в эти процессы вовлечены как стволовые клетки, так и различные ростовые факторы, цитокины и др.
Второй способ: воздействие на определенные гены
При изучении молекулярных признаков старения, как правило, бывает не вполне ясно, какие изменения в организме являются собственно старением, а какие его следствием. Чтобы провести подобное разграничение, исследователи обычно используют генетические манипуляции с биохимическими путями. Пример тому — сигнальный путь фактора NF-κB (белкового комплекса, контролирующего транскрипцию ДНК). Он участвует в клеточном ответе на стресс, свободные радикалы, бактерии, вирусы и др. При сравнении старых и молодых тканей у мыши и человека, ученые выявили: в постаревших тканях повышается уровень экспрессии генов, регулируемых сигнальным путем NF-κB. Установление этого факта породило гипотезу о том, что сигнальный путь NF-κB необходим для поддержания возрастного фенотипа. Для проверки этой гипотезы ученые создали трансгенных мышей, в коже которых сигнальный путь NF-κB возможно было ингибировать по желанию экспериментаторов в определенный момент. Когда мыши постарели, и стали заметны такие признаки старения кожи как её истончение, был включен ген ингибитора NF-κB. Это привело к заметному омоложению клеток кожи. При этом маркеры клеточного репликативного старения, такие как p16 (ингибирует клеточное деление), исчезли, а стволовые клетки вернули свою пролиферативную активность и восстановили утратившиеся слои кожи [2].
Третий способ: фармакологическое воздействие на клетки
Вернуть молодость на клеточном и молекулярном уровне возможно путем фармакологического вмешательства. Фермент mTOR распознает уровень питательных веществ в клетке, а также регулирует синтез белков и утилизацию энергии. Было показано, что ингибитор mTOR — рапамицин (препарат, использующийся как иммунодепрессант) — увеличивает продолжительность жизни у мышей. В кроветворной системе старение связано с увеличением активности mTOR в стволовых клетках и клетках-предшественниках. Рапамицин, введенный старым мышам, не только ограничивал возрастное повышение mTOR, но и повышал пролиферацию стволовых клеток [2].
Таким образом, разделить процессы старения и дифференцировки возможно. Осталось только разобраться, чем же различаются механизмы «обнуления» клеток и их омоложения.
Знакомьтесь, эпигенетика
Основные механизмы перепрограммирования клеточного ядра и его дедифференцировки — это объекты, изучаемые эпигенетикой [13]. Эта наука изучает механизмы, которые меняют экспрессию генов, но не затрагивают при этом последовательность ДНК.
Пример. Клетки нашего организма имеют одинаковый генетический материал, но они экспрессируют различные гены, что приводит к клеточной специализации (клетки печени, кости, нейроны). Важно, что эпигенетические механизмы не только «руководят» дифференцировкой, но и постоянно поддерживают специализацию образовавшейся клетки. Дифференцированные клетки многократно делятся и постоянно подвергаются воздействию дестабилизирующих внешних факторов, однако сохраняют свои функции [2]. Несмотря на эпигенетическую устойчивость, описанные выше эксперименты демонстрируют, что статус клеток пластичен и обратим. Изучая динамику перепрограммирования мышиных клеток (фибробластов) в ИПСК, ученые выяснили, что на четвертый—седьмой день в клетках происходит дестабилизация эпигенома.
Но возникновение дестабилизации еще не гарантирует, что клетки перейдут в ИПСК. Если в это самое время устранить факторы перепрограммирования, то клетки обратно превращаются в фибробласты [6]. Исходя из этого, возникла любопытная гипотеза (еще не подтвержденная), объясняющая различие механизмов дедифференцировки и омоложения (рис. 3). При омоложении клетки подвергаются дестабилизирующим факторам недолгое время. Поэтому возрастные эпигенетические метки (как менее устойчивые) стираются, а эпигенетические метки, отвечающие за специализацию клетки, сохраняются. Поэтому клетки возвращаются в исходное состояние. При «обнулении» клетки подвергаются длительному воздействию факторов перепрограммирования. Поэтому все эпигенетические метки, существовавшие до этого в клетке, стираются. Теряются и специализация, и возраст клетки, и она превращается в стволовую. Возможен и третий способ: переход из состояния эпигенетической нестабильности сразу в клетку другого типа. Уже существуют способы превращения фибробластов в кардиомиоциты или в нейроны с использованием всего лишь нескольких транскрипционных факторов [14].
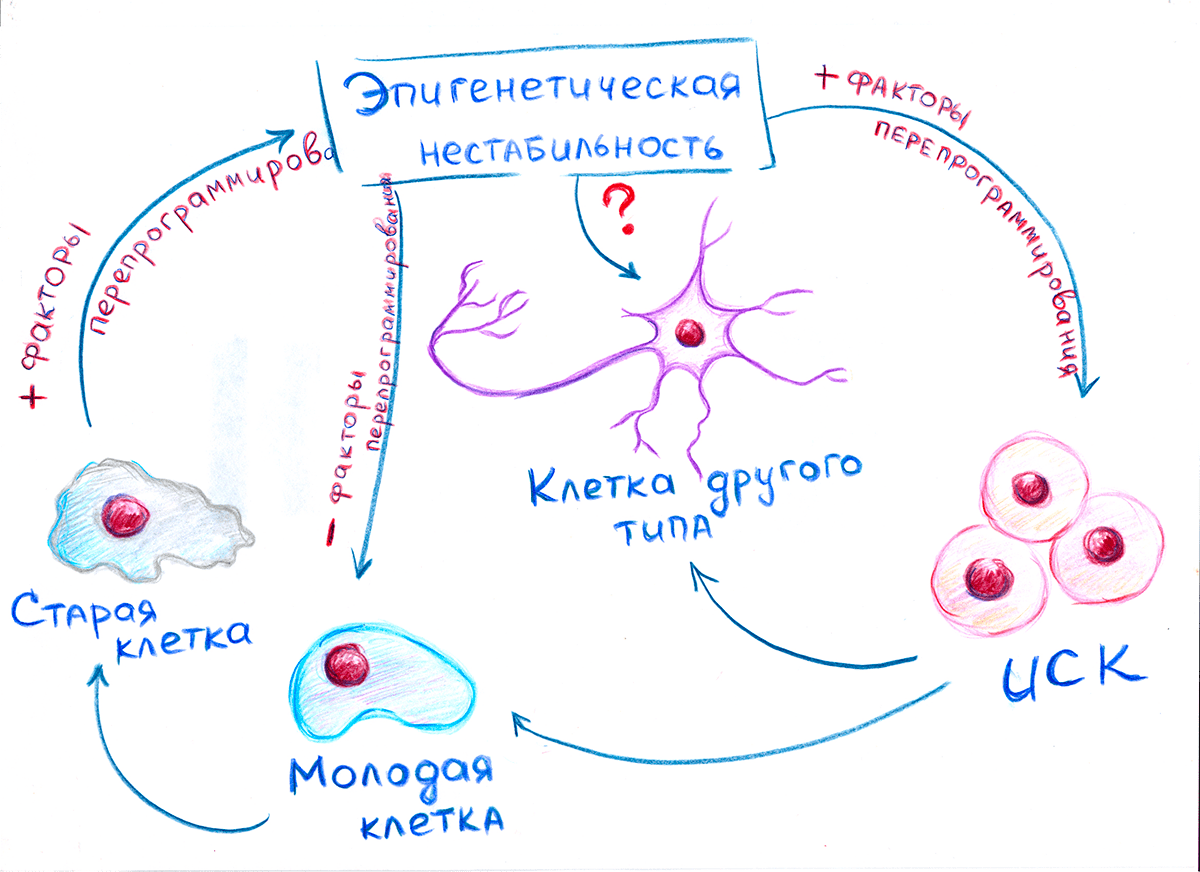
Рисунок 3. Иллюстрация гипотезы, объясняющей различия между процессами омоложения и перепрограммирования клеток. При омоложении клетки подвергаются кратковременному воздействию факторов перепрограммирования, поэтому теряют только те признаки, которые менее устойчивы (возраст). При длительном воздействии этих факторов клетки теряют даже устойчивые признаки клетки (специализацию).
рисунок автора статьи
Заключение
Опыты по омоложению клеток, как и выявление фактора омоложения GDF11, безусловно, впечатляют. Может показаться, что эликсир молодости вот-вот будет изобретен. Но, к сожалению, не так всё просто. Сделанные на сегодняшний день открытия — это лишь самые первые шаги. Ученые далеки от полного понимания механизмов старения и того, каким образом его можно контролировать/регулировать. Не стоит также забывать, что эксперименты проводились на мышах. Будет ли действовать тот же фактор GDF 11 на человека — неизвестно. И, наконец, существует вероятность, что мобилизация стволовых клеток у старых людей инициирует возникновение злокачественных опухолей или других побочных эффектов. Поэтому, если вам предложат омоложения ради испить «настойки из молодой крови» или «коктейль из стволовых клеток», не спешите. Клиники молодости едва ли появятся в ближайшие десять лет. Но если вы хотите быть молодым и крепким уже сейчас, следуйте примеру Джеффри Лайфа (рис. 4), действуйте по-старинке: занимайтесь спортом, бегайте, ешьте овощи и фрукты. Организм перед вами в долгу не останется.

Рисунок 4. Джеффри Лайф, 74-летний бодибилдер. Начал заниматься спортом только в 57 лет. Сейчас он выглядит значительно лучше, чем почти 20 лет назад.
Литература
- Старение — плата за подавление раковых опухолей?;
- Thomas A. Rando, Howard Y. Chang. (2012). Aging, Rejuvenation, and Epigenetic Reprogramming: Resetting the Aging Clock. Cell. 148, 46-57;
- W. Wayt Gibbs. (2014). Biomarkers and ageing: The clock-watcher. Nature. 508, 168-170;
- Эпигенетические часы: сколько лет вашему метилому?;
- Была клетка простая, стала стволовая;
- Maria Manukyan, Prim B. Singh. (2012). Epigenetic rejuvenation. Genes to Cells. 17, 337-343;
- Французским исследователям удалось омолодить клетки столетних людей;
- Снежный ком проблем с плюрипотентностью;
- Irina M. Conboy, Michael J. Conboy, Amy J. Wagers, Eric R. Girma, Irving L. Weissman, Thomas A. Rando. (2005). Rejuvenation of aged progenitor cells by exposure to a young systemic environment. Nature. 433, 760-764;
- Irina M. Conboy, Thomas A. Rando. (2005). Aging, Stem Cells and Tissue Regeneration: Lessons from Muscle. Cell Cycle. 4, 407-410;
- Knoepfler P. (2014). Young Blood’s Anti-Aging Powers in Mice: Perspectives on New Paper. The Niche;
- Jill Bouchard, Saul A. Villeda. (2015). Aging and brain rejuvenation as systemic events. J. Neurochem.. 132, 5-19;
- Развитие и эпигенетика, или История о Минотавре;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- Saul A. Villeda, Tony Wyss-Coray. (2013). The circulatory systemic environment as a modulator of neurogenesis and brain aging. Autoimmunity Reviews. 12, 674-677.







