
Чем новорожденные обязаны рецептору CCR10
01 ноября 2008
Чем новорожденные обязаны рецептору CCR10
- 745
- 4
- 4
Не знаю, проводились ли специальные научные исследования на эту тему, но «в народе» всем известно: дети, вскормленные молоком матери, в течение всей жизни будут более здоровыми, чем те, которым повезло меньше, и которые получали искусственное питание
-
Автор
-
Редакторы
Темы
У детей в течение, по меньшей мере, первого полугода жизни практически не вырабатываются иммуноглобулины A (IgA), ответственные за первичную иммунную реакцию, «встречающую» инфекцию в слизистых оболочках тела. Поэтому чрезвычайно важным считают грудное вскармливание, при котором антитела IgA передаются малышу с материнским молоком, защищая его от болезней в младенчестве. Американские учёные установили, каким образом антителообразующие клетки направленно мигрируют в область слизистой оболочки молочной железы во время лактации: хемотаксис в этом случае основан на взаимодействии хемокинового рецептора CCR10 с хемокином CCL28.
Покровы тела человека, а в особенности слизистая оболочка, непрерывно контактируют с огромным количеством патогенов и токсинов, а значит, иммунная защита слизистых — непременное условие выживания организма. Защита слизистых зависит от эффективного «хоуминга» клеток иммунитета — процесса направленной миграции именно в те ткани и органы, где этим клеткам предстоит выполнять свои функции. Слизистую защищают несколько типов иммунных клеток — «эффекторные» Т-лимфоциты типов αβ и γδ, а также B-лимфоциты, секретирующие антитела и, в первую очередь, иммуноглобулин А (IgA). (Такие лимфоциты называют также плазматическими клетками гуморального иммунитета, плазмоцитами или антителообразующими клетками.) Иммуноглобулин содержится во всех слизистых оболочках тела человека (не только внешних, но и внутренних: например, он секретируется в просвет кишечника), а также в различных жидкостях, выделяемых телом: в слюне, слезах, секрете дыхательных путей и в материнском молоке.
Иммунитет новорожденных называют «наивным» — то есть, он состоит только из набора врождённых реакций и иммуноглобулинов IgG, полученных от матери во время внутриутробного развития (эти антитела, в отличие от IgA, проникают через плаценту). Приобретённый иммунитет, «запоминающий» инфекцию при первом контакте и в дальнейшем не позволяющий болезни развиваться, у новорожденных отсутствует, а их слизистые в течение, по крайней мере, первого полугода жизни не вырабатывают иммуноглобулина A, делая малышей особенно уязвимыми для кишечных инфекций. На этом фоне становится понятной исключительно важная роль грудного вскармливания, во время которого ребёнок может «воспользоваться» антителами матери, поступающими с материнским молоком ему в желудок, и позволяющими ему избежать множества инфекций.
Ключевым моментом в иммунитете — не только клеточном, но и гуморальном, — является хемотаксис, позволяющий лимфоцитам и другим иммунным клеткам перемещаться в нужные ткани и органы. В частности, известно, что антителообразующие клетки мигрируют в слизистые оболочки и кожные покровы, «чувствуя» хемокины CCL28 и CCL27, соответственно. В этом процессе хемокины (называемые также хемотаксическими цитокинами) секретируются тканью, «притягивающей» к себе клетки иммунитета, которые «слышат» этот зов при помощи специальных рецепторов, расположенных в их мембране. (Рецепторы хемокинов принадлежат к крупному семейству G-белоксопряжённых рецепторов, к которому относится и фоторецептор глаза — родопсин [1].) Хотя роль хемотаксиса в миграции плазмоцитов в область слизистых давно не подвергается сомнению, точный механизм, лежащий в основе этого эффекта, до недавнего времени был неизвестен.
Американские учёные решили прояснить ситуацию и установить, какое взаимодействие конкретно отвечает за эту миграцию? «Претендентом» на роль чувствующего химический сигнал рецептора стал хемокиновый рецептор CCR10, подробно охарактеризовать роль которого и взялись исследователи. «Рабочим инструментом» для подобных экспериментов in vivo (т. е., в живом организме) уже давно стал метод генетического нокаута [2], позволяющий получать животных (обычно мышей) с направленно изменённым генотипом. Именно на мышах американцы провели эксперимент, однозначно подтверждающий роль взаимодействия CCL28–CCR10 в хоуминге плазмоцитов в область слизистых, причём — именно в область лактирующей молочной железы [3].
Для эксперимента была получена специальная линия мышей, в которой был «выключен» ген рецептора CCR10 (CCR10−/−), причём это была не просто делеция, поскольку существовали данные, что подобное удаление гена может вызвать развитие неврологических заболеваний, а вставка на его место конструкции, содержащей ген зелёного флуоресцентного белка, что позволяет в данном случае дополнительно судить об успешности встраивания и нормальной активности промотора гена CCR10. (Тут сошлись вместе две «нобелевские» технологии — ведь и за получение трансгенных мышей [2], и за открытие и изучение флуоресцентных белков [4] вручены Нобелевские премии.) Кстати, для большей надёжности в качестве «контрольных» животных выступали не просто мыши «дикого типа», а особи с генотипом CCR10+/+, получавшиеся от скрещивания гетерозиготных трансгенных мышей наравне с CCR10−/− животными.
Самым важным результатом эксперимента стало наблюдение, что в CCR10−/− мышах не происходит миграции антителообразующих клеток в область слизистой молочной железы во время лактации. Это было показано как на срезах молочной железы с помощью иммуноферментного анализа с использованием антитела к IgA (рис. 1), так и при непосредственном подсчёте клеток на проточном цитометре (тут-то и используется новоприобретенная возможность клеток флуоресцировать). Кроме того, потерю способности плазмоцитов к хемотаксису на CCL28 продемонстрировали и in vitro.
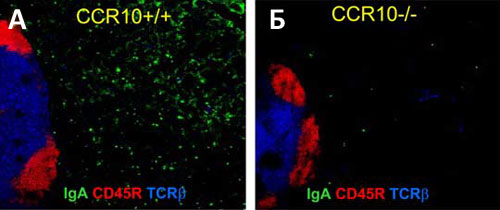
Рисунок 1. Антителообразующие B-лимфоциты CCR10−/− мышей теряют способность мигрировать в слизистую лактирующей молочной железы. На рисунке показана конфокальная микрофотография среза лактирующей молочной железы (на 9-й день после рождения мышат) у «контрольных» CCR10+/+ (А) и лишённых рецептора CCR10 (CCR10−/−) мышей (Б). Препараты иммуногистохимически окрашены флуоресцентно-меченными антителами к IgA (зелёный), общему лейкоцитарному антигену CD45R (красный) и антигенраспознающим рецепторам Т-лимфоцитов TCRβ (синим). В обоих случаях на фотографию попала часть подвздошного лимфатического узла.
Чтобы доказать, что дело именно в потере «чувствительности» клеток к хемокину, а не в каких-либо структурных повреждениях, учёные продемонстрировали, что уровень IgA в сыворотке и кале остался прежним, а также что в слизистой желудка плазмоциты содержатся в том же количестве, что и у контрольных CCR10+/+ мышей. Это, кстати, стало неожиданностью: оказалось, что рецептор CCR10 отвечает за миграцию плазмоцита по градиенту концентрации хемокина CCL28 именно в молочные железы, а для перемещения в слизистую пищеварительной системы существуют какие-то другие механизмы.
Ну и чтобы закрыть уже этот вопрос, исследователи измерили уровень IgA в молоке трансгенных мышей, а также в кале их 9-дневных мышат, и обнаружили, конечно, что столь необходимых защитных антител там практически нет.
«Все слышали, что материнское вскармливание очень хорошо для ребёнка, но мог ли кто-то точно ответить почему? — говорит Эрик Уильсон (Eric Wilson), “старший” по этому исследованию [5]. — Одна из причин тому, несомненно, — защита новорожденного от инфекций с помощью антител, передающихся с материнским молоком, и наша работа объясняет, какие механизмы задействуются в организме матери, чтобы доставить антителообразующие клетки именно туда, куда нужно, — в область протоков молочной железы».
Литература
- Зрительный родопсин — рецептор, реагирующий на свет;
- Нобелевскую премию по физиологии или медицине вручили за технологию нокаутирования мышей;
- O. Morteau, C. Gerard, B. Lu, S. Ghiran, M. Rits, et. al.. (2008). An Indispensable Role for the Chemokine Receptor CCR10 in IgA Antibody-Secreting Cell Accumulation. The Journal of Immunology. 181, 6309-6315;
- Флуоресцирующая Нобелевская премия по химии;
- How Breastfeeding Transfers Immunity To Babies. (2008). ScienceDaily.






