Ревматоидный артрит: изменить состав суставов
23 июня 2017
Ревматоидный артрит: изменить состав суставов
- 36745
- 7
- 18
рисунок Елены Беловой
-
Автор
-
Редакторы
-
Рецензент
-
Иллюстратор
Ревматоидным артритом болеют миллионы человек по всему миру, но в качестве лечения мы можем предложить пациенту только симптоматическую помощь. Остановить или замедлить разрушение суставов и сделать жизнь пациентов максимально комфортной — вот задачи, которые стоят перед научным и медицинским сообществом. Но для этого необходимо глубокое понимание биологии процесса, сковывающего движения пациентов. В этой статье мы попробуем разобраться в медицинских, биологических и социальных вопросах, которые задает нам ревматоидный артрит.
Аутоиммунные заболевания
Мы продолжаем цикл по аутоиммунным заболеваниям — болезням, при которых организм начинает бороться сам с собой, вырабатывая аутоантитела и/или аутоагрессивные клоны лимфоцитов. Мы рассказываем о том, как работает иммунитет и почему иногда он начинает «стрелять по своим». Для соблюдения объективности мы пригласили стать куратором спецпроекта доктора биологических наук, чл.-корр. РАН, профессора кафедры иммунологии МГУ Дмитрия Владимировича Купраша. К тому же у каждой статьи есть свой рецензент, более детально вникающий во все нюансы.
Эту статью рецензировал Григорий Ефимов, к.б.н., заведующий лабораторией трансплантационной иммунологии в ФГБУ «Гематологический научный центр».
Партнеры проекта — Михаил Батин и Алексей Маракулин (Open Longevity / «Объединенные Консультанты Финправо»).
Ревматоидный артрит — тяжелое заболевание, которому подвержено от 0,5 до 2% людей по всему миру (рис. 1) [1]. Неутешительна ситуация и в России: по данным фармацевтической фирмы Roche, ревматоидным артритом болеет около миллиона человек. Женщин среди них большинство: по статистике, они заболевают в пять раз чаще мужчин.
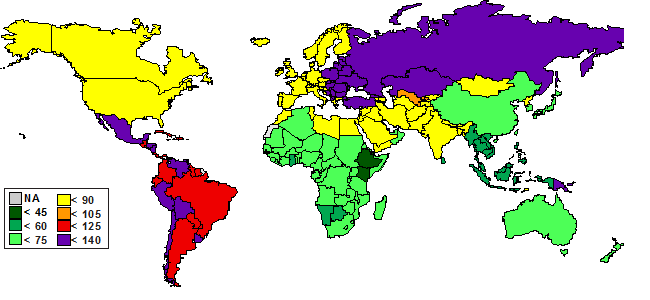
Рисунок 1. Распространенность ревматоидного артрита в мире. Приведены данные по годам жизни, скорректированным по нетрудоспособности (DALY) — показателю, оценивающему суммарное «бремя» болезни.
Артрит — это собирательный термин для обозначения практически любых воспалительных болезней суставов. Соответственно, и причин для развития этого состояния достаточно много. Болезнь, которая называется ревматоидным артритом, обусловлена поражением сустава иммунными клетками, атакующими собственные ткани организма. Из-за этой атаки развиваются отек, избыточное разрастание тканей сустава и в конечном счете его деформация.
Сильные боли в суставах и их малоподвижность приводят к инвалидизации пациентов с ревматоидным артритом. К сожалению, пока не существует «волшебной пилюли», способной вылечить человека с этим диагнозом. Современная медицинская практика предполагает лишь симптоматическое лечение, позволяющее купировать боль и подавлять воспалительную реакцию. К тому же врачам приходится бороться с большим количеством осложнений, сопровождающих болезнь. Например, с почечной недостаточностью и инфекциями — основными причинами смерти пациентов с ревматоидным артритом.
Факторы, приводящие к развитию ревматоидного артрита, до сих пор не до конца известны. Тем не менее понятно, что для того чтобы заболеть, необходимо иметь к этому генетическую и эпигенетическую предрасположенность. Но и этого недостаточно: пусковым фактором для развития ревматоидного артрита у предрасположенных к нему пациентов служит стресс, причем совершенно разного рода — от перенесенной инфекции и переохлаждения до курения и ожирения.
Иммунитет на страже беспорядка: как иммунные клетки разрушают сустав
При ревматоидном артрите наиболее часто поражаются суставы кистей рук — межфаланговые и пястно-фаланговые (схема строения сустава приведена на рисунке 3). Клетки иммунной системы мигрируют в суставную сумку, вызывая ее воспаление, или синовит. Воспаление ведет к разрушению хряща и дальнейшей эрозии костной ткани. Так как хрящевая ткань практически не способна восстанавливаться, а костная в ходе постоянных процессов разрушения и регенерации деформируется, ревматоидные поражения остаются с пациентами на всю жизнь. Характерная картина поражения суставов кисти рук показана на рисунке 4.
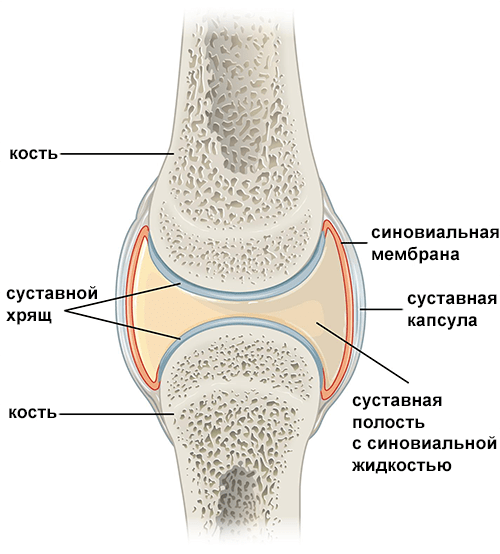
Рисунок 3. Схема строения сустава. Сустав — это подвижное соединение костей скелета, позволяющее им совершать движения относительно друг друга. Поверхности костей, входящие в сустав, покрыты хрящевой тканью. Между ними находится суставная полость, содержащая синовиальную жидкость — «смазочный материал» для предотвращения взаимного трения поверхностей хрящей, а также для питания и увлажнения сустава. Весь сустав снаружи заключен в суставную сумку. Наружный слой сумки, образованный плотной волокнистой соединительной тканью, защищает сустав от внешних воздействий. Кроме того, к нему прикрепляются связки, отвечающие за подвижность сустава. Внутренний слой суставной сумки, который называется синовиальной оболочкой, выстилает всю внутреннюю поверхность сустава за исключением хрящей и отвечает за выработку суставной жидкости. Этот слой обильно иннервирован и снабжен кровеносными сосудами, осуществляющими обмен веществ.
сайт philschatz.com
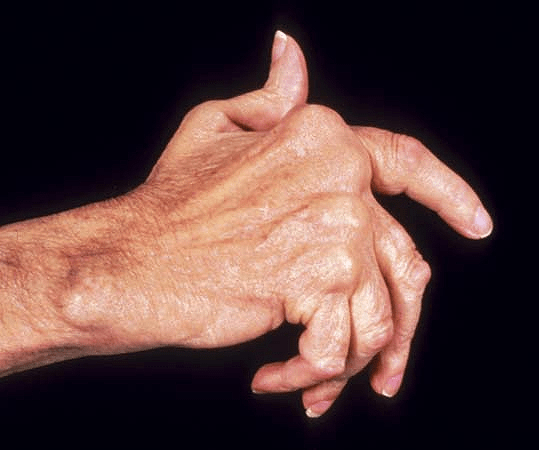
Рисунок 4. «Ревматоидная кисть» — характерная деформация суставов кисти руки при ревматоидном артрите. Именно она позволяет отличить ревматоидный артрит от аналогичных поражений конечностей при других заболеваниях, например, псориатическом артрите и системной красной волчанке.
сайт mediklive.ru
Для того чтобы началась «оккупация» (инфильтрация) сустава иммунными клетками, в синовиальной оболочке должны произойти функциональные изменения. Эндотелий сосудов начинает производить молекулы адгезии, необходимые для закрепления проплывающих мимо лейкоцитов и их проникновения из сосудистого русла в ткань. Кроме того, происходит разрастание сосудистой системы (неоангиогенез), что также помогает усиленной инфильтрации сустава иммунными клетками [3]. Освежить знания по строению и функционированию иммунной системы можно, обратившись к вводной статье цикла «Иммунитет: борьба с чужими и... своими» [4].
Фибробласты синовиальной сумки тоже активируются. Они становятся подвижными, теряют способность останавливать свое деление при контакте с другими клетками (так называемое контактное ингибирование) и избегают клеточной гибели (апоптоза). Это происходит из-за мутаций в генах опухолевых супрессоров — например, p53 [5], — а также из-за повышения продукции белка синовиолина, способного регулировать экспрессию p53, и стрессовых молекул, включая белки теплового шока.
Кроме того, фибробласты начинают производить большие количества матриксных металлопротеиназ и провоспалительных хемокинов — цитокинов, привлекающих иммунные клетки. Матриксные металлопротеиназы — специальные ферменты, способные расщеплять белковые компоненты внеклеточного матрикса. Они разрушают коллагеновые сети, составляющие основу хряща [6]. Тканевых ингибиторов металлопротеиназ, тоже вырабатываемых фибробластами, оказывается недостаточно для остановки лавинообразного процесса разрушения сустава.
Иммунные клетки, привлекаемые цитокинами, инфильтрируют синовиальную оболочку сустава. В таком иммунном инфильтрате присутствуют Т- и В-лимфоциты, макрофаги, нейтрофилы, тучные клетки и другие клетки врожденного иммунитета.
Несмотря на обилие в пораженном суставе Т-клеток, их функциональная роль до сих пор малопонятна. Попытки лечения пациентов путем прямого подавления активности Т-лимфоцитов (например, с помощью иммуносупрессанта циклоспорина) оказались неэффективны. Это может объясняться тем, что в патогенезе ревматоидного артрита принимают участие разные субпопуляции Т-лимфоцитов, чьи эффекты могут быть диаметрально противоположными. С одной стороны, иммуносупрессанты подавляют, как это и нужно, активность Т-хелперов первого типа (Th1) и Th17-лимфоцитов, которые выделяют множество провоспалительных цитокинов, усиливающих воспаление и привлекающих всё новые иммунные клетки в сустав. С другой стороны, они точно так же подавляют дифференцировку и функциональность регуляторных Т-клеток, которые могли бы остановить воспалительную реакцию.
В то же время использование абатацепта — препарата на основе молекулы CTLA-4 (не путать с терапевтическими антителами к ней [7]), блокирующего костимулирующий сигнал между лимфоцитом и антигенпрезентирующей клеткой, — оказалось достаточно успешным. Такого эффекта можно было ожидать, ведь в синовиальной оболочке достаточно много дендритных клеток, способных активировать Т-лимфоциты.
Свой вклад в «запутывание» роли Т-лимфоцитов может вносить динамика заболевания. Дело в том, что Т-клетки важны для запуска аутоиммунного процесса, однако позже, когда в воспалительный каскад вовлекаются всё новые и новые иммунные клетки (например, макрофаги), они отходят на второй план. Лечение же препаратами, нацеленными на Т-лимфоциты, начинается только после появления симптомов, то есть уже на втором этапе заболевания. Неудивительно, что при такой запаздывающей стратегии они оказываются неэффективными.
В-клетки и плазматические клетки синовиальной оболочки также участвуют в патогенезе ревматоидного артрита. Как правило, В-клетки образуют с Т-клетками особым образом пространственно организованные скопления, называемые третичными лимфоидными структурами. Напоминая по строению лимфоузлы, они осуществляют ту же функцию: способствуют встрече антигенпрезентирующих клеток с лимфоцитами и дальнейшему их созреванию. В роли антигенпрезентирующей клетки может выступать и сам В-лимфоцит. Кроме того, В-клетки синтезируют провоспалительные цитокины, чем дополнительно поддерживают работу патологического каскада.
Аутоантитела, продуцируемые В-лимфоцитами, уже много лет используются в качестве биомаркеров в диагностике ревматоидного артрита. Но их нельзя воспринимать лишь как «немых свидетелей» заболевания — они вносят вклад в его развитие и даже называются артритогенными. Как всё происходит, пока не совсем ясно, однако корреляция темпов развития болезни с уровнем в крови таких антител надежно установлена. Антитела (как правило, класса IgM) к собственным иммуноглобулинам класса IgG называют ревматоидным фактором (РФ). Это одно из проявлений нарушения толерантности к собственным антигенам, которым и характеризуется аутоиммунный процесс. Считается, что РФ образует с IgG макроскопические иммунные комплексы, которые наносят механические повреждения стенкам сосудов и синовиальным оболочкам, однако это не единственный возможный механизм патогенного действия РФ.
В сыворотке крови пациентов с ревматоидным артритом часто обнаруживают и антитела к циклическому цитруллинированному пептиду (АЦЦП). Цитруллин — это одна из аминокислот в организме, которая не кодируется в ДНК специфическим кодоном, а образуется из аргинина уже после синтеза белка (схема реакции представлена на рисунке 5). Замена аргинина на цитруллин влияет на химические свойства белка и делает его более гидрофобным, что сказывается на его пространственной структуре. Такие необычно свернутые белки могут быть замечены иммунной системой, и к ним образуются аутоантитела. Во многих белках синовиальной жидкости, включая фибрин и фибриноген, есть аргининовые остатки, которые в условиях воспаления модифицируются в цитруллин и вызывают аутоиммунный ответ. Согласно последним данным, РФ и АЦЦП усиливают действие друг друга [8].

Рисунок 5. Схема цитруллинирования белков. В реакции принимают участие ферменты деиминазы, заменяющие кетоиминовую группу аргинина (=NH) на кетоновую (=O).
сайт www.cytoskeleton.com
Макрофаги — основные продуценты провоспалительных цитокинов, ответственных за развитие синовита. Кроме того, они синтезируют активные формы кислорода и азота, а также ферменты, разрушающие межклеточный матрикс. Этим же занимаются и другие клетки врожденного иммунитета, присутствующие в воспаленном суставе, — например, нейтрофилы и тучные клетки. Но всё же пальму первенства в запуске воспаления следует отдать макрофагам.
Коктейль из провоспалительных цитокинов запускает дифференцировку остеокластов, осуществляющих резорбцию кости, то есть попросту разрушающих ее. Под воздействием противовоспалительных препаратов этот процесс удается замедлить, но вернуть кости первоначальный облик невозможно, так как она не в состоянии регенерировать с сохранением прежней архитектуры.
Орел или решка: генетическая и эпигенетическая предрасположенность к заболеванию ревматоидным артритом
Ревматоидный артрит — комплексное заболевание, на развитие которого влияют как генетические факторы, так и факторы окружающей среды. Полногеномный поиск ассоциаций [9] показал, что существенное влияние на возникновение и развитие этого заболевания оказывают определенные варианты генов, регулирующих работу иммунной системы.
Сильнее всего на предрасположенность к ревматоидному артриту влияют гены главного комплекса гистосовместимости. Как мы помним из первой статьи этого цикла [4], именно кодируемые этими генами белки отвечают за презентирование антигена Т-лимфоцитам. Какие-то их варианты могут осуществлять этот процесс эффективнее в отношении собственных антигенов, способствуя тем самым запуску аутоиммунного процесса. Одним из самых интересных в этом отношении считается ген HLA-DRB1 [10], чья связь с ревматоидным артритом давно известна. Он кодирует компоненты поверхностного рецептора HLA-DR антигенпрезентирующих клеток, взаимодействующего с Т-клеточным рецептором. Различные аллели этого гена — например, кодирующие белки с аминокислотным мотивом QKRAA, — связаны с наибольшей предрасположенностью к заболеванию [11]. К самым «неблагоприятным» относят варианты из семейства DRB1*04 (определяющие серотип HLA-DR4) [12].
Аллельные варианты генов множества белков, вовлеченных в активацию Т-лимфоцитов, также отвечают за предрасположенность их носителей к ревматоидному артриту. Среди таких белков — молекулы, связанные с костимулирующим сигналом (CD28, CTLA-4), провоспалительные цитокины и их рецепторы (IL2, IL2RA, IL21), необходимые для функционирования Т-клеток, а также различные ферменты — важные внутриклеточные игроки в активации лимфоцитов (PTPN22, PRKCQ, TAGAP). Взаимодействие специфических аллельных вариантов разных генов (например, HLA-DRB1 и PTPN22) увеличивает вероятность заболевания [13].
Эпигенетические механизмы тоже могут регулировать работу иммунной системы, повышая риск развития ревматоидного артрита. Действие регуляторных РНК, модификации гистонов или ДНК могут приводить к изменению привычного «графика» работы ключевых генов, вовлеченных в патогенез.
Некоторые факторы окружающей среды увеличивают вероятность заболевания у людей, имеющих ассоциированные с ревматоидным артритом аллели. К таким факторам относят, например, курение [14]. Это связано с тем, что курение — серьезный стресс для дыхательной системы, который может повышать уровень посттрансляционных модификаций белков, в том числе и цитруллинирования. А, как мы помним, подобные неординарные белки и становятся антигенами в аутоиммунном процессе. Например, цитруллинированную форму α-енолазы можно найти примерно у 50% АЦЦП- положительных пациентов.
Инфекция — чека для запуска ревматоидного артрита
Инфекционные агенты — вирусы и бактерии — могут способствовать развитию ревматоидного артрита, причем, по-видимому, многими способами. Наиболее известный механизм — так называемая молекулярная мимикрия. Некоторые молекулы — чаще всего пептиды, входящие в состав микроба, — могут иметь структуру, схожую со структурой собственных биомолекул организма. Во время инфекции иммунная система распознает такие молекулы как чужеродные и эффективно борется с их носителями, но после нападает на клетки собственного организма, содержащие похожие антигены. В случае с ревматоидным артритом так может происходить, например, при заражении вирусом Эпштейна-Барр [15], цитомегаловирусом, кишечной палочкой и различными протеями.
Кроме того, при инфекционном заболевании образуются иммунные комплексы, состоящие из антигенов и специфических к ним антител. Если комплексов много, то такие антитела сами могут стать антигенами. Антитела против антител и есть тот самый ревматоидный фактор, о котором мы говорили ранее.
Инфекционные агенты могут и напрямую способствовать развитию ревматоидного артрита. Недавно было показано, что гигиена ротовой полости может влиять на заболеваемость ревматоидным артритом [16]. Дело в том, что бактерия, вызывающая пародонтоз, Porphyromonas gingivalis, способна синтезировать деиминазу и, соответственно, принимать участие в цитруллинировании белков хозяина, то есть человека.
Всё больше данных указывает на то, что состав микробиоты кишечника — еще один важный фактор, влияющий на вероятность развития ревматоидного артрита [17], [18], [19]. В модельных системах удалось убедительно показать, что определенные виды бактерий ассоциированы с ревматоидным артритом. Возможно, в недалеком будущем нас ждет разработка специальной диеты, позволяющей держать их под контролем и этим снижать риск развития аутоиммунитета.
Нельзя вылечить, но можно облегчить. Современные стратегии лечения ревматоидного артрита
Раз четкую мишень аутоиммунного процесса при ревматоидном артрите найти не удается, то и специфического лечения разработать пока нельзя. Можно лишь достаточно надежно купировать воспаление и стараться максимально долго поддерживать у пациента состояние ремиссии. Основные современные стратегии лечения направлены на подбор максимально эффективных противовоспалительных препаратов [20]. Ниже пойдет речь о различных их вариантах.
Нестероидные противовоспалительные препараты (НПВП), такие как ибупрофен и напроксен, уменьшают воспаление и снижают болевые ощущения. Они подавляют активность ферментов циклооксигеназ, которые способствуют выработке простагландинов — веществ, повышающих чувствительность рецепторов к медиаторам боли. К сожалению, у НПВП, как и у любого лекарства, есть побочные эффекты. В результате длительного приема этих препаратов (особенно если они не селективные — Ред.) может развиться поражение слизистой оболочки желудка и двенадцатиперстной кишки, что приведет к образованию язв и кровотечениям. Диарея и тошнота также иногда могут сопровождать лечение. Кроме того, подавление выработки простагландинов отрицательно сказывается на функционировании эпителия сосудов, что может привести к инфаркту миокарда, тромбозам и — из-за снижения почечного кровотока — к острой почечной недостаточности.
Кортикостероиды — еще один класс препаратов, уменьшающих воспаление и боль. К ним относится, например, преднизолон. Эти лекарства сильнее НПВП и, соответственно, имеют более серьезные и частые побочные эффекты, такие как сахарный диабет 1 типа [21], ожирение и ломкость костей, вызванная потерей ими кальция. В силу этого кортикостероиды назначают только тогда, когда выраженность симптомов ревматоидного артрита усиливается, а старые методы снятия боли уже плохо помогают.
Как обособленную терапевтическую группу обычно рассматривают так называемые базисные противовоспалительные препараты (БПВП). Очень важно для достижения наилучших отдаленных результатов, чтобы пациент начал принимать эти препараты как можно раньше. Дело в том, что эти средства обладают иммуносупрессивными свойствами, то есть способностью подавлять активность и деление иммунных клеток, а также клеток сустава. Соответственно, аутоиммунный процесс, в буквальном смысле съедающий пораженный ревматоидным артритом сустав, может быть ограничен на ранней стадии. Самыми распространенными и эффективными препаратами из БПВП являются метотрексат, лефлуномид и сульфасалазин.
Эффект от приема БПВП наблюдается у 60% пациентов с ревматоидным артритом, но развивается он очень медленно, поэтому курс приема препарата длится минимум шесть месяцев. Если же за время терапии больной не почувствовал улучшения, то ему, как правило, назначают комбинированное лечение сразу несколькими БПВП. Однако с этой тактикой нужно быть осторожным, так как она заметно повышает вероятность побочных эффектов.
Побочные эффекты БПВП, как правило, затрагивают желудочно-кишечный тракт и кроветворную систему. Дело в том, что БПВП подавляют пролиферацию наиболее активно делящихся клеток нашего организма, то есть иммунных клеток (на чём и основан их терапевтический эффект), но также и других клеток крови (например, мегакариоцитов, из которых образуются тромбоциты, и эритроцитов) и клеток эпителия кишечника, страдающих совершенно незаслуженно.
Биологические препараты — сравнительно новый метод лечения ревматоидного артрита. Они представляют собой антитела или же растворимые рецепторы и благодаря этому могут целенаправленно блокировать определенные молекулы, вовлеченные в развитие ревматоидного артрита. Такими «молекулами-мишенями» могут служить провоспалительные цитокины и рецепторы на поверхности иммунных клеток (рис. 6).
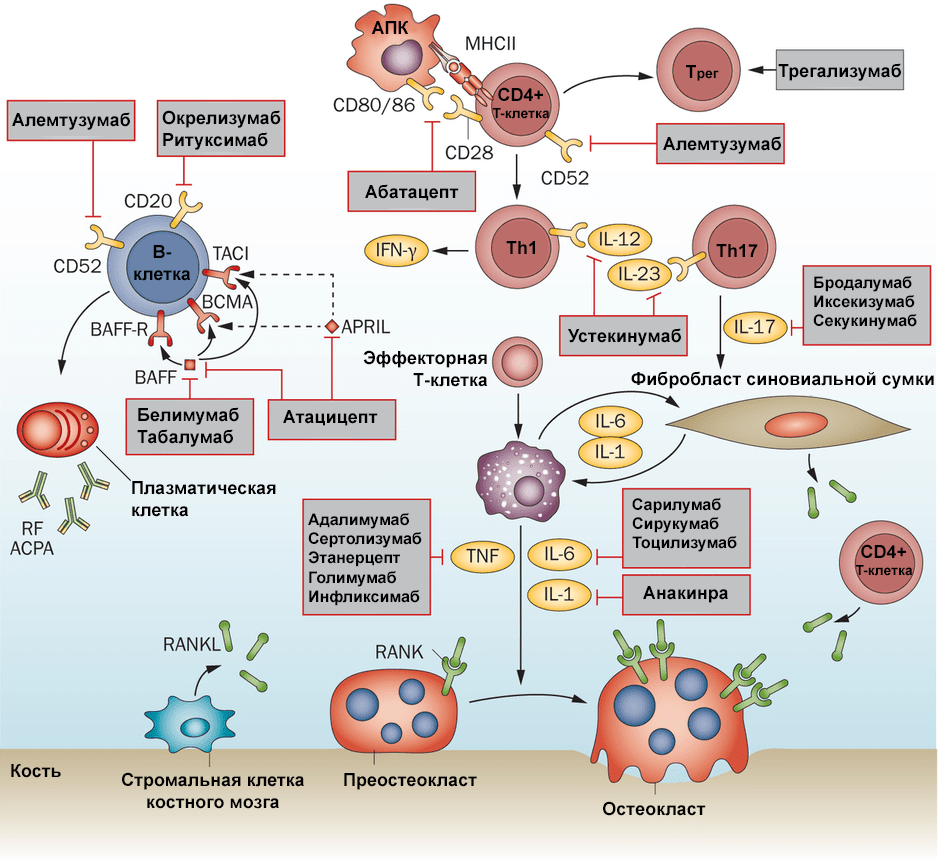
Рисунок 6. Схема иммунного ответа и основные биологические препараты, которые можно использовать в лечении ревматоидного артрита. Чтобы увидеть рисунок в полном размере, нажмите на него.
сайт www.nature.com
Наиболее распространены препараты, блокирующие провоспалительные цитокины, — антитела к фактору некроза опухолей (ФНО), интерлейкину-6 и интерлейкину-1. К первым относятся, например, инфликсимаб и адалимумаб — моноклональные антитела, связывающие ФНО. Для блокировки ФНО используют и этанерцепт — препарат, состоящий из растворимого рецептора ФНО и Fc-фрагмента антитела (IgG1). Терапевтическое антитело тоцилизумаб блокирует рецептор интерлейкина-6, что также способствует снижению воспаления. Анакинра — генно-инженерная версия белка IL1-RA, естественного антагониста рецептора интерлейкина-1. Присоединяясь к рецептору, анакинра блокирует проведение через него сигнала и, следовательно, запуск воспалительной реакции.
Как уже могли догадаться читатели, в терапии ревматоидного артрита просто невозможно было не воспользоваться средствами, блокирующими костимулирующий сигнал Т-клетке от антигенпрезентирующих клеток. На этом основано действие упомянутого ранее абатацепта, состоящего из молекулы CTLA-4 (блокатора костимулирующих молекул на поверхности антигенпредставляющих клеток) и Fc-фрагмента IgG1.
Поскольку не последнюю роль в патогенезе ревматоидного артрита играют В-клетки, то подавление их активности также может быть достаточно эффективной стратегией лечения. Применение ритуксимаба, препарата на основе моноклональных антител к CD20, приводит к селективному удалению зрелых В-клеток (плазматические клетки, вырабатывающие антитела, не затрагиваются) и уменьшению воспаления.
Применение биологических препаратов в сочетании с БПВП взаимно усиливает их терапевтический эффект, поэтому именно эти две группы препаратов стали самыми значимыми в лечении ревматоидного артрита. Увы, так обстоят дела не во всех странах. Высокая цена биологических препаратов сильно тормозит их повсеместное применение. В России стоимость, например, инфликсимаба составляет около 50 тыс. рублей за 100 мг. Этого недостаточно даже в качестве начальной дозы при лечении, которое предполагает получение пациентом препарата как минимум каждые два месяца в течение года и более [20].
К сожалению, биологические препараты тоже не лишены серьезных побочных эффектов, в первую очередь связанных с отсутствием селективности в блокировке молекул, важных для эффективного иммунного ответа. Применение таких препаратов может вызвать ослабление адекватного иммунного ответа при инфекции. Практически все биологические препараты содержат фрагменты антител, а это может вести к развитию аутоиммунного ответа, в котором они будут играть роль антигенов. Адресное действие и снижение иммуногенности самих лекарств — одни из важнейших задач, которые можно будет решить с помощью новых подходов к разработке биологических препаратов.
Постоянное наблюдение за пациентом с ревматоидным артритом и своевременное изменение стратегии лечения в случае неэффективности того или иного препарата может годами и даже десятилетиями поддерживать состояние ремиссии. Без должного лечения воспаление и связанные с ним симптомы развиваются достаточно быстро, и это может довести до хирургического удаления пораженных суставов.
Новые лекарства — минимум нежелательных реакций при максимуме эффективности
Применение биологических препаратов оказалось самым эффективным методом лечения ревматоидного артрита, однако серьезные побочные эффекты, связанные с системностью их действия, заставляют ученых разрабатывать новые лекарства. Следующей ступенью в эволюции терапии ревматоидного артрита могут стать селективные блокаторы воспаления, лишенные этого недостатка.
В лаборатории Сергея Артуровича Недоспасова, находящейся в Институте молекулярной биологии РАН (Москва), этой проблемой занимаются уже более 10 лет. Одним из возможных способов ее решения ученые считают создание препарата, который блокирует ключевой провоспалительный цитокин, ФНО, продуцируемый лишь определенным типом клеток, например, макрофагами. Такая избирательная нейтрализация позволит снизить воспаление, связанное с ревматоидным артритом, но не повлияет на способность организма противостоять инфекциям.
Для решения этой задачи была получена биспецифическая молекула, которая состоит из антитела, блокирующего ФНО, и второго антитела, связывающегося с молекулой F4/80 на поверхности макрофагов мыши [22]. При создании такой конструкции ученые использовали полученные из ламы и верблюда однодоменные антитела, о биоинженерии которых рассказано в статье Оксаны Горяйновой «От рака вылечит... верблюд!» [23]. Эксперименты на мышах показали, что такие антитела действительно справляются со своей задачей. Конечно, до применения подобных препаратов в лечении реальных пациентов еще очень далеко, но первые шаги на пути к этому уже сделаны.
Пациентские организации
Информационная поддержка, юридическая помощь пациентам, помощь в получении консультаций специалистов, реабилитации, необходимых лекарств — вот несколько направлений деятельности пациентских организаций. Кроме того, общественная организация может стать площадкой для общения и взаимоподдержки пациентов.
В России такой организацией является Российская ревматологическая ассоциация «Надежда». На ее базе во многих городах страны регулярно проходят школы и конференции для пациентов с различными ревматологическими заболеваниями, включая ревматоидный артрит. Кроме того, основная деятельность организации направлена на разработку памяток для пациентов и распространение их как в печатном виде, так и в интернете.
Интернет-форумы — еще один формат общения пациентов. В Рунете существует ресурс revmatikov.net, на котором пациенты могут поделиться историей своей болезни, оставить отзыв о лечебном учреждении и конкретном враче, получить бесплатную консультацию специалистов, узнать о последних методах лечения и даже купить необходимое лекарство. Для многих пациентов, вынужденных из-за болезни вести маломобильный образ жизни, такие форумы становятся жизненно необходимой площадкой для общения единомышленников.
Как минимум одна пациентская организация для больных ревматоидным артритом существует почти в каждой цивилизованной стране. Сайты американских организаций — отличный пример информационного портала, на котором пациенты могут найти всю необходимую информацию о течении заболевания, методах его лечения и диагностики. Вот адреса некоторых удачных проектов, посвященных ревматоидному артриту:
- Американская общественная организация Arthritis Foundation;
- Американский колледж ревматологии;
- Система поддержки пациентов с ревматоидным артритом;
- Центр для пациентов с ревматоидным артритом при университете Джонса Хопкинса.
На сегодняшний день при своевременной диагностике и адекватном лечении пациент с ревматоидным артритом может вести активный образ жизни достаточно долго, а новые научные разработки помогут ему делать это еще дольше.
Литература
- Shimek K.J. (2011). Rheumatoid arthritis — an analysis of the global clinical development. Сайт kjshimek;
- Pouya Entezami, David A. Fox, Philip J. Clapham, Kevin C. Chung. (2011). Historical Perspective on the Etiology of Rheumatoid Arthritis. Hand Clinics. 27, 1-10;
- Iain B. McInnes, Georg Schett. (2011). The Pathogenesis of Rheumatoid Arthritis. N Engl J Med. 365, 2205-2219;
- Иммунитет: борьба с чужими и… своими;
- G Salvador. (2005). p53 Expression in rheumatoid and psoriatic arthritis synovial tissue and association with joint damage. Annals of the Rheumatic Diseases. 64, 183-187;
- Кто рубит коллагеновый лес;
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Carolin Hecht, Matthias Englbrecht, Jürgen Rech, Sarah Schmidt, Elizabeth Araujo, et. al.. (2015). Additive effect of anti-citrullinated protein antibodies and rheumatoid factor on bone erosions in patients with RA. Ann Rheum Dis. 74, 2151-2156;
- GWAS и психогенетика: консорциумы в поисках ассоциаций;
- S. Kerlan-Candon, B. Combe, R. Vincent, J. Clot, V. Pinet, J. -F. Eliaou. (2001). HLA-DRB1 gene transcripts in rheumatoid arthritis. Clin Exp Immunol. 124, 142-149;
- Peter K. Gregersen, Jack Silver, Robert J. Winchester. (1987). The shared epitope hypothesis. an approach to understanding the molecular genetics of susceptibility to rheumatoid arthritis. Arthritis & Rheumatism. 30, 1205-1213;
- Fugger L. and Svejgaard A. (2000). Association of MHC and rheumatoid arthritis. HLA-DR4 and rheumatoid arthritis: studies in mice and men. Arthritis Res. 2, 208–211;
- Daniela Di Giuseppe, Andrea Discacciati, Nicola Orsini, Alicja Wolk. (2014). Cigarette smoking and risk of rheumatoid arthritis: a dose-response meta-analysis. Arthritis Res Ther. 16, R61;
- Júlia Kurkó, Timea Besenyei, Judit Laki, Tibor T. Glant, Katalin Mikecz, Zoltán Szekanecz. (2013). Genetics of Rheumatoid Arthritis — A Comprehensive Review. Clinic Rev Allerg Immunol. 45, 170-179;
- От поцелуя до лимфомы один вирус;
- Ted R. Mikuls, Jeffrey B. Payne, Fang Yu, Geoffrey M. Thiele, Richard J. Reynolds, et. al.. (2014). Periodontitis andPorphyromonas gingivalisin Patients With Rheumatoid Arthritis. Arthritis & Rheumatology. 66, 1090-1100;
- Микробиом кишечника: мир внутри нас;
- Зоопарк в моем животе;
- Xuan Zhang, Dongya Zhang, Huijue Jia, Qiang Feng, Donghui Wang, et. al.. (2015). The oral and gut microbiomes are perturbed in rheumatoid arthritis and partly normalized after treatment. Nat Med. 21, 895-905;
- Каратеев Д.Е. (2007). Современная медикаментозная терапия ревматоидного артрита. Лечащий врач. 2;
- Сахарный диабет I типа, или Охота на поджелудочную железу;
- Grigory A. Efimov, Andrei A. Kruglov, Zoya V. Khlopchatnikova, Fedor N. Rozov, Vladislav V. Mokhonov, et. al.. (2016). Cell-type–restricted anti-cytokine therapy: TNF inhibition from one pathogenic source. Proc Natl Acad Sci USA. 113, 3006-3011;
- От рака вылечит... верблюд!.