
Дизайнер промахнулся!
05 декабря 2008
Дизайнер промахнулся!
- 1443
- 8
- 1
Ом Хеллинга широко известен благодаря своим работам по дизайну ферментов. L. TODD/DUKE PHOTOGRAPHY
-
Автор
-
Редакторы
Солидный ученый, аспирантка и две отозванные статьи. Мы публикуем перевод материала Эрики Гайден, который посвящён случаю, получившему широкий резонанс в научном сообществе.

Рисунок 1. Мэри Двайер была обвинена Хеллингой — её бывшим научным руководителем — в фальсификации результатов
лаборатория Дональда МакДоннела
Когда Мэри Двайер (Mary Dwyer; рис. 1) искала научного руководителя для своей аспирантской работы, Ом Хеллинга (Homme Hellinga) был одним из первых среди рассматриваемых кандидатур. Биохимик из Медицинского Центра Университета Дюка в Дурхаме (Северная Каролина) имел ряд новаторский идей и предлагал весьма интересную научно-исследовательскую программу. Он также разделял интересы Двайер в области поиска взаимосвязей между структурой и функцией белков. Однако аспиранты, уже работавшие в лаборатории Хеллинги, предупреждали её, что работа здесь может «оказаться ей не по зубам», да и вообще, — вокруг много хороших лабораторий. В качестве аргументов ей, в частности, приводили, что куда бóльшее число аспирантов покинуло лабораторию Хеллинги, нежели защитилось там под его руководством. Не вняв предупреждениям, Двайер, ознакомившись с лабораторией, решила, что это как раз для неё, и 9 лет назад стала сотрудником Хеллинги.
Работая под руководством Хеллинги, Двайер опубликовала ряд весьма серьезных публикаций в журналах, включающих Nature и Science, добавляя блеска и без того восхитительной карьере Хеллинги. Однако в прошлом году ряд исследователей, попытавшихся повторить результаты Хеллинги, установили неприятные факты, повлекшие за собой опровержение двух их совместных работ, в результате чего Хеллинга переложил всю ответственность на Двайер, обвинив её в фабрикации результатов. Этот эпизод вызвал широкое обсуждение и пересуды, обнажив при этом проблему серьезного давления на исследователей, работающих в наиболее животрепещущих тематиках.
Хеллинга — солидный ученый с безупречной до того репутацией, — начиная со своей первой работы, опубликованной в Nature [1], задался таким основным вопросом: «каким образом последовательности аминокислот кодируют функцию белков?». «Взлом» этого кода является одной из самых важных и интересных задач молекулярной биологии, поскольку это открывает возможности для создания ферментов с заданными свойствами. В 1991 году Хеллинга совместно со своим научным руководителем Фредериком Ричардсом (Frederic Richards) из Йельского университета опубликовал работу, посвящённую программе, которая якобы позволяла делать это [2]. Программа DEZYMER предсказывает последовательность белка, который может формировать заданную структуру и выполнять заданную функцию, в том числе — абсолютно не встречавшуюся раньше в природе. Было похоже на то, что Хеллинга всерьез взялся за проблему структуры белка. Те, кто знает его, описывают Хеллингу как человека весьма самоуверенного, берущегося только за глобальные и фундаментальные задачи. Один из его коллег привёл в пример высказывание Хеллинги, обращённое к своему компаньону: «Как ты думаешь, стану ли я однажды более известным, чем Дарвин?». На вопрос, согласен ли Хелинга с утверждением, что он слишком самоуверен, он ответил: «Я бы сказал — нет. Хотя могу выглядеть самоуверенным со стороны. Когда ты пытаешься провести сложный эксперимент, у тебя должна быть определённая доля уверенности в собственных силах, чтобы сказать: „Всё идет как надо, и в данный момент мы думаем, что используемые методы и идеи дадут желаемый результат“».
Украсть — так миллион!
В 2002 году Хеллинга решил взяться за наиболее непростую из задач, которые он планировал решить — существенно переделать малоактивный белок в высокоэффективный фермент, называемый триозофосфатизомеразой (ТФИ). Этот фермент — часть гликолиза (важнейшего биохимического пути) — присутствует у большинства организмов (рис. 2).
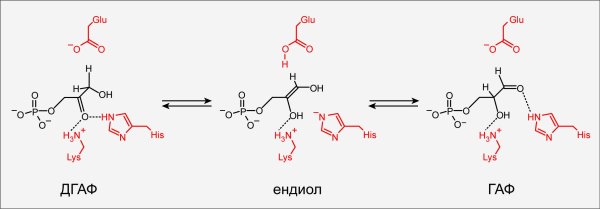
Рисунок 2. Схема работы триозофосфатизомеразы. Фермент триозофосфатизомераза действует на одном из важных этапов метаболизма сахаров и имеется у всех организмов. Фермент (аминокислотные остатки активного центра выделены красным) позволяет клетке эффективно превращать дигидроксиацетонфосфат (ДГАФ) в глицеральдегидфосфат (ГАФ) и обратно, через промежуточную таутомерную форму ендиола.
Цель Хеллинги была весьма амбициозной: другие исследователи также осуществляли попытки дизайна ферментов [3], но далеко не таких активных, как ТФИ, благодаря очень высокой эффективности прозванный «совершенным ферментом».
Хеллинга выбрал Двайер и другого аспиранта — Лорена Лугера (Loren Looger) — для работы над проектом в бактериях Escherichia coli. Эта пара должна была превратить рибозо-связывающий белок из E. coli, не имеющий ферментативной активности, в ТФИ. Лугер и Хеллинга написали компьютерные программы, которые позволяли предсказать, каким образом должен быть изменён рибозо-связывающий белок, чтобы работать как ТФИ. Двайер использовала программу для дизайна мутантных форм рибозо-связывающего белка, получавших шифр «NovoTIM», и впоследствии исследовала их активность в лабораторных условиях.
Двайер, которая описывает себя как «достаточно консервативную личность», была настроена скептически по поводу того, что дело выгорит. «Я постоянно испытывала сомнение во время работы», — говорит она. После шести месяцев тестирования 25 спроектированных мутантов, Двайер обнаружила несколько действительно активных белков, хотя и обратила при этом внимание на ряд проблем, связанных с этими ферментами. Бактерии E. coli производили гораздо меньшее количество белков NovoTIM по отношению к собственным белкам. Более того, NovoTIM были крайне нестабильными.
Возможно из-за этого, результаты экспериментов Двайер по измерению активности NovoTIM выглядели противоречивыми. Так, при определении кинетических параметров ферментативной активности не удавалось получить одних и те же значений в различных измерениях. «Я чувствовала, что никак не могу ухватить эти кинетические параметры из-за наблюдаемого нами большого разброса в значениях», — продолжает рассказ Двайер. Даже после того, как она стала работать совместно с одним из своих коллег, они «по-прежнему получали данные с очень большим разбросом. И никак не могли объяснить и понять это». В свою очередь, Хеллинга в ответ на жалобы Двайер прокомментировал, что наблюдаемая ими вариабельность «ничуть не более чем можно ожидать в таком эксперименте».
В начале 2004 года Хеллинга был готов публиковаться. 29 марта он отправил в Science статью, описывающую белки NovoTIM, которая была принята к публикации 6 мая. Однако в этой статье ничего не было сказано о большом разбросе активности, обнаруженной Двайер. В статье были представлены только лучшие результаты из полученных Двайер, и заявлялось о победе [4]. «Используя технику компьютерного дизайна, мы успешно превратили белок, лишенный каталитической активности, в триозофосфатизомеразу», — утверждается в статье.
Двайер была первым автором в статье, опубликованной в Science, в соавторстве с Хеллингой и Лугером, который покинул Дюк в тот же год и теперь работает в Медицинском институте Горварда Хьюза в Вирджинии. Однако Двайер не торопилась праздновать свои достижения. «Это было достаточно странно», — продолжает она рассказ. Она хотела продолжать исследование вариабельности наряду с действительно странными результатами, которые были получены ей. «Я чувствовала, что мы не до конца разобрались со всем этим».
Двайер говорит, что она постоянно высказывала Хеллинге свою озабоченность. При этом, по его мнению, он никогда не давил на Двайер или кого-либо ещё, чтобы публиковать результаты слишком поспешно. «Такие вещи обсуждаются очень тщательно среди всех людей, вовлечённых в исследования», — говорит Хеллинга.
В сентябре 2004 года Национальный институт здоровья (США) наградил Хеллингу одним из девяти грантов для «Директоров-пионеров» в размере 2,5 миллионов долларов сроком на пять лет. В октябре он получил за свои эксперименты Фейманскую премию в размере 10 000 долларов от Форсайтовского института нанотехнологии в Пало-Альто (Калифорния). В это же время Хеллинга и его жена, структурный биохимик Лорена Биз (Lorena Beese), также работавшая в Дюке, получали различные предложения работы, включая место в Йельском университете. Однако в апреле 2005 Университет Дюка присвоил Хеллинге звание профессора биохимии, а Биз получила такой же статус годом позже. В Университете даже организовали новое отделение — Институт биологической структуры и дизайна, директорами в котором стала «сладкая» парочка.
Слово в слово
Так как карьера Хеллинги начала стремительный взлет, вполне возможно, что он пропустил письмо, полное похвал и восхищения, которое пришло ему в декабре 2004. «Уважаемый профессор Хеллинга, — начиналось письмо. — Я был бы весьма признателен, если бы Вы были заинтересованы в сотрудничестве».
Письмо было написано Джоном Ричардом (John Richard), биохимиком из Государственного нью-йоркского университета в Буффало (рис. 3). Учителями Ричарда были такие мастодонты энзимологии, как Пери Фрей (Perry Frey) из Университета Висконсин-Мэдисон, Билл Дженкс (Bill Jencks) из Университета в Волхэме (Массачусетс) и Ирвин Роуз (Irwin Rose), работающий в Университете Калифорнии в Ирвине, который получил в 2004 году Нобелевскую премию по химии за открытие роли убиквитина в деградации белков в клетке.

Рисунок 3. Джон Ричард, начав сотрудничество с Хеллингой, обнаружил дилетанскую ошибку в его публикации. D. LEVERE, UNIV. BUFFALO.
Ричард разработал методику анализа реакций, катализируемых ТФИ [5], [6]. Он видел работу Хеллинги в Science и хотел сравнить характеристики «дизайнерских» ферментов NovoTIM с аналогичными для природных ТФИ. Ричард предложил Хеллинге провести такое исследование, но не получил никакого ответа. «Это не было делом первоочередной важности», — объясняет Хеллинга.
Эти два человека пришли из совсем разных научных культур. Ричард был специалистом в механистической энзимологии, и получил известность благодаря своим работам в области физической органической химии, которая перестала быть популярной, — возможно потому, что, по его собственным словам, «все простые эксперименты были уже сделаны». Он добился успеха в этой сфере, что связано с особой аккуратностью и педантичностью в проведении экспериментов. «На сегодняшний день Джон действительно один из лучших в мире специалистов в физической органической химии, работающих с ферментами», — говорит Джозеф Каппок (Joseph Kappock) — биохимик из Университета Пардью. В то же время белковый дизайн как весьма горячая область требует в первую очередь дерзости, чтобы — даже если не понимать до конца как это работает — всё равно заниматься улучшением свойств молекул.
В июле 2006 года Ричард обсуждал статью в Science с другим химиком — Джеком Киршем (Jack Kirsch), почётным профессором в Университете Калифорнии, где Хеллинга проводил семинар по своей работе. 9 августа Кирш послал Хеллинге е-мейл. «[Ричард] передал мне, что адресовал Вам письмо, запрашивая материалы, — писал Кирш. — Есть ли какие-то причины тому, что Вы не смогли ответить на его запрос?».
Это письмо существенно ускорило весь ход дела. 20 октября Хеллинга отписал Ричарду о согласии прислать образцы ДНК для белков NovoTIM, описанных в статье в Science. Он также отправил образцы ДНК второй партии NovoTIM, полученной Двайер вместе с коллегой двумя годами позже. Статья, описывающая эти белки, была опубликована в Journal of Molecular Biology [7]. Хеллинга послал Ричарду также инструкции по экспрессии и выделению NovoTIM с припиской: «Я надеюсь, Ваши эксперименты будут успешными, жду от Вас характеристики наших „дизайнерских“ ферментов».
В Буффало Ричард нанял лаборанта Астрид Куделку (Astrid Koudelka; рис. 4) для работы над NovoTIM-проектом, которая следовала указанием Хеллинги, согласно которым для выделения NovoTIM ей следовало использовать метод элюции ступенчатым градиентом. Однако тут возникли проблемы — оказалось, что этот метод не позволяет отделить NovoTIM от примесей других белков.
Затем жена Ричарда — химик Тина Амейс (Tina Amyes; рис. 4) — измеряла кинетические параметры для белков NovoTIM — в частности, значение константы Михаэлиса. Она обнаружила, что константа отличается от той, что была опубликована Хеллингой в статье в Science, и при этом была той же самой, что и для белка ТФИ дикого типа из E. coli. Несмотря на то, что Амейс работала с NovoTIM в течение всей первой половины 2007 года, ничего подобного опубликованному Хеллингой ей получить не удалось — всё указывало на то, что она измеряет активность белка ТФИ дикого типа.

Рисунок 4. Тина Амейс (слева) и Астрид Куделка (справа) так и не смогли воспроизвести результаты Хеллинги. N. J. PARISI.
Тем временем Куделка модифицировала процедуру выделения, рекомендованную Хеллингой, и использовала более эффективную методику — элюцию непрерывным градиентом вместо ступенчатого. Новый метод, наконец, позволил очистить NovoTIM от примесей. Однако когда Амейс провела исследования чистого NovoTIM, она не обнаружила вообще никакой ферментативной активности. В то же время белки, содержащиеся в примеси, были активными и по характеру активности выглядели как ТФИ E. coli дикого типа.
В конце июля группа в Буффало наконец убедилась, что что-то пошло не так с опытами Хеллинги. Они были уверены, что из-за использования ступенчатой методики выделения в лаборатории Хеллинги просто-напросто не удалось очистить NovoTIM от примесей белка ТФИ дикого типа. «Дизайнерские» ферменты оказались нерабочими, а всю активность, о которой писал Хеллинга в своих статьях, стоило отнести на счет нативного ТФИ. «Я был крайне огорчен, — говорит Ричард. — Мы потратили уйму времени, денег и ресурсов, чтобы в итоге ничего не сделать и показать лишь, что просто что-то было неправильно». С этого момента команда Ричарда почувствовала себя обязанными попытаться исправить ошибку в исследованиях, уже ставших научным достоянием. «Просто сказать „это не правильно, давайте спишем это и продолжим“ — не честно по отношению к научному сообществу», — говорит Куделка.
Быстрый ответ
26 июля Ричард послал электронное письмо Хеллинге с подробным описанием того, что было сделано его командой, а также с указанием на похожие проблемы в других статьях «дизайнера». При этом копии письма были также отправлены редакторам Science и Journal of Molecular Biology. «Я думаю, что эти вопросы не могут быть оставлены без внимания, — писал Ричард, добавляя: — Пожалуйста, поймите, насколько трудно мне было писать это письмо».
В этот раз Хеллинга ответил незамедлительно. В электронном письме от 30 июля он писал, что ключевые эксперименты «были повторены несколько раз разными людьми из моей исследовательской группы». Эти эксперименты включали тесты активности NovoTIM и серию экспериментов с отрицательным контролем. По словам Хеллинги, данные экспериментов с отрицательным контролем показывают отсутствие активности у чистого рибозо-связывающего белка (эти результаты не были представлены ни в одной статье). Тем не менее, он согласился ещё раз повторить эксперименты с NovoTIM.
Всё это время Двайер ничего не слышала про контакты Ричарда с Хеллингой. После получения учёной степени она покинула лабораторию Хеллинги в 2005 году, чтобы продолжить свою научную работу на другой кафедре. Поэтому она не особенно забеспокоилась, когда получила е-мейл от Хеллинги 3 сентября прошлого года, в День труда (первый понедельник сентября в США. — А. П.) с пожеланием встретиться на неделе для обсуждения вопросов, связанных с NovoTIM. Однако новый руководитель Двайер — Дональд МакДоннел (Donald McDonnell), профессор фармакологии и онкологии, — посоветовал ей одной не встречаться с Хеллингой. Он чувствовал, что ей необходимо взять кого-нибудь, кто помог бы защитить ей свои интересы. МакДоннел организовал встречу в конце недели, на которой помимо него, Двайер и Хеллинги присутствовали два сотрудника факультета с кафедры биохимии. Хеллинга буквально набросился на Двайер: «Он говорил: „Мне трудно поверить, что ты это сделала не специально [подтасовала результаты]“, и он продолжал высказываться в таком же роде снова и снова, — говорит Двайер. — Это было ужасно». Руководитель Двайер выступил в ее защиту, а она продолжала заявлять о своей невиновности. «Я говорила, „это просто смешно, нет, я не делала этого“», — рассказывает она.
Неделю спустя МакДоннел, Хеллинга, Двайер и заведующий кафедрой биохимии встретились снова. На встрече присутствовал и муж Двайер, который также занимается наукой. Она показала Хеллинге свои лабораторные записи, считая, что это послужит ей алиби. Однако, по словам Двайер, «он даже не захотел смотреть на них. Это была моя вина — и всё тут». Однако Хеллинга запомнил эту встречу по-другому: «Это неправда, — говорит он. — Конечно, я видел эти результаты, и даже попросил людей из моей лаборатории повторить эксперименты».
8 октября Хеллинга написал Ричарду: «Мы полностью повторили эксперименты с NovoTIM, — писал он. — Я согласен с Вами, что „дизайнерские“ белки NovoTIM не обладают ферментативной активностью, а также что активность, о которой было заявлено, является следствием примесей в образце, вероятнее всего — триозофосфатизомеразы дикого типа». О повторённых экспериментах с отрицательным контролем Хеллинга писал, что нашел «активность ТФИ в образцах исходного рибозо-связывающего белка, полученных методом элюции ступенчатым градиентом».
Он также добавлял, что эти эксперименты были повторены тремя людьми, «но НЕ Мэри Двайер, автором статьи, ответственным за проведение экспериментов, описанных в Science, а также за большую часть экспериментов с отрицательным контролем к статье в Journal of Molecular Biology». Назвав Двайер ответственной за все эксперименты, Хеллинга противоречил тому, что написал в письме Ричарду от 30 июля, где было написано, что «разные люди» были вовлечены в исследование. Однако Хеллинга прокомментировал ситуацию для Nature, сказав, что письмо от 30 июля было «несколько неаккуратным», в то время как только Двайер отвечала за эксперименты с отрицательным контролем.
В письме Ричарду Хеллинга продолжает: «С Двайер связались для получения объяснений. ... Материалы были отправлены в канцелярию декана Медицинской Школы [при Университете Дюка] для дальнейшего расследования, которое продолжается на данный момент».
Комитет по обеспечению чистоты исследований провёл формальные слушания по делу Двайер, на которых ей необходимо было ответить на выдвинутые против неё обвинения. 4 февраля она получила письмо от Уэсли Бэрли (Wesley Byerly), зам. декана Медицинской Школы, снимающее с неё обвинения в фальсификации и подтасовке результатов.
Дело ясное, что дело тёмное
Тем временем известие о проведённом расследовании распространилось в научных кругах и сильно возмутило многих исследователей, которые почувствовали всю несправедливость обвинений в мошенничестве, выдвигаемых наставником своему подопечному. «Это достойно порицания, — говорит один учёный. — Это обязанность руководителя — обучать студента (аспиранта), показывать ему, какие проблемы могут быть связаны с получением и интерпретацией данных, какие „подводные камни“ можно встретить на пути».
В феврале 2008 года обе статьи — в Science и Journal of Molecular Biology — были формально отозваны. «Триозофосфатизомеразная активность, которую мы наблюдали в своих образцах, была обусловлена присутствием ТФИ дикого типа», — так начинается сообщение об отзыве статей в Science и Journal of Molecular Biology. Многие биохимики были удивлены, что в лаборатории Хеллинги столкнулись с такой простой проблемой, как чистота образца. «Это абсолютно дилетантская ошибка — не очистить нормально исследуемый белок», — говорит Уоллас Клеланд (Wallace Cleland) из Университета Висконсин-Мэдисон.
Однако что же произошло на самом деле, до сих пор остаётся весьма туманным. 10 марта в Science были опубликованы заметки Ричарда и Кирша, в которых они не соглашаются с формулировкой отзыва публикаций. В частности, они пишут, что полученные Хеллингой кинетические параметры для NovoTIM отличаются от таковых для ТФИ. Это не позволяет в действительности считать, что описанная активность является следствием присутствия ТФИ дикого типа.
Кирш также поднимает вопрос по поводу других экспериментов, описанных в статье в Science, которые «имеют смысл только в случае успешного дизайна». Например, в статье было написано, что NovoTIM могут заменять ТФИ дикого типа в E. coli, лишённых этого фермента. Кроме того, различные тесты якобы показывают, что мутантные NovoTIM менее активны, как и предсказывал DEZYMER. Откуда могли взяться такие результаты, если дизайнерские ферменты были вообще неактивными?
Хеллинга не предоставил никаких объяснений на этот счет. Двайер считает, что вопросы по поводу экспрессии дизайнерских белков и их странной активности уже не имеют такого значения, раз хотя бы одна ошибка в экспериментах была обнаружена. Но при этом никто не предложил чёткого объяснения по поводу того, что же на самом деле произошло и что пошло не так. Это особенно расстраивает Ричарда, потратившего изрядное количество времени и ресурсов, чтобы докопаться до правды.
Однако благодаря работе Ричарда другая исследовательская группа получила возможность стать первооткрывателями после ниспровержения Хеллинги. В марте группа под руководством Дэвида Бэйкера (David Baker) из Университета в Вашингтоне (Сиэтл) опубликовала две статьи, показывающие, как на самом деле компьютерные программы могут быть использованы для дизайна ферментов [8], [9] (см. также «Дизайнерские ферменты на службе общества» [10]).
А между тем, ряд учёных поднимает вопрос о том, не должнó ли быть проведено расследование по поводу самого Хеллинги. Согласно одному из пунктов в уставе Дюка, в случае предъявления бездоказательного обвинения, нанесшего вред репутации, дело должно рассматриваться в соответствии с политикой Университета и существующими механизмами.
При этом Хеллинга заявляет, что не получал никаких уведомлений о том, что он находится под следствием. Университет также не предоставил никаких специальных заявлений по этому поводу, сообщив лишь: «Мы знаем, что отзыв публикаций Др. Хеллинги вызвал определенный резонанс в научном сообществе. Дюк продолжает следить за этими дискуссиями и рассматривать различные точки зрения, существующие на сегодняшний момент».
Что касается Двайер, то она чувствует себя просто обескураженной сложившейся ситуацией: «Я чувствую себя чудовищно виноватой, что не смогла предотвратить этого. Я этого не сделала и теперь должна как-то жить с этим». Она старается преодолеть душевный дискомфорт и продолжать свою карьеру дальше: теперь она работает в другой лаборатории и другой области — в эндокринологии, под руководством Дональда МакДоннела. Однако временами, по словам Двайер, она мысленно возвращается к тем людям, которые много лет назад пытались предупредить её по поводу работы в лаборатории Хеллинги, — насколько всё могло бы сложиться по-другому для неё, прислушайся она вовремя к совету.
Перевод статьи Эрики Гайден (Erika Hayden) из новостей Nature [11].
Литература
- Homme W. Hellinga, Philip R. Evans. (1987). Mutations in the active site of Escherichia coli phosphofructokinase. Nature. 327, 437-439;
- Homme W. Hellinga, Frederic M. Richards. (1991). Construction of new ligand binding sites in proteins of known structure. Journal of Molecular Biology. 222, 763-785;
- D. N. Bolon, S. L. Mayo. (2001). Enzyme-like proteins by computational design. Proceedings of the National Academy of Sciences. 98, 14274-14279;
- M. A. Dwyer. (2004). Computational Design of a Biologically Active Enzyme. Science. 304, 1967-1971;
- AnnMarie C. O'Donoghue, Tina L. Amyes, John P. Richard. (2005). Hydron Transfer Catalyzed by Triosephosphate Isomerase. Products of Isomerization of (R)-Glyceraldehyde 3-Phosphate in D2O†. Biochemistry. 44, 2610-2621;
- AnnMarie C. O'Donoghue, Tina L. Amyes, John P. Richard. (2005). Hydron Transfer Catalyzed by Triosephosphate Isomerase. Products of Isomerization of Dihydroxyacetone Phosphate in D2O†. Biochemistry. 44, 2622-2631;
- Malin Allert, Mary A. Dwyer, Homme W. Hellinga. (2007). RETRACTED: Local Encoding of Computationally Designed Enzyme Activity. Journal of Molecular Biology. 366, 945-953;
- L. Jiang, E. A. Althoff, F. R. Clemente, L. Doyle, D. Rothlisberger, et. al.. (2008). De Novo Computational Design of Retro-Aldol Enzymes. Science. 319, 1387-1391;
- Daniela Röthlisberger, Olga Khersonsky, Andrew M. Wollacott, Lin Jiang, Jason DeChancie, et. al.. (2008). Kemp elimination catalysts by computational enzyme design. Nature. 453, 190-195;
- Дизайнерские ферменты на службе общества;
- Erika Check Hayden. (2008). Chemistry: Designer debacle. Nature. 453, 275-278;
- О живой воде, внутреннем огне и медных трубах.





