
Эгоисты, вечные и такие... полезные? Или немного о ТА-модулях
18 февраля 2026
Эгоисты, вечные и такие... полезные? Или немного о ТА-модулях
- 107
- 0
- 1
Они просто узники своего творения... Или нет? Узнаем!
Рисунок в полном размере.
фон — Hotel California — «Википедия»; передний план — bioinfo-mml
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Как только человечество не демонизирует бактерии! И рога, и клыки, и когти им в мультиках и рекламе жидкого мыла пририсовать норовит, и в черный плащ с капюшоном их переодевает, и «черной смертью» называло. Строго говоря, нет ни абсолютно «хороших», ни истинно «злых» бактерий; они, как и все живые существа, просто стараются выжить и оставить потомство. А вред или польза, которые они при этом могут принести другим видам (например, нам, людям) — лишь побочное следствие их существования.
Однако всех бактерий объединяет одно: они готовы вести изнуряющую борьбу за свое выживание, находить лазейку, ускользать, и так далее по кругу. Свойственно это и патогенным бактериям, по вине которых каждый год умирают тысячи и миллионы людей. А что, если роли поменяются, и жертвой станет сама бактерия? Более того, паразит пришел изнутри и фактически поработил бактерию, предъявив ей железный ультиматум: «Сосуществуй или умри». Оказывается, и тут нашелся выход: раз нельзя избавиться, то можно приспособить, сделать внутреннего оккупанта шестеренкой в своем механизме — превратить в симбионта.
В этой статье речь пойдет о паразите в не совсем привычном понимании этого слова, поскольку им является не живой организм, а ген. Не простой — эгоистичный, ради себя готовый на все. И в этой готовности, вкупе с навыком бактерий в случае надобности идти на компромисс, оказался заложен огромный потенциал, который сейчас исследуется и используется учеными по всему миру. Все это — про системы токсин-антитоксин, или ТА-модули.
Конкурс «Био/Мол/Текст»-2025/2026
Эта работа опубликована в номинации «Школьная» конкурса «Био/Мол/Текст»-2025/2026.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — Благотворительный фонд «Белая лилия», который поддерживает школьников, студентов профильных вузов, научных коллективов врачей и ученых по разработке и созданию прорывных технологий в области медицины.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Осмотримся на местности
Один из главных вопросов современной эволюционной генетики прокариот неспроста звучит так: «Как из бактериального генома получился эукариотический?». Почему именно этот? Потому что различия между ними обоими весьма существенны.
А как вообще устроен прокариотический геном? Любой геном характеризуется несколькими важными параметрами: размером геномной ДНК (в тыс. пар нуклеотидов, или килобазах, Кб), количеством генов, кодирующих белки, их компактизацией и плотностью, долей некодирующих и мобильных элементов, а также числом хромосом.
Первое важное отличие: хромосома у бактерий одна. Хотя есть и виды, у которых число постоянных хромосом доходит до 10 и даже до 17, но это скорее исключение, чем правило. Второе: хромосома в основном кольцевая, но у некоторых бактерий и архей она бывает и линейной. Длина геномной ДНК бактерий составляет от 130 килобаз до 14 мегабаз (млн пар нуклеотидов, Мб). Третье: гены расположены плотнее, чем у эукариот. Простой пример. В человеческом геноме обнаружено около 20 тысяч генов, кодирующих белки, а общая длина геномной ДНК всех хромосом составляет 2,9 миллиарда пар нуклеотидов. У Escherichia coli — от 4 до 5,5 тысяч генов при длине ДНК от 4,6 до 5,6 мегабаз. Учитывая, что размер самих генов у людей и кишечных палочек примерно одинаков (без учета регуляторных элементов, которые у эукариот устроены заметно сложнее), то плотность генов у бактерий выше таковой у человека почти в 150 раз!
Как бактериям удалось этого добиться? Отчасти это объясняется тем, что кодирующие последовательности у бактерий зачастую собраны в функциональные блоки — опероны (рис. 1). В оперон собираются гены (цистроны), считывание с которых происходит совместно (образующаяся РНК называется полицистронной) и объединены под одним промотором — элементом регуляции транскрипции. То есть считывание со всех цистронов, входящих в состав оперона, регулируется одинаково, что позволяет заметно упростить этот процесс.
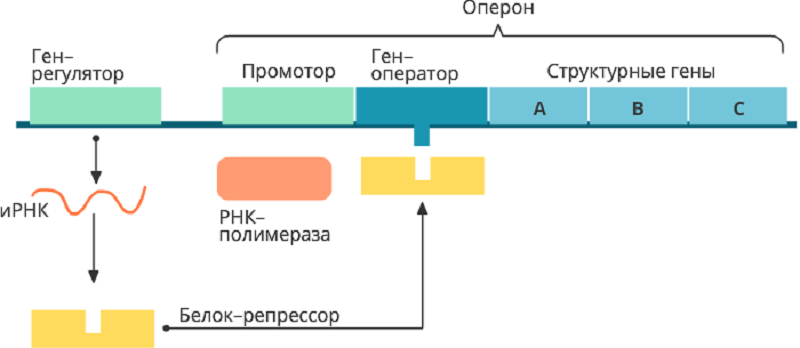
Рисунок 1. Структура оперона. В большинстве своем опероны состоят из нескольких частей: промотора — «посадочной площадки» для РНК-полимеразы; оператора — участка, с которым связывается регуляторный белок, активатор или репрессор, и прочность его связывания можно увеличить или уменьшить за счет модификации белка или аллостерической регуляции; структурных генов-цистронов; терминатора, знаменующего окончание транскрипции.
Во-вторых, доля некодирующих элементов у эукариот гораздо выше, чем у прокариот. Долгое время считалось, что у бактерий вовсе нет, например, интронов и псевдогенов, но 30 лет назад было показано, что у них в геноме все-таки присутствуют и те, и другие, иногда в весьма значительных количествах (до 40%). А у эукариот доля некодирующих элементов доходит до 98%.
Несмотря на все это, ДНК в бактериях относительно их размера очень много (рис. 2) [1]. Клетка буквально заполнена ей, и это создает еще больше различий между прокариотами и эукариотами: транскрипция и трансляция у первых не разделены в пространстве, еще транскрибируемая мРНК может сразу же связываться с рибосомой и транслироваться.

Рисунок 2. Хромосома в клетке Caulobacter crescentus, рисунок в масштабе.
Еще одна важная особенность бактерий — зачастую они несут внегеномные элементы, которые в основном не требуют постоянного присутствия и функционирования, но могут быть полезными для специфической физиологии конкретного штамма или устойчивости особи к неблагоприятным факторам среды. К примеру, плазмиды, самые распространенные среди них, могут нести на себе гены антибиотикорезистентности (невосприимчивости к конкретному антибиотику или нескольким антибиотикам, которая была выработана в результате мутаций) [2], или генетические модули, способствующие развитию состояния персистенции [3]. Персистенция — это состояние, подобное криосну из «Интерстеллара»: физиологические процессы в бактерии, направленные на рост и активную жизнедеятельность, прекращаются, и бонусом бактерия-персистор получает устойчивость почти к любым неблагоприятным условиям окружающей среды (кроме совсем уж экстремальных, на этот случай некоторые виды научились образовывать споры). Например, при обработке колонии бактерий неведомым страшным антибиотиком немногие особи из колонии — такая удача выпадает лишь одной бактерии из 100 тысяч своих собратьев, — становятся персисторами, и к тому моменту, когда воздействие антибиотика прекратится, некоторые из них развивают полноценную резистентность, порождая потом устойчивую колонию. Развитие персистенции — сложный процесс, отчасти зависящий от стохастических факторов (мудреное слово, примерно означающее «с неопределенным поведением»), но запукаемый детерминированными (с полной определенностью поведения) факторами. Ими, детерминированными факторами, часто и являются те генетические элементы, о которых пойдет речь в этой статье.
Итак, начнем…
... мы поговорим о системах токсин-антитоксин, или модулях привыкания, или ТА-модулях. Название, как видно, может быть разным, и в этой статье в основном будет использоваться последнее. С одной стороны, в аббревиатуре «ТА» заключены оба обязательных элемента всех этих систем, с другой — слово «модуль» демонстрирует связь их работы и регулируемость. Описать их можно как первично эгоистичные генетические элементы, вторично приспособленные бактериями для своих нужд, отделение которых от бактерии влечет снижение ее жизнеспособности вплоть до гибели. В этом плане ТА-модули отличаются от «молчащих» эгоистичных элементов, например, от IS-элементов (о том, кто они такие, подробно рассказано в статье про МГЭ прокариот [4]): они не есть 0, они есть +1 и —1.
Любой ТА-модуль неснт в свонм составе как минимум два гена, часто объединннных в один оперон: токсина и антитоксина. Токсин — он и в архее токсин: он устраивает саботаж, тормозя работу жизненно необходимых клеточных механизмов, таких как транскрипция, репликация, трансляция, синтез клеточной стенки или деление клетки. Не всегда, однако, при этом убивая ен, и этот важный момент сыграл решающую роль в интеграции ТА-модулей в системы самообороны и альтруистического самоубийства. Но не будем спешить.
Антитоксин встречается, в зависимости от типа системы, в двух формах: белок и РНК. Это антидот, заветная пилюля, защищающая бактерию от действия токсина. «Так, токсин плюс антитоксин равно —1 плюс 1... равно 0, все сходится», — можно тут подумать, но суть заключается не в конечном результате этого противостояния, который в благоприятных условиях действительно равен 0, а в постоянной борьбе +1 и —1, антитоксина и токсина. Именно из постоянства процесса при потенциальной неизменности результата, но с возможностью регуляции отклонения (см. далее), вытекают все те преимущества, которые обеспечиваются действием ТА-модулей.
У войны есть свои законы, а уж у бесконечной, ставшей частью повседневности — тем более. У войны токсина и антитоксина тоже есть свой коротенький кодекс, которому подчиняется абсолютное их большинство:
- Антитоксин прямо или косвенно нейтрализует эффект токсина. Достигается это посредством прямого связывания с токсином или его мРНК, предотвращающего его трансляцию, мишенью токсина, запуском активной деградации токсина и пр. (см. далее);
- Время полужизни антитоксина всегда меньше такового у токсина. В первую очередь это связано с природой антитоксина, т.к., если он представляет собой РНК, то он априори будет гораздо нестабильнее белка-токсина [5]. Антитоксины-белки же имеют более рыхлую «консистенцию» (конформацию) по сравнению с токсинами, отчего больше подвержены протеазной деградации, например, Lon-протеазами [6];
- Антитоксин в благоприятных для бактерии условиях синтезируется в некотором избытке.
Третий пункт, очевидно, прямо вытекает из второго. Если воины в одной армии слабее другой, значит, для сохранения баланса на поле боя их должно быть больше. Вместе эти два пункта составляют тот самый ультиматум, который ТА-модули предъявляют бактерии: если по какой-то причине оба гена модуля резко пропадут или считывание с них полностью прекратится, то лабильный (нестабильный) антитоксин разрушится за весьма незначительное время, что «развяжет руки» токсину. Бактерию после этого ждет незавидная судьба: она погибнет, либо ее жизнеспособность на какое-то время сильно пошатнется. Быстро это произойдет или мучительно, во время деления или от голода — зависит от мишени токсина.
В случае оперонной организации ТА-модуля возникает вопрос: как регулируется соотношение токсин-антитоксин? В последние годы этот вопрос стал предметом дискуссий, в основном вращающихся вокруг ТА-зависимого развития персистентного состояния у бактерий (см. раздел «Один за всех, и за себя заодно»). Научное сообщество, изучающее ТА-модули, разделилось на два лагеря: один верит, что вариабельным (изменяемым) параметром является интенсивность деградации антитоксина; другой склонен считать, что на соотношение токсина и антитоксина влияет скорость трансляции антитоксина (в системах типа II и IV–VII, рис. 3), а интенсивность деградации антитоксина конститутивна (т.е. неизменна).
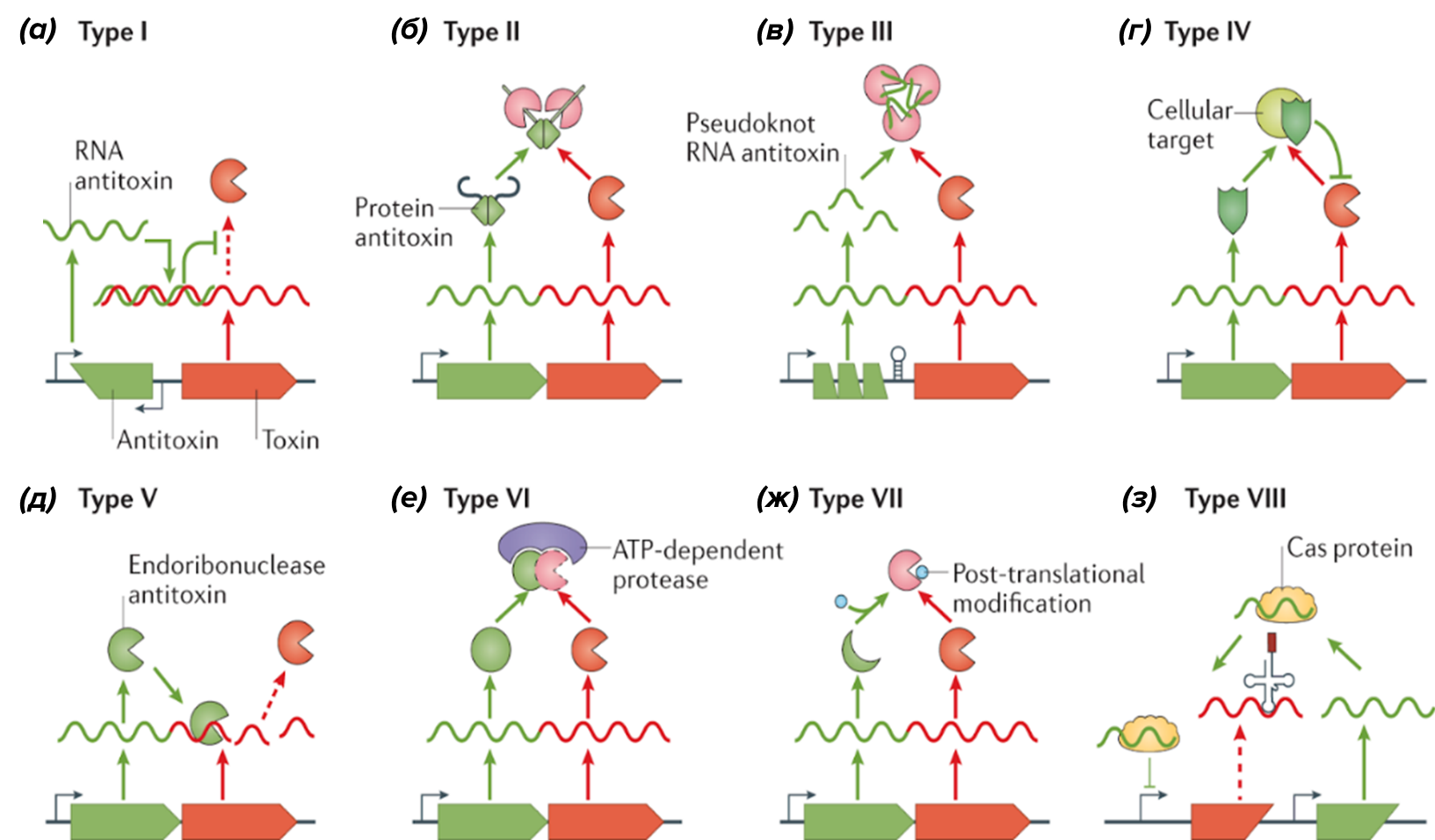
Рисунок 3. Типы систем токсин–антитоксин. (а) — взаимодействие «мРНК—нкРНК». Токсин и антитоксин считываются с одного оперона, после чего антитоксин-нкРНК (нкРНК расшифровывается как некодирующая РНК) взаимодействует с мРНК токсина, что подавляет (ингибирует) его трансляцию [7]. Токсин в основном нарушает целостность мембран и процесс деления [8]; (б) — взаимодействие «белок—белок». Токсин и антитоксин вступают во взаимодействие уже после синтеза на рибосоме, и в результате него токсин становится неактивным. Системы этого типа в настоящее время изучены лучше всего [9]; (в) — взаимодействие «белок—РНК». Антитоксин, представляющий собой РНК, образует комплекс с токсином и ингибирует его, не проходя трансляцию (просто не имея возможности сделать это, такова уж ее природа). Иногда токсин и антитоксин образуют красивые гомотримеры. Первично была описана как система защиты от фагов путем протекания абортивной инфекции [10]; (г) — защита мишени. И токсин, и антитоксин представляют собой белки, но антитоксин не действует на токсин напрямую, а защищает от его действия белок—мишень [11]; (д) — антитоксин представляет собой РНКазу, которая расщепляет мРНК токсина до ее трансляции [12]; (е) — антитоксин образует комплекс с токсином и, жертвуя собой, направляет его на протеазную деградацию (похожим образом функционирует убиквитин-протеасомная система [13]), как в утиль [14]; (ж) — антитоксин модифицирует токсин, причём эта модификация инактивирует токсин [15]; (з) — редкий и сравнительно недавно обнаруженный пример системы, в которой и токсин, и антитоксин представляют собой антисмысловые РНК. Оба они находятся под разными оперонами. Токсин комплементарно связывается с мРНК нескольких ключевых белков, что нарушает важные клеточные функции. Антитоксин же связывается с белками-РНКазами (например, семейства Cas) и либо способствует деградации токсина, либо подавляет транскрипцию его гена [8].
Для того, чтобы в дальнейшем понять аргументы обеих сторон, стоит рассмотреть, как вообще происходит транскрипция в опероне типичного ТА-модуля. Как правило, ген антитоксина расположен выше гена токсина, прямо под промотором [17], хотя встречаются и альтернативные архитектурные решения: ген токсина расположен выше антитоксина [18], [19] (рис. 4). Важный момент: токсин и антитоксин имеют каждый свои, пересекающиеся друг с другом открытые рамки считывания (ОРС). Однако они имеют определенные различия между собой. Важной частью бактериальной ОРС являются два элемента, необходимых для нормального прохождения трансляции: последовательность Шайна-Дальгарно (SD), нужная для узнавания соответствующей мРНК рибосомой, и старт-кодон (AUG), с которого неизменно начинается процесс трансляции. Так вот, оба этих элемента присутствуют в ОРС антитоксина и исправны, как швейцарские часы. А вот последовательность SD токсина является субоптимальной (не совсем оптимальной), что неумолимо снижает эффективность трансляции. Этим и достигается стационарное, «повседневно» высокое соотношение антитоксин/токсин: часть цистронов на мРНК токсина просто-напросто не пройдет трансляцию и канет втуне, а антитоксин будет транслироваться, стабильно перевыполняя план [20].
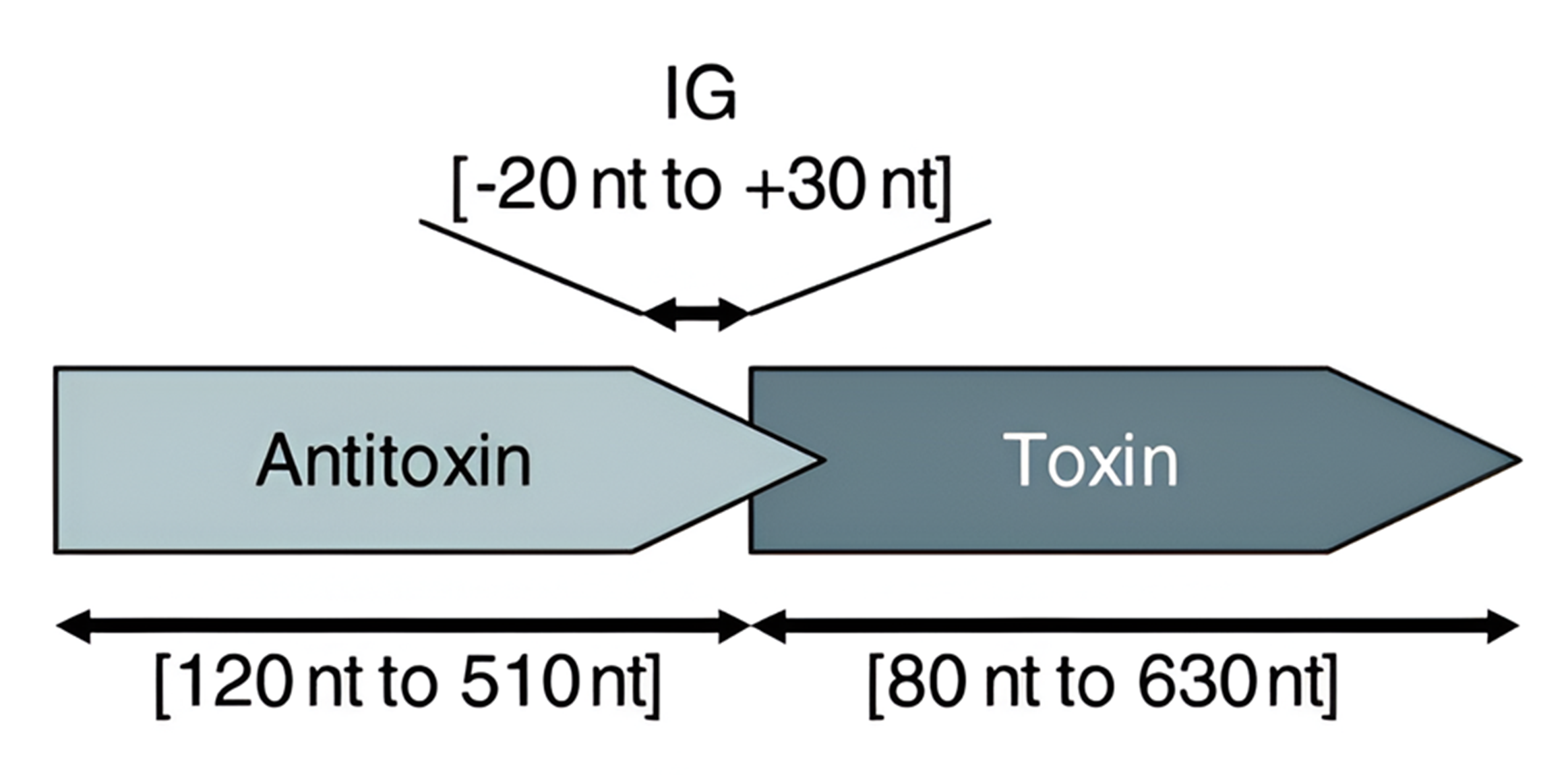
Рисунок 4. Строение локуса типичного ТА-модуля. ТА-модуль всегда состоит из гена токсина и антитоксина, разделенного интергенным регионом (IG-region). Иногда в этот «тандем» добавляются и другие гены, специфичные для конкретного семейств систем (см. далее). Подробнее см. текст.
В соответствии с пунктом 1, активный антитоксин во многих модулях образует комплекс с токсином (назовем его для удобства комплекс Т-А). И вот тут начинается интересное. От соотношения антитоксин/токсин, как показали наблюдения, зависит судьба комплекса Т-А. По-видимому, у комплексов существует две стехиометрические формы (различающиеся соотношением токсина и антитоксина в них). Комплексы, образующиеся при высоком соотношении антитоксина и токсина в клетке, являются ауторепрессорами, т.к. взаимодействуют со своим оператором и выступают в роли замедлителя собственной транскрипции. При более умеренном же соотношении образуются нейтральные комплексы Т-А, не связывающиеся с опероном. Соотношение антитоксин/токсин, меньшее 1, препятствует образованию комплекса [19].
В настоящее время известно восемь типов ТА-модулей, различающихся по механизму защиты мишени от действия токсина. Они представлены и описаны на рис. 3.
Где же можно найти ТА-модули? До начала 2000-х гг. ответ на этот вопрос был один: в составе плазмид. В частности, первый открытый «эгоистичный модуль» был обнаружен на т.н. F-плазмиде (F — от англ. fertility — «фертильность», «плодовитость»). Такие плазмиды интересны тем, что способны передаваться от одной бактерии к другой, не являющейся ее прямым потомком [21]. Процесс передачи F-плазмиды получил название «конъюгация», которая, наравне с трансдукцией и трансформацией [22], относится к процессам горизонтального переноса генов (в противовес вертикальному, когда генетический материал передается от материнской клетки к дочерним). И здесь все сходится, ведь передача копии плазмиды с ТА-модулем другой особи потенциально увеличивает число ее носителей вдвое, а именно этого ей и нужно. Так посчитали и ученые.
Но спустя примерно 20 лет произошло то, чего исследователи вряд ли могли ожидать: при секвенировании генома Escherichia coli, обожаемой всеми биологами кишечной палочки, были обнаружены генетические элементы, до боли похожие на ТА-модули [20]. Уж что-что, а обнаружение эгоистичного элемента на бактериальной хромосоме стало неожиданным открытием! Оно изменило все, потому что заставило ученых задуматься и пересмотреть взгляд на физиологическую роль ТА-модулей. Если они встречаются на геномной ДНК, которая сама по себе не может быть изъята из клетки без прекращения ее существования, значит, и «эгоистами» как таковыми эти модули быть перестали. Они так же, как и их плазмидные аналоги, способны убить клетку, если токсин начнет преобладать над антитоксином, только вместе с клеткой и сам ТА-модуль канет в небытие. Значит, он уже оказывается вовлечен в физиологические процессы бактерии, направленные на ее выживание. Выражаясь образно, когда модуль оказался таким образом неразрывно связан с бактериальным геномом, он вздохнул и пробурчал: «Я буду спасать тебя, но только чтобы уцелеть самому». А бактериям этого и надо было. Вот так генетический паразит и начал становиться шестеренкой. Как именно ТА-модули встраиваются в хромосомы — пока неизвестно.
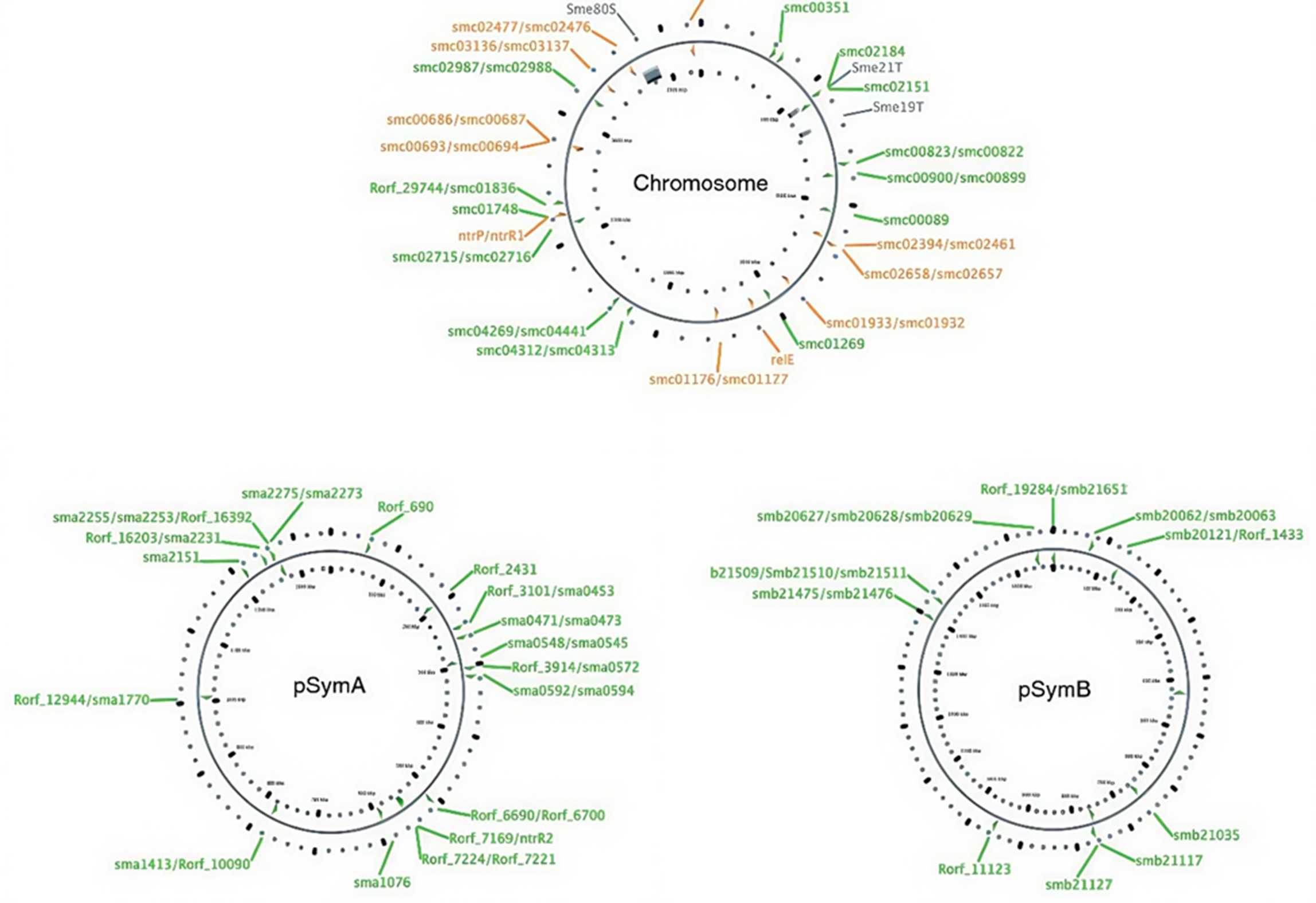
Рисунок 5. Карта локусов ТА-модулей в хромосоме и двух мегаплазмидах pSymA и pSymB Sinorhizobium meliloti. S. meliloti [23] — почвенная бактерия, которая, подобно Rhizobium, формирует симбиотические отношения с бобовыми растениями. Помимо единственной хромосомы, у данного вида обнаруживаются также две мегаплазмиды, pSymA и pSymB, — крупные плазмиды размером 1354 кб и 1683 Кб, соответственно. Излеченные от мегаплазмид особи S. meliloti теряют способность заражать бобовые и вступать с ними в симбиоз, что позволяет предположить, что на них расположены гены, играющие ключевую роль в фитопатогенности (nod) и азотфиксации (nit). Предполагается, что ТА-модули здесь играют роль в противофаговой защите, регуляции динамики развития популяции и развития симбиотических отношений.
Закономерно возник вопрос: а могут ли плазмидные модули быть вовлечены в какие-то нужные бактерии процессы? Оказалось, что да! В настоящее время каждый год открываются новые системы токсин–антитоксин, и во многих случаях оказывается, что они обеспечивают бактерии или колонии выживание в неблагоприятных условиях. Собственно, вокруг защиты бактерии, колонии и самого себя от опасности и вращаются все их функции.
Один за всех, и за себя заодно
Казалось бы, содержание таких систем должно обходиться бактерии постоянной тратой ресурсов, что невыгодно. Однако, как уже было сказано, эта игра с огнем для бактерий по-настоящему стоит свеч.
Первой функцией некоторых ТА-модулей является участие в развитии персистенции. Это состояние замедления метаболизма в ответ на любой стресс, например, антибиотики. Одной из таких систем является HipA/HipB-система [24]. В ней токсин выступает в роли т.н. серин-треониновой киназы, т.е. представляет собой фермент, который изменяет активность определенных клеточных белков путем их фосфорилирования по остаткам серина и треонина. В случае с системой HipA/HipB токсин инактивирует ферменты глутамил-тРНК-синтазу и триптофанил-тРНК-синтазу, которые участвуют в трансляции, доставляя к рибосоме аминокислоты глутамин и триптофан. Как следствие, кирпичи есть, а везти их не на чем, из-за чего синтез белка останавливается, а это фактически означает прекращение роста и переход в состояние персистенции. К тому же это способствует активации белка SpoT, играющего ключевую роль в развитии стрессового ответа (см. рис. 6).
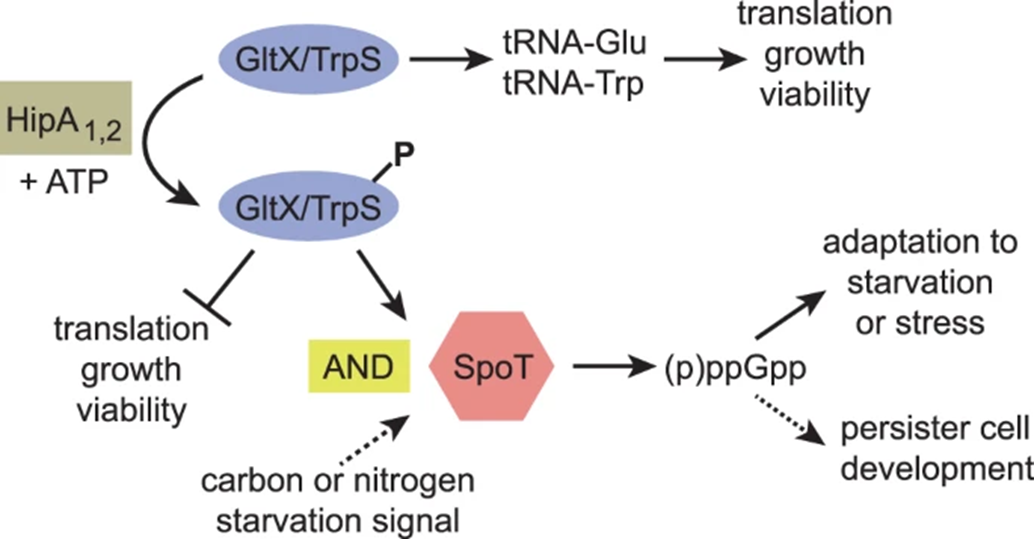
Рисунок 6. Регуляторная сеть токсина HipA. Токсин HipA — киназа, которая фосфорилирует глутамил-тРНК-синтазу и триптофанил-тРНК-синтазу, что приводит к снижению их активности. Это подавляет трансляцию, а следовательно, и рост бактерии с последующим уменьшением ее жизнеспособности, но для развития персистентного состояния только этого недостаточно. Вкупе с этим клетка должна испытывать углеродное или азотное голодание. Тогда происходит активация белка SpoT (или RelA, соответственно) [25], катализирующего реакцию ГДФ (ГТФ) + АТФ = (p)ppGpp + АМФ. (p)ppGpp называют гуанозинпентафосфатом или гуанозинтетрафосфатом, соответственно. Его действие основано на аллостерическом связывании с кор-ферментом РНК-полимеразы, которое изменяет ее «предпочтения» при выборе σ-фактора. Основными конкурирующими сторонами в большинстве случаев выступают факторы σ70 и σ38 [26]. Первый способствует инициации транскрипции «обычных» генов домашнего хозяйства, второй связывается с промоторами «стрессовых» генов. Так вот, сцапав в аллостерический центр (p)ppGpp, РНК-полимераза гораздо легче связывается с σ38, чем с σ70. Это запускает стрессовый ответ и развитие персистенции.
В разделе «Итак, начнем...» уже упоминалось некоторое разногласие среди исследователей относительно того, какой фактор, уменьшающий отношение антитоксина к токсину, является постоянным, а какой — переменным: интенсивность деградации антитоксина или же его трансляции. На основе каждой из теорий были сформированы две модели: «активная» и «пассивная» (рис. 7).
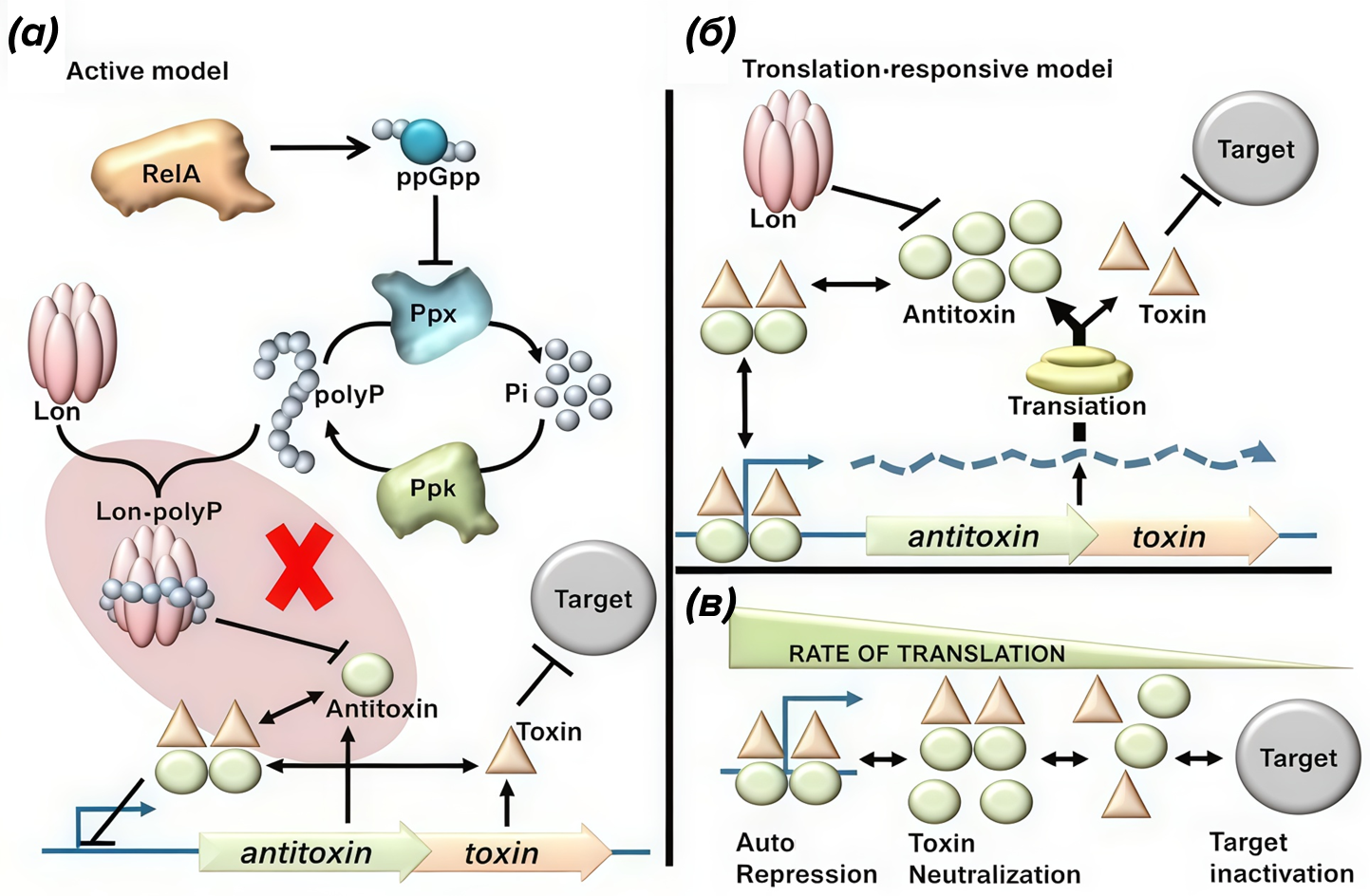
Рисунок 7. Различные модели регуляции систем токсин–антитоксин типа II. (а) — «активная» модель, показанная на примере RelA-опосредованной индукции персистентного состояния; (б) — «пассивная» модель, согласно которой скорость транскрипции оперона ТА-модуля косвенно зависит от интенсивности трансляции; (в) — последствия регуляции транскрипции генов ТА-модуля по «пассивной» модели. При наибольшей интенсивности трансляции образующийся комплекс Т-А подавляет транскрипцию. При уменьшении интенсивности трансляции комплекс сначала становится нейтральным, а в дальнейшем, при совсем уж низком соотношении антитоксин/токсин, свободный токсин начинает свой «рейд» по клетке. Подробнее см. текст.
Активная модель признает постоянство скорости трансляции, опутывая регуляторными сетями протеазы и РНКазы, которые ускоряют или замедляют деградацию антитоксина. В частности, эта модель описывает процесс развития персистенции, дополняя рис. 6. Алармон ppGpp аллостерически связывается с ферментом экзополифосфатазой (PPX), ингибируя его. Этот фермент катализирует терминальную (начиная с конца) деполимеризацию длинных молекул — полифосфатов, которые являются компактными «связками» из ценных фосфатных групп. PPX работает в тандеме с другим ферментом, своим антагонистом — полифосфаткиназой (PPK) [27], которая, соответственно, полимеризует фосфатные группы в «связку». Значит, при увеличении концентрации ppGpp возрастет концентрация полифосфатов. А они, как утверждали сторонники активной модели, являются модуляторами (усилителями) Lon-протеазы, вследствие чего скорость деградации и так не стабильного белка-антитоксина возрастает. Таким образом, модель признает основным индуктором персистенции стресс. И тут было бы неплохо привести ссылки на подтверждающие статьи, если бы... большинство из них не было отозвано. И на то были причины. Главная из них: отсутствие доказательств того, что Lon-зависимая деградация зависит от полифосфатов. Напротив, в последующих исследованиях было показано, что полифосфаты в этом процессе не участвуют [28]. К тому же, активная модель предполагает, что регуляция ТА-модулей является бистабильной, т.е. у их оперонов есть лишь два состояния: «включено», при котором преобладает транскрипция токсина, и «выключено», при котором верх берет антитоксин. В свете данных об ауторегуляции комплексами Т-А своей транскрипции и присутствии нескольких сценариев образования комплекса (см. раздел «Итак, начнем...» и рис. 7в) это утверждение кажется спорным.
Теперь рассмотрим, что же демонстрирует «пассивная» модель. Интенсивность общеклеточной трансляции может сильно варьировать, и зависит она от многих факторов. А если клетка переходит в состояние покоя, то ингибирование трансляции как основная причина его развития выглядит очень логично: бактерии не только не приходится тратить драгоценный АТФ на интенсивный протеолиз, но и синтезировать белки вообще. Так гораздо экономнее, не правда ли? К тому же, тут действует другая система, объясняющая также потенциальное усиление деградации антитоксина. При падении интенсивности трансляции, обусловленном дефицитом аминокислот (один из факторов, активирующих SpoT!), рибосомы останавливают свою работу, за чем следует активация неспецифичных протеаз, кромсающих многие белки почти без разбора, в т.ч. и антитоксины. Однако эта модель также придает значение и постоянству скорости протеолиза в стационарной, спокойной среде. Попробуем соединить вместе то, что мы уже знаем, и проследим за одним экспериментом [29]. Предположим, что в каком-нибудь штамме бактерии будет дефицит протеазы. К чему это приведет? К падению скорости деградации антитоксина. Следовательно, в условиях более эффективной его трансляции по сравнению с токсином будет происходить его накопление. Соотношение антитоксин/токсин будет неуклонно возрастать! А ранее уже было сказано, что при слишком высоком этом соотношении комплекс Т-А будет подавлять собственную транскрипцию. Как итог — опероны ТА-модулей обречены на вечное «молчание». То есть скорость транскрипции в данном случае оказывается зависима от интенсивности трансляции. Значит, в такой модели нужно менять именно скорость трансляции, и вслед за ней будет меняться и скорость транскрипции.
За кем же правда? Это еще предстоит выяснить.
Второе, что стоит упомянуть — это вклад некоторых ТА-модулей в клеточный иммунитет. «Натуралистами открыты у паразитов паразиты», как писал Дж. Свифт. В случае бактерий ими стали особые вирусы — бактериофаги [30], или просто фаги, а открыли их независимо друг от друга английский бактериолог Фредерик Туорт и канадско-французский микробиолог Феликс д’Эрелль в 1915 году и 1917 году, соответственно. Бактериофаги, как и все вирусы, при заражении «впрыскивают» свою ДНК (или РНК, хоть и реже) внутрь бактерии. После этого внутри нее разворачивается настоящая битва вооружений — результат эволюционной гонки длиной в миллиарды лет. Фаг всеми силами пытается остаться незамеченным, а бактерия — обнаружить незваного гостя и среагировать на вторжение как можно быстрее. Линий обороны у бактерий множество, и они являются излюбленной темой для исследователей (например, не так давно открытая система PARIS [31], или нашумевшая система CRISPR-Cas9, или система рестрикции-модификации [32]). Причем они не функционируют обособленно друг от друга, а оказываются вплетены в сеть взаимно скоординированных взаимодействий [33]. Впрочем, у вирусов есть почти так же много хитростей и уловок, позволяющих им проскользнуть мимо всех цепных псов и переплыть все рвы, так сказать [34].
В защиту от «закадычных врагов» бактерий оказались вовлечены и некоторые ТА-модули. Пример: система DarTG [35]. Токсин DarT представляет собой ДНК-АДФ-рибозилтрансферазу, присоединяющую к вирусной ДНК остатки АДФ-рибозы, тем самым подавляя ее репликацию (воспроизведение). А раз нет репликации, нет и образования новых вирионов, и план вируса по превращению бактерии в фабрику по производству себе подобных проваливается. Но бактериофаги, не менее ловкие, чем бактерии, прохиндеи, придумали как минимум два способа обмануть и эту систему защиты [36]. Одни фаги, например, SECφ18, накопили мутации в гене своей ДНК-полимеразы, в результате чего та стала невосприимчивой к преграде в виде АДФ-рибозы. Другие в результате однонуклеотидного полиморфизма в гене gp145 [37] приобрели два белка, AdfA и AdfB, которые ведут себя как антитоксины системы типа II, взаимодействуя с DarT и нейтрализуя его эффект.
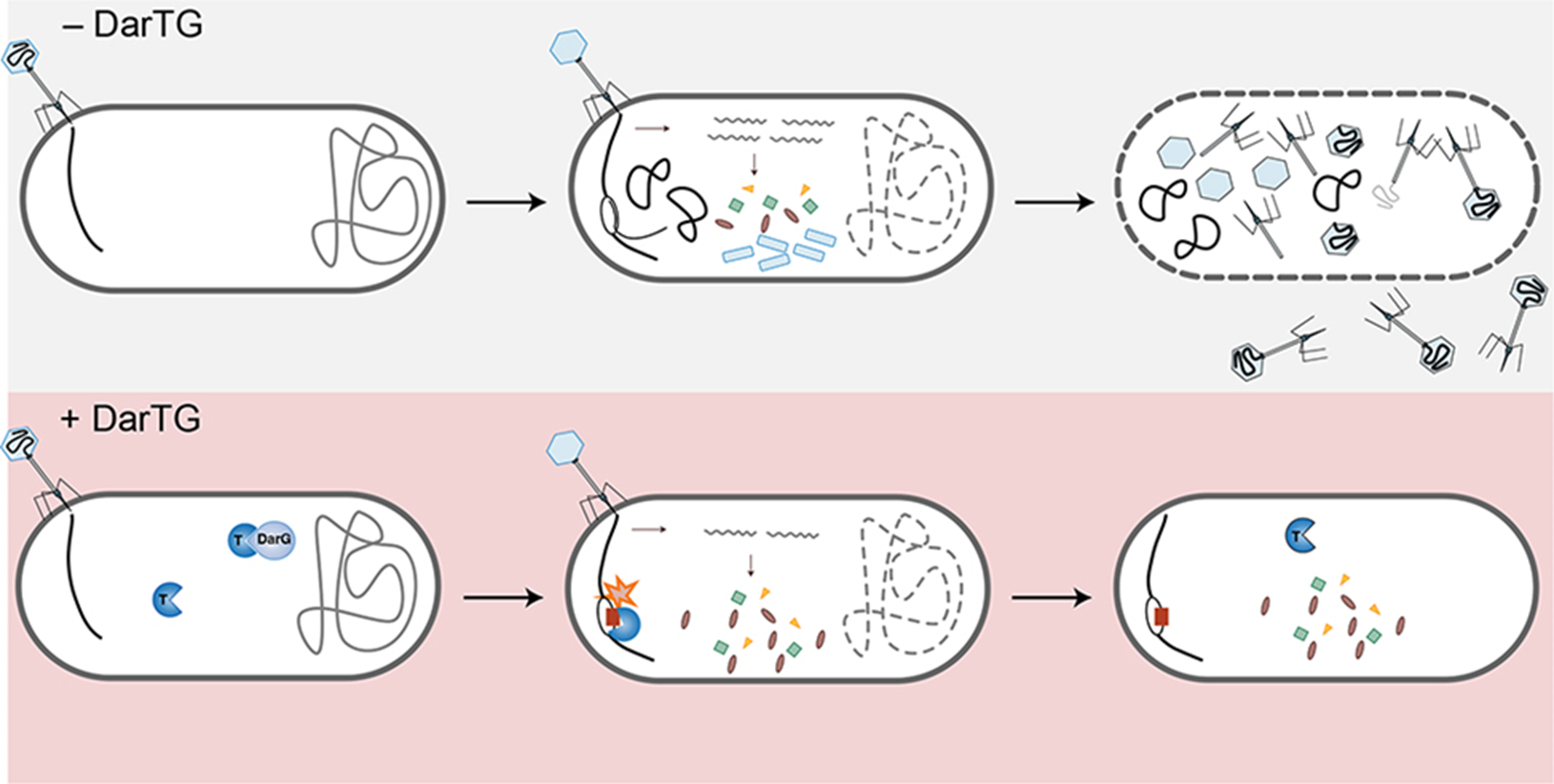
Рисунок 8. Принцип работы системы DarTG. В отсутствие ТА-модуля в бактерии (DarTG-) вирусная нуклеиновая кислота проникает в бактерию, где начинается ее репликация и транскрипция, за чем следует сборка вирусных капсидов и, как правило, скорый лизис клетки.
Если же бактерии посчастливилось быть носителем ТА-модуля семейства DarTG (DarTG+), то при попадании вирусной ДНК в цитоплазму происходит высвобождение и активация DarT, являющейся т.н. ДНК-АДФ-рибозилтрансферазой — ферментом, модифицирующим вирусную ДНК остатками АДФ-рибозы, блокируя репликацию и тем самым останавливая образование новых зрелых вирионов.
Следующая функция демонстрирует феномен, претендующий на звание исковерканной китайской мудрости: эгоизм порождает альтруизм. Первично эгоистичное поведение ТА-модулей вызывает альтруистичное поведение отдельно взятой бактерии, служащее на благо целой колонии. Организация бактерий в колонии столь многогранна и продумана эволюцией, что невольно наводит на мысль о многоклеточных организмах [38]. А с помощью ТА-модулей бактерия способна пожертвовать собой во благо колонии. Например, при длительном голодании по аминокислотам, E.coli начинает гиперэкспрессировать токсин из системы mazEF [39], который запускает программируемую клеточную гибель, а на ее останках пируют ее сородичи, что позволяет им выжить. Уже сама программируемая клеточная гибель для защиты колонии — это очень «по-многоклеточному»!
Что мы можем? Возможности для биотехнологии
К сожалению, пока что использование ТА-модулей в медицине и биотехнологии исследовано недостаточно, и возможности, описанные ниже – пока что лишь перспективы, хотя и весьма заманчивые. Слишком уж недавно началось глубинное исследование этой темы, хотя его обороты все еще представляются недостаточно интенсивными.
Во-первых, очевидно, ТА-модули рассматриваются в качестве будущих мишеней для лекарственных препаратов [40]. Плавно перетекая в биоинженерию, рассмотрим еще один модуль. Его особенность в том, что это не ТА-модуль, а скорее ТАШ-модуль (или, следуя международной привычке, TAC-модуль), потому что, помимо двух воюющих лагерей, на поле брани оказывается «полевой медик» — шаперон [41]. Это белковые машины, обеспечивающие нормальную укладку белков в структуру, в которой они становятся активны. Напрашивается предположение, что «медики» работают на стороне антитоксина как более нестабильного «бойца». Было показано, что антитоксин в таких системах несет короткую C-концевую последовательность, именуемую ChAD, и являющуюся визитной карточкой для шаперона SecB, который, кстати, является частью бактериальной секреторной системы Sec [42]. Примечателен также тот факт, что пары ChAD/SecB могут функционировать обособленно, как самостоятельный модуль. Поэтому, если в классическом ТА-модуле к антитоксину «пристегнуть» последовательность ChAD, а в оперон еще добавить ген шаперона, то вся система станет зависимой от шаперона. Возможность модификации систем токсин-антитоксин, приведение их в некотором роде «под одну гребенку» представляется заманчивой перспективой общей регуляции работы ТА-модулей множества колоний в культуре со сразу несколькими ТА-модулями, поскольку все они в этом случае будут зависеть в значительной степени от одного белка — шаперона. Систем много, решение — одно.
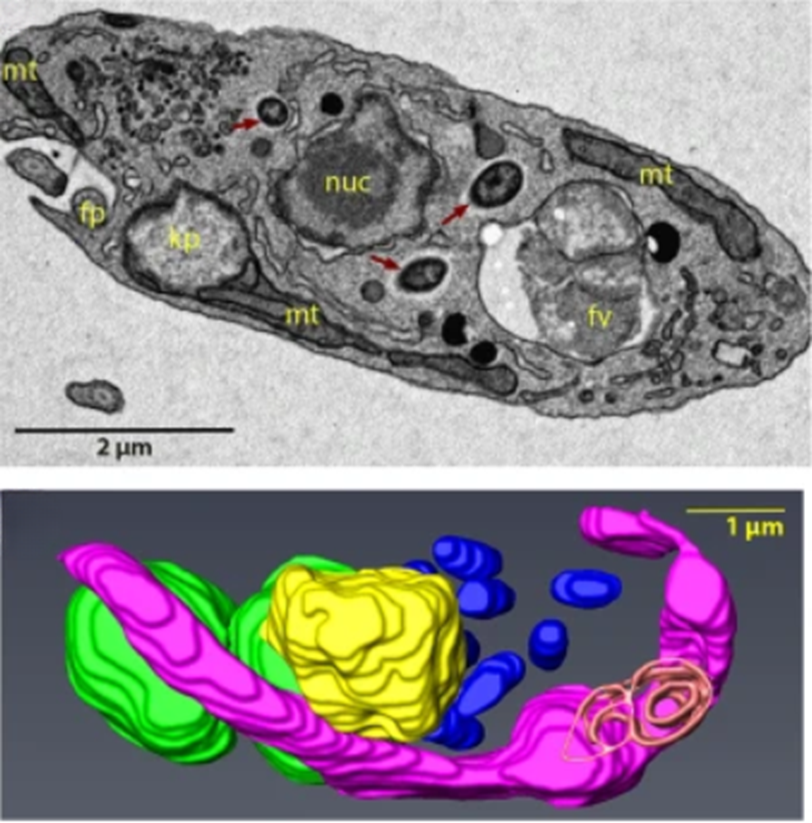
Рисунок 9. Симбиоз бактерий Candidatus Bodocaedibacter vickermanii с Bodo saltans. B. saltans и ее эндосимбионты — бактерии Candidatus Bodocaedibacter vickermanii. Вверху показана трансмиссионная электронная микрофотография, на которой обозначено относительное положение в клетке протиста ядра (nuc), митохондрии (mt), жгутикового кармана (fp), пищеварительной вакуоли (fv), кинетопласта (kp) и бактерий-симбионтов (три бордовые стрелки). Внизу видна 3D-модель, демонстрирующая относительное положение органоидов в клетке и C. B. vickermanii (синие).
Завершая наш рассказ, хочется упомянуть про совсем уж замысловатую комбинацию адаптаций, порабощений и симбиозов. Жгутиконосное простейшее Bodo saltans (класс Kinetoplastea, к которому относятся также небезызвестные лейшмании и трипаносомы), несет в себе симбиотических бактерий Candidatus Bodocaedibacter vickermanii, похожих на Paracaedibacter (рис. 9). Ну, как симбиотических... Оказалось, что только два пути, биосинтез лизина и треонина, оказались потенциальными кандидатами на сотрудничество протиста и бактерии. Для бактерий жгутиконосец — и стол, и дом, а вот B. saltans от своего квартиранта избавиться не может, а мешают ему ТА-модули и секреторная система Sec. Токсином и антитоксином, который бактерия производит сама, она щедро делится и с жгутиконосцем, секретируя их в его цитоплазму [43]. Пресловутый эгоизм, косвенно распространяющийся на эукариота, но к которому бактерия, ставшая «эгоистичным симбионтом», приспособлена долгой эволюцией, а вот на ее «симбионте» защелкивается ошейник! Выходит, бактерии научились не только защищать себя и своих собратьев, используя ТА-модули, но и проводить с их помощью полноценную интервенцию. А человек по мере овладения технологией контроля действия ТА-модулей и открытия новых подобных примеров зависимости эукариот от прокариот сможет получать все большую власть и над ними. Но важно понимать, что пока это тоже лишь заманчивая перспектива.
Что же дальше?
Итак, мы подошли к заключению, что мы опять в начале пути. Нет, серьезно: ТА-модули эволюционировали вместе с бактериями миллиарды лет, и у них было достаточно времени для того, чтобы сформировать сногсшибательное разнообразие систем, всех сортов и мастей, с таким количеством примеров, что хоть отдельную книгу про это пиши. И это разнообразие далеко не всегда идет на пользу людям: бактерии — мастера превращать оружия врагов в свои собственные; «все, что их не убивает, делает сильнее». Зло и невзгоды для них — учителя и сенсеи, закаляющие их микроскопические тела. Не лишены они и навыков дипломатии: если есть возможность превратить своего врага в своего союзника или вообще в свою часть — они это сделают, рано или поздно. Точно так же произошло и с ТА-модулями — плодом случайности, закабалившей бактерии, может быть, на миллионы лет. Но пока одни тоскливо напевают: We are all just prisoners here of our own device, другие действуют. Весь вопрос в том, кто? Антибиотикорезистентность ведь наше творение... Сможем ли мы выбраться из порочного круга, выйти из баталии между антибиотиком и устойчивостью победителями? Возможно, так, как это делают бактерии, переставив какую-нибудь шестеренку из бактериального механизма в свой, обратив ее против них? Возможно, когда-нибудь наши враги и убийцы станут нашими союзниками, которые спустя сотни лет будут уже неотъемлемой частью нашей жизни. А пока война с крутыми парнями продолжается, нам приходится узнавать о них как можно больше, чтобы давать достойный отпор, чтобы в лабораториях бессонными ночами рождались планы контрнаступления. Какую роль могут в этом сыграть ТА-модули? Очень уж много здесь вариантов и возможностей, от вполне обоснованных гипотез до догадок, близких к научной фантастике. Слишком уж обширна сеть интеграций ТА-модулей в молекулярные механизмы, благодаря которым бактерии держатся на плаву в тяжелые времена. Слишком уж полезны эти эгоисты, и для кого в большей степени — время покажет.
Литература
- Asli Yildirim, Michael Feig. (2018). High-resolution 3D models of Caulobacter crescentus chromosome reveal genome structural variability and organization. Nucleic Acids Research. 46, 3937-3952;
- Противостояние с резистентными бактериями: наши поражения, победы и планы на будущее;
- Персистенция бактерий — угроза, которую мы не замечаем в страхе перед антибиотикорезистентностью;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- Ciarán Condon. (2007). Maturation and degradation of RNA in bacteria. Current Opinion in Microbiology. 10, 271-278;
- Irene Lee, Carolyn K. Suzuki. (2008). Functional mechanics of the ATP-dependent Lon protease- lessons from endogenous protein and synthetic peptide substrates. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1784, 727-735;
- Régine Brielle, Marie-Laure Pinel-Marie, Brice Felden. (2016). Linking bacterial type I toxins with their actions. Current Opinion in Microbiology. 30, 114-121;
- Garima Singh, Mohit Yadav, Chaitali Ghosh, Jitendra Singh Rathore. (2021). Bacterial toxin-antitoxin modules: classification, functions, and association with persistence. Current Research in Microbial Sciences. 2, 100047;
- Nathan Fraikin, Frédéric Goormaghtigh, Laurence Van Melderen. (2020). Type II Toxin-Antitoxin Systems: Evolution and Revolutions. J Bacteriol. 202;
- Francesca L. Short, Chidiebere Akusobi, William R. Broadhurst, George P. C. Salmond. (2018). The bacterial Type III toxin-antitoxin system, ToxIN, is a dynamic protein-RNA complex with stability-dependent antiviral abortive infection activity. Sci Rep. 8;
- Hisako Masuda, Qian Tan, Naoki Awano, Kuen‐Phon Wu, Masayori Inouye. (2012). YeeU enhances the bundling of cytoskeletal polymers of MreB and FtsZ, antagonizing the CbtA (YeeV) toxicity in Escherichia coli. Molecular Microbiology. 84, 979-989;
- Xiaoxue Wang, Dana M Lord, Hsin-Yao Cheng, Devon O Osbourne, Seok Hoon Hong, et. al.. (2012). A new type V toxin-antitoxin system where mRNA for toxin GhoT is cleaved by antitoxin GhoS. Nat Chem Biol. 8, 855-861;
- Танец знамений: убиквитин и протеасома в судьбе внутриклеточных белков;
- Monica Markovski, Sue Wickner. (2013). Preventing Bacterial Suicide: A Novel Toxin-Antitoxin Strategy. Molecular Cell. 52, 611-612;
- Xiaoxue Wang, Jianyun Yao, Yi-Cheng Sun, Thomas K. Wood. (2021). Type VII Toxin/Antitoxin Classification System for Antitoxins that Enzymatically Neutralize Toxins. Trends in Microbiology. 29, 388-393;
- Dukas Jurėnas, Nathan Fraikin, Frédéric Goormaghtigh, Laurence Van Melderen. (2022). Biology and evolution of bacterial toxin–antitoxin systems. Nat Rev Microbiol. 20, 335-350;
- Alexander Harms, Ditlev Egeskov Brodersen, Namiko Mitarai, Kenn Gerdes. (2018). Toxins, Targets, and Triggers: An Overview of Toxin-Antitoxin Biology. Molecular Cell. 70, 768-784;
- Breann L. Brown, Dana M. Lord, Simina Grigoriu, Wolfgang Peti, Rebecca Page. (2013). The Escherichia coli Toxin MqsR Destabilizes the Transcriptional Repression Complex Formed between the Antitoxin MqsA and the mqsRA Operon Promoter. Journal of Biological Chemistry. 288, 1286-1294;
- Bhaskar Chandra Mohan Ramisetty. (2020). Regulation of Type II Toxin-Antitoxin Systems: The Translation-Responsive Model. Front. Microbiol.. 11;
- Emeric W Sevin, Frédérique Barloy-Hubler. (2007). RASTA-Bacteria: a web-based tool for identifying toxin-antitoxin loci in prokaryotes. Genome Biol. 8;
- Dugger G. A dictionary of life sciences. London: Macmillan, 1976. — 392 p.;
- «Элементы»: «Мобильная ДНК заставляет бактерии жертвовать собой»;
- Salif Ba, Anne Willems, Philippe de Lajudie, Philippe Roche, Habib Jeder, et. al.. (2002). Symbiotic and Taxonomic Diversity of Rhizobia Isolated from Acacia tortilis subsp. raddiana in Africa. Systematic and Applied Microbiology. 25, 130-145;
- Charlie Y. Huang, Carlos Gonzalez-Lopez, Céline Henry, Ivan Mijakovic, Kathleen R. Ryan. (2020). hipBA toxin-antitoxin systems mediate persistence in Caulobacter crescentus. Sci Rep. 10;
- Gemma C. Atkinson, Tanel Tenson, Vasili Hauryliuk. (2011). The RelA/SpoT Homolog (RSH) Superfamily: Distribution and Functional Evolution of ppGpp Synthetases and Hydrolases across the Tree of Life. PLoS ONE. 6, e23479;
- Mark Paget. (2015). Bacterial Sigma Factors and Anti-Sigma Factors: Structure, Function and Distribution. Biomolecules. 5, 1245-1265;
- M. Akiyama, E. Crooke, A. Kornberg. (1993). An exopolyphosphatase of Escherichia coli. The enzyme and its ppx gene in a polyphosphate operon.. Journal of Biological Chemistry. 268, 633-639;
- Bhaskar C. M. Ramisetty, Dimpy Ghosh, Maoumita Roy Chowdhury, Ramachandran S. Santhosh. (2016). What Is the Link between Stringent Response, Endoribonuclease Encoding Type II Toxin–Antitoxin Systems and Persistence?. Front. Microbiol.. 7;
- Susanne K Christensen, Kim Pedersen, Flemming G Hansen, Kenn Gerdes. (2003). Toxin–antitoxin Loci as Stress-response-elements: ChpAK/MazF and ChpBK Cleave Translated RNAs and are Counteracted by tmRNA. Journal of Molecular Biology. 332, 809-819;
- Огромный и загадочный мир бактериофагов;
- Nathaniel Burman, Svetlana Belukhina, Florence Depardieu, Royce A. Wilkinson, Mikhail Skutel, et. al.. (2024). A virally encoded tRNA neutralizes the PARIS antiviral defence system. Nature. 634, 424-431;
- «Элементы»: «Две системы бактериального „иммунитета“ помогают друг другу бороться с вирусами»;
- Clemente F. Arias, Francisco J. Acosta, Federica Bertocchini, Miguel A. Herrero, Cristina Fernández-Arias. (2022). The coordination of anti-phage immunity mechanisms in bacterial cells. Nat Commun. 13;
- Как преодолеть PARIS с помощью тРНК;
- Michele LeRoux, Sriram Srikant, Gabriella I. C. Teodoro, Tong Zhang, Megan L. Littlehale, et. al.. (2022). The DarTG toxin-antitoxin system provides phage defence by ADP-ribosylating viral DNA. Nat Microbiol. 7, 1028-1040;
- Anna Johannesman, Leila C. Awasthi, Nico Carlson, Michele LeRoux. (2025). Phages carry orphan antitoxin-like enzymes to neutralize the DarTG1 toxin-antitoxin defense system. Nat Commun. 16;
- Kishen M. Patel, Kimberley D. Seed. (2024). Sporadic phage defense in epidemic Vibrio cholerae mediated by the toxin-antitoxin system DarTG is countered by a phage-encoded antitoxin mimic. mBio. 15;
- Биопленки. Как живется в бактериальных многоэтажках?;
- Hanna Engelberg-Kulka, Ronen Hazan, Shahar Amitai. (2005). mazEF: a chromosomal toxin-antitoxin module that triggers programmed cell death in bacteria. Journal of Cell Science. 118, 4327-4332;
- Wai Ting Chan, Dolors Balsa, Manuel Espinosa. (2015). One cannot rule them all: Are bacterial toxins-antitoxins druggable?. FEMS Microbiology Reviews. 39, 522-540;
- Patricia Bordes, Ambre Julie Sala, Sara Ayala, Pauline Texier, Nawel Slama, et. al.. (2016). Chaperone addiction of toxin–antitoxin systems. Nat Commun. 7;
- Erin R. Green, Joan Mecsas. (2016). Bacterial Secretion Systems: An Overview. Microbiol Spectr. 4;
- Samriti Midha, Daniel J Rigden, Stefanos Siozios, Gregory D D Hurst, Andrew P Jackson. (2021). Bodo saltans (Kinetoplastida) is dependent on a novel Paracaedibacter -like endosymbiont that possesses multiple putative toxin-antitoxin systems. The ISME Journal. 15, 1680-1694.







