И жили они долго и счастливо — что такое CRM и с чем его едят
12 ноября 2018
И жили они долго и счастливо — что такое CRM и с чем его едят
- 3430
- 1
- 9
Суда Сюй Фу. Картина японского живописца Утагавы Куниёси (1797–1861).
-
Автор
-
Редактор
Темы
Статья на конкурс «био/мол/текст»: В Древнем Китае императоры очень хотели найти эликсир бессмертия и отправляли целые экспедиции на его поиски. Так, в 219 г. до н.э. император Цинь Шихуанди из династии Цинь послал к Восточному Морю даосского алхимика Сюй Фу и 500 юношей c 500 девушками впридачу. Они не вернулись и, по легенде, нашли Японию. Если бы император жил в наше время, ему бы не пришлось тратить казну на такие экстремальные мероприятия: он мог бы просто держать при дворе ученых, изучающих CRM (caloric restriction mimetics) — вещества, которые имитируют эффект ограничения калорий и, возможно, станут нашим эликсиром бессмертия. О них и пойдет речь в статье.
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2018.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Мы живем дольше — но не здоровее. Есть ли решение проблемы?
Ожидаемая продолжительность жизни стабильно растет, и население Земли, в глобальном смысле, стареет. Так, предположительно, к 2030 году население старше 65 лет будет составлять уже 19,3% — против 13% в 2010 году [1].
Однако, по данным ВОЗ, сам по себе возраст является основным фактором риска развития серьезных заболеваний, которые часто становятся причинами смерти [1]. Это сердечно-сосудистые и некоторые нейродегенеративные заболевания (например, болезнь Альцгеймера [2], [3]), злокачественные опухоли и диабет II типа (как ни удивительно, по прогнозам ВОЗ, к 2030 году он будет занимать седьмое место среди причин смертности). Ожидается, что в течение 20 следующих лет число людей, страдающих от этих заболеваний, удвоится [1]. Что же делать?
Пока найдено несколько стратегий, и три из них связаны с изменением образа жизни — это ограничение потребления калорий, интервальное голодание (режим питания с длительными периодами без приемов пищи) и достаточная физическая активность. Но лишь немногим хватает самодисциплины, чтобы изменить свой образ жизни и поддерживать его [4], [5]. Что делать остальным?
Подробнее о связи питания с развитием заболеваний и старением читайте в статьях «Биомолекулы»: «Нутригеномика: питание vs. заболевания» [6], «Нутригеронтология: питание vs. старение» [7].
Кажется, есть альтернативное решение — CRM (caloric restriction mimetics) [8]. Это большая группа веществ, и сейчас активно ведутся их испытания и поиск новых соединений. Большинство из CRM пока существует только в виде БАДов и традиционных средств лечения, но есть и те, что уже используются в доказательной медицине.
Решений много, но в чем суть?
Несмотря на кажущееся разнообразие решений, все они направлены на одно — усиление аутофагии — процесса, при котором клетка «переваривает» собственные структуры. Это необходимо для ее обновления и удаления «отслуживших своё» частей [9], [10]. Скорость аутофагии увеличивается при недостатке питательных веществ и под действием CRM.
Еще про аутофагию можно прочитать в статьях «Биомолекулы» «Аутофагия, протофагия и остальные» [11] и «Нобелевская премия по медицине и физиологии 2016: за самоедство» [12].
Регуляция аутофагии — сложный процесс, в котором участвует много путей оповещения клетки. Клетка может реагировать на сигнал двумя способами:
- включать и выключать транскрипцию генов и медленно менять количество в клетке белков, которые ими кодируются;
- быстро менять активность уже имеющихся белков путем химических модификаций.
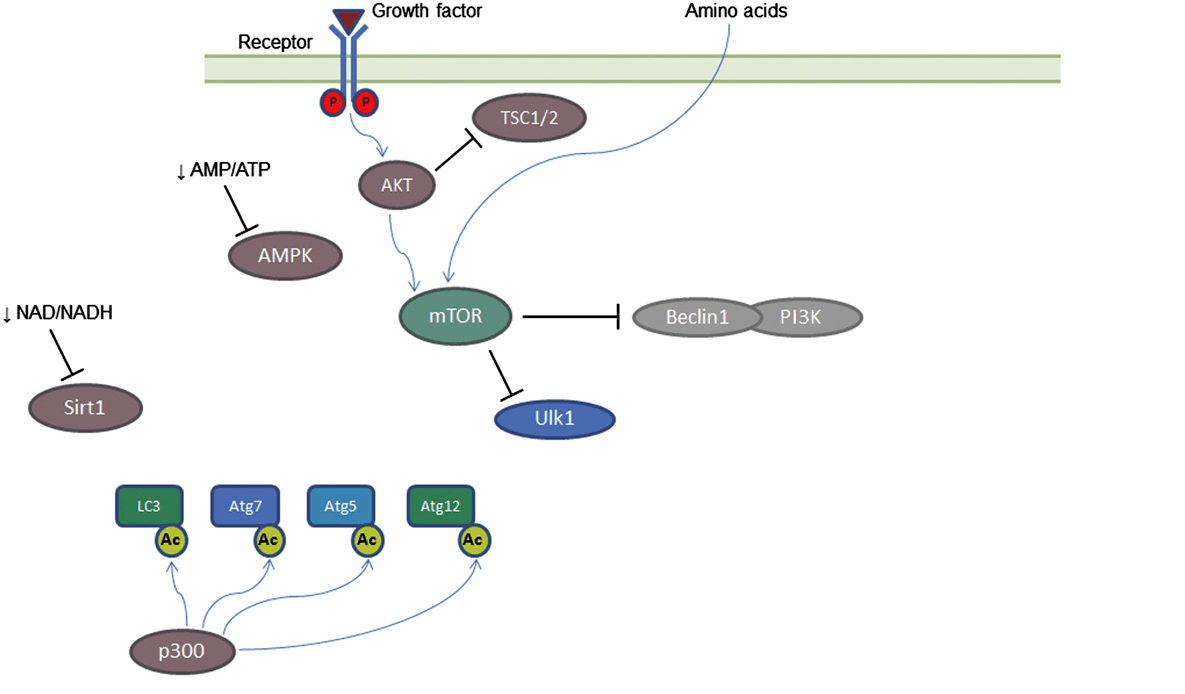
Главные из таких модификаций — присоединение к молекуле полипептида фосфатной или ацетильной группы. Так регулируется состояние и активность многих белков, в том числе ферментов. Источниками этих групп являются молекулы АТФ и ацетилкофермента А (ацКоА), и их содержание в клетке говорит о наличии в ней энергетических запасов и питательных веществ. Так, молекула АТФ запасает энергию в собственных связях и необходима для протекания большинства энергозатратных реакций, которых в клетке очень много. А ацетил-КоА — продукт расщепления глюкозы, аминокислот с разветвленными цепями и жирных кислот, то есть почти всех питательных веществ. Есть и NADH — важный игрок, который поставляет электроны для многочисленных окислительно-восстановительных реакций. Получается такая цепочка, как на рисунке 1.

Рисунок 1. Как поступление питательных веществ контролирует протекание реакций и состояние ферментов в клетке
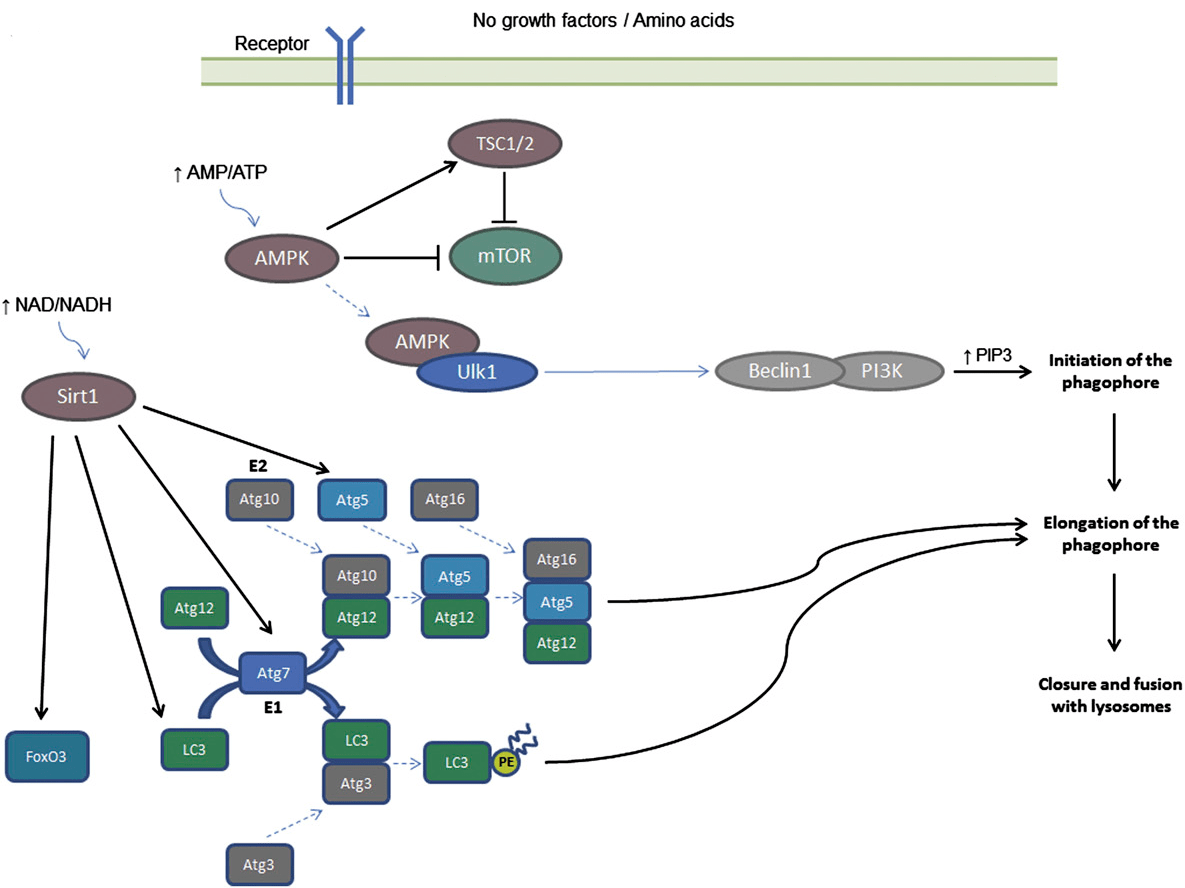
Как это реализуется на молекулярном уровне? Посмотрим поближе — рисунок 2.
Схема кажется запутанной, но все не так сложно:
- Про АТФ и NADH мы только что говорили. Они очень важны, и клетке надо точно знать, есть ли они и в каком количестве. Поэтому молекулы АМФ и NAD+ (то, что остается после использования АТФ и NADH) могут самостоятельно контролировать активность некоторых ферментов (в нашем случае AMPK и сиртуина SIRT1). Если питательных веществ много, много и АТФ с NADH — и ферменты неактивны. Когда питательных веществ не хватает, АТФ и NADH расходуются с образованием АМФ и NAD+, и ферменты активируются.
- Есть специальные рецепторы факторов роста — молекул, которые сообщают клетке, что ей надо расти, делиться и, вообще, развиваться. Они активируют фермент протеинкиназу B альфа(AKT), а та — фермент mTOR, который присоединяет фосфатную группу к комплексам Ulk1 и Beclin/class III P13K, чтобы они не работали. Именно эти комплексы ответственны за активацию аутофагии — и, если факторов роста нет, они активируются.
- Есть фермент P300 — он отвечает за перенос ацетильных групп и, понятно, активен, когда они есть. Когда много питательных веществ, много и ацетил-КоА, значит, P300 работает и ингибирует кучу ферментов, нужных для формирования и удлинения фагофора — мембранной структуры, которая, замыкаясь, формирует аутофагосому. Когда клетка голодает, P300 не работает, и запускается аутофагия.
Аутофагия — процесс, необходимый для нормальной жизни клетки. Он помогает:
- разрушать нарушенные или просто отслужившие своё белки и препятствовать появлению белковых агрегатов, а также удалять дефектные органеллы — например, отработавшие митохондрии;
- избавляться от внутриклеточных патогенов;
- сохранять поток потребления питательных веществ при голодании, повторно используя собственные структуры клетки в качестве источников аминокислот и нуклеотидов.
Неудивительно, что нарушения аутофагии тесно связаны с развитием многих заболеваний, включая нейродегенеративные и сердечно-сосудистые, а также с образованием злокачественных опухолей и воспалительных процессов [10].
Неужели так просто?
К сожалению, связь не всегда удачная — в зависимости от ситуации аутофагия может как помогать клеткам справляться со стрессом и выживать, так и окончательно разрушать их. Да и в зависимости от заболевания и его стадии бывает нужно либо сохранять, либо убивать клетки.
Так, например, происходит на разных стадиях развития злокачественных опухолей. На ранней стадии аутофагия может помогать организму — она стабилизирует геном клеток и удерживает их рост и деление. Но на поздних стадиях может, наоборот, помогать раковым клеткам. Например, часто бывает, что внутри опухоли плохо развита кровеносная система, и клеткам не хватает питательных веществ. А аутофагия помогает им использовать то, что есть (то есть собственные структуры) и выживать. Или из-за нее может хуже работать лечение — химио-, радио- и другие терапии.
Так же и при сердечно-сосудистых заболеваниях. Показано, что нарушения процесса аутофагии связаны с развитием сердечной недостаточности и болезни Данона (при которой клетка не может расщепить гликоген и накапливает его). А вот при нарушении кровоснабжения ткани сердца — ишемии — аутофагия помогает клеткам переживать стресс (так же, как и при плохом кровоснабжении опухоли).
Белковые включения и агрегаты в нейронах и межклеточном веществе играют ключевую роль в развитии некоторых нейродегенеративных заболеваний. В болезни Альцгеймера это — бета-амилоиды и нейрофибриллярные клубки из тау-белка. В болезни Паркинсона и некоторых других заболеваниях — тельца Леви, образованные из разных белков, полисахаридов и жирных кислот [13], [14]. В болезни Хантингтона — включения из белка хангтингтина [15]. Аутофагия же помогает клеткам рассасывать белковые агрегаты, и, возможно, с ее помощью их удастся вылечить.
Аутофагия важна и в процессах, связанных с инфекциями и иммунным ответом: в зависимости от вида патогена она может помогать ему или хозяину и она же является одним из поставщиков кусочков патогенных молекул для презентации антигена и развития иммунного ответа. Есть и данные о связи нарушения аутофагии с ожирением и диабетом второго типа.
Старение — очень сложный процесс, но одна из его черт — уменьшение скорости аутофагии и накопление продуктов метаболизма внутри клеток. Это может приводить ко всем упомянутым заболеваниям и, в итоге, к уменьшению продолжительности жизни. Стимуляция же аутофагии уменьшает вероятность развития связанных с возрастом болезней и увеличивает среднюю продолжительность жизни — и это уже показано на самых разнообразных объектах — от дрожжей и нематод до грызунов и макак [9].
Что же делать?
Как мы уже говорили, остаться молодыми поможет диета или физическая активность. К сожалению, самодисциплина хромает, и на них не приходится полагаться: по данным ВОЗ, уровень ожирения увеличился почти в три раза за последние 40 лет по всему миру [16]. И тренд, похоже, не собирается меняться: ученые из Гарвардской школы общественного здравоохранения считают, что более 57% современных детей в США будут страдать ожирением к 35 годам [17].
Поэтому важно искать фармакологические методы — и перспективными кажутся CRM, которые имитируют эффект диеты на аутофагию и здоровье.
Как мы уже обсудили, запуск аутофагии и ее регуляция — сложные процессы с кучей участников. А на каждого такого участника можно повлиять — это и делают CRM. Поэтому кандидатов на роль будущих лекарств очень много.
На заре исследований было предложено использовать антигликолитики (вещества, мешающие гликолизу) и ингибиторы переваривания и всасывания жиров и углеводов. Но вмешательство в такие процессы слишком глобально и затрагивает реакции, которые трогать не стоит. Из-за этого такие добавки небезопасны и имеют слишком много побочных эффектов — например, показано, что антигликолитик 2-дезоксиглюкоза обладает кардиотоксичностью [18].
Поэтому лучше, чтобы мишенями CRM были элементы, представленные на рисунке 2 — тогда действие лекарств будет точнее. Для любого фермента можно подобрать свои ингибиторы и активаторы, а также индукторы или супрессоры транскрипции. Сейчас исследования сосредоточились на нескольких контрольных точках:
- количество ацетил-КоА;
- количество NADH;
- активность сиртуинов;
- активность ацетилтрансферазы Р300 и связанного с ней фактора PCAF;
- активность протеинкиназы mTOR.
Конечно, деление несколько условно, и его точечность преувеличена — у вещества может быть множество эффектов, одно- или разнонаправленных, положительных или отрицательных. Мы увидим, что CRM влияют на самые разные патологии, но механизмы их действия до сих пор не до конца изучены — непонятно даже, все ли из них связаны с аутофагией, или есть и совсем другие пути. Поэтому так важно точно проследить действие каждого вещества и сопоставить выгоду, которую может получить пациент, с возможными побочными эффектами.
| Что регулируем | Вещество | Где содержится | Признано ли доказательной медициной, существуют ли лекарственные препараты (не БАДы) |
|---|---|---|---|
| АцКоА | Гидроксицитрат | Гарциния камбоджийская (карри), гибискус (чай каркадэ) | Нет |
| NADH | Никотинамид, никотиновая кислота, никотинамида рибозид | Ржаной хлеб, ананас, манго, фасоль, грибы, мясо, гречка, свёкла | Никотиновая кислота применяется для понижения уровня «плохого» холестерина и профилактики инфарктов |
| Ресвератрол | Красное вино, чай, орехи, виноград | Нет | |
| Кофеиновая кислота | Шалфей, тимьян, анис, корица | Нет | |
| Катехин, эпикатехин, эпигаллокатехин | Зеленый чай | Нет | |
| Р300 | Анакардическая кислота | Шкурка кешью | Нет |
| Гарцинол | Гарциния камбоджийская (карри) | Нет | |
| Куркумин | Куркума | Нет | |
| Спермидин | Дуриан, натто (сброженные бобы сои), соя, яблоки, орехи, брокколи | Нет | |
| Эпигаллокатехин-3-галлат | Зеленый чай | Нет | |
| mTOR | Рапамицин и рапалоги | Streptomyces hygroscopius | Да, иммунодепрессант |
Уровень ацетил-КоА
На содержание ацКоА в клетке может влиять гидроксицитрат, или гидроксилимонная кислота. Показано, что это вещество ингибирует фермент цитратлиазу, который синтезирует ацетил-КоА в процессе расщепления углеводов. Под действием гидроксицитрата ацКоА не образуется, и его уровень в клетке снижается. Гидроксицитрат содержится в плодах гарцинии камбоджийской и в гибискусе (а, значит, есть в составе карри и чая каркадэ) и входит в состав многочисленных жиросжигательных БАДов.

Рисунок 3. Примеры БАДов, которые содержат гидроксицитрат
Действительно, показано, что гидроксицитрат усиливает синтез белков у крыс [19] и снижает накопление жировых капель в куриных гепатоцитах [20]. Однако к людям это почти не относится: если добавки и обладают каким-то эффектом, то очень небольшим и краткосрочным [21]. К тому же зарегистрированы случаи, когда их употребление приводило к дисфункциям мужской репродуктивной системы — правда, скорее всего, это можно списать на недостатки производства [22], [23].
Уровень NADH
Как мы уже говорили, соотношение NAD и NADH контролирует активность ферментов сиртуинов. А изменить его могут предшественники NAD — никотинамид, никотиновая кислота (витамин B3, или ниацин) и никотинамида рибозид [24].
Уже показано, что никотинамида рибозид может регулировать окислительный стресс в нейронах, а также уменьшать патологии тау-белка и бета-амилоида и улучшать когнитивные показатели при болезни Альцгеймера [25]. Кроме того, он может предотвращать дегенерацию нейронов при эксайтотоксичности — патологии, при которой нейромедиаторы гиперактивируют рецепторы мозга, что приводит к повреждениям и смерти нейронов [26]. А так как эксайтотоксичность играет роль в патогенезе разнообразных дегенеративных заболеваний — от Альцгеймера до Паркинсона и рассеянного склероза — никотинамида рибозид теоретически может помочь при всех этих патологиях, но это еще предстоит изучить. В свою очередь никотинамид поддерживает функционирование сердца при кардиомиопатии [27]. Впрочем, праздновать рано, так как все эти исследования использовали только нейронные культуры и мышиные модели — то есть до человека пока далеко.
А вот действие никотиновой кислоты уже исследовалось на людях, и ее уже применяют для повышения уровня «хорошего» холестерина (высокой плотности) [28]. Впрочем, это не гарантирует эффективность в предотвращении сердечно-сосудистых заболеваний [29]. Также есть данные о том, что ниацин может положительно влиять на детское ожирение, но их слишком мало, чтобы делать однозначные выводы [30].
Активность сиртуинов
Активность сиртуинов можно регулировать некоторыми полифенолами [31], [32]. Например, в винограде, орехах, зеленом чае и красном вине содержится ресвератрол — возможная причина французского парадокса — относительно низкого уровня коронарной болезни сердца у нации, которая потребляет много холестерина и насыщенных жиров.

Рисунок 5. Примеры БАДов, которые содержат ресвератрол, катехин и кверцетин
Действительно, есть данные, что ресвератрол и его производные положительно действуют на микробиоту и — через нее — на сердечно-сосудистую систему и развитие ожирения [33]. Есть и исследования, которые говорят о влиянии ресвератрола на восстановление нейронов при болезни Альцгеймера [34]. Все это — пока на мышиных моделях. Но и у людей есть повод для радости: показано, что ресвератрол действительно работает как антиоксидант, и у принимавших его пациентов с диабетом II типа значительно уменьшились показатели маркеров окислительного стресса, а также индекс массы тела и кровяное давление [35].
Есть и другие полифенолы, такие как кофейная кислота и группа флавоноидов — катехин, эпикатехин и эпигаллокатехин, кверцетин и др. Так, еще с 90-х годов XX века кверцетин исследовали на предмет профилактики сердечно-сосудистых заболеваний — что важно, как на животных, так и на людях. Показано, что он понижает кровяное давление и, действительно, помогает. Причем в действие могут быть вовлечены и антиоксидантные свойства самого кверцетина, и эндотелий, и ангиотензинпревращающий фермент [36].
Активность P300
Веществ, которые могут влиять на активность фермента P300 — тьма, и изучены они лучше всех.

Рисунок 6. Примеры БАДов, которые содержат гарцинол, куркумин, спермидин и эпигаллокатехин-3-галлат
Вот анакардическая кислота может, влияя на биоэнергетические процессы клетки, приводить к митохондриальному стрессу и ингибировать пролиферацию культуры клеток рака молочной железы [37]. То есть, по сути, это один из митоканов, класса противораковых препаратов, цель которых — нарушение функционирования митохондрий и образование в них АФК (активных форм кислорода) [38]. Есть и другие механизмы, через которые анакардическая кислота может влиять на развитие рака. Так, она способна ингибировать ангиогенез (образование новых сосудов) внутри опухоли, тем самым лишая раковые клетки доступа к питательным веществам [39]. Или работать в синергии с другими препаратами: есть in vitro исследование, в котором анакардическая кислота, загруженная в липосомы вместе с митоксантроном (противоопухолевым препаратом), повышала его эффективность и в то же время защищала нормальные, нераковые, клетки [40].
Гарцинол тоже неплохо изучен [41]. Показано, что он обладает антиоксидантным, противомикробным и противораковым действиями, и уже накоплено столько исследований in vitro и на животных моделях, что осталось проверить его токсичность и фармакокинетику — и можно переходить к клиническим испытаниям [42–44].
Куркумин не отстает — его антибактериальные свойства открыли еще в 1949 году, а к нашему времени уже накопили множество результатов исследований как на животных моделях (от мышей до лошадей и обезьян), так и на людях (в ходе доклинических испытаний). Исследовалась его активность при борьбе с раком, неврологическими, аутоиммунными, сердечно-сосудистыми, метаболическими заболеваниями и болезнями печени и легких [45]. Ну чем не панацея? Правда, пока Национальный центр комплементарной и интегративной медицины (если проще — Центр нетрадиционной медицины) дает куда более скромные обещания. По их данным, доклинические испытания показывают, что куркуминоиды могут: уменьшить количество инфарктов после операции по шунтированию сердца, уменьшить боль в колене при остеоартрите так же эффективно, как ибупрофен, и убрать кожные раздражения после радиотерапии. А некоторые исследователи решили, что куркумин будет эффективно бороться с зубным налетом в составе ополаскивателя полости рта [46]. Почему бы и нет?
А спермидин недавно заслужил целый обзор в Science [47]: его кардио- и нейропротекторные свойства, а также стимулирование противоракового действия иммунной системы хорошо изучены на мышах. Но, главное, эпидемиологические исследования уже позволяют говорить о том, что потребление полиаминов (к которым он относится) коррелирует со снижением смертности от сердечно-сосудистых заболеваний и рака. Говорится и о том, что спермидин сохраняет митохондриальные функции, обладает противовоспалительными свойствами и предотвращает старение стволовых клеток.
Эпигаллокатехин-3-галлат обладает противоопухолевой активностью и является в этом отношении самым эффективным полифенолом, содержащимся в зеленом чае [48], [49]. К тому же есть некоторые свидетельства, что он может сохранять здоровье кожи, предотвращая обезвоживание, формирование морщин и пигментацию [50], и даже защищать от вируса Зика, препятствуя его проникновению в клетки [51], [52].
Активность mTOR

Рисунок 7. Сиролимус — препарат рапамицина
Самые признанные вещества из нашего списка ингибируют фермент mTOR. Это рапамицин [53] и его аналоги — рапалоги. Рапамицин уже применяется в доказательной медицине как иммунодепрессант — например, при трансплантации органов. А на животных моделях показано, что он мог бы эффективно служить для увеличения продолжительности жизни, если бы не одно «но» — его серьезные побочные эффекты. Дело в том, что фермент mTOR существует в клетках в двух формах: в составе двух белковых комплексов — mTORC1 и mTORC2. Первый чувствителен к рапамицину, и его ингибирование, действительно, может увеличить продолжительность жизни и замедлить старение. А вот второй комплекс чувствителен к рапамицину только при продолжительном, хроническом, применении, но при этом ответственен за негативные последствия для здоровья и продолжительности жизни млекопитающих и за побочные эффекты рапамицина. Поэтому сейчас идет поиск эффективных рапалогов — аналогов рапамицина, которые будут действовать на первый комплекс и не трогать второй, а, значит, обладать всеми плюсами рапамицина без его побочных эффектов.
Заключение
Как мы видим, CRM — огромный полигон для будущих исследований. Начавшись с традиционной медицины, перейдя к действию через регулирование аутофагии, мы дошли до огромного разнообразия этих веществ и их аналогов и до обширного спектра их действия, которое может и не быть ограничено одной аутофагией, а использовать совсем другие пути.
К сожалению, изучать влияние чего-то на продолжительность жизни человека очень сложно. Тем более если это что-то — диетическая особенность. Поэтому большинство веществ из нашего списка существуют только в альтернативной медицине и сомнительных БАДах. Но прогресс есть, их действие тщательно изучается и, возможно, когда-то мы сможем отнести их к признаваемым доказательной медициной и спокойно использовать для снижения риска основных болезней и увеличения продолжительности жизни. Конечно, для этого потребуются еще не одно исследование и не один год, но потенциальные возможности обширны и того стоят. Пока же тем, кто верит, надеется и готов рисковать, придется наугад пить БАДы и следить, чтобы они были от авторитетного производителя. Или со спокойной душой перейти на диету из красного вина и круассанов с маслом. Кому как больше нравится.
Литература
- Rafael de Cabo, Didac Carmona-Gutierrez, Michel Bernier, Michael N. Hall, Frank Madeo. (2014). The Search for Antiaging Interventions: From Elixirs to Fasting Regimens. Cell. 157, 1515-1526;
- β-амилоид: невидимый враг или тайный защитник? Запутанная тропка болезни Альцгеймера;
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- Colin D Mathers, Dejan Loncar. (2006). Projections of Global Mortality and Burden of Disease from 2002 to 2030. PLoS Med. 3, e442;
- Rena R Wing, Suzanne Phelan. (2005). Long-term weight loss maintenance. The American Journal of Clinical Nutrition. 82, 222S-225S;
- Нутригеномика: питание vs. заболевания;
- Нутригеронтология: питание vs. старение;
- Guillermo Mariño, Federico Pietrocola, Frank Madeo, Guido Kroemer. (2014). Caloric restriction mimetics: natural/physiological pharmacological autophagy inducers. Autophagy. 10, 1879-1882;
- Bradley R. Webster, Iain Scott, Javier Traba, Kim Han, Michael N. Sack. (2014). Regulation of autophagy and mitophagy by nutrient availability and acetylation. Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. 1841, 525-534;
- Guillermo Mariño, Federico Pietrocola, Tobias Eisenberg, Yongli Kong, Shoaib Ahmad Malik, et. al.. (2014). Regulation of Autophagy by Cytosolic Acetyl-Coenzyme A. Molecular Cell. 53, 710-725;
- Аутофагия, протофагия и остальные;
- Нобелевская премия по медицине и физиологии 2016: за самоедство;
- Болезнь Паркинсона: что изучать? как изучать?;
- Диагностика патологий клеточного метаболизма при нейродегенеративных заболеваниях;
- Как спасти Тринадцатую? (Перспективы лечения болезни Хантингтона);
- Obesity and overweight. (2018). WHO;
- Zachary J. Ward, Michael W. Long, Stephen C. Resch, Catherine M. Giles, Angie L. Cradock, Steven L. Gortmaker. (2017). Simulation of Growth Trajectories of Childhood Obesity into Adulthood. N Engl J Med. 377, 2145-2153;
- Donald K. Ingram, George S. Roth. (2015). Calorie restriction mimetics: Can you have your cake and eat it, too?. Ageing Research Reviews. 20, 46-62;
- Ningning Han, Longlong Li, Mengling Peng, Haitian Ma. (2016). (-)-Hydroxycitric Acid Nourishes Protein Synthesis via Altering Metabolic Directions of Amino Acids in Male Rats. Phytother. Res.. 30, 1316-1329;
- Longlong Li, Mengling Peng, Chongyang Ge, Lei Yu, Haitian Ma. (2017). (-)-Hydroxycitric Acid Reduced Lipid Droplets Accumulation Via Decreasing Acetyl-Coa Supply and Accelerating Energy Metabolism in Cultured Primary Chicken Hepatocytes. Cell Physiol Biochem. 43, 812-831;
- Igho Onakpoya, Shao Kang Hung, Rachel Perry, Barbara Wider, Edzard Ernst. (2011). The Use ofGarciniaExtract (Hydroxycitric Acid) as a Weight loss Supplement: A Systematic Review and Meta-Analysis of Randomised Clinical Trials. Journal of Obesity. 2011, 1-9;
- Nadiya Bakhiya, Rainer Ziegenhagen, Karen I. Hirsch-Ernst, Birgit Dusemund, Klaus Richter, et. al.. (2017). Phytochemical compounds in sport nutrition: Synephrine and hydroxycitric acid (HCA) as examples for evaluation of possible health risks. Mol. Nutr. Food Res.. 61, 1601020;
- Dallas L. Clouatre, Harry G. Preuss. (2017). The evidence of hydroxycitric acid (HCA) health risks to the testes points to manufacturing failings, not to properly made HCA salts. Mol. Nutr. Food Res.. 61, 1770094;
- Laurent Mouchiroud, Riekelt H. Houtkooper, Johan Auwerx. (2013). NAD+metabolism: A therapeutic target for age-related metabolic disease. Critical Reviews in Biochemistry and Molecular Biology. 48, 397-408;
- Dong Liu, Michael Pitta, Haiyang Jiang, Jong-Hwan Lee, Guofeng Zhang, et. al.. (2013). Nicotinamide forestalls pathology and cognitive decline in Alzheimer mice: evidence for improved neuronal bioenergetics and autophagy procession. Neurobiology of Aging. 34, 1564-1580;
- Pauline Vaur, Bernard Brugg, Mathias Mericskay, Zhenlin Li, Mark S. Schmidt, et. al.. (2017). Nicotinamide riboside, a form of vitamin B3, protects against excitotoxicity-induced axonal degeneration. The FASEB Journal. 31, 5440-5452;
- Nicolas Diguet, Samuel A.J. Trammell, Cynthia Tannous, Robin Deloux, Jérôme Piquereau, et. al.. (2018). Nicotinamide Riboside Preserves Cardiac Function in a Mouse Model of Dilated Cardiomyopathy. Circulation. 137, 2256-2273;
- Vaijinath S. Kamanna, Moti L. Kashyap. (2008). Mechanism of Action of Niacin. The American Journal of Cardiology. 101, S20-S26;
- Preethi Mani, Anand Rohatgi. (2015). Niacin Therapy, HDL Cholesterol, and Cardiovascular Disease: Is the HDL Hypothesis Defunct?. Curr Atheroscler Rep. 17;
- O. A. Galescu, M. K. Crocker, A. M. Altschul, S. E. Marwitz, S. M. Brady, J. A. Yanovski. (2018). A pilot study of the effects of niacin administration on free fatty acid and growth hormone concentrations in children with obesity. Pediatric Obesity. 13, 30-37;
- Federico Pietrocola, Guillermo Mariño, Delphine Lissa, Erika Vacchelli, Shoaib Ahmad Malik, et. al.. (2012). Pro-autophagic polyphenols reduce the acetylation of cytoplasmic proteins. Cell Cycle. 11, 3851-3860;
- E Morselli, M C Maiuri, M Markaki, E Megalou, A Pasparaki, et. al.. (2010). Caloric restriction and resveratrol promote longevity through the Sirtuin-1-dependent induction of autophagy. Cell Death Dis. 1, e10-e10;
- Julia K Bird, Daniel Raederstorff, Peter Weber, Robert E Steinert. (2017). Cardiovascular and Antiobesity Effects of Resveratrol Mediated through the Gut Microbiota. Adv Nutr. 8, 839-849;
- Xinxin Wang, Shanshan Ma, Bo Yang, Tuanjie Huang, Nan Meng, et. al.. (2018). Resveratrol promotes hUC-MSCs engraftment and neural repair in a mouse model of Alzheimer’s disease. Behavioural Brain Research. 339, 297-304;
- ShadiSadat Seyyedebrahimi, Hadi Khodabandehloo, Ensieh Nasli Esfahani, Reza Meshkani. (2018). The effects of resveratrol on markers of oxidative stress in patients with type 2 diabetes: a randomized, double-blind, placebo-controlled clinical trial. Acta Diabetol. 55, 341-353;
- Rahul V. Patel, Bhupendra M. Mistry, Surendra K. Shinde, Riyaz Syed, Vijay Singh, Han-Seung Shin. (2018). Therapeutic potential of quercetin as a cardiovascular agent. European Journal of Medicinal Chemistry. 155, 889-904;
- Brandie N. Radde, Negin Alizadeh-Rad, Stephanie M. Price, David J. Schultz, Carolyn M. Klinge. (2016). Anacardic Acid, Salicylic Acid, and Oleic Acid Differentially Alter Cellular Bioenergetic Function in Breast Cancer Cells. J. Cell. Biochem.. 117, 2521-2532;
- Jiri Neuzil, Xiu-Fang Wang, Lan-Feng Dong, Pauline Low, Stephen J. Ralph. (2006). Molecular mechanism of ‘mitocan’-induced apoptosis in cancer cells epitomizes the multiple roles of reactive oxygen species and Bcl-2 family proteins. FEBS Letters. 580, 5125-5129;
- Y. Wu, L. He, L. Zhang, J. Chen, Z. Yi, et. al.. (2011). Anacardic Acid (6-Pentadecylsalicylic Acid) Inhibits Tumor Angiogenesis by Targeting Src/FAK/Rho GTPases Signaling Pathway. Journal of Pharmacology and Experimental Therapeutics. 339, 403-411;
- Dominik Lipka, Mateusz Legut, Nina Filipczak, Jerzy Gubernator, Adriana Piwoni, Arkadiusz Kozubek. (2014). Anacardic acid enhances the anticancer activity of liposomal mitoxantrone towards melanoma cell lines – in vitro studies. IJN. 653;
- Karanam Balasubramanyam, M. Altaf, Radhika A. Varier, V. Swaminathan, Aarti Ravindran, et. al.. (2004). Polyisoprenylated Benzophenone, Garcinol, a Natural Histone Acetyltransferase Inhibitor, Represses Chromatin Transcription and Alters Global Gene Expression. J. Biol. Chem.. 279, 33716-33726;
- Chaoqun Liu, Paul Chi-Lui Ho, Fang Cheng Wong, Gautam Sethi, Ling Zhi Wang, Boon Cher Goh. (2015). Garcinol: Current status of its anti-oxidative, anti-inflammatory and anti-cancer effects. Cancer Letters. 362, 8-14;
- Sadhna Aggarwal, Satya N. Das. (2016). Garcinol inhibits tumour cell proliferation, angiogenesis, cell cycle progression and induces apoptosis via NF-κB inhibition in oral cancer. Tumor Biol.. 37, 7175-7184;
- Yu Wang, Mei-Ling Tsai, Li-Yu Chiou, Chi-Tang Ho, Min-Hsiung Pan. (2015). Antitumor Activity of Garcinol in Human Prostate Cancer Cells and Xenograft Mice. J. Agric. Food Chem.. 63, 9047-9052;
- Subash C. Gupta, Gorkem Kismali, Bharat B. Aggarwal. (2013). Curcumin, a component of turmeric: From farm to pharmacy. BioFactors. 39, 2-13;
- Turmeric. (2016). NIH;
- Frank Madeo, Tobias Eisenberg, Federico Pietrocola, Guido Kroemer. (2018). Spermidine in health and disease. Science. 359, eaan2788;
- K.-C. Choi, M. G. Jung, Y.-H. Lee, J. C. Yoon, S. H. Kwon, et. al.. (2009). Epigallocatechin-3-Gallate, a Histone Acetyltransferase Inhibitor, Inhibits EBV-Induced B Lymphocyte Transformation via Suppression of RelA Acetylation. Cancer Research. 69, 583-592;
- Guang-Jian Du, Zhiyu Zhang, Xiao-Dong Wen, Chunhao Yu, Tyler Calway, et. al.. (2012). Epigallocatechin Gallate (EGCG) Is the Most Effective Cancer Chemopreventive Polyphenol in Green Tea. Nutrients. 4, 1679-1691;
- Eunji Kim, Kyeonghwan Hwang, Jongsung Lee, Sang Han, Eun-Mi Kim, et. al.. (2018). Skin Protective Effect of Epigallocatechin Gallate. IJMS. 19, 173;
- Bruno M. Carneiro, Mariana N. Batista, Ana Cláudia S. Braga, Maurício L. Nogueira, Paula Rahal. (2016). The green tea molecule EGCG inhibits Zika virus entry. Virology. 496, 215-218;
- Вирус Зика — глобальная угроза?;
- Sebastian I. Arriola Apelo, Dudley W. Lamming. (2016). Rapamycin: An InhibiTOR of Aging Emerges From the Soil of Easter Island. GERONA. 71, 841-849.