Яды пауков защитят нейроны и кардиомиоциты
27 февраля 2023
Яды пауков защитят нейроны и кардиомиоциты
- 823
- 0
- 7
Иллюстрация, демонстрирующая содержание статьи: в ней вы узнаете, как яды различных пауков могут спасти нервные клетки и клетки сердца.
Рисунок в полном размере.
рисунок автора статьи
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Пауки — удивительные существа, вырабатывающие многокомпонентный яд, постоянно подвергающийся эволюционному «редактированию» для получения более действенных и сложных веществ, предназначенных для защиты и нападения на жертв. Среди широкого спектра разнообразных токсичных веществ содержатся в яде и соединения, модулирующие катионные каналы. Эти соединения активно изучают биохимики — причем не только со стороны функций, но и какие структуры образуют такие молекулы при образовании комплексов с каналами. На базе таких знаний можно разрабатывать препараты, предназначенные для защиты клеток при различных заболеваниях.
Конкурс «Био/Мол/Текст»-2022/2023
Эта работа опубликована в номинации «Нейробиология» конкурса «Био/Мол/Текст»-2022/2023.
Партнер номинации — компания «Сесана»: — один из ведущих поставщиков оборудования и реагентов для полного цикла научного исследования.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Пауки — хищники, состав яда которых многократно изменялся в ходе эволюции для наиболее эффективной атаки на жертв, борьбы с конкурентами и защиты от агрессоров. Их яды представляют собой смесь огромного количества нейротоксинов, каждый из которых обладает своей биологической активностью. Основные три группы таких токсинов — белки, пептиды и низкомолекулярные соединения, главные мишени которых — клеточные рецепторы и ионные каналы. Ввиду этого, токсины пауков являются эффективными молекулярными инструментами для представления и понимания физиологической роли ионных каналов в качестве модели для создания новых лекарственных препаратов, направленных на лечение заболеваний, связанных с нарушением работы ионных каналов [1].
Введение. Нейроны и нейромедиаторы
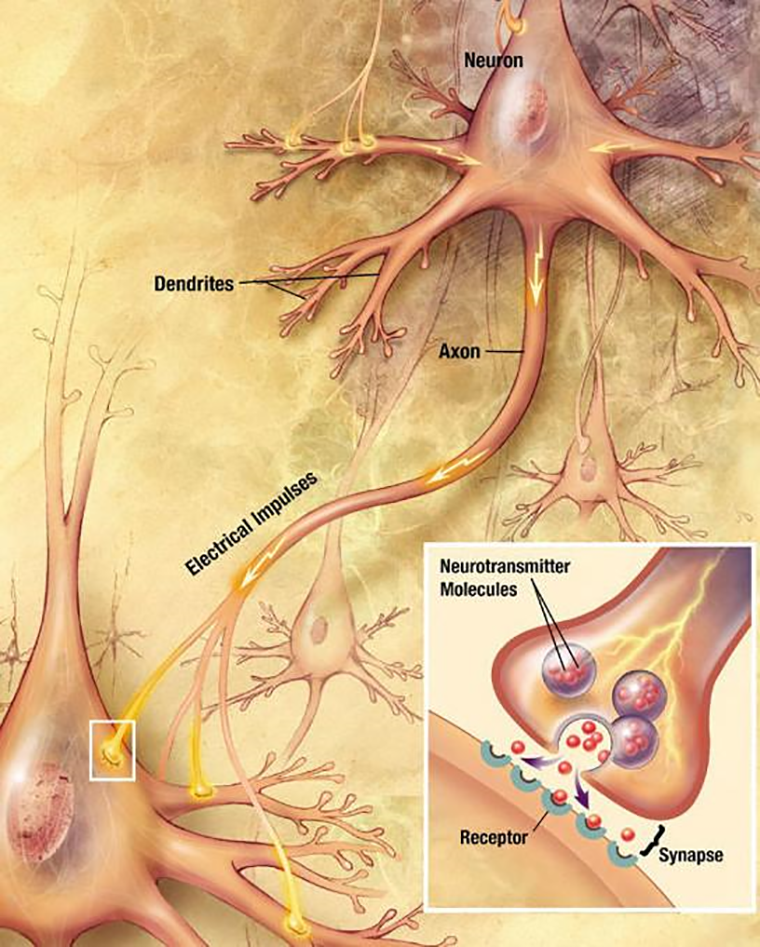
Рисунок 1. Выделение нейромедиатора. Клетка наполнена органеллами, которым (как и самим клеткам) необходимо обмениваться «посылками». И если по нервному волокну сигнал передается в форме электрического потенциала действия, то передача между нервными клетками выполняется за счет выброса в синаптическую щель молекул нейромедиатора, укомплектованных в такие пузырьки-«посылки» — везикулы. За объяснение системы доставки клеточных отправлений с разными молекулами (гормонами, белками, нейромедиаторами), вовремя и по адресу, Джеймс Ротман, Рэнди Шекман и Томас Зюдоф получили Нобелевскую премию: «Нобелевская премия по физиологии и медицине (2013): везикулярный транспорт» [4].
Нервная система человека устроена необычайно сложно. Она состоит из огромного числа нервных клеток — нейронов, соединенных большим количеством связей. Работа нейронов заключается в приеме, обработке, хранении и передаче информации другим клеткам. Передача информации в виде нервного импульса между клетками осуществляется через специальные межнейронные контакты — синапсы. Чтобы передать сигнал, пресинаптическая клетка выделяет особое химическое соединение — нейромедиатор, — которое диффундирует через синаптическую щель и связывается с рецепторами, находящимися на мембране постсинаптической клетки [2].
Выделение нейромедиатора служит сигналом, который необходимо получить рецепторам принимающей клетки. Взаимодействие нейромедиатора с рецептором приводит к открытию ионных каналов в мембране, что вызывает перераспределение потоков ионов снаружи и внутри мембраны [3]. По этой причине происходит изменение полярности мембранного потенциала и образуется нервный импульс — потенциал действия (рис. 1).
Роль нейромедиаторов в коммуникации между клетками крайне важна. При правильной работе этих соединений стабильно функционирует нервная система. А сбой в выработке нейромедиаторов, их взаимодействии с рецепторами и прочие нарушения, связанные с психическими, неврологическими заболеваниями и воздействием веществ, влекут за собой тяжелые последствия для всего организма [5], [6].
Блокировка Glu рецепторов с помощью яда паука
Глутамат (Glu), помимо того, что это просто аминокислота, — основной возбуждающий нейромедиатор в нервной системе, причастный к таким когнитивным функциям, как обучение и память. Глутамат способен связываться с разнообразными рецепторами, в числе которых есть и те, что открывают ионам кальция (Ca2+) доступ в клетку.
При некоторых заболеваниях нервной системы концентрация глутамата сильно увеличивается за счет гиперактивации Glu рецепторов, что, в свою очередь, повышает содержание кальция и оказывает токсичное влияние на нервные клетки, запуская апоптоз [7], [8]. Чтобы предотвратить этот процесс и избежать клеточной гибели, необходимы специальные вещества-блокаторы, которые могли бы пригодиться и для лечения неврологических заболеваний, включающих боковой амиотрофический склероз, эпилепсию, болезни Альцгеймера, Паркинсона и пр. [5], [7]. Поиск специфических блокаторов, проницаемых для Ca2+ рецепторов AMPA — возможный путь к лечению этих болезней.
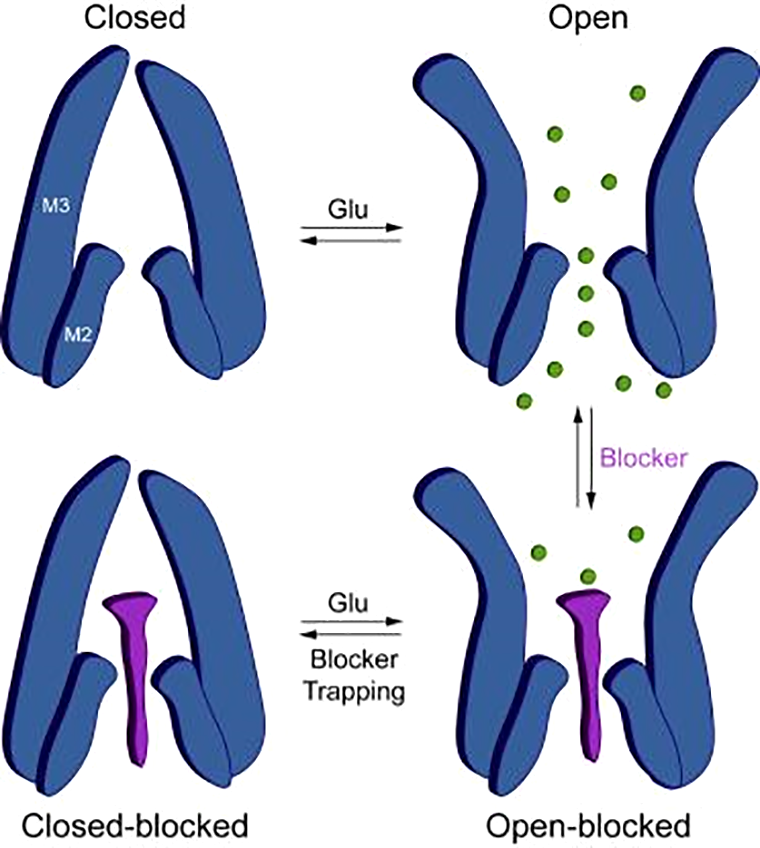
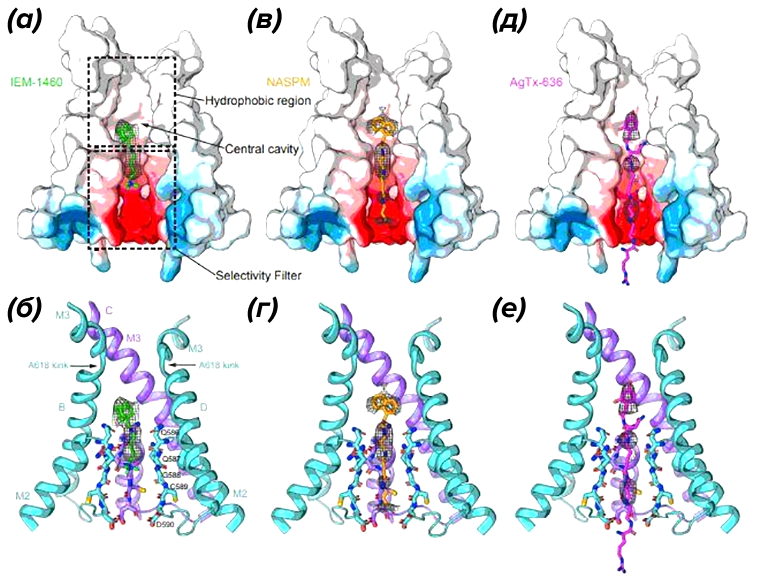
Одна из ведущих в России и в мире групп исследователей животных нейротоксинов — Лаборатория молекулярных инструментов для нейробиологии в Институте биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова, работающая под руководством А. А. Василевского, — объединилась с лабораторией А. Соболевского в Колумбийском университете (США), исследующей мембранные рецепторы и ионные каналы методами криоэлектронной микроскопии. Результатом этого сотрудничества стало открытие молекулярной структуры комплексов глутаматного AMPA-рецептора с тремя блокаторами, среди которых был природный нейротоксин аргиопин, выделенный из яда паука Argiope lobata (рис. 2) [7].
Химическая формула всех отобранных веществ-блокаторов включает в себя две части: «голову», напоминающую остаток ароматической аминокислоты, и полиаминный «хвост», состоящий из аминогрупп, связанных разными по длине углеводородными мостиками (рис. 3). В ходе исследования выяснено, что выбранные для эксперимента блокаторы способны проникать в AMPA-рецептор, когда тот открывается под действием нейромедиатора. Положительно заряженный «хвост» блокатора располагается в узкой, отрицательно заряженной области ионного канала, пропускающего исключительно катионы. Блокатору не удается пройти по каналу, поскольку «голова» играет роль «затычки», застревая внутри рецептора (рис 4А и 4Б) [7].
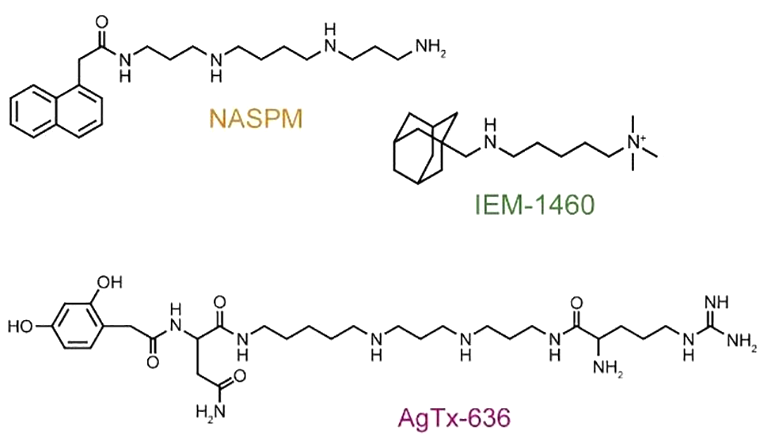
Рисунок 3. Химические структуры поровых блокаторов AMPA-рецепторов, использованные в работе. AgTx-636 — токсин паука Argiope lobata.
Аргиопин и его искусственные аналоги могут блокировать только пропускающие кальций AMPA-рецепторы , не оказывая никакого влияния на другие. Это значит, что нервные импульсы продолжат передаваться от нейрона к нейрону, а сами клетки не пострадают от переизбытка кальция, что приведет работу нервной системы в норму [7].
Для простоты в этой статье не рассказывается, что существуют разные формы AMPA-рецепторов, возникающие в результате редактирования мРНК, — проводящие и непроводящие Ca2+. — Прим. ред.
Благодаря проделанной работе выяснено, каким образом аргиопин и аналоги связываются в канале AMPA-рецептора. На основе полученных данных возможно создание новых, более совершенных блокаторов, которые не допустят проникание избыточного количества кальция в нейроны при заболеваниях и могут стать прототипами лекарств от неврологических заболеваний.
Токсин паука против паралича
Возбудимость и сокращение мышц осуществляется из-за разности потенциалов на мембране клеток, который распространяется по нервному или мышечному волокну в виде волны открывания/закрывания ионных каналов, возникающей в ответ на первичное изменение мембранного потенциала (деполяризацию).
Однако случается, что из-за генетических нарушений каналы работают неправильно. К примеру, потенциал-чувствительный натриевый канал (Nav) даже в закрытом состоянии может пропускать небольшое количество ионов, причем проходящих не через основную (центральную) пору, а через один из «дефектных» потенциал-чувствительных доменов — это называется «током утечки». При таком сбое разность потенциалов на сторонах мембраны будет уже не такой, как нужно, а значит, при нервном импульсе потоки ионов станут не настолько интенсивными, какими должны быть при нормальной работе каналов.
По итогу, мышца окажется неспособной среагировать, как подобает, ведь она начнет слабо сокращаться или вообще перестанет функционировать. В частности, подобный «сбой» канала Nav1.4 лежит в основе гипокалиемического периодического паралича (ГПП). Нарушение мышечной возбудимости проявляется в виде периодической мышечной слабости или паралича, который продолжается от нескольких часов до нескольких дней [10].
Уже было известно, что сбой в работе каналов возникает за счет ряда мутаций, меняющих важные остатки аргинина в трансмембранной спирали S4 потенциал-чувствительного домена белка. Благодаря этим заряженным аргининам изменение мембранного потенциала побуждает спираль к смене состояния подобно поршню: она движется вверх и вниз, приводя к открыванию или закрыванию канала. Замена аргининов же меняет структуру домена, и в нем фактически образуется «дырка» [10].
Исследователи из ИБХ РАН (тот же самый Александр Василевский и другие коллеги) и Института неврологии Университетского колледжа Лондона изучили, как трансформируется структура натриевого канала Nav1.4 в мышцах с присоединением к нему токсина паука Heriaeus melloteei, названного Hm-3 (рис. 5) [10]. Оказалось, токсин Hm-3 способен «заткнуть» «подтекающие» участки каналов — это установили с помощью генной и белковой инженерии, электрофизиологии, компьютерного моделирования и ЯМР-спектроскопии (рис. 6) [10], [11].

Рисунок 5. Паук Heriaeus melloteei. Изучение его яда было начато еще под руководством академика Е. В. Гришина; оттуда выделили и полипептид Hm-3, относящийся к группе модификаторов натриевых каналов.

Рисунок 6. Структура комплекса потенциал-чувствительного домена канала Nav1.4 из мышц человека с паучьим токсином по данным эксперимента ЯМР.
(а) — комплекс токсин Hm-3 — ПЧД канала: для упрощения эксперимент по связыванию и ЯМР проводили не с целым каналом, а только с одним из его ПЧД.
(б) — визуализация положения токсина Hm-3 относительно полной структуры канала. Nav-канал состоит из четырех гомологичных повторов, свернутых с образованием поры по центру и окружающих ее ПЧД. Каждый такой повтор состоит из шести трансмембранных α-спиралей, среди которых S1—S4 формируют ПЧД. S4 непосредственно служит сенсором потенциала, а мутации заряженных остатков аргинина в ней и приводят к «паразитному» пропусканию ионов.
Проделанная работа направлена на изучение потенциал-чувствительных катионных каналов и, в том числе, анализ мутационных изменений ионного канала Nav1.4, которые являются причиной гипокалиемического паралича. Исследование демонстрирует существование токсинов природного происхождения, которые могут предотвратить пропускание ионов [10] и стать прототипом лекарств, облегчающих ГПП и похожие болезни.
Яды пауков в борьбе с ишемией
Перейдем теперь к другому типу ионных каналов — кислоточувствительным ASIC, также находящимся в нервных клетках ЦНС. Субъединица канала ASIC1a участвует в процессах синаптической пластичности, определяющей память и способность к обучению. Однако, помимо этого, канал ASIC1a задействован в ишемических процессах при ацидозе, что негативно сказывается на нейронах или кардиомиоцитах [12], [13].

Рисунок 7. Паук Hadronyche infensa. Выделенный токсин из яда паука участвовал в более ранних работах ученых, в которых Hi1a существенно снижал повреждения мозга, даже если применять его через 8 часов после начала инсульта. В моделях ишемического инсульта у грызунов, активация каналов ASIC с низким pH приводит к нейрональным повреждениям, а при ингибировании ASIC1a с помощью блокады токсином Hi1a и подавлении экспрессии генов, кодирующих ASIC1a, проявляется нейропротекторное действие. Исследователи решили проверить Hi1a и на клетках сердца, поскольку и сердце, и мозг являются самыми чувствительными органами к потере кровяного тока и дефициту кислорода при ИРП [13], [14].
Ишемически-реперфузионное повреждение (ИРП) — патологическое состояние, которое заключается в снижении кровоснабжения какого-либо органа, в том числе и сердца, что ведет к дефициту кислорода. В свою очередь, это приводит к снижению внутриклеточного и внеклеточного pH из-за накопления молочной кислоты во время ишемии, в результате чего возникает ацидоз, который увеличивает ишемическое повреждение и оказывает влияние на работу сердца [12], [13].
Австралийские ученые из Университета Куинсленда применили ряд генетических, а также фармакологических методов, чтобы исследовать кислоточувствительный ионный канал ASIC1a в ИРП сердца — как на клеточном уровне, так и на уровне всего органа с применением ингибиторов (блокаторов), выделенных из токсинов пауков [13].
Для проверки эффективности используемых блокаторов ASIC1a были взяты кардиомиоциты, полученные из индуцированных стволовых клеток человека для исследования in vitro, а также использованы модели ИРП на мышах ex vivo и in vivo [13].
В экспериментах участвовали два блокатора: Hi1a, выделенный из токсина паука Hadronyche infensa, и PcTx1, выделенный из паука-птицееда (рис. 7). Они оказались сильнодействующими и эффективными ингибиторами кислоточувствительного канала ASIC1a, при этом не проявляющими активность в отношении других субъединиц ASIC (а всего их шесть). Отобранные вещества схожи на структурном уровне (Hi1a состоит из двух PcTx1-подобных доменов), однако обладают разными механизмами ингибирования: первый блокирует активацию ASIC1a, а второй способствует стабилизации десенбилизированного состояния канала (рис. 8) [13].
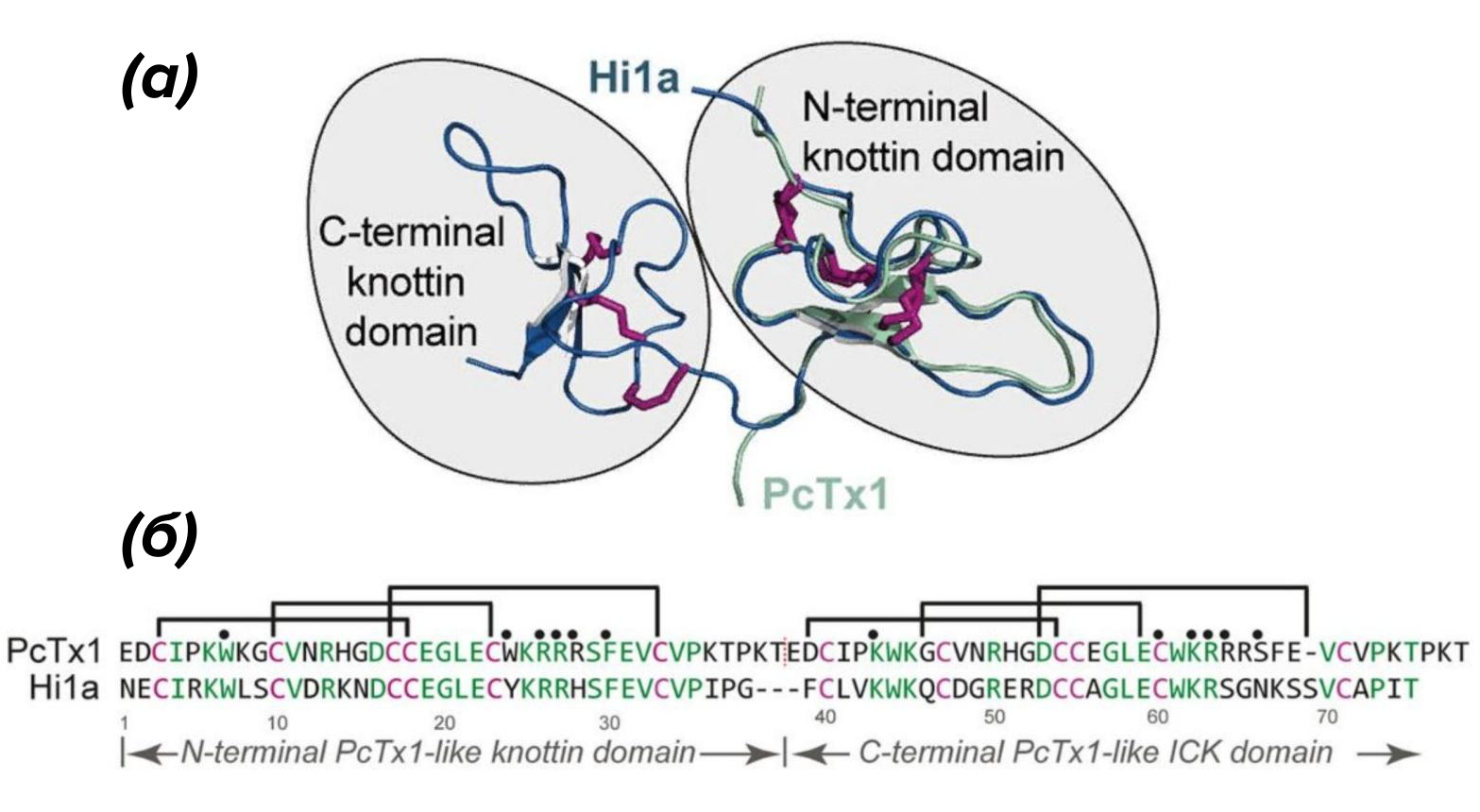
Рисунок 8. Строение токсина Hi1a.
(а) — 3D-структура Hi1a с выделенными узловыми доменами, на N-концевой домен которой наложена 3D-структура PcTx1.
(б) — последовательность Hi1a и двух копий PcTx1 с цистеинами и прочими консервативными остатками, а также остатки фармакофора PcTx1 (отмечены черными точками).
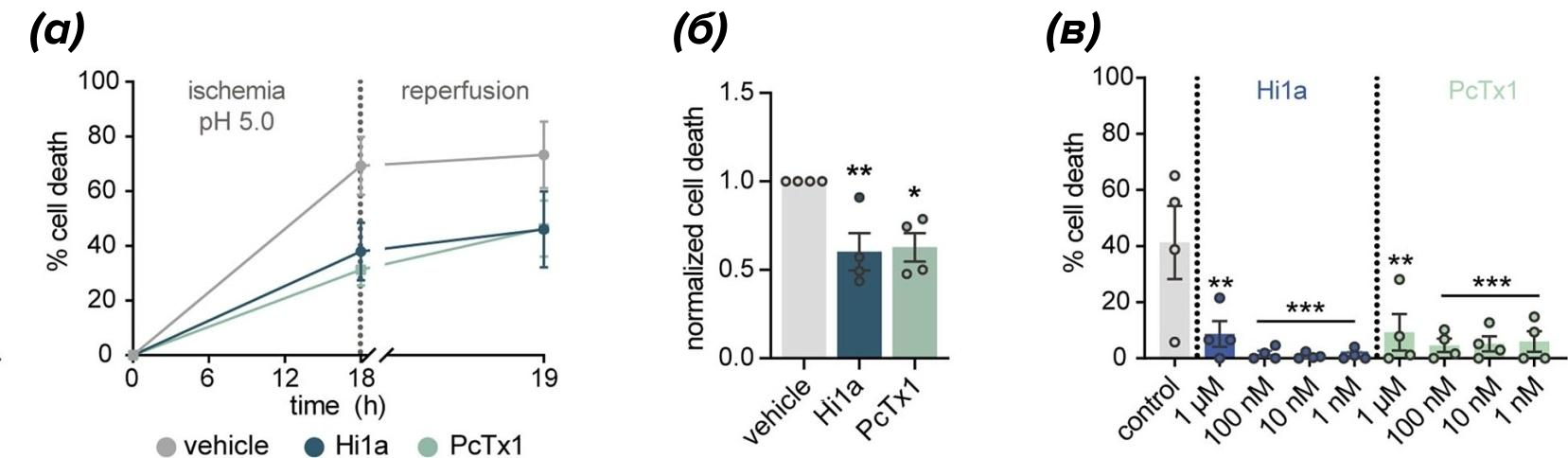
Для определения ингибирующих свойств блокаторов по отношению к каналу была произведена оценка гибели клеток в ответ на ишемию и ацидоз in vitro. Результаты показали, что блокада канала ингибиторами Hi1a и PcTx1 существенно улучшает жизнеспособность клеток (рис. 9А) [13].
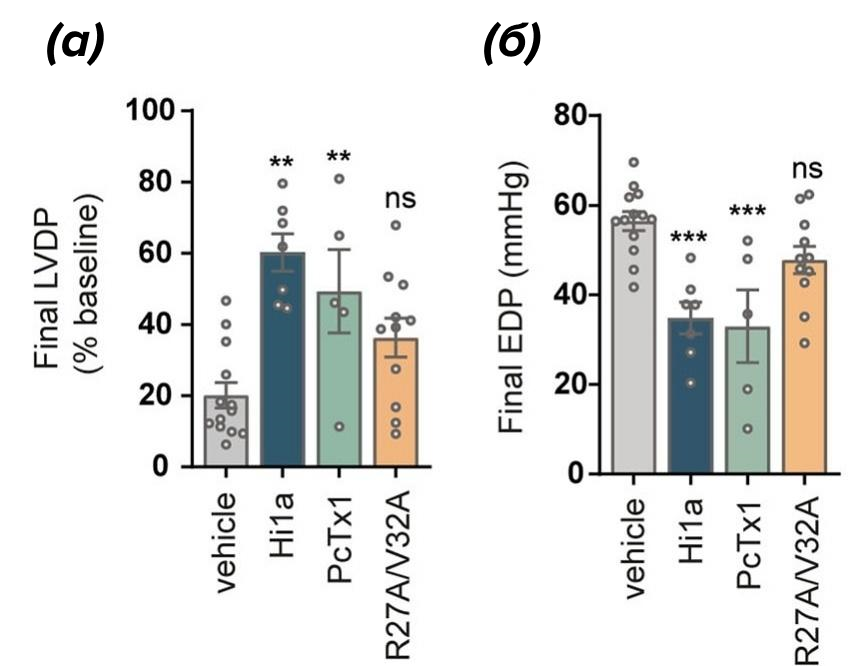
В исследованиях ex vivo и in vivo на мышах с ИРП оба блокатора (наиболее мощным из которых оказался Hi1a, специфичность которого заключалась в отсутствии осложнений на функциональное восстановление после ИРП) восстанавливали сердечную сократимость и улучшали состояние и функцию сердца при ишемии (рис. 9Б) [13].
По заявлениям специалистов, проведенные исследования показывают, что соединения, ингибирующие каналы ASIC1a, безопасны и имеют потенциальное применение при трансплантации сердца и инфаркте миокарда с возможной перспективой использования в других клинических аспектах, в которых ИРП миокарда представляет большие риски для здоровья и жизни [13].
Заключение
Наши обыденные знания о пауках, по большей части, ассоциируются с опасностью и вредом от укуса ядовитого существа. Действительно, практически все пауки вырабатывают яд, который служит им для обездвиживания добычи и защиты. Тем не менее, токсичность пауков варьируется от вида к виду, и на самом деле лишь немногие представляют угрозу для человека.
Кроме того, паучий яд играет важную роль в медицине и в науке в целом. В течение своей богатой эволюционной истории пауки сотворили обширную библиотеку биоактивных соединений в составе своих ядов, оптимизированную для высокой точности и селективности по отношению к различным молекулярным мишеням.
По этой причине такие токсины весьма интересуют исследователей. Благодаря трудам ученых были открыты и описаны соединения, избирательно и эффективно модулирующие активность разных ионных каналов — натриевых, калиевых, кислоточувствительных и многих других. Изучение токсинов и научный прогресс в разработке лекарственных препаратов на основе ядов пауков в перспективе открывают много новых терапевтических возможностей.
Литература
- Василевский А.А., Козлов С.А., Гришин Е.В. (2009). Молекулярное разнообразие яда пауков. Успехи биологической химии. 49, 211–274;
- Как происходит выделение нейромедиатора;
- Формирование мембранного потенциала покоя;
- Нобелевская премия по физиологии и медицине (2013): везикулярный транспорт;
- Дофаминовые болезни;
- Спокоен как GABA;
- Edward C. Twomey, Maria V. Yelshanskaya, Alexander A. Vassilevski, Alexander I. Sobolevsky. (2018). Mechanisms of Channel Block in Calcium-Permeable AMPA Receptors. Neuron. 99, 956-968.e4;
- Очень нервное возбуждение;
- Великому комбинатору и не снилось: комбинаторика токсинов пауков;
- Roope Männikkö, Zakhar O. Shenkarev, Michael G. Thor, Antonina A. Berkut, Mikhail Yu Myshkin, et. al.. (2018). Spider toxin inhibits gating pore currents underlying periodic paralysis. Proc Natl Acad Sci USA. 115, 4495-4500;
- Antonina A. Berkut, Steve Peigneur, Mikhail Yu. Myshkin, Alexander S. Paramonov, Ekaterina N. Lyukmanova, et. al.. (2015). Structure of Membrane-active Toxin from Crab Spider Heriaeus melloteei Suggests Parallel Evolution of Sodium Channel Gating Modifiers in Araneomorphae and Mygalomorphae. Journal of Biological Chemistry. 290, 492-504;
- Осмаков Д. И., Андреев Я. А., Козлов С. А. (2014). Кислоточувствительные рецепторы и их модуляторы. Успехи биологической химии. 54, 231–266;
- Meredith A. Redd, Sarah E. Scheuer, Natalie J. Saez, Yusuke Yoshikawa, Han Sheng Chiu, et. al.. (2021). Therapeutic Inhibition of Acid-Sensing Ion Channel 1a Recovers Heart Function After Ischemia–Reperfusion Injury. Circulation. 144, 947-960;
- Irène R. Chassagnon, Claudia A. McCarthy, Yanni K.-Y. Chin, Sandy S. Pineda, Angelo Keramidas, et. al.. (2017). Potent neuroprotection after stroke afforded by a double-knot spider-venom peptide that inhibits acid-sensing ion channel 1a. Proc Natl Acad Sci USA. 114, 3750-3755.