
Иглистые мыши и их уникальные способности к регенерации
26 декабря 2022
Иглистые мыши и их уникальные способности к регенерации
- 3610
- 2
- 7
Иглистые мыши способны к аутотомии и могут отбросить лоскут кожи или хвост, если их схватил хищник, и поврежденный участок эффективно регенерирует без образования рубца. Оказалось, что их способности к регенерации не ограничиваются только залечиванием ран после аутотомии, а распространяются на многие ткани и органы.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Иглистые мыши — маленькие грызуны, которые обладают поистине выдающимися способностями к регенерации. Они могут восстанавливать сердце и почки, заживлять огромные раны на коже и регенерировать спинной мозг после разрыва. Это очень необычно, так как большинство других млекопитающих, в том числе и человек, обладают крайне низкими способностями к регенерации. Как иглистым мышам это удается? Почему остальные млекопитающие не умеют так же эффективно заживлять повреждения? Можно ли человеку «научиться» у иглистой мыши этой суперспособности? В нашей статье мы постараемся ответить на эти вопросы и расскажем о других особенностях этого удивительного животного.
Конкурс «Био/Мол/Текст»-2022/2023
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2022/2023.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Что такое регенерация
Восстановление поврежденных тканей и органов можно разделить на репарацию и регенерацию [1]. Репарация приводит к образованию рубца на месте повреждения, который восстанавливает целостность органа, но не обеспечивает восстановление функций. При этом образование рубца может пойти по патологическому пути, что приводит к деформации ткани и нарушению ее функции, как, например, при образовании келоидного рубца (рис. 1). Регенерация, напротив, приводит к практически полному восстановлению исходной архитектуры и функции органов [2].
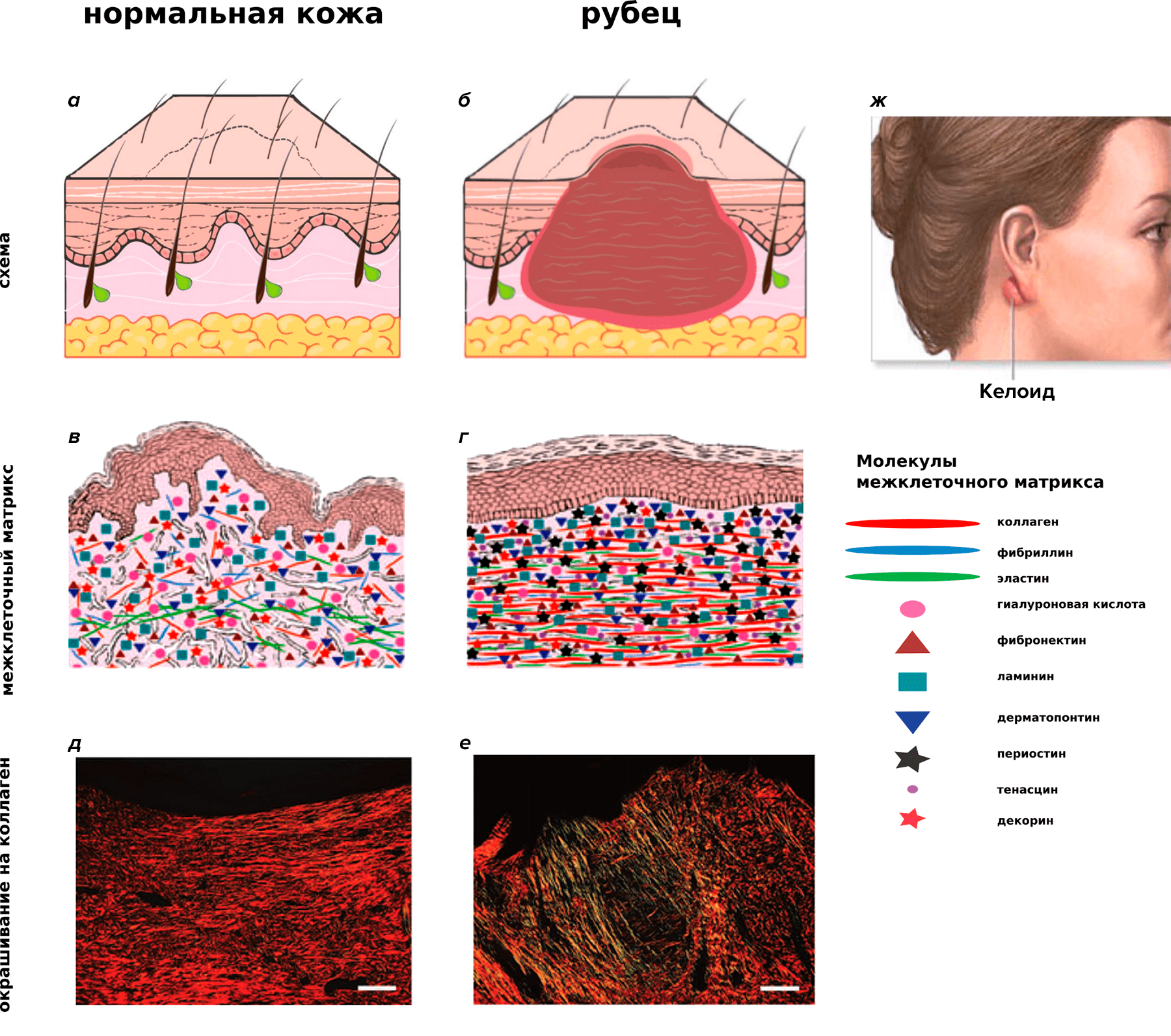
Рисунок 1. Пример патологической репарации — образование келоидного рубца на месте повреждения кожи. а, б — Схематичное изображение. в, г — Различия в молекулярном составе нормальной кожи и келоидного рубца. д, е — Отличия в ориентации волокон коллагена в нормальной коже и келоидном рубце. ж — Келоидный рубец на мочке уха, возникший из-за прокола.
У большинства взрослых млекопитающих, в том числе и у человека, способности к регенерации сильно ограничены. У пациентов, которые подверглись хирургическим операциям или получили обширные травмы, восстановление обычно идет именно по пути репарации: в месте повреждения формируется «заплатка» из клеток соединительной ткани и дезорганизованного межклеточного матрикса, что ведет к потере функции данной области и иногда сопровождается хроническими болями [2]. Изучение животных, которые обладают выдающимися способностями к регенерации, может подсказать способы достижения «правильного» заживления повреждений у человека.
Способность к регенерации теряется в ходе эволюции
Если посмотреть на эволюционное дерево, то в целом можно сказать, что чем сложнее организм, тем хуже ему удается регенерация [3]. Губки — самые примитивные многоклеточные — могут собирать заново целый организм, даже если его раскрошат на отдельные клетки. Некоторые беспозвоночные, такие как черви и иглокожие, умеют восстанавливать организм из фрагмента тела. Широко известна способность к регенерации конечностей и хвостов у амфибий. Но чем дальше мы пойдем по возрастанию сложности организма, тем меньше мы будем обнаруживать выраженные способности к регенерации. У позвоночных животных способности к регенерации встречаются только в некоторых таксонах (рис. 2). Но почему это так? Ведь, казалось бы, регенерация — это крайне полезное свойство с точки зрения естественного отбора, но оно почему-то утрачивается в ходе эволюции. Причины этого неясны. Остается открытым вопрос, являются ли эти ограничения адаптивными или же закрепились в разных ветвях случайным образом.
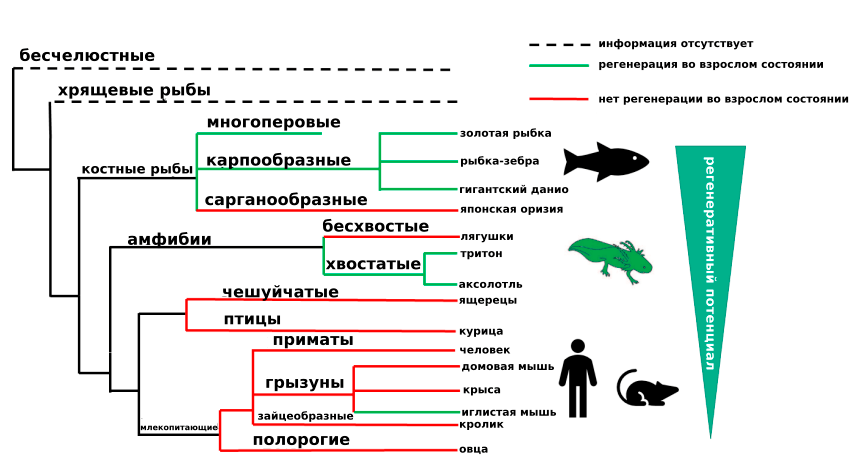
Рисунок 2. Эволюционное дерево позвоночных животных, отражающее способности к регенерации во взрослом состоянии
[3], рисунок адаптирован
Однако все же существуют немногочисленные примеры млекопитающих, в той или иной степени способных к регенерации. Среди домовых мышей выдающимися способностями к регенерации обладают линии MRL/MpJ и родственные ей. Мыши этих линий умеют восстанавливать ушные перфорации, кожу, суставы и роговицу глаза (рис. 3). Интересно, что повышенная способность к регенерации у этих линий возникла спонтанно и изначально не являлась целью отбора при их выведении. Среди возможных причин возникновения повышенной способности к регенерации у этих мышей могут быть изменения в регуляции клеточного цикла и пониженный воспалительный ответ на повреждение, однако точные механизмы этого явления еще только предстоит выяснить [4].

Рисунок 3. Линия домовых мышей MRL/MpJ, которая имеет повышенную способность к регенерации. а — Внешний вид. б — Заживление ушных перфораций (для сравнения показаны перфорации у мыши линии B6, которые не обладают способностями к регенерации). Мыши линии MRL/MpJ выводились как модельный объект для исследований красной волчанки, регенерация не являлась целью отбора и возникла спонтанно.
Однако даже выдающиеся возможности к регенерации у мышей линии MRL/MpJ покажутся скромными, если сравнить их с «чемпионами» по регенерации среди млекопитающих — иглистыми мышами.
Иглистые мыши способны регенерировать разнообразные органы
Иглистые мыши (Acomys spp.) — грызуны из надсемейства мышеобразные (Muroidea), обитают в Африке, на Ближнем Востоке и в Южной Азии. Их характерная внешняя особенность — жесткие волоски на спине, напоминающие колючки, из-за которых они и получили название «иглистые мыши» (греч. Acomys от acme —«острый наконечник», mus — «мышь», англ. spiny mouse) (рис. 4) [5]. Иглистых мышей содержат в качестве лабораторных и декоративных животных с начала XX века, однако их поразительные способности к регенерации заметили всего несколько лет назад. На данный момент известно, что они могут эффективно восстанавливать обширные повреждения кожи, сердца, почек, скелетной мускулатуры и спинного мозга. Все началось с того, что у иглистых мышей заметили одно очень необычное свойство — аутотомию, или способность отбрасывать часть своего тела в качестве защитной реакции (рис. 4) [6].
Среди млекопитающих аутотомия очень редка и обычно ограничивается отбрасыванием хвоста с переломом позвонков (истинная аутотомия) или потерей шкуры на хвосте (ложная аутотомия) [7]. Аутотомия иглистых мышей заключается в отбрасывании лоскутов кожи. Их кожа очень непрочная и может легко порваться, если животное кто-то схватил. Такая хрупкость обусловлена особыми свойствами межклеточного матрикса: с одной стороны, он непрочен и позволяет лоскутам кожи легко отделяться, с другой стороны, это способствует заживлению в месте повреждения. В коже не были найдены никакие специальные зоны, по которым она бы отделялась, подобно тому, как это происходит у гекконов и сцинков [6]. Кровотечение при повреждении минимально [8], раневая поверхность быстро эпителизируется, затем полностью восстанавливаются волосяные фолликулы, дерма, железы и мышцы. В результате участок кожи полностью регенерирует без образования рубца (рис. 4б и 4в). Причем создается впечатление, что повреждения не доставляют животным каких-либо беспокойств: они продолжают двигаться и питаться как обычно [6]. Также иглистые мыши могут отбрасывать хвосты, но, в отличие от рептилий, хвосты у них не восстанавливаются, поэтому поднимать иглистую мышь за хвост, как это делают с обычными мышами — это плохая идея [9].
Чтобы понять молекулярные основы такого эффективного заживления кожи, провели анализы протеома и транскриптома, которые показали значительные различия в экспрессии генов в местах повреждения кожи у иглистой и домовой мышей [10], [11]. По сравнению с домовыми мышами после травмы в месте ранения уровень провоспалительных факторов, таких как цитокины Il6, Cxcl3, Ccl12, Ccl7, Il1b, у иглистых мышей снижен. Также отличается состав иммунных клеток: в большом количестве присутствуют прорепаративные макрофаги (М2), а провоспалительных макрофагов (М1) и нейтрофилов мало. Это указывает на уникальные иммунные реакции, протекающие в месте повреждения [10]. После повреждения кожи у иглистых мышей активировались гены, которые связаны с развитием мышц в ходе эмбриогенеза. Это позволяет предположить, что восстановление подкожных мышц идет по пути, очень похожему на их развитие у плода. У иглистых мышей на высоком уровне также производятся ферменты, участвующие в перестройке межклеточного матрикса [12], такие как матричные металлопротеиназы [10], а синтез коллагенов I и III типов, участвующих в образовании рубца, очень низок [13].
Вскоре выяснилось, что способности иглистых мышей заживлять большие повреждения не ограничиваются только кожей. В ходе исследований повреждали разные органы: прокалывали ушные раковины, вводили токсины в мышцы, моделировали инфаркт миокарда, вызывали острое и хроническое повреждение почек. Картина была везде одна и та же — иглистые мыши блестяще справлялись со всеми повреждениями (рис. 5).
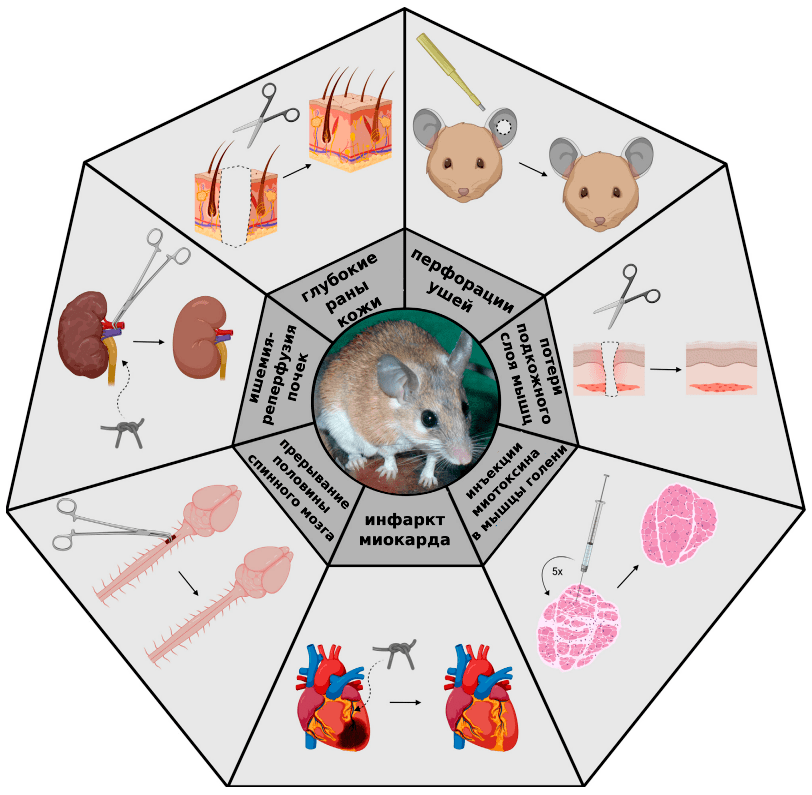
Рисунок 5. Возможности регенерации иглистой мыши
[39], рисунок адаптирован
Особый интерес как с теоретической, так и с практической точек зрения представляет способность иглистых мышей к регенерации нервной системы. Млекопитающие — худшие из худших среди позвоночных животных по способностям к регенерации, а их нервная система — худшая из худших по способностям к регенерации среди систем органов. Повреждения ЦНС часто ведут к необратимой потере ее функций, а в мире живет около 80 миллионов людей с инвалидностью, полученной из-за травм головного или спинного мозга [14].
Повреждение ЦНС млекопитающих обычно приводит к развитию астроцитарного рубца. С одной стороны, это защитная реакция, направленная на поддержание оставшихся нейронов, но, с другой стороны, это затрудняет рост аксонов и таким образом препятствует восстановлению функций [14]. Поскольку у иглистых мышей отсутствует образование рубцов при регенерации кожи, возникло предположение, что также не образуются и астроцитарные рубцы. И действительно, это подтвердили в 2019 году при изучении травмы спинного мозга [15]. Иглистые мыши практически полностью восстанавливают функции спинного мозга, и у них отсутствуют признаки астроцитарного рубца (рис. 6).
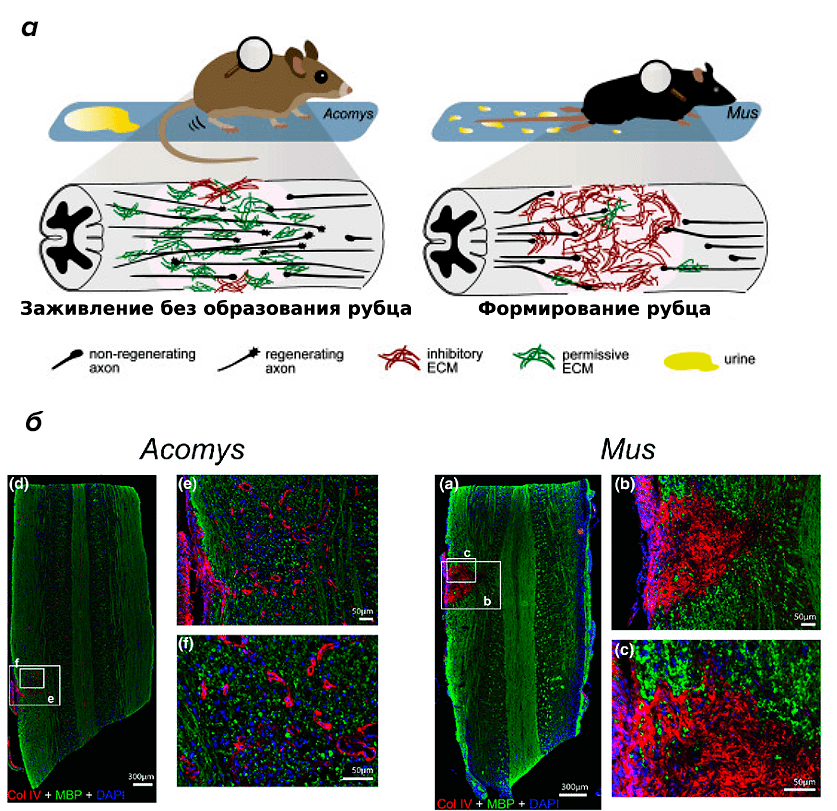
Рисунок 6. Восстановление спинного мозга иглистой мыши. а — Иглистая мышь восстанавливает контроль движения задних конечностей и мочеиспускания после повреждения спинного мозга, в отличие от домовой мыши. б — Иммуногистохимический анализ срезов спинного мозга показывает у иглистых мышей почти полное отсутствие признаков астроцитарного рубца. Красным цветом окрашен коллаген IV типа (маркер рубцевой ткани), зеленым — основной белок миелина, синим — ядра клеток.
В ответ на повреждение спинного мозга иглистые мыши демонстрируют уникальный паттерн экспрессии генов в астроцитах и фибробластах [15], а состав межклеточного матрикса в месте повреждения у иглистых и домовых мышей значительно различается. В месте повреждения у иглистых мышей повышается содержание тех компонентов межклеточного матрикса, которые обеспечивают рост и поддержание новых отростков нейронов, а те компоненты, которые препятствуют этому, наоборот, имеют пониженное содержание. Среди компонентов межклеточного матрикса, которые обеспечивают рост аксонов — кератансульфаты. Кератансульфаты участвуют в регуляции роста цитоскелета, поддержании формы клеток, в транспорте и хранении нейротрансмиттеров, в росте аксонов и нейропластичности [16]. Количество b-1,3-N-ацетилглюкозаминтрансферазы 7 (b3gnt7), важнейшего фермента для синтеза кератансульфата, у иглистых мышей в месте повреждения спинного мозга сильно увеличивается. Ученые задались вопросом: можно ли «приручить» фермент b3gnt7, чтобы он работал не только в иглистой мыши, но и в других организмах, синтезировал в них кератансульфаты и тем самым облегчал рост новых аксонов и заживление спинальной травмы? Первые шаги на пути к этому уже сделаны. Ген b3gnt7 удалось экспрессировать в клетках линии CHO (Chinese Hamster Ovary, линии клеток яичников китайского хомячка Cricetulus griseus), на которых затем культивировали нейроны. В этих условиях нейроны демонстрировали очень активный рост нейритов (рис. 7) [17]. Эти данные свидетельствуют, что b3gnt7 может служить мишенью при лечении спинальной травмы.
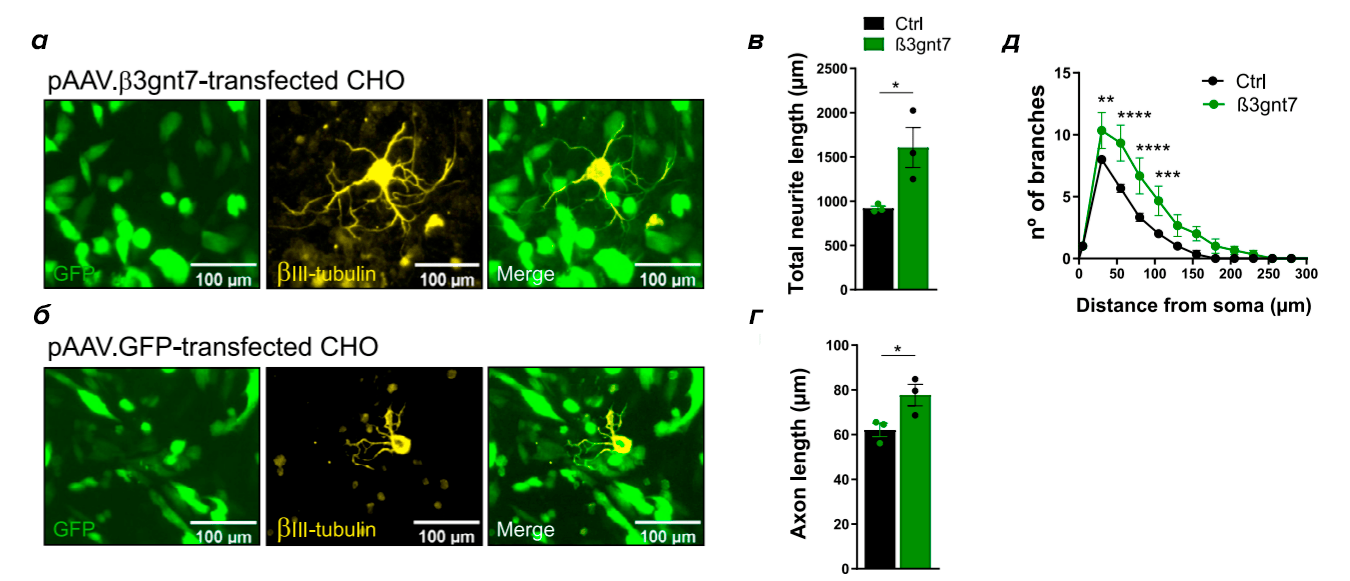
Рисунок 7. Фермент b3gnt7 способствует росту отростков нейронов in vitro. а — Нейроны (показаны желтым цветом) растут на клетках линии СНО (показаны зеленым цветом), синтезирующих b3gnt7. б — Контроль, нейроны растут на клетках СНО без гена b3gnt7. в, г — Длина отростков нейронов при культивации на клетках СНО: в — СНО синтезируют b3gnt7, г — контроль. д — Производство фермента b3gnt7 влияет на число отростков нейронов.
[17], рисунок адаптирован
Открытие генов иглистой мыши, которые ответственны за регенерацию спинного мозга, может привести к разработке принципиально нового подхода в лечении спинальных травм — генной терапии [18]. Эти гены можно доставить в место повреждения с помощью генетических векторов, например, аденоассоциированных вирусов [19]. Таким образом, человек может «научиться» у иглистой мыши заживлять травмы, позаимствовав у нее для этого некоторые гены.
Помимо регенерации спинного мозга, также огромный интерес представляет восстановление головного мозга. Источником возобновления клеток мозга, утраченных после повреждения, могут быть нейрональные стволовые клетки. У взрослых млекопитающих нейрональные стволовые клетки расположены в двух зонах: в субгранулярной зоне зубчатой извилины гиппокампа и в вентрикулярно-субвентрикулярной зоне. Было обнаружено, что в этих зонах у иглистых мышей по сравнению с домовыми мышами в несколько раз больше стволовых и делящихся клеток (рис. 8). Значительно увеличенное количество нейрональных стволовых клеток может свидетельствовать о том, что эти животные обладают повышенными регенеративными возможностями также и при повреждениях головного мозга, что открывает широкое поле для исследований в этой области [20].
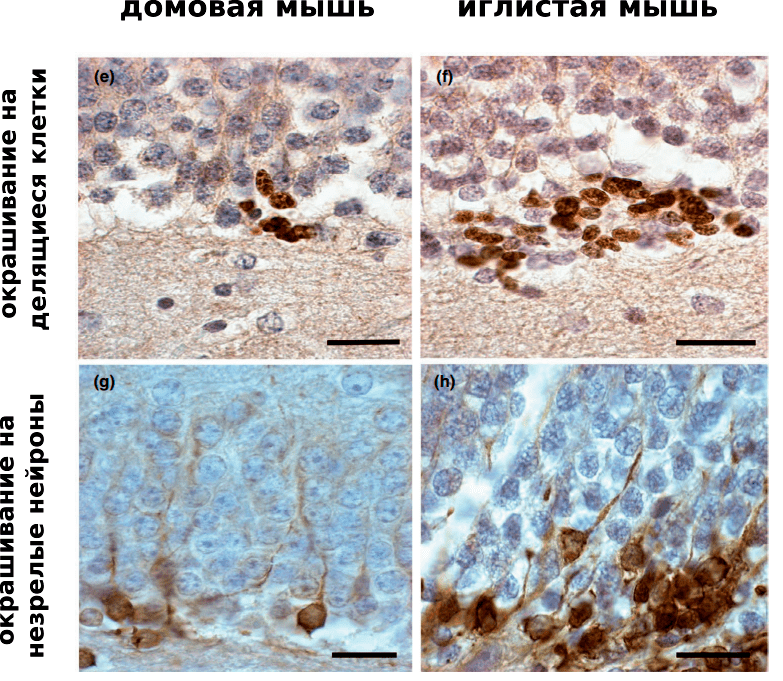
Рисунок 8. В области зубчатой извилины гиппокампа, где находятся нейрональные стволовые клетки, у иглистых мышей по сравнению с домовыми мышами больше делящихся клеток и незрелых нейронов, что может свидетельствовать об их повышенной способности к регенерации головного мозга. Верхний ряд — окрашивание на маркер делящихся клеток Ki-67. Нижний ряд — окрашивание на маркер незрелых нейронов DCX.
Иглистые мыши обладают необычными биологическими особенностями
Помимо удивительной способности к регенерации у иглистых мышей есть еще очень много необычных биологических особенностей, что делает их интересными объектами и в других областях биологии. До того как иглистыми мышами заинтересовалась регенеративная медицина, они были (и остаются поныне) объектами исследований в области диабета, физиологии мочевыделительной и репродуктивной системы, бихевиористики и развития мозга. А все благодаря особенностям, которые очень необычны для грызунов, но которые сближают их с человеком (рис. 9).
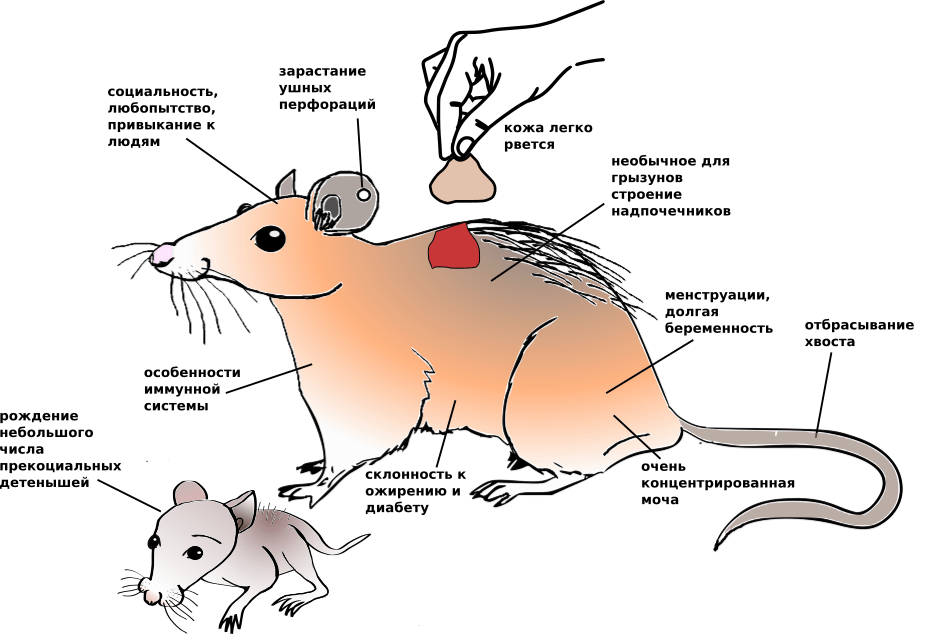
Рисунок 9. Биологические особенности иглистых мышей
рисунок автора статьи
Социальная организация
Для иглистых мышей характерна сложная социальная организация: они живут колониями со свободным скрещиванием и совместной заботой о потомстве — самки вскармливают не только своих, но и чужих детенышей [8], [21]. Иглистые мыши активны, любопытны и легко привыкают к людям, которые за ними ухаживают.
Приспособления к засушливым местообитаниям
Иглистые мыши являются полупустынными животными, в связи с чем у них имеются некоторые физиологические адаптации к жизни в сухом климате и на малопитательном корме. Метаболизм иглистых мышей характеризуется высокой эффективностью использования питательных веществ. Уровень метаболизма у них на 25–30% ниже, чем рассчитанный для грызунов их размера, а для одного из видов — A. russatus — вообще один из самых низких среди известных грызунов [22]. В ответ на потребление пищи у них выделяется мало инсулина [23], что также является следствием жизни на скудном корме. Это ведет к тому, что в условиях содержания в неволе, при свободном доступе к высокопитательной и жирной пище, иглистые мыши склонны к развитию ожирения и диабета. При жирной высококалорийной диете у иглистых мышей развивается гипергликемия и глюкозурия, гиперплазия бета-клеток островков Лангерганса, которые при дальнейшем поддержании такого режима питания дегенерируют. Эта особенность позволила использовать иглистых мышей в качестве модели развития диабета II типа [24]. Таким образом, при содержании иглистых мышей в неволе важно избегать жирных продуктов, таких как семена и орехи, поскольку такая диета может вызвать у них ожирение и диабет [25].
Другая адаптация к полупустынному образу жизни — экономия влаги, которая выражается в выделении очень концентрированной мочи. Концентрация мочевины в их моче — одна из самых высоких среди млекопитающих и достигает 4,8 моль на литр. Это послужило причиной использования иглистых мышей для исследований в области физиологии мочевыделительной системы [26].
Особенности размножения
Половая зрелость наступает в возрасте 3–4 месяцев у самок и 5–6 недель у самцов [27]. У самок 11-дневный эстральный цикл, в конце которого происходит отторжение эндометрия, сопровождающееся кровотечением, что делает их единственными известными грызунами с менструацией и открывает возможности их использования в качестве модели женской репродуктивной биологии [28].
Беременность длится 39 дней, что значительно дольше, чем у других грызунов, на свет появляется от одного до четырех детенышей (обычно два или три). Мышата прекоциальны — они рождаются с шерстью, открытыми глазами и слуховыми проходами, вскоре после рождения способны покидать гнездо и употреблять твердую пищу (рис. 10). Благодаря тому, что при рождении их мозг уже достаточно развит, что отличает их от альтрициальных мышей и крыс, они стали объектом в области исследований развития мозга, бихевиористики и нейропластичности [29], [30].
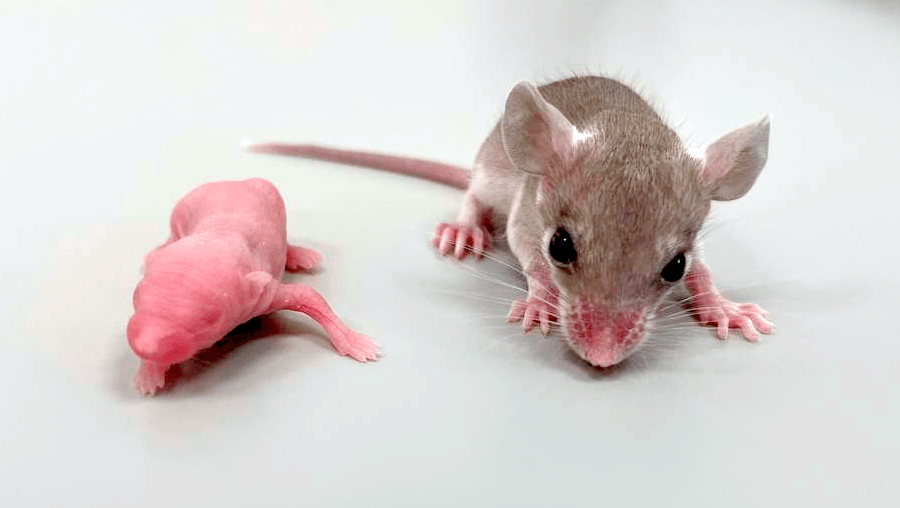
Рисунок 10. Мышата иглистой мыши прекоциальны, в то время как у большинства других грызунов детеныши альтрициальны. Однодневный мышонок иглистой мыши (справа) и мышонок домовой мыши того же возраста (слева).
фото автора статьи
Продолжительность жизни
В неволе продолжительность жизни иглистой мыши составляет 3–4 года [31]. Статистика смертности от конкретных заболеваний не описана. Большой интерес представляет установить процент смертности от опухолей, так как у близкородственного семейства Песчанковых, а также у домовой мыши и серой крысы они являются главными причинами гибели [32], [33].
Заключение
Существование млекопитающих, к которым в ходе эволюции вернулась способность к регенерации, свидетельствует о том, что на нее нет принципиального запрета для высокоорганизованных животных. Благодаря этому иглистая мышь представляет крайний интерес в области регенеративной медицины. Уникальные иммунные реакции, особое строение межклеточного матрикса, включение «эмбриональных» генов — вот, похоже, главные особенности, позволяющие иглистым мышам так блестяще справляться даже с тяжелыми повреждениями. Изучение молекулярных механизмов регенерации у этих животных поможет найти гены и сигнальные пути, которые можно «приручить» человеку и использовать в качестве мишеней при лечении различных травм. Например, в место повреждения с помощью методов генной терапии можно доставить гены иглистой мыши, которые ответственны за эффективную регенерацию, и заставить их работать на благо пациента. Таким образом, изучение иглистой мыши поможет найти способы «возвращения» к человеку утраченной в ходе эволюции способности к регенерации и открыть новые методы лечения травм и повреждений.
Литература
- Регенерация на кончиках пальцев;
- Ting‐Xin Jiang, Hans I‐Chen Harn, Kuang‐Ling Ou, Mingxing Lei, Cheng‐Ming Chuong. (2019). Comparative regenerative biology of spiny ( Acomys cahirinus) and laboratory ( Mus musculus) mouse skin. Exp Dermatol. 28, 442-449;
- Brewer C.M. Evolutionary adaptations in developmental signaling pathways underlie regenerative scar-free wound repair in African Spiny Mouse (Genus Acomys): Thesis (Ph.D.). — University of Washington, 2018. — 185 p.;
- Ahlke Heydemann. (2012). The super super-healing MRL mouse strain. Front. Biol.. 7, 522-538;
- Scott J. Steppan, John J. Schenk. (2017). Muroid rodent phylogenetics: 900-species tree reveals increasing diversification rates. PLoS ONE. 12, e0183070;
- Ashley W. Seifert, Stephen G. Kiama, Megan G. Seifert, Jacob R. Goheen, Todd M. Palmer, Malcolm Maden. (2012). Skin shedding and tissue regeneration in African spiny mice (Acomys). Nature. 489, 561-565;
- Gérard Dubost, Jean‐Pierre Gasc. (1987). The process of total tail autotomy in the South‐American rodent, Proechimys. Journal of Zoology. 212, 563-572;
- Gonçalo Pinheiro, Diogo Filipe Prata, Inês Maria Araújo, Gustavo Tiscornia. (2018). The African spiny mouse (Acomysspp.) as an emerging model for development and regeneration. Lab Anim. 52, 565-576;
- Eyal Shargal, Lea Rath‐Wolfson, Noga Kronfeld, Tamar Dayan. (1999). Ecological and histological aspects of tail loss in spiny mice (Rodentia: Muridae, Acomys ) with a review of its occurrence in rodents. Journal of Zoology. 249, 187-193;
- Jason Orr Brant, Maria-Cecilia Lopez, Henry V. Baker, W. Brad Barbazuk, Malcolm Maden. (2015). A Comparative Analysis of Gene Expression Profiles during Skin Regeneration in Mus and Acomys. PLoS ONE. 10, e0142931;
- Jennifer Simkin, Ashley W. Seifert. (2018). Concise Review: Translating Regenerative Biology into Clinically Relevant Therapies: Are We on the Right Path?. Stem Cells Translational Medicine. 7, 220-231;
- Что такое внеклеточный матрикс и почему его все изучают;
- Thomas R. Gawriluk, Jennifer Simkin, Katherine L. Thompson, Shishir K. Biswas, Zak Clare-Salzler, et. al.. (2016). Comparative analysis of ear-hole closure identifies epimorphic regeneration as a discrete trait in mammals. Nat Commun. 7;
- Michael V. Sofroniew. (2015). Astrogliosis. Cold Spring Harb Perspect Biol. 7, a020420;
- Kristi A. Streeter, Michael D. Sunshine, Jason O. Brant, Aaron G. W. Sandoval, Malcolm Maden, David D. Fuller. (2020). Molecular and histologic outcomes following spinal cord injury in spiny mice,
Acomys cahirinus . J Comp Neurol. 528, 1535-1547; - James Melrose. (2019). Keratan sulfate (
KS )‐proteoglycans and neuronal regulation in health and disease: the importance ofKS ‐glycodynamics and interactive capability with neuroregulatory ligands. Journal of Neurochemistry. 149, 170-194; - Joana Nogueira-Rodrigues, Sérgio C. Leite, Rita Pinto-Costa, Sara C. Sousa, Liliana L. Luz, et. al.. (2022). Rewired glycosylation activity promotes scarless regeneration and functional recovery in spiny mice after complete spinal cord transection. Developmental Cell. 57, 440-450.e7;
- Генная терапия: познакомьтесь с лекарствами будущего;
- Крохотные курьеры: как аденоассоциированные вирусы спасают жизни;
- Malcolm Maden, Nicole Serrano, Monica Bermudez, Aaron G. W. Sandoval. (2021). A profusion of neural stem cells in the brain of the spiny mouse, Acomys cahirinus. J Anat. 238, 1191-1202;
- Vladimíra Tučková, Radim Šumbera, Barbora Čížková. (2016). Alloparental behaviour in Sinai spiny mice Acomys dimidiatus: a case of misdirected parental care?. Behav Ecol Sociobiol. 70, 437-447;
- Degen A.A. (2013). Field metabolic rates of Acomys russatus and Acomys cahirinus, and a comparison with other rodents. Isr. J. Zool. 40, 127–134;
- Alexander Rabinovitch, Arndt Gutzeit, Albert E Renold, Erol Cerasi. (1975). Insulin Secretion in the Spiny Mouse (Acomys Cahirinus): Dose and Time Kinetic Studies with Glucose in Vivo and in Vitro. Diabetes. 24, 1094-1100;
- Кардиопротекция при сахарном диабете;
- E. Shafrir, E. Ziv, R. Kalman. (2006). Nutritionally Induced Diabetes in Desert Rodents as Models of Type 2 Diabetes: Acomys cahirinus (Spiny Mice) and Psammomys obesus (Desert Gerbil). ILAR Journal. 47, 212-224;
- Amiram Shkolnik, Arieh Borut. (1969). Temperature and Water Relations in Two Species of Spiny Mice (Acomys). Journal of Mammalogy. 50, 245;
- B. Peitz, D. Foreman, M. Schmitt. (1979). The reproductive tract of the male spiny mouse (Acomys cahirinus) and coagulation studies with other species. Reproduction. 57, 183-188;
- Nadia Bellofiore, Shreya Rana, Hayley Dickinson, Peter Temple-Smith, Jemma Evans. (2018). Characterization of human-like menstruation in the spiny mouse: comparative studies with the human and induced mouse model. Human Reproduction. 33, 1715-1726;
- D’Udine B. and Alleva E. (1988). The Acomys cahirinus (spiny mouse) as a new model for biological and neurobehavioural studies. Pol. J. Pharmacol. Pharm. 40, 525–534;
- Rotem Cohen, Noga Kronfeld-Schor, Chidambaram Ramanathan, Anna Baumgras, Laura Smale. (2010). The Substructure of the Suprachiasmatic Nucleus: Similarities between Nocturnal and Diurnal Spiny Mice. Brain Behav Evol. 75, 9-22;
- Peter Morrison, Robert Dieterich, Diane Preston. (1977). Longevity and mortality in 15 rodent species and subspecies maintained in laboratory colonies. Acta Theriol.. 22, 317-335;
- S. E. Rowe, J. L. Simmons, D. H. Ringler, D. M. Lay. (1974). Spontaneous Neoplasms in Aging Gerbillinae. A Summary of Forty-four Neoplasms. Vet Pathol. 11, 38-51;
- J. M. Snyder, J. M. Ward, P. M. Treuting. (2016). Cause-of-Death Analysis in Rodent Aging Studies. Vet Pathol. 53, 233-243;
- Heather E. desJardins-Park, Shamik Mascharak, Malini S. Chinta, Derrick C. Wan, Michael T. Longaker. (2019). The Spectrum of Scarring in Craniofacial Wound Repair. Front. Physiol.. 10;
- G.P. Sidgwick, A. Bayat. (2012). Extracellular matrix molecules implicated in hypertrophic and keloid scarring. Journal of the European Academy of Dermatology and Venereology. 26, 141-152;
- Ataru Sunaga, Hideaki Kamochi, Shunji Sarukawa, Hirokazu Uda, Yasushi Sugawara, et. al.. (2017). Reconstitution of Human Keloids in Mouse Skin. Plastic and Reconstructive Surgery - Global Open. 5, e1304;
- Chieh Tseng, Krishna Sinha, Haiying Pan, Yan Cui, Ping Guo, et. al.. (2019). Markers of Accelerated Skeletal Muscle Regenerative Response in Murphy Roths Large Mice: Characteristics of Muscle Progenitor Cells and Circulating Factors. Stem Cells. 37, 357-367;
- Janak Gaire, Justin A. Varholick, Sabhya Rana, Michael D. Sunshine, Sylvain Doré, et. al.. (2021). Spiny mouse (Acomys): an emerging research organism for regenerative medicine with applications beyond the skin. npj Regen Med. 6;
- Aaron Gabriel W. Sandoval, Malcolm Maden. (2020). Regeneration in the spiny mouse, Acomys, a new mammalian model. Current Opinion in Genetics & Development. 64, 31-36;
- Daniel Wehner, Catherina G. Becker. (2022). An exception to the rule? Regeneration of the injured spinal cord in the spiny mouse. Developmental Cell. 57, 415-416;
- Janak Gaire, Justin A. Varholick, Sabhya Rana, Michael D. Sunshine, Sylvain Doré, et. al.. (2021). Spiny mouse (Acomys): an emerging research organism for regenerative medicine with applications beyond the skin. npj Regen Med. 6.








