Регенерация на кончиках пальцев
08 марта 2021
Регенерация на кончиках пальцев
- 7660
- 2
- 9
Регенерация похожа на божественное искусство. В ней задействованы самые разные гены, но точная координация их работы творит чудеса. Прямо как работа мазками разных цветов: под умелой рукой они складываются в картину.
рисунок авторов статьи
-
Авторы
-
Редакторы
-
Рецензент
Статья на конкурс «Био/Мол/Текст»: Почти у всех нас есть конечности. Мы настолько к ним привыкли, что воспринимаем как нечто само собой разумеющееся. Часто ли мы задумываемся об их важности? Вспоминается грустная пословица «Что имеем не храним, потерявши плачем». Авторы статьи искренне желают читателю никогда не познать ее в жизни. Во всяком случае, в таком контексте. Но все же — обязательно ли «плакать» в случае потери конечности, и нет ли способа вернуть ее в случае несчастья? А может, такой способ появится в будущем? Большие вещи начинаются с малого. Понимание регенерации целой руки и ноги кроется в осознании процессов, происходящих на самых кончиках пальцев. О них и пойдет речь дальше.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Важность конечностей неоспорима. Недаром даже есть поговорки: «С руками нигде не пропадешь», «Волка ноги кормят». Потеря или необратимые повреждения конечностей могут оставить человека инвалидом на всю жизнь. С помощью современных медицинских подходов можно, конечно, поставить человека «на ноги». Возможны реплантация ампутированной конечности (ее обратное приживление) или закрытие раны участками кожи для формирования культи с последующим применением протезирующих устройств. Несмотря на стремительно развивающееся протезирование и появление киберпротезов, которые (как пророчат книги, игры и фильмы) уже в недалеком будущем будут почти идентичны утраченной части тела и легко и дешево заменимы, уж очень привлекательна перспектива полного структурного и функционального восстановления ампутированной конечности собственными силами организма (или с помощью небольшой дополнительной стимуляции — рис. 1).

Рисунок 1. В настоящем 2077 протезы уже не будут нужны
рисунок Анастасии Кисловой
Известно, что многие рыбы и амфибии способны к регенерации утраченных конечностей. Но способен ли на это человеческий организм? Оказывается, и да, и нет. Все зависит от правильного взаимодействия различных факторов: от активности генов и иммунной системы до морфологического строения поврежденной конечности и концентрации кислорода в ране. Попытаемся подробнее изучить основные эволюционные изменения процессов регенерации, рассмотреть все тонкости регенерации конечностей, а также порассуждать, насколько хорошо проходит регенерация у млекопитающих.
Регенерация — от прошлого к настоящему
Еще в древних мифах описывалось необычное свойство некоторых существ восстанавливать любую отрубленную часть тела. Так, Лернейская гидра в битве с Гераклом могла отращивать новые головы на месте отрубленной. При этом для победы Геракл использовал вполне оригинальный и логичный способ: он прижег горящими головнями места, где вырастали новые головы, что воспрепятствовало бесконечной регенерации. Можно вспомнить и другой пример из древнегреческой мифологии — каждый день печень Прометея, который похитил для людей божественный огонь, склевывал орел, а каждую ночь она отрастала заново. Однако древние греки едва ли могли объяснить описываемые явления с биологической точки зрения. Так чем же обусловлены эти процессы у существующих организмов?
Наши передние и задние конечности состоят из различных типов клеток: остеоцитов (образуют скелет), миоцитов (мышцы), адипоцитов (жировая ткань), нейронов (нервная ткань), кератиноцитов (эпидермиса). Каждая клетка имеет свой генетический профиль и историю его реализации, называемую дифференцировкой. Клетки специализируются и сохраняют приобретенные особенности, так как хранят запись биохимических сигналов своих клеточных предков, полученных еще на эмбриональной стадии. По сути, регенерация конечности — это прохождение клеточной специализации заново. И пройти ее должны все названные выше типы клеток. Восстановить группу клеток одного типа — уже непростая задача, что уж говорить о регенерации более сложноорганизованных структур. В организме для этого формируется бластема — неоднородная популяция клеток, которая временно образуется на раневой поверхности после ампутации как результат миграции и компенсаторной пролиферации клеток, а затем подвергается морфогенезу и замещает поврежденную часть органа (рис. 2). Бластема становится источником стволовых клеток — недифференцированных (незрелых) клеток, из которых впоследствии формируются ткани. Именно они затем специализируются и восстанавливают первоначальный размер и форму утраченной конечности.
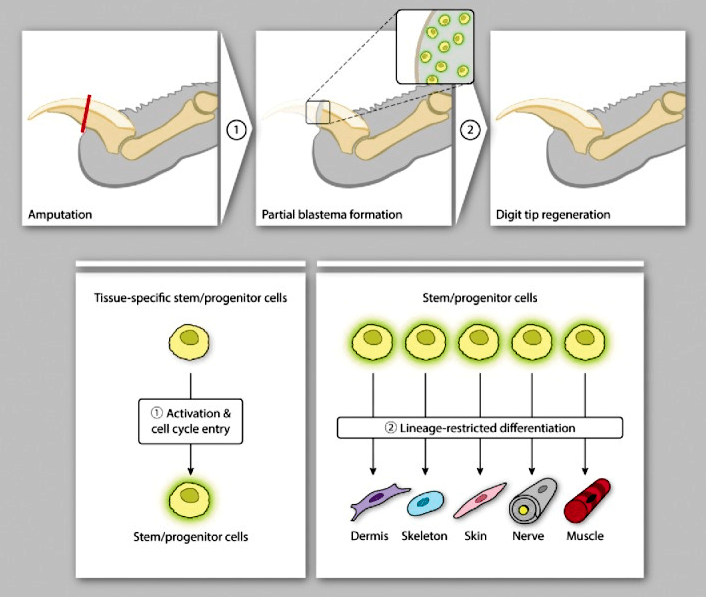
Рисунок 2. Регенерация пальца у мышей. В ход идут клеточные механизмы, единые для всех позвоночных: прежде всего активируются стволовые клетки, которые формируют бластему. Затем стволовые клетки на основе своей уникальной программы, заложенной в геноме, дифференцируются в соответствующий тип клеток (кожи, мышц, костей и др.) и восстанавливают исходный размер и форму кончика пальца.
Ослабление способности к регенерации с течением эволюции
Среди млекопитающих не найти столь впечатляющих примеров регенерации, как среди хвостатых амфибий. Но сравнение эпиморфной регенерации у классических моделей (земноводных и рыб) и млекопитающих приближает нас к пониманию того, что мешает нам (млекопитающим) регенерировать так же эффективно, и как это можно преодолеть. Сложно поверить, но механизмы регенерации, как и механизмы развития, схожи не только у всех позвоночных, но также и среди основных типов беспозвоночных.
Информацию о механизмах регенерации содержит геном, практически идентичный во всех клетках организма. Клетки разных тканей отличаются друг от друга потому, что экспрессируют разные наборы генов (а не потому, что содержат разные гены). Избирательная экспрессия генов обусловливает и разные стадии регенерации:
- пролиферацию, дающую множество клеток из одной;
- специализацию, создающую клетки с разной пространственной ориентацией и биологическими характеристиками;
- связь клеток между собой, определяющую поведение одной клетки по отношению к соседям;
- перемещение (миграцию), при которой клетки группируются, чтобы сформировать ткани и органы заданной структуры.
Во всех этих процессах клетка постепенно переходит из недифференцированного (столового) состояния в последующие, более специализированные. Возможен и альтернативный путь: клетка может уже пройти частично путь специализации, но перейти на другой под воздействием особых сигналов среды. Это как раз случай бластемы.
Но почему же примитивные беспозвоночные и низшие позвоночные (анамнии) способны к регенерации, а высшие (амниоты) утратили эту суперспособность?
С течением эволюции у всех животных — от низших до высших, вплоть до человека, — набор генов менялся не слишком сильно. Для согласованного построения многоклеточной структуры разные организмы используют всего несколько довольно консервативных путей передачи межклеточных сигналов. Однако по мере усложнения организмов дар регенерации постепенно угасал. В результате амниоты (рептилии, птицы, млекопитающие) почти утратили способность формировать бластему. Почему? Различия в общем плане строения организма возникают во многом из-за различий в генах регуляторных и сигнальных белков, которые отвечают за то, когда и где другие гены, кодирующие структурные белки, должны быть активированы или ингибированы.
Ученые из лаборатории молекулярных основ эмбриогенеза ИБХ РАН выдвинули гипотезу, что изменения в регуляторных участках и некоторых генах коррелируют с потерей регенерации. Чтобы ее проверить, они поочередно ингибировали и активировали гены, которые могли быть причастны к формированию раневого эпителия и бластемы. Выяснилось, что гены транскрипционных факторов Ag1 и сигнальных белков Ras-dva встречаются только в геномах низших позвоночных, рыб и амфибий, но отсутствуют у высших — рептилий, птиц и млекопитающих (рис. 4) [2]. При этом эти гены одновременно и стимулируют регенерацию конечностей, и подавляют развитие конечного мозга. Именно с их потерей у высших позвоночных в эмбриогенезе зародился конечный мозг.

Рисунок 4. Регенерация, которую мы потеряли. Видно, что с усложнением организации высших позвоночных происходила потеря генов семейства Ras-dva, а вместе с этим и способности к регенерации.
Оказывается, где-то на развилках эволюции самым драматическим образом произошел обмен регенерации конечностей на мощный мозг. Видимо, раз мы смогли написать для вас эту статью, то он оказался полезным. Однако почему же нельзя было оставить нам и регенерацию?
На данный момент регенерацию изучают больше всего на амфибиях (саламандры и тритоны) и рыбах данио рерио (зебрафиш) [3]. Например, хвостатые амфибии способны восстанавливать конечность, хвост, хрусталик глаза и часть нижней челюсти. Исследования проводят и на млекопитающих, хотя их потенциал далеко не так впечатляет. Ампутированные кончики пальцев у грызунов, повреждения ушной раковины у иглистых мышей и кроликов — вот, по сути, всё, что можно изучать из области эпиморфной регенерации у млекопитающих. Эти исследования позволяют связать регенеративную биологию и регенеративную медицину. В статье мы будем использовать информацию, полученную из исследований как на амниотах, так и анамниях, ибо, несмотря на потерю транскрипционных факторов Ag1 и сигнальных белков Ras-dva, консервативные пути передачи регенеративного сигнала в клетках в течение эволюции сохранились, и общий план строения конечностей у анамний и амниот схож.
Разбираем бластему: этап за этапом, клетка за клеткой, ген за геном
Сначала необходимо понять, какие внешние воздействия могут способствовать или мешать формированию бластемы. Для этого лучше изучить регенерацию «на практике». Вот мы ампутировали конечность. А дальше? Что мы можем сделать для стимуляции регенеративных процессов? Оказывается, не так много. Конечно, можно использовать разные шовные материалы и медицинские клеи для остановки кровотечения. Однако может получиться так, что регенерация остановится уже на первых этапах и не успеет достигнуть стадии бластемы. В исследовании, проведенном на мышах, ученые пробовали покрывать рану медицинским клеем (рис. 5) [4]. Это привело к следующему результату — раневая поверхность покрылась беспорядочной богатой коллагеном соединительной тканью, называемой фиброзной, которая составила основу культи и мало чем напоминала нормальную конечность.
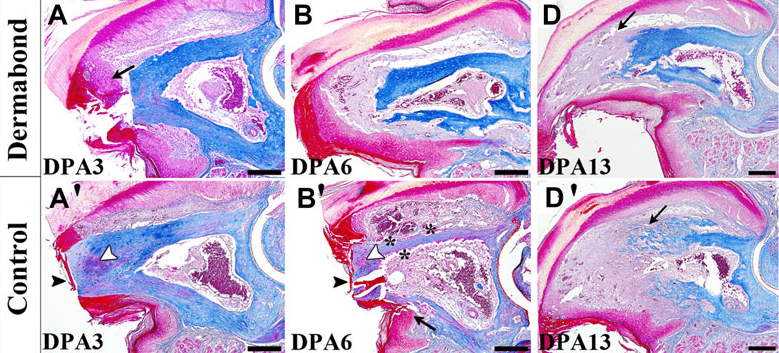
Рисунок 5. Хронология регенерации ампутированного кончика пальца при обработке медицинским клеем (фирма Dermabond; A, B и D) и без обработки (Control; A’, B’ и D’) в течение 13 дней после ампутации (DPA — days post-amputation). Можно заметить, что закрытие раны эпидермисом у пальца, обработанного клеем, на третий день после ампутации (A) началось преждевременно (черная стрелка) по сравнению с контрольной группой (A’), где наблюдалось лишь образование сгустка крови в полости костного мозга (белая стрелка). Впоследствии структурные изменения становились все более заметными, в результате чего на 13-й день после ампутации у пальца, не обработанного клеем, бластема была больше по объему и числу клеток (черная стрелка на срезе D’ указывает на клетки разрушенной костной ткани, которые впоследствии будут вовлечены в процесс регенерации), чем у пальца, обработанного клеем (срез D).
Оказалось, что важнейшую роль на разных этапах восстановления конечности играет локальное изменение концентрации кислорода [5]. Примечательно, что в норме на начальных этапах регенерации концентрация кислорода должна быть повышена (а при использовании медицинского клея выходит наоборот), а впоследствии падать из-за образования раневого эпидермиса на поверхности раны и активировать сигнальные пути регенерации. Если же изначально закрыть рану, то образования стабильного микроокружения из клеток и сигнальных молекул для формирования бластемы не происходит.
Цикл регенерации можно разбить на шесть этапов (рис. 6). Рассмотрим каждый из них подробнее и опишем процессы, которые при этом происходят.
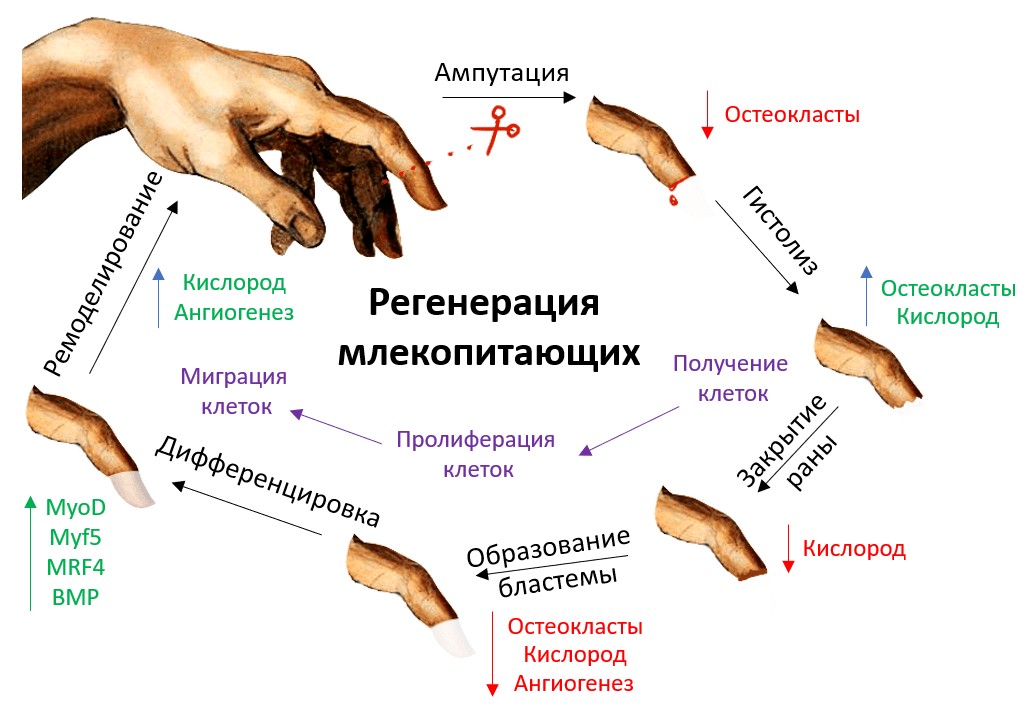
Рисунок 6. Цикл регенерации кончика пальца у млекопитающих: ампутация, гистолиз, закрытие раны, образование бластемы, дифференцировка, ремоделирование. Для каждого этапа характерны свои особенности и нюансы, о которых речь пойдет дальше.
рисунок авторов статьи
1. Ампутация
После столь ужасной травмы организму первым делом необходимо остановить кровопотерю и создать условия для образования бластемы. Сразу после травмы включается иммунная реакция, останавливается кровотечение, происходит вазоконстрикция (сужение сосудов) и коагуляция тромбоцитов. Они формируют сгусток фибрина, который составляет основу тромба [6], [7]. Вместе с этим в рану мигрируют воспалительные клетки — нейтрофилы и моноциты. Последние на месте повреждения превращаются в макрофаги, ну а нейтрофилы «пожирают» патогенные микроорганизмы, после чего «кончают с собой» путем апоптоза. Эти клетки входят в систему врожденного иммунитета, и в числе первых запускают защитную реакцию и воспаление. Этот этап длится первые несколько часов после травмы.
Как упоминалось ранее, у заживления после ампутации возможны два исхода: образование рубца из фиброзной ткани или эпиморфная регенерация. А что именно произойдет — решится в следующей фазе.
2. Гистолиз
Это разрушение тканей путем их «растворения» протеолитическими ферментами перед заживлением раны. Можно сказать, что организм действует по принципу «вред во благо». Это одна из ключевых стадий эпиморфной регенерации, так как именно в результате гистолиза формируется микроокружение, стимулирующее дедифференцировку клеток в стволовые, благодаря чему и формируется бластема. Происходит необходимое разрушение кости и уменьшение ее в объеме (до 60–75%) для того, чтобы ее компоненты (в том числе мезенхимальные и гемопоэтические, или кроветворные, стволовые клетки) могли принять участие в регенерации (рис. 7). Параллельно этому синтезируются протеазы (ферменты, расщепляющие белки) клетками иммунной системы, реорганизуются фрагменты внеклеточного матрикса и образуются факторы роста — специальные белки, контролирующие рост клеток и их вступление в клеточный цикл и усиливающие или ингибирующие регенеративные процессы.

Рисунок 7. Гистолизу подвергается преимущественно костная ткань, а разрушают ее предназначенные для этого клетки — остеокласты. Данный процесс может длиться вплоть до образования бластемы (12–14 дней после ампутации).
[34], рисунок адаптирован
Активная роль в разрушении тканей принадлежит ферментам матриксным металлопротеиназам (ММП). Они расщепляют белки внеклеточного матрикса, которые вовлечены в процесс заживления ран и контролируют процесс ремоделирования тканей.
- Внеклеточный матрикс
- многокомпонентная субстанция, которая объединяет разрозненные клетки в единый многоклеточный организм, и в которую погружены все клетки организма [8]. Внеклеточный матрикс, который формируется при воздействии иммунных клеток, содержит гиалуроновую кислоту и специфические белки (гликопротеины и протеогликаны), а затем дополняется другими белками (коллагены типа I и III, эластин, фибронектин, тенасцин-C и др.), что делает матрикс более организованным и структурированным [9]. Примечательно, элементы внеклеточного матрикса легко окрашиваются, поэтому по их градиенту концентрации легко визуализировать и отслеживать, с каким успехом проходят восстановительные процессы. Все перечисленные соединения синтезируются преимущественно фибробластами — клетками соединительной ткани, которые вносят основной вклад в образование бластемы и ремоделирование конечностей [10].
Раневые участки содержат множество типов ММП, которые поддерживают различные реакции, связанные с миграцией фибробластов, ангиогенезом (восстановлением сосудистой сети) и предотвращением синтеза базальной мембраны между тканями конечности и раневым эпидермисом, что и подавляет рубцевание. Ингибирование ММП приводит к замедлению заживления ран и нарушению миграции и дифференцировки стволовых клеток. Например, мыши с мутацией коллагена типа I, который устойчив к расщеплению ММП-1, демонстрируют нарушение ремоделирования и замедленное заживление тканей. Однако в ряде исследований многие ММП-дефицитные мутанты не демонстрируют таких аномалий, что может быть связано со сложной специфической ролью каждой ММП [9], [11]. При этом активность ММП не может продолжаться долго, она подавляется тканевыми ингибиторами металлопротеиназ, когда приходит время создавать новый каркас для клеток из внеклеточного матрикса на стадии ремоделирования.
3. Закрытие раны
На 7–10 день после ампутации происходит эпителизация поврежденного участка, что связано с ростом количества кератиноцитов. При этом продолжают работу иммунные клетки: макрофаги и нейтрофилы синтезируют активные формы кислорода, чтобы нейтрализовать инородные микроорганизмы и подвергнуть фагоцитозу поврежденную ткань [9]. Макрофаги — важный источник как воспалительных, так и противовоспалительных сигналов, поступающих в поврежденную область после травмы, где они участвуют в обмене компонентов внеклеточного матрикса, очищают ткани от инородных частиц и подвергают фагоцитозу апоптотические клетки (останки клеток после программируемой гибели). Эти процессы опосредованы специальными белками, контролирующими рост клеток — цитокинами. Благодаря провоспалительным цитокинам, которые запускают механизм специфического иммунитета и действуют через свои рецепторы на клетки мишени на ранней стадии воспаления (интерлейкины IL-1, IL-6, IL-8; фактор некроза опухоли-α TNF-α), фибробласты выделяют факторы роста кератиноцитов KGF-1, KGF-2, сигнализирующие кератиноцитам мигрировать и пролиферировать. Также клетками иммунной системы синтезируются хемокины (семейство цитокинов), необходимые для миграции фибробластов, а впоследствии и противовоспалительные цитокины (IL-4, IL-10, трансформирующий фактор роста TGF-β), которые ослабляют воспаление и стимулируют ангиогенез [12]. К примеру, сигнальная молекула TGF-β подавляет пролиферацию кератиноцитов, что способствует регенеративным процессам благодаря замедлению рубцевания. А у мышей с мутациями, нарушающими синтез TGF-β, наблюдалось более быстрое заживление ран и рубцевание. Поэтому неудивительно, что в исследованиях на мышах недостаток макрофагов и нейтрофилов или нарушение их регуляции после ампутации приводит к неполному восстановлению мышц и образованию рубцов [13].
Таким образом, уменьшение количества иммунных клеток вызывает снижение миграции фибробластов и кератиноцитов, так как снижается концентрация сигнализирующих белков. Однако и нормальное содержание макрофагов и нейтрофилов приводит к воспалению, а затем к образованию рубцовой ткани, что преимущественно и наблюдается у млекопитающих. Поэтому нельзя однозначно ответить, положительно или отрицательно клетки иммунной системы влияют на процессы регенерации. Стоит помнить, что иммунная система примитивных животных и низших позвоночных не так сложна, как у высших, что также может объяснять их лучшую способность к регенерации. Примечательно, что в ряде исследований, мутантные модели мышей, испытывающие дефицит макрофагов и нейтрофилов, все еще были способны заживлять небольшие раны без образования рубцовой ткани [13].
4. Образование бластемы
После заживления раны на 10–14 день после ампутации организму необходимо накопить достаточное число стволовых клеток для формирования бластемы. Обычно полученных на стадии гистолиза стволовых клеток взрослому организму бывает недостаточно, так как регенерация сложных структур конечности требует большого количества клеток-предшественников. Решение данной проблемы — дедифференцировка и трансдифференцировка уже детерминированных клеток соседних тканей. При этом анамнии справляются с дефицитом стволовых клеток путем свободного формирования клеток-предшественников из дифференцированных клеток в бластеме, а у амниот дедифференцировка совмещена с трансдифференцировкой [1]. Переход к более недифференцированному состоянию или смена клеткой своей специализации сопровождается реорганизацией цитоскелета (клеточного каркаса), перегруппировкой клеток, изменением взаимодействия между молекулами клеточной адгезии (преимущественно кадгерином и интегрином).
- Кадгерины и интегрины
- кальций-зависимые и кальций-независимые соединения соответственно, которые управляют перемещениями клеток, взаимодействуют с элементами внеклеточного матрикса и контролируют избирательное связывание клеток друг с другом в пункте назначения.
Синтез цитокинов, факторов роста, сигнальных молекул и молекул клеточной адгезии, от которых зависит потеря или смена клеточной специализации и пролиферация клеток в бластеме, коррелирует с кислородным голоданием — гипоксией. Если обратить внимание на хронологическую последовательность регенерации конечности у мыши, то можно заметить, что гипоксия наблюдается как раз к 12-му дню после ампутации конечности (рис. 8) [5].
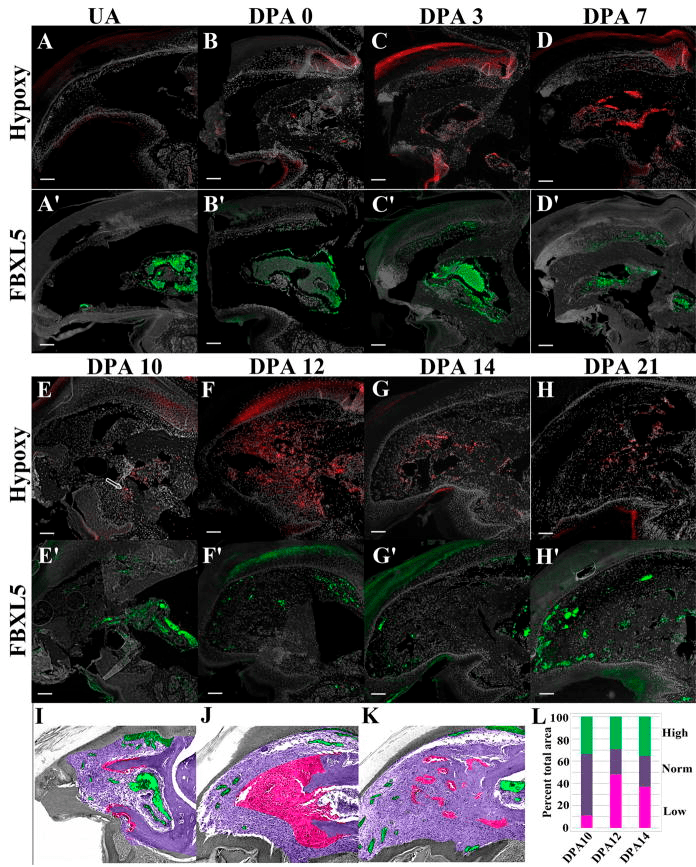
Рисунок 8. Кислород на месте ампутированной конечности. На кончике пальца мыши после ампутации можно заметить области гипоксии (A–H; красный цвет) и нормальной концентрации кислорода (A’-H’; зеленый цвет). Примечательно, в первые 7 дней после ампутации (DPA — days post-amputation) концентрация кислорода была по большей части повышена в тканях пальца, что связано с беспрепятственным проникновением кислорода через незакрытую эпидермисом рану, однако после ее закрытия можно наблюдать обширные области сниженной концентрации кислорода в тканях, что впоследствии приводит к формированию бластемы на 12-й день после ампутации (F, J, L).
На основе работ по изучению гипоксии во время регенерации можно предположить, что кислородное голодание является своеобразным стимулятором регенеративных процессов на стадии формирования бластемы. Однако как клеткам, которым обычно необходим кислород для нормального функционирования, приспособиться к таким непростым условиям? В это время в них синтезируются молекулы, призванные поддерживать их жизнеспособность — фактор, индуцируемый гипоксией, или HIF-1α [14]. Он побуждает клетки синтезировать те гены, которые адаптируют метаболизм под условия недостатка кислорода и участвуют в пролиферации и выживаемости клеток. Однако работа HIF-1α на данном этапе не закончена. Впоследствии он будет необходим уже для восстановления сосудистой сети.
Клетки бластемы обладают сложным генетическим профилем. Какие же гены отвечают за перепрограммирование зрелых клеток в стволовые? Общий фон экспрессии генов бластемы схож с таковым у эмбриональных стволовых клеток уже после формирования зародышевых листков. Кажется, многие слышали о возможности превратить окончательно дифференцированные клетки в стволовые, которые называются индуцированными плюрипотентными стволовыми клетками: ученые Джон Гардон и Шинья Яманака на опыте продемонстрировали, как вектор из четырех генов (Myc, Oct3/4, Sox2 и Klf4; данный список продолжает пополняться), внедренный в клетки, может обратить вспять биологические часы [15]. По сути, такие же гены активны в стволовых клетках бластемы.
К сожалению, было доказано, что клетки бластемы находятся не в плюрипотентном состоянии даже у анамний. Только четыре из шести ключевых генов транскрипционных факторов (Klf4, Sox2, Lin28, c‐Myc; без Nanog и Oct4), используемых для перепрограммирования взрослых специализированных клеток, активно экспрессируются [16]. Именно поэтому стволовые клетки бластемы относят к мультипотентным — клеткам, которые могут дифференцироваться только в клетки определенного типа ткани. Наряду с обязательными генами в общий профиль бластемы может входить до 50 генов, в разной степени вовлеченных в процесс формирования и поддержания бластемы. Однако необходимо еще распределить такое разнообразие клеток в пространстве для последующих дифференцировки и ремоделирования.
Для этого существуют так называемые направляющие воздействия. Активность небольшой группы соединений координирует миграцию большой популяции клеток, не только стволовых. Среди них помимо градиента кислорода важное место занимает комплекс из сигнальной молекулы и рецептора SDF1/CXCR4 [17]. Во время регенерации сигнальные молекулы SDF1 синтезируются преимущественно в фибробластах, которые, как говорилось ранее, необходимы для организации внеклеточного матрикса в бластеме. SDF1/CXCR4 примечателен тем, что его синтез повышается в ответ на повышение концентрации HIF-1α и механические повреждения, что приводит к усиленной миграции стволовых клеток посредством хемотаксиса в область ампутации (рис. 9) [14], [17]. Таким образом, к концу стадии образования бластемы у организма уже есть резерв стволовых клеток и место для их дислокации для последующей дифференцировки.
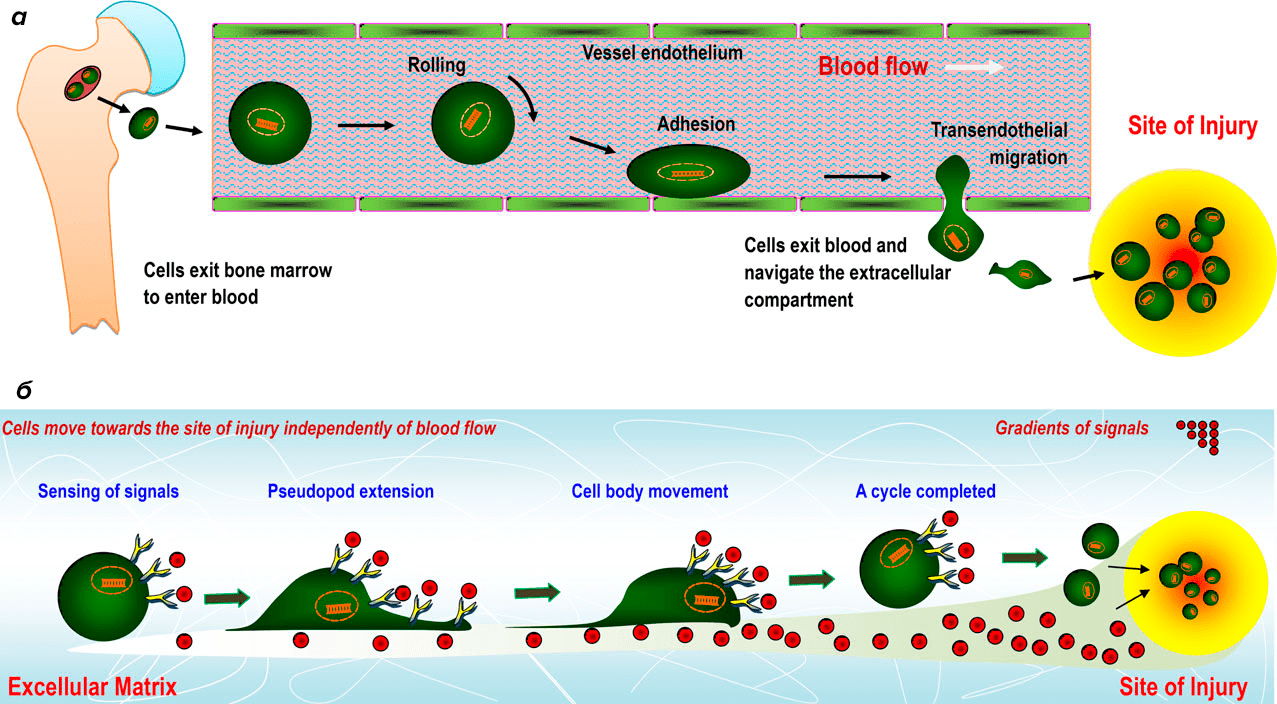
Рисунок 9. Миграция стволовых клеток по градиенту сигнальных молекул (например, факторов роста и хемокинов), которые высвобождаются тканью в ответ на повреждение. Стволовые клетки мобилизуются из костной ткани и мигрируют по кровеносным сосудам (а) или непосредственно по внеклеточному матриксу (б) с помощью белков клеточной адгезии, достигая места повреждения.
5. Дифференцировка
После образования бластемы необходимо направить дифференцировку стволовых клеток в нужное русло для последующего ремоделирования поврежденной конечности. У каждой более специализированной группы клеток активны определенные гены, которые кодируют сигнальные молекулы, молекулы клеточной адгезии, структурные белки и другие соединения. Чтобы восстановить ткань, нужно направить стволовые клетки по пути переспециализации, которая, в свою очередь, достигается за счет смены экспрессируемых генов.
Рассмотрим в качестве примера активацию сателлитных стволовых клеток — предшественников миоцитов. Направление миогенной дифференцировки осуществляется при помощи различных факторов роста, к которым относятся фактор роста гепатоцитов (HGF), фактор роста фибробластов (FGF), трансформирующий фактор роста β (TGF-β). Взаимодействуя со своими рецепторами, они активируют внутриклеточные сигнальные пути, что приводит к экспрессии специфических миогенных регуляторов. Среди них можно выделить белки и их семейства — Pax (Pax3, Pax7), MyoD, Myf5, MRF4, миогенин [18]. Они заставляют клетки дифференцироваться и производить специфические для мышц актин и миозин, цитоскелетные, метаболические и мембранные белки, характерные именно для мышечной клетки. При регенерации происходит активация не всех регуляторов сразу, процесс последователен: сначала в клетках-предшественниках активен белок Pax7, затем начинает синтезироваться MyoD, потом Myf5 и MRF4, а миогенин вырабатывается позднее, одновременно с началом производства тяжелых цепей миозина (рис. 10). При этом порядок их синтеза отличается от картины, характерной для миогенеза в ходе эмбрионального развития.
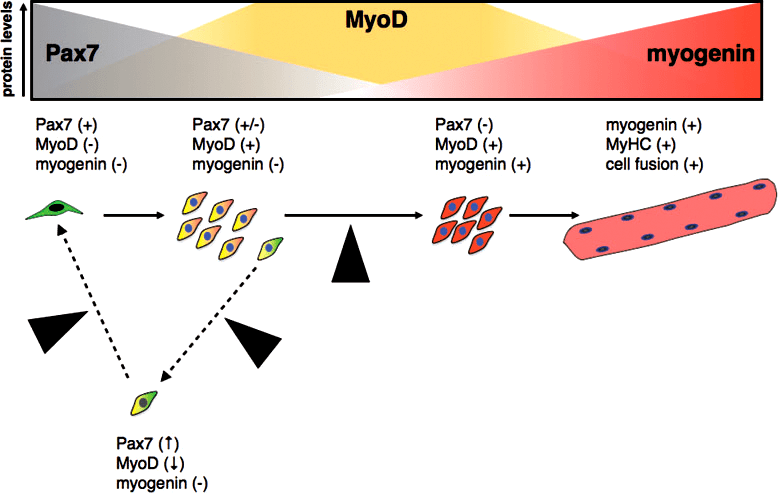
Рисунок 10. При пролиферации и самообновлении сателлитных клеток повышена выработка Pax7, затем под воздействием внешних стимулов происходит постепенная дифференцировка, за которую отвечает регулятор MyoD, в конце дифференцировки к общему фону экспрессии подключается ген транскрипционного фактора миогенина, который стимулирует синтез основных сократительных белков мышц (актин и миозин) и белков клеточной адгезии.
Особенное место при восстановлении конечности занимает дифференцировка клеток соединительной ткани. В основе этого процесса лежит активность преобладающих в бластеме фибробластов. В плане регенерации фибробласты являются уникальной группой клеток: после повреждения они мигрируют по градиенту сигнальных молекул, помогая восстанавливать как внеклеточный матрикс, так и почти все клетки соединительной ткани — костные клетки (остеобласты, остеоциты), хрящевые клетки (хондроциты), жировые клетки (адипоциты) и клетки гладких мышц (входят в состав сосудов) [19], [20]. Фибробласты в разных частях организма могут сильно отличаться друг от друга, даже в одной конечности между ними есть различия. Так, «зрелые» фибробласты, почти дифференцированные клетки с меньшей способностью к преобразованиям, могут существовать рядом с «незрелыми» фибробластами (часто называемыми мезенхимальными стволовыми клетками), которые способны развиваться в любой тип клеток соединительной ткани (рис. 11).
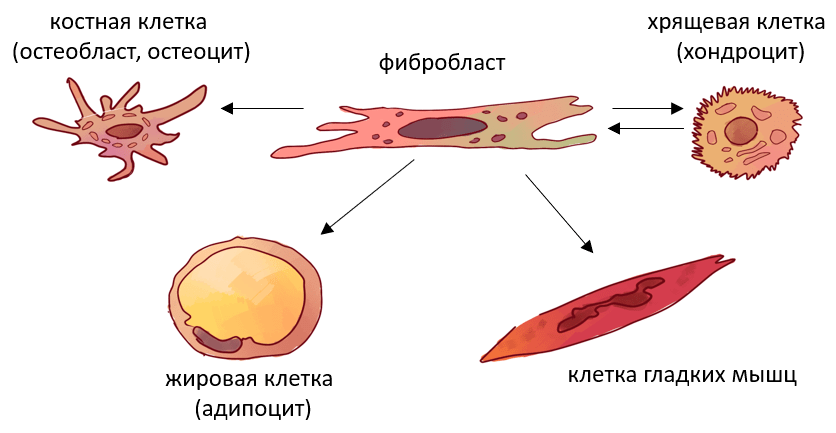
Рисунок 11. Универсальные фибробласты. Стрелками показаны взаимные превращения, происходящие между представителями семейства соединительной ткани.
[19], рисунок адаптирован
Поэтому грань между стволовыми клетками и фибробластами может быть довольно тонкой. Механизм этих взаимных превращений изучен не до конца, но можно выделить несколько наиболее важных участников сигнальных путей фибробластов: костные морфогенетические белки (BMP) и трансформирующий фактор роста β (TGF-β) [21]. Они регулируют рост, дифференцировку клеток соединительной ткани, а также контролируют синтез внеклеточного матрикса.
Параллельно с процессами дифференцировки происходит развитие сосудистой сети. Под влиянием ряда факторов роста — фибробластов (FGF), тромбоцитарного (PDGF), эпидермального (EGF), трансформирующего (TGF-β), фактора некроза опухоли-альфа (TNF-α), IL-6, IL-1 — происходит повышение уровня синтеза фактора роста эндотелия сосудов (VEGF). Он же является мощным стимулятором эндотелиоцитов, выстилающих кровеносные сосуды [13], [22]. VEGF связывается с рецепторами на поверхности эндотелиоцитов, побуждая их разрастаться и проникать в испытывающую кислородное голодание ткань после образование бластемы, чтобы обеспечить ее новыми кровеносными сосудами. Чтобы эндотелиальные клетки бесконтрольно не разрастались, они взаимодействуют между собой и с краевыми клетками для своевременной приостановки ангиогенеза. Таким образом, если запустить нужную комбинацию работы генов, можно преобразовать стволовые клетки в определенный тип дифференцированных клеток.
Наиболее простой способ — обратиться к внешним стимулам, которые в норме поступают от соседних клеток. Общая схема дифференцировки основана на том, что сигнальные белки от окружающих бластему клеток направляют развитие группы клеток по определенному пути. Можно выделить шесть групп сигнальных путей, необходимых как для самообновления стволовых клеток в бластеме, так и для их дифференцировки: FGF, TGFβ, BMP, Hedgehog (Hh), Notch, Wnt. Все ранее упомянутые молекулы в той или иной степени являются их участниками. Пути могут пересекаться и иметь общие сигнальные молекулы (рис. 12).
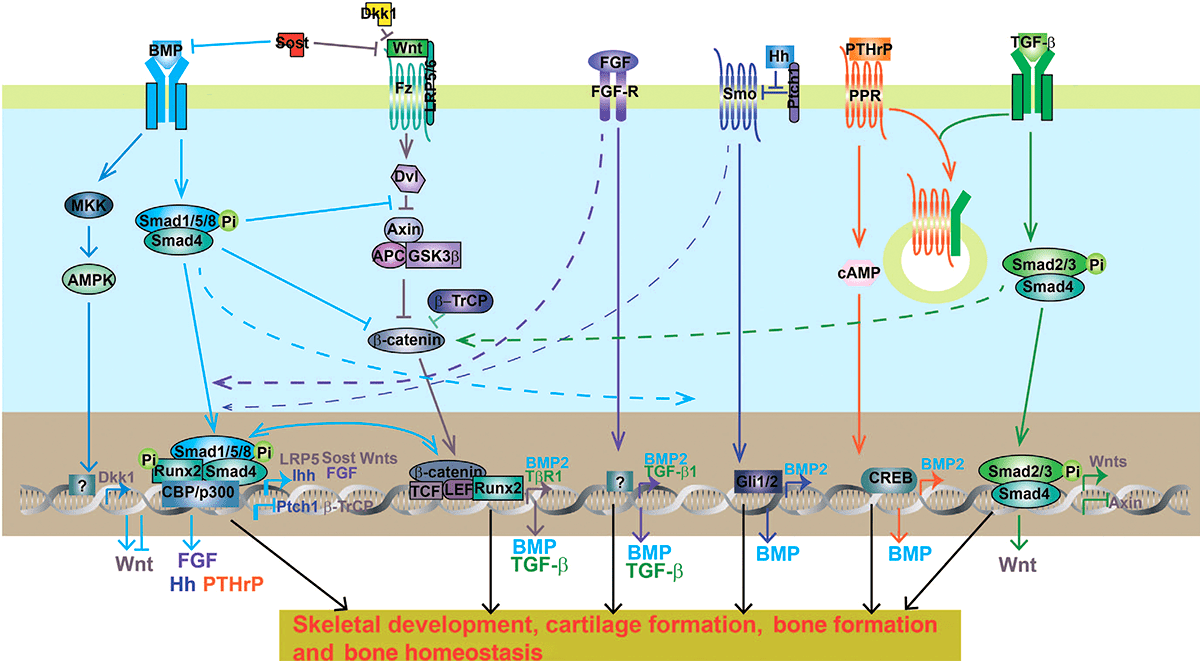
Рисунок 12. Общая схема и перекрестное взаимодействие некоторых сигнальных путей. Их активация связана со сложным каскадом взаимодействий между комплексами белков и ДНК, что в итоге приводит к синтезу белков, необходимых для регенерации поврежденных тканей.
Наиболее изученными в плане регенерации являются белки семейства Wnt. Они способны активировать Wnt/β-катениноный путь (канонический Wnt-путь), который основан на протеолизе (расщеплении) β-катенина — белка-регулятора генов, что приводит к окончательному определению судьбы клеток и морфогенезу; и неканонические (β-катенин-независимые) пути, которые регулируют реорганизацию цитоскелета и метаболизм кальция в клетках [23]. При этом дифференцировка клеток не обязательно должна быть однородной.
Существует механизм, обусловливающий чередование обычных эпидермальных клеток с сенсорными. За него преимущественно отвечает путь Notch. В основе лежит связывание сигнального белка Delta с рецептором Notch. Этот путь направляет сигнал клеткам вблизи предшественника сенсорной клетки не становиться на такой же путь дифференцировки. В результате они становятся эпидермальными.
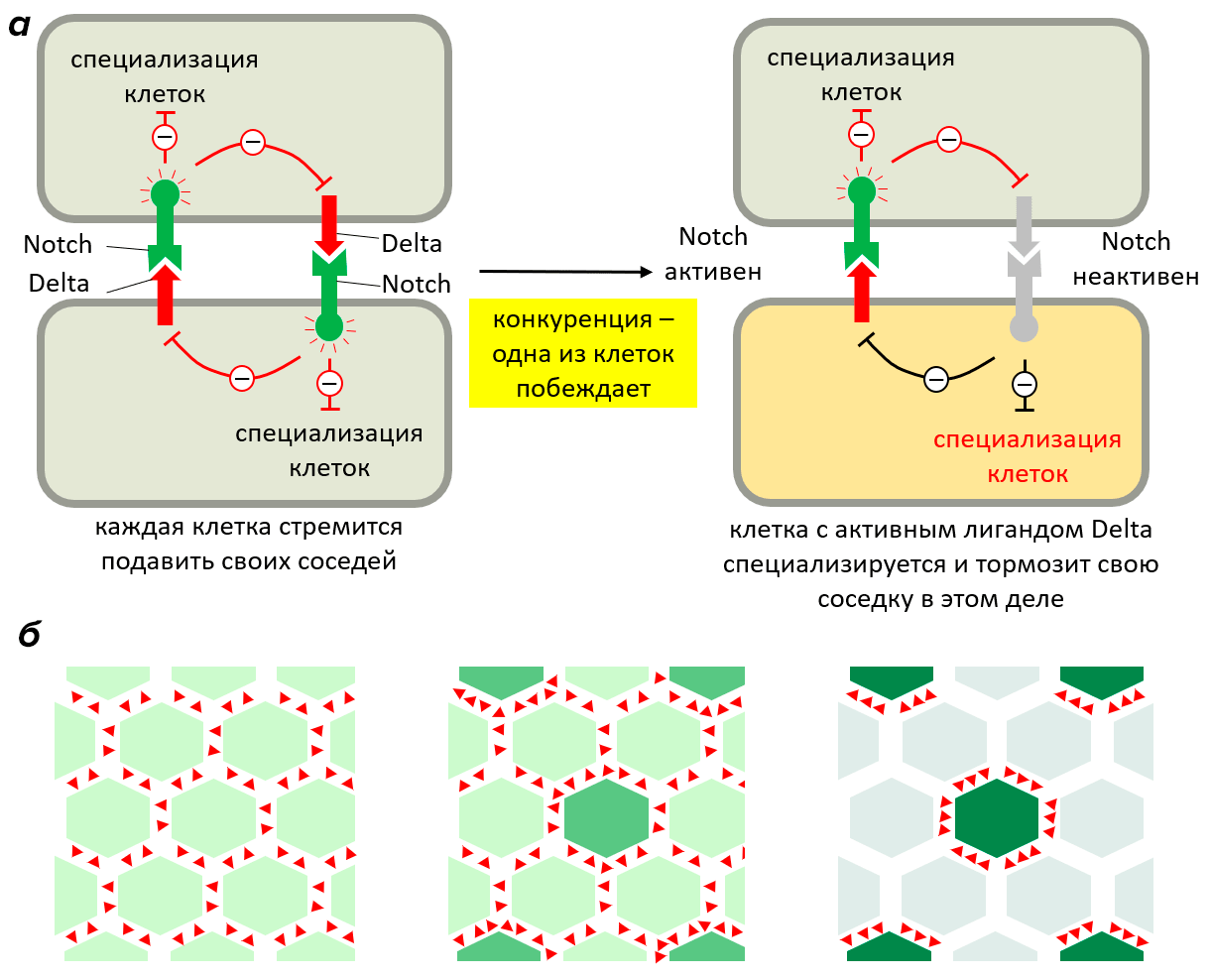
Рисунок 13. а — Механизм конкурентного ингибирования соседствующих клеток. Сначала все клетки в группе эквивалентны и синтезируют и трансмембранный рецептор Notch, и его сигнальную молекулу Delta, что препятствует специализации (серый цвет клеток). Когда одна из клеток дифференцируется (оранжевый цвет клеток), она пытается предотвратить дифференцировку в том же направлении соседних клеток за счет более сильной выработки Delta (у неспециализированной клетки производство Delta подавляется). б — Исход того же процесса в более многочисленной группе клеток. Выигрывающая клетка по мере того, как становится все более и более дифференцированной, тормозит своих соседей все сильнее.
[35], рисунок адаптирован
Таким образом, результатом активации или ингибирования перечисленных сигнальных путей является изменение транскрипции ДНК в отвечающей на сигнал клетке. Одни гены включаются, а другие выключаются. Разные сигнальные молекулы (факторы роста, гормоны, цитокины) активируют разные виды регулирующих гены белков, поэтому одни и те же клетки по-разному реагируют на один и тот же сигнал, посылаемый в разное время, а клетки разного типа по-разному реагируют на одинаковый сигнал. При этом молекулы сигнальных путей образуют группу сигнальных молекул — морфогенов, изменение концентрации которых приводит к изменению градиента концентрации сигнала, что побуждает клетки ступать на различные пути развития (высокая концентрация — один путь развития, низкая концентрация — другой). Когда клетка делает свой окончательный выбор в дифференцировке, она обязуется следовать сложной программе, предполагающей экспрессию строго определенного набора генов. В конечном счете это приводит к ремоделированию конечности, где каждая специализированная клетка занимает свое место.

Рисунок 14. Иногда выбор пути клеточной специализации навевает воспоминания о дорожном камне из русских былин
рисунок Анастасии Кисловой
6. Ремоделирование
Вместе с процессами дифференцировки происходит ремоделирование — восстановление исходного размера и формы конечности. Эти процессы могут быть растянуты во времени и занимать от 14 до 40 дней после ампутации. Необходимо учесть факт, что к концу дифференцировки каждая клетка обладает своей пространственной ориентацией благодаря молекулам клеточной адгезии и запоминает положение по биохимическим реакциям соседей — возникает подобие позиционной памяти. Передние и задние конечности обладают одним и тем же набором дифференцированных тканей (кости, кожа, мышцы). Однако именно различие в пространственном положении тканей друг относительно друга отличает руку от ноги. И клеточная память хранит информацию об этом. Если перенести элемент бластемы с дистальной (дальше от туловища) части конечности к более проксимально (ближе к туловищу) расположенной бластеме той же конечности, то клетки будут формировать нормальную конечность [16]. Если же взять часть клеток бластемы, которая в норме должна образовывать заднюю конечность, и интегрировать в область бластемы передних конечностей, то нас ждет весьма интересный результат: из-за позиционной памяти часть клеток передних конечностей будет содержать морфологические признаки задних конечностей (рис. 15).
Рисунок 15. Такие маленькие мелочи, как происхождение бластемы, могут иметь большое значение
рисунок Анастасии Кисловой
Как происходит регуляция положения клеток, приводящая к формированию нужной? Она осуществляется с помощью так называемых гомеозисных генов (консервативных генов, отвечающих за регуляцию развития и формирование органов и тканей). Различают несколько комплексов гомеозисных генов, которые объединены в кластеры на нескольких хромосомах. Общее число таких генов в течение эволюции достигло 48 у млекопитающих. При этом к наиболее важным семействам генов относится Hox-группа, которая участвует в определении формы конечностей и экспрессируется неоднородно в проксимальном и дистальном положениях в бластеме. Так, в конечности позвоночных гены из пары комплексов Hох (НохА и НоxD) экспрессируются в виде регулярной системы, подчиняющейся обычным правилам последовательной экспрессии генов в этих комплексах (всего их четыре: НохА, HoxB, HoxC и НоxD). Они помогают в сочетании с другими факторами регулировать различия в поведения клеток по проксимально-дистальной оси конечности. В результате клетка запоминает свой «адрес» по оси конечности в пределах своего сегмента [24].
Но не все регуляторы относятся к группе гомеозисных белков. Например, группа морфогенов — Wnt, Bmp, Sox9 [25]. Это трио лежит в основе реакционно-диффузионный механизма, открытого Аланом Тьюрингом в 1979 году. Благодаря взаимной активации и ингибированию при участии описанных выше факторов роста и гомеозисных белков происходит формирование в бластеме градиентного сигнала и паттерна из полос Sox9, в результате чего образуется необходимое число и приобретается правильная форма пальцев [26]. При этом любое нарушение одного из компонентов может нарушить нормальное строение конечности.
Нервная иннервация и бластема — «два сапога пара»
Следует учитывать, что на всех этапах регенерации, особенно на ранних стадиях, важную роль играет нервная иннервация места повреждения, которая является своеобразным связующим звеном в процессах регенерации. Можно сказать, что нейроны способствуют миграции и создают дополнительный стимул к дифференцировке стволовых клеток [9]. Еще в 2003 году было доказано, что факторы роста, среди которых можно выделить нейротрофический фактор мозга (BDNF) и глиальный нейротрофический фактор (GDNF), необходимые для нормального развития бластемы и дополнительного привлечения нервов к месту ампутации, образуются как раз при взаимодействии микроокружения бластемы с нервами [27]. К примеру, ампутированные конечности тритона без иннервации не регенерируют, а раны просто зарубцовываются. Даже была сформулирована нейротрофическая теория Маркуса Сингера на основе его работ 1942–1978 годов, согласно которой существует некий порог числа нервных волокон для успешного формирования бластемы в зависимости от места повреждения. Причем тип нервных волокон (чувствительные или двигательные), согласно ей, не влияет существенно на ход регенерации. Результаты исследований, проведенных на тритонах, подтверждают, что чем больше площадь поперечного сечения у конечности, тем большее число нервных волокон необходимо для регенерации (количество нервных волокон на единицу площади при этом оставалось постоянным) [28]. Эта теория работает и на млекопитающих, хотя роль иннервации в регенерации у них изучена не до конца: у мышей при удалении нервов задней конечности в области кончиков пальцев наблюдалось утолщение кожи и нарушение роста костей, однако стволовые клетки все же не утрачивали способность к дифференцировке [29].
«Через неделю пациент пришел со старым отрубленным пальцем в сумке и новым на руке» — Каковы реальные возможности регенеративной медицины настоящего и будущего?
Мы постарались объяснить процессы, за счет которых происходит регенерация конечностей, но пока оставили без должного внимания самый важный вопрос — до какой степени возможна регенерация? Анамнии способны отращивать всю конечность заново, но у амниот все иначе. По названию статьи и примерам, приведенным по ходу, читатель уже мог догадаться, что у амниот, особенно у млекопитающих, регенерация возможна не для плеча, не для предплечья, даже не для кисти, а только лишь для фаланг пальцев (и то не всех)! В исследовании на мышах ученые ампутировали различные фаланги пальцев, а затем наблюдали за формированием бластемы. На 10-й день после ампутации образование бластемы на уровне второй фаланги наблюдалось лишь в некоторых случаях. При этом даже попытка приживления бластемы из первой фаланги ко второй не увенчалась успехом (наблюдалось менее 10% случаев успешного формирования бластемы) [30]. На успех регенерации может влиять ногтевая пластина, вокруг которой обнаружено скопление стволовых клеток, способных влиять на другие мультипотентные стволовые клетки. После ампутации кончика пальца в пределах ногтевой пластины стволовые клетки за счет активности уже известных генов группы Bmp и Wnt и перечисленных ранее в статье цитокинов, факторов роста, транскрипционных факторов и молекул клеточной адгезии оказались способны восстановить утраченный кончик пальца. Мыши после ампутации выше ногтевой пластины в пределах второй фаланги были почти лишены способности к регенерации [31].
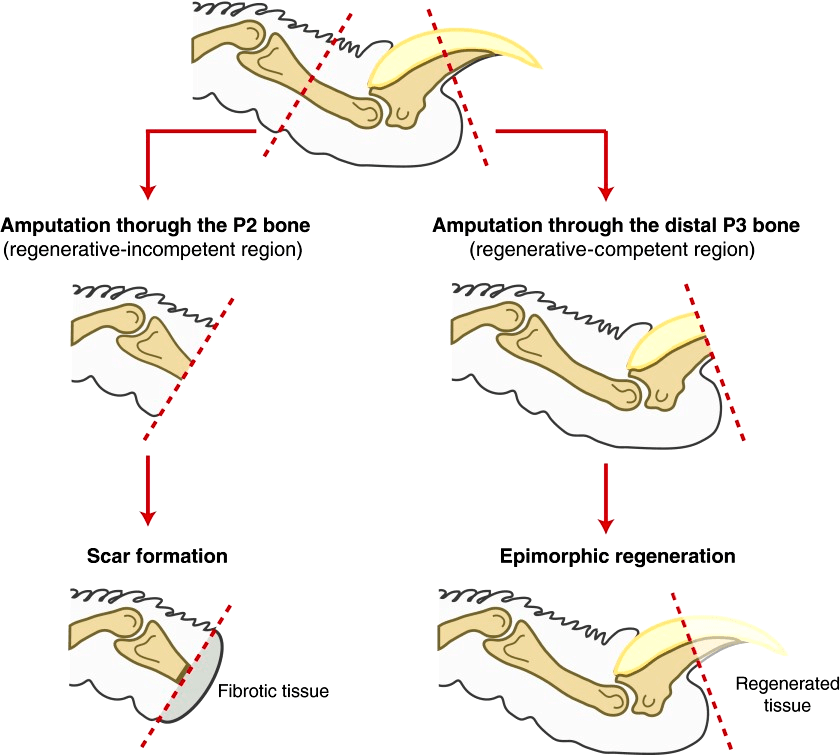
Рисунок 16. Когда регенерация невозможна. Если произвести срез в пределах первой фаланги (правый путь), то регенерация утраченной части конечности возможна. Если же ампутация произошла дальше, в пределах второй фаланги (левый путь), то образуется преимущественно фиброзная ткань.
У людей наблюдается похожая картина: пострадавший после несчастного случая может регенерировать первую фалангу пальца, на которой осталась нетронутая ногтевая пластина. Может ли врач поспособствовать более эффективному процессу регенерации? В силу сложности хирургической работы с мелкими сосудами проводить операции по реплантации нецелесообразно. Лучший вариант — наложить окклюзионную повязку на место ампутации, тем самым предотвращая возможное заражение и предоставить организму самому справиться с проблемой, как это было ранее упомянуто в исследовании с медицинским клеем.
В журнале International Journal of Molecular Sciences ученые впервые описывают изменения, происходившие на раневой поверхности в течение недели после ампутации у людей. Выяснилось, что в экссудате, полученном с окклюзионных повязок, была повышена концентрация упомянутых ранее факторов роста — VEGF, EGF, FGF, BDNF, — а также воспалительных цитокинов на первой неделе после ампутации. На второй — противовоспалительных цитокинов [32]. При этом неясной оставалась роль иммунитета, результаты действия которого связывали с образованием фиброзной ткани. Успешная регенерация в основном наблюдалась у детей. Примечательно, что после регенерации отпечаток пальца не восстанавливался. Тем не менее в интернете можно найти немало сопровождающихся фотографиями рассказов о случаях успешной регенерации у взрослых. Вот еще один повод беречь свои ногти!
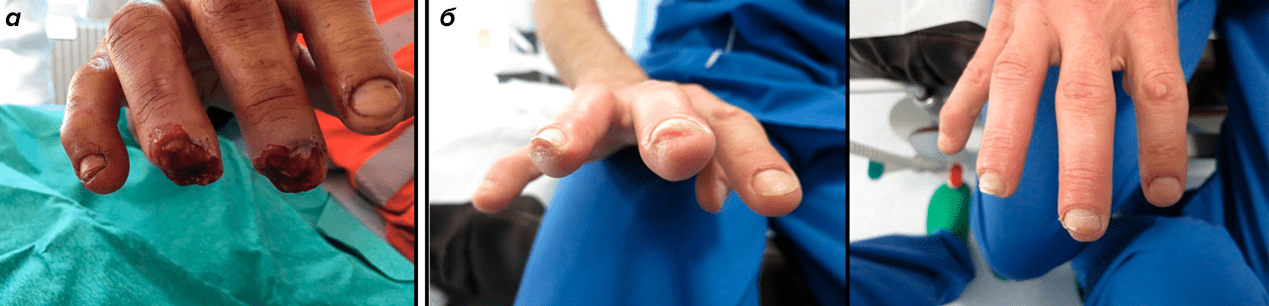
Рисунок 17. Клинический случай регенерации: а — перед наложением окклюзионной повязки; б — через три месяца после травмы. Регенерированные пальцы по морфологическим и функциональным характеристикам аналогичны пальцам на другой руке.
Может показаться, что в регенерации кончиков пальцев нет ничего важного. Слишком уж мелки они, что в физических размерах, что в значимости для организма по сравнению с другими органами. Однако ее изучение впоследствии позволит расширить знания о созревании стволовых клеток, и в будущем станет возможным спроецировать модель восстановления кончиков пальцев на более сложные структуры. Надеемся, развитие технологий регенеративной медицины позволит создать будущее, в котором протезы уже не будут нужны.
Литература
- Elizabeth R. Zielins, Ryan C. Ransom, Tripp E. Leavitt, Michael T. Longaker, Derrick C. Wan. (2016). The role of stem cells in limb regeneration. Organogenesis. 12, 16-27;
- Лаборатория молекулярных основ эмбриогенеза: от гена к признаку;
- Туберкулез: роковая история коварной болезни;
- Jennifer Simkin, Mimi C. Sammarco, Lindsay A. Dawson, Catherine Tucker, Louis J. Taylor, et. al.. (2015). Epidermal closure regulates histolysis during mammalian (Mus) digit regeneration. Regeneration. 2, 106-119;
- Mimi C Sammarco, Jennifer Simkin, Danielle Fassler, Alex J Cammack, Aaron Wilson, et. al.. (2014). Endogenous Bone Regeneration Is Dependent Upon a Dynamic Oxygen Event. J Bone Miner Res. 29, 2336-2345;
- Как работает свертывание крови?;
- Последний путь тромбоцита;
- Что такое внеклеточный матрикс и почему его все изучают;
- Yohan Choi, Fanwei Meng, Charles S. Cox, Kevin P. Lally, Johnny Huard, Yong Li. (2017). Regeneration and Regrowth Potentials of Digit Tips in Amphibians and Mammals. International Journal of Cell Biology. 2017, 1-13;
- Sarah Calve, Shannon J. Odelberg, Hans-Georg Simon. (2010). A transitional extracellular matrix instructs cell behavior during muscle regeneration. Developmental Biology. 344, 259-271;
- Bellayr I., Holden K., Mu X., Pan H., Li Y. (2013). Matrix metalloproteinase inhibition negatively affects muscle stem cell behavior. Int. J. Clin. Exp. Pathol. 2, 124–141;
- James W. Godwin, Alexander R. Pinto, Nadia A. Rosenthal. (2013). Macrophages are required for adult salamander limb regeneration. Proc Natl Acad Sci USA. 110, 9415-9420;
- Jennifer Simkin, Mimi C. Sammarco, Lindsay A. Dawson, Paula P. Schanes, Ling Yu, Ken Muneoka. (2015). The mammalian blastema: regeneration at our fingertips. Regeneration. 2, 93-105;
- Lizhen Liu, Qin Yu, Jie Lin, Xiaoyu Lai, Weijie Cao, et. al.. (2011). Hypoxia-Inducible Factor-1α Is Essential for Hypoxia-Induced Mesenchymal Stem Cell Mobilization into the Peripheral Blood. Stem Cells and Development. 20, 1961-1971;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- David L. Stocum. (2017). Mechanisms of urodele limb regeneration. Regeneration. 4, 159-200;
- Xuan Li, Xiao-Tao He, Yuan Yin, Rui-Xin Wu, Bei-Min Tian, Fa-Ming Chen. (2017). Administration of signalling molecules dictates stem cell homing forin situregeneration. J. Cell. Mol. Med.. 21, 3162-3177;
- Hugo C. Olguín, Addolorata Pisconti. (2012). Marking the tempo for myogenesis: Pax7 and the regulation of muscle stem cell fate decisions. J. Cell. Mol. Med.. 16, 1013-1025;
- Fibroblasts and their transformations: the connective-tissue cell family. In: Molecular Biology of the Cell (4th Edition) / ed. by Alberts B., Johnson A., Lewis J., Raff M., Roberts K., Walter P. NY: Garland Science, 2002. — 712 p.;
- Такие разные стволовые клетки;
- Mengrui Wu, Guiqian Chen, Yi-Ping Li. (2016). TGF-β and BMP signaling in osteoblast, skeletal development, and bone formation, homeostasis and disease. Bone Res. 4;
- Ling Yu, Mingquan Yan, Jennifer Simkin, Paulina D. Ketcham, Eric Leininger, et. al.. (2014). Angiogenesis is inhibitory for mammalian digit regeneration. Regeneration. 1, 33-46;
- Важнейшие стрелочники клеток организма: белки Wnt;
- Гены, от которых вырастают крылья. И ноги. И всё остальное;
- Ashley W. Seifert, Ken Muneoka. (2018). The blastema and epimorphic regeneration in mammals. Developmental Biology. 433, 190-199;
- Дай пять: как математика управляет развитием пальцев;
- J Boyd. (2003). Glial cell line-derived neurotrophic factor and brain-derived neurotrophic factor sustain the axonal regeneration of chronically axotomized motoneurons in vivo. Experimental Neurology. 183, 610-619;
- Marcus Singer. (1947). The nervous system and regeneration of the forelimb of adult triturus. VII. The relation between number of nerve fibers and surface area of amputation. J. Exp. Zool.. 104, 251-265;
- Yuval Rinkevich, Daniel T. Montoro, Ethan Muhonen, Graham G. Walmsley, David Lo, et. al.. (2014). Clonal analysis reveals nerve-dependent and independent roles on mammalian hind limb tissue maintenance and regeneration. Proc Natl Acad Sci USA. 111, 9846-9851;
- Yuanyuan Wu, Karen Wang, Adrine Karapetyan, Warnakulusuriya Akash Fernando, Jennifer Simkin, et. al.. (2013). Connective Tissue Fibroblast Properties Are Position-Dependent during Mouse Digit Tip Regeneration. PLoS ONE. 8, e54764;
- Makoto Takeo, Wei Chin Chou, Qi Sun, Wendy Lee, Piul Rabbani, et. al.. (2013). Wnt activation in nail epithelium couples nail growth to digit regeneration. Nature. 499, 228-232;
- Paris Jafari, Camillo Muller, Anthony Grognuz, Lee Applegate, Wassim Raffoul, et. al.. (2017). First Insights into Human Fingertip Regeneration by Echo-Doppler Imaging and Wound Microenvironment Assessment. IJMS. 18, 1054;
- Гончарук С. (2018). Ras-dva и готово. ИБХ РАН;
- Lina M. Quijano, Kristen M. Lynch, Christopher H. Allan, Stephen F. Badylak, Tabassum Ahsan. (2016). Looking Ahead to Engineering Epimorphic Regeneration of a Human Digit or Limb. Tissue Engineering Part B: Reviews. 22, 251-262;
- Альбертс Б., Джонсон А., Льюис Д. и др. Молекулярная биология клетки: в 3-х томах. М.: «Мир», 1994. — 1560 с..