Ископаемая биомолекула: иголка в стоге сена?
03 марта 2021
Ископаемая биомолекула: иголка в стоге сена?
- 450
- 0
- 2
Иллюстрация к роману Майкла Крайтона «Парк Юрского периода».
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Существует ли связь с древними мирами и организмами, их населявшими? Реально ли найти молекулы, которые принадлежали доисторическим монстрам? Можно ли вернуться в прошлое и поймать динозавра «за хвост»? На эти вопросы отвечают молекулярные палеонтологи. Поиск органических молекул, принадлежащих вымершим существам, начался еще в 1960-е годы. Их достижениям и разочарованиям, методам работы и будущим экспериментам посвящена статья.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Камни преткновения молекулярной палеонтологии
— Для того чтобы воспроизвести динозавра, нам нужно получить всю цепочку ДНК полностью. И она у нас вот тут, — он взял один из желтых камней. — В янтаре — окаменевшей смоле, в которую когда-то превратился сок доисторических деревьев.
— Когда древесный сок стекает, — стал объяснять Ву, — в него попадают и остаются там насекомые. Потом эти насекомые отлично сохраняются внутри окаменелости. Каких только насекомых не найдешь в янтаре, включая паразитов, сосавших кровь у крупных животных... Если у этого насекомого содержатся инородные клетки крови, мы сможем извлечь их и получить палео-ДНК или ДНК вымершего животного...
Майкл Крайтон. «Парк Юрского периода»
ДНК — главная молекула в организме, ответственная за хранение всей его генетической информации, программ развития и функционирования. В фантастическом романе Майкла Крайтона «Парк Юрского периода» ученые находят в янтаре ДНК вымерших рептилий и с ее помощью воскрешают динозавров. Руководство уверено, что парк с настоящими доисторическими монстрами ждет грандиозный успех, однако стечение обстоятельств превращает его в смертельно опасное место.
Опубликованный в 1990 году роман стал бестселлером, а его экранизация Стивеном Спилбергом вызвала настоящую «динозавроманию» и бум на палеонтологию. Заложенная в сюжете идея поиска древних биомолекул не является исключительно фантазией автора. В реальном мире изучением ископаемых биоорганических молекул занимаются молекулярные палеонтологи. Помимо ДНК, они также ищут белки, липиды, полисахариды, пигменты, а в качестве источника выступает не только янтарь, но и различные остатки растительного и животного происхождения (рис. 1).

Рисунок 1. Геохронологическая шкала. Геологическая история Земли делится на эры, периоды и эпохи. Такое деление связано с глобальными вымираниями и кардинальной сменой флоры и фауны, происходившими на Земле.
cайт Present5
В отличие от фантастики, реальные ископаемые биомолекулы доходят до исследователей в разрушенном и химически измененном состоянии. По иронии судьбы, наиболее «ценная» для науки биомолекула — ДНК — имеет самый короткий «срок годности». Для ее поддержания в живых клетках существуют специальные механизмы. После гибели клетки они выключаются, и ДНК постепенно рвется на короткие фрагменты, окисляется и теряет гуаниновые и адениновые основания [1–3]. Не менее информативны и белки, однако и они подвергаются распаду, а входящие в их состав аминокислоты — физико-химическим превращениям [4]. Согласно расчетам, полное разрушение ДНК наступает за 400 000–800 000 лет, а белков — за 2,7 млн лет при 0 °С [5], [6].
Вторая особенность, с которой столкнулись молекулярные палеонтологи, заключается в загрязнении, или контаминации, образца внешними биомолекулами. Источником контаминации может быть все, что угодно: микроорганизмы, лабораторные растворы, реактивы и даже человек. Его слюна, волосы и частицы кожи являются распространенными загрязняющими агентами [7], [8]. Тем не менее, наибольший вклад вносят вездесущие микробы. Они присутствуют на любой поверхности, проникают во все трещины и полости. В костях динозавра, например, могут жить целые сообщества бактерий, а в янтаре — различные грибы [9].
Перед учеными возник вопрос: можно ли предотвратить контаминацию и как отличить древнюю биомолекулу от ее современной копии? В 2000 году для этих целей был составлен свод правил [1], [10], [11]. Так, работа должна проводиться в специально изолированной и оборудованной лаборатории, а каждый эксперимент требует обязательной постановки контролей. Признаком ископаемых биомолекул является степень их распада: древняя ДНК никогда не будет представлена длинными фрагментами, а белки — полной аминокислотной последовательностью. Принятые стандарты способствовали получению достоверных и воспроизводимых результатов. Более подробно с ними можно ознакомиться в статье «Биомолекулы»: «Древняя ДНК: привет из прошлого» [12].
Наука не стоит на месте; появляются новые чувствительные методы анализа. «Добыча» белков, полисахаридов и пигментов активно ведется и в образцах, возраст которых превышает все допустимые сроки существования биомолекул. Разнообразие находок поражает воображение и задает исследователям новые загадки: как биомолекулы сохранились в течение десятков миллионов лет и какие механизмы этому способствовали?
В данной статье мы рассмотрим наиболее интригующие открытия в области молекулярной палеонтологии. Мы ознакомимся с ее основными методами и узнаем про механизмы и гипотезы, объясняющие невероятную химическую устойчивость биомолекул. Рассказ начнем с организмов, которые в романе «Парк Юрского периода» выступали проводниками человека в мир древних ящеров.
Ископаемая кровь и насекомые
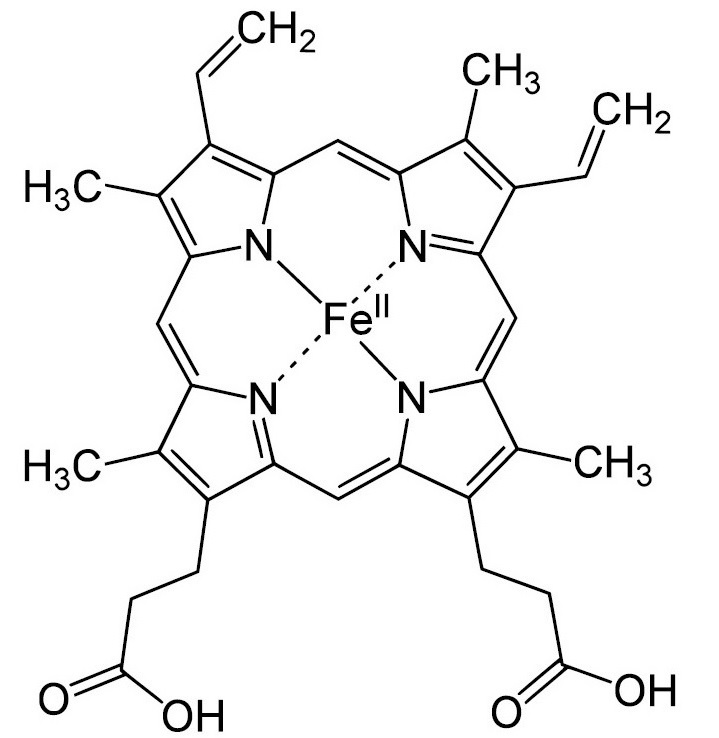
Кровь современных позвоночных хорошо изучена и представляет собой жидкость, богатую белками, минеральными солями и глюкозой. Красный цвет ей придает дыхательный пигмент гемоглобин, содержащий атом железа (рис. 2а). Он имеет сложную структуру и входит в состав эритроцитов — клеток крови, переносящих кислород к органам и тканям [13]. А что известно о крови ископаемых видов? Какие биомолекулы входили в ее состав? Какого она была цвета? На эти вопросы дали ответ молекулярные палеонтологи.
В сланцевых породах на северо-западе Монтаны, США, они нашли захоронение комаров Culiseta возрастом 46 млн лет [14]. Среди них были как самцы, так и самки (рис. 2б, рис. 2в). В них ученые обнаружили следы древней крови. Внешне о ее присутствии говорили размер и черная окраска брюшка насекомого, а молекулярный состав крови был определен с помощью масс-спектрометрии. Суть данного метода заключается в том, что под некоторым воздействием органические молекулы рвутся на определенные части. Для каждой биомолекулы набор фрагментов индивидуален, и по нему можно восстановить исходную структуру.
Анализ показал, что в ископаемых комарах присутствует соединение, которое по своим свойствам напоминает гемоглобин. Оно имеет схожее химическое строение, тоже связано с ионом железа и относится к классу порфиринов [14]. Порфирины являются распространенными компонентами различных пигментов и могут взаимодействовать с другими металлами, например, с магнием. По-видимому, именно ион железа выключает у гемоглобина химическую активность и позволяет ему храниться практически в неизмененном состоянии на протяжении многих миллионов лет [14].
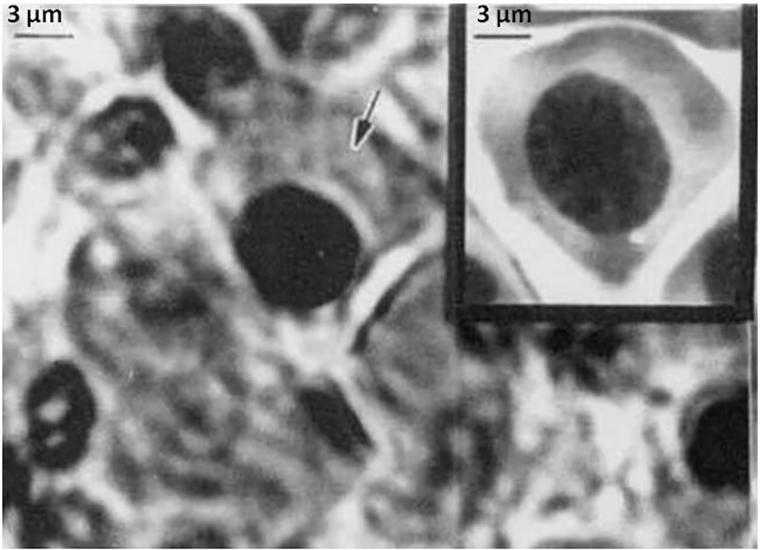
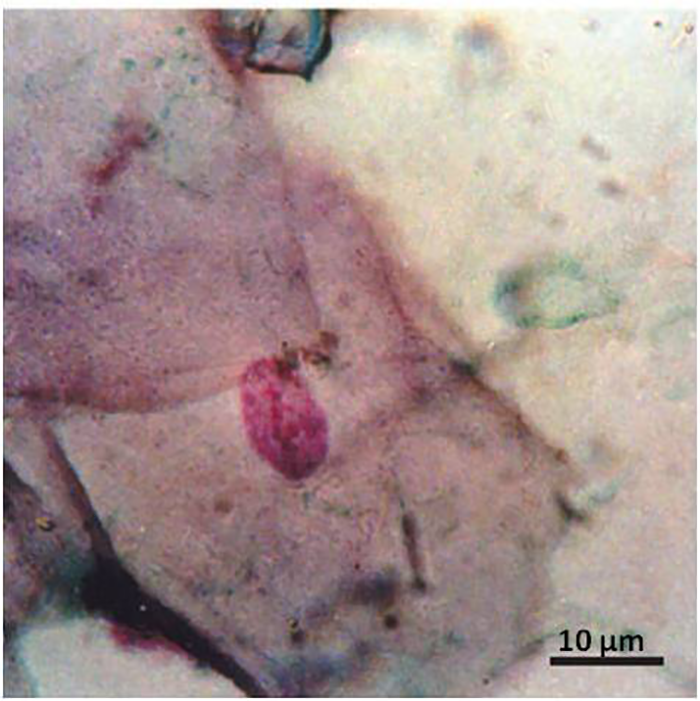
Обнаруженные экземпляры — не единственные примеры везения в мире палеонтологии. В 2004 году в янтаре был найден новый вид насекомого. Окаменелость размером 1 мм — песчаная муха, которую назвали Palaeomyia burmitis (рис. 3) [15]. В ее желудке ученые увидели структуры, похожие на клетки крови [15]. Они были неправильной формы, имели ядро и внешне напоминали эритроциты современных ящериц. Поскольку муха существовала одновременно с динозаврами, то она вполне могла питаться кровью этих животных.
Данная находка повторяет сюжет романа М. Крайтона: ученые находят в янтаре насекомых, внутри которых содержится кровь; из нее выделяют ДНК и воскрешают динозавров. О том, можно ли это сделать в реальном мире, рассказано в следующей главе.
Биомолекулы из янтаря
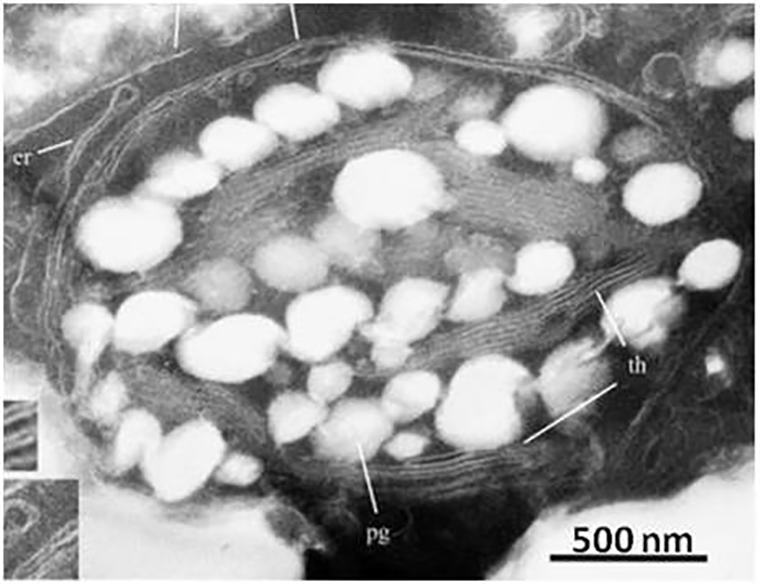
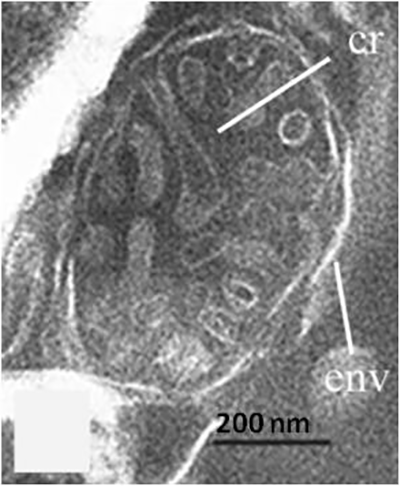
Смола древних растений, представленная в виде камней оранжевого, желтого и голубого цветов, называется янтарем. Под воздействием воды она претерпевает химические реакции — полимеризуется — и с течением времени затвердевает. Вместе с ней превращаются в камень и различные организмы, ставшие ее пленниками. Растения и насекомые в ней прекрасно сохранились и дошли до исследователей в первозданном виде. В их клетках различимы ядра, митохондрии и хлоропласты (рис. 4) [16]. Такая особенность позволяет предположить, что в них может присутствовать ДНК [17], [18].
К сожалению, все попытки получить генетическую информацию пока оказываются неудачными: ДНК либо нет, либо она не имеет никакого отношения к ископаемому организму и является следствием контаминации [19]. Причиной этому служит тот факт, что в янтарь легко проникают молекулы кислорода [20]. Данный газ взаимодействует с азотистыми основаниями, в результате чего ДНК их теряет, и за многие миллионы лет от молекулы ничего не остается [1].
Но кроме ДНК, в живых организмах есть много других соединений. Что происходит с этими биомолекулами в процессе полимеризации смолы и превращения ее в янтарь? Согласно масс-спектрометрии, полисахарид хитин, которым, как броней, покрыты все насекомые, претерпевает химические превращения и в течение 25–30 миллионов лет переходит в более простые соединения. Те же процессы происходят с целлюлозой и лигнином. Эти биомолекулы защищают растительные клетки от внешних воздействий и входят в состав их оболочек — клеточных стенок [21]. В янтаре были обнаружены и аминокислоты, которые некогда принадлежали меловым насекомым и перьям палеогеновых птиц [4], [21]. По-видимому, смола замедляет распад не только полисахаридов, но и белков [16].
Вклад в определение состава янтарных включений внес и гистохимический анализ. Он заключается в окрашивании образца веществами, которые избирательно взаимодействуют с теми или иными органическими соединениями. Такие индикаторы разработаны для всех типов биомолекул и позволяют визуализировать отдельные части клетки. Данный метод показал прекрасную сохранность веточки кипариса Glyptostrobus, которая попала в смолу 45 млн лет назад (рис. 5). Ее ткани хорошо различимы между собой, а у отдельных клеток есть ядра и клеточные стенки. Это означает, что фрагменты окисленной ДНК и растительных полисахаридов до сих пор присутствуют в данной окаменелости [16].
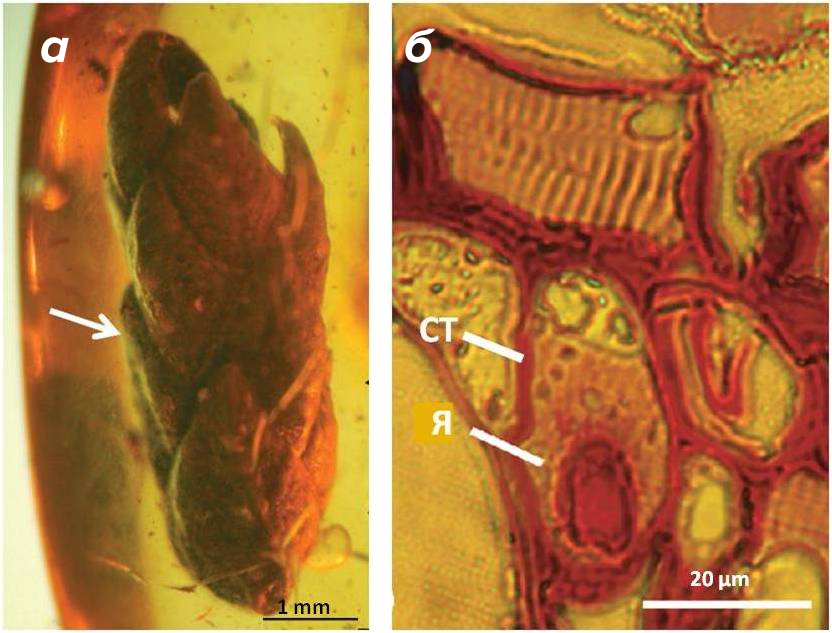
Рисунок 5. Веточка кипариса Glyptostrobus в янтаре из палеогенового периода. (а) — внешний вид, шкала 1 мм. (б) — клетка с ядром (Я) и клеточной стенкой (СТ); шкала 20 мкм
Смола защищает угодивший в нее организм от повреждений, служит барьером для воды, погодных условий и бактерий [22]. С течением времени она проникает во все его ткани и взаимодействует с его биомолекулами. Когда они претерпевают химические изменения и распадаются на простые составляющие, смола удерживает их «вместе», и насекомые и растения не разрушаются [16], [22].
Ископаемые смолы являются не единственной средой, которая сохраняет организмы в первозданном виде. Богатые кремнеземом и карбонатом воды также могут хорошо фиксировать клетки и ткани. Процесс проникновения минералов и их осаждения на органической поверхности называется минерализацией [23]. Данному процессу посвящена следующая глава.
Каменные растения
Торфяные болота, горячие источники, вулканические озера и прочие опасные водоемы приносят гибель многим организмам. Озеро Натрон, расположенное на севере Танзании — одно из них. Попадая в его горячие и богатые щелочью воды, животные немедленно погибают, а их останки покрываются минералами и превращаются в каменные статуи (рис. 6).
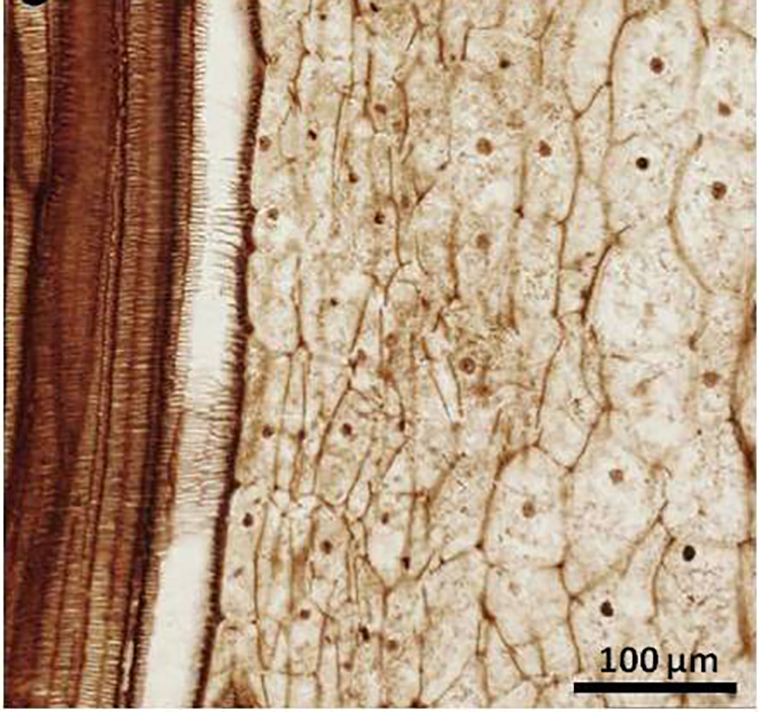
Давным-давно в подобные воды попало и корневище папоротника Osmundaceae. Спустя 180 миллионов лет его обнаружил палеонтолог-любитель Густав Андерссон. Эта ничем не примечательная снаружи окаменелость 40 лет пролежала среди экспонатов музея, и только в 2013 году раскрыла перед исследователями свои тайны. Ее особенностью оказалась высокая детализация тканей. На поперечных срезах можно различить внешние и внутренние слои, а в клетках видна цитоплазма, ядра с ядрышками и другие органеллы. Более того, некоторые из клеток «застыли» на разных стадиях деления (рис. 7). Этот процесс у современных растений занимает всего 15 минут [24].
Насыщенные минеральные растворы, как и древесная смола, способствуют фиксации тканей и клеток. На данный процесс влияют рН, температура и состав раствора. Механизмы минерализации до конца неизвестны. Моделирование в кремнезем-богатых растворах показало, что ядра в клетках могут содержаться вплоть до 3 месяцев [25].
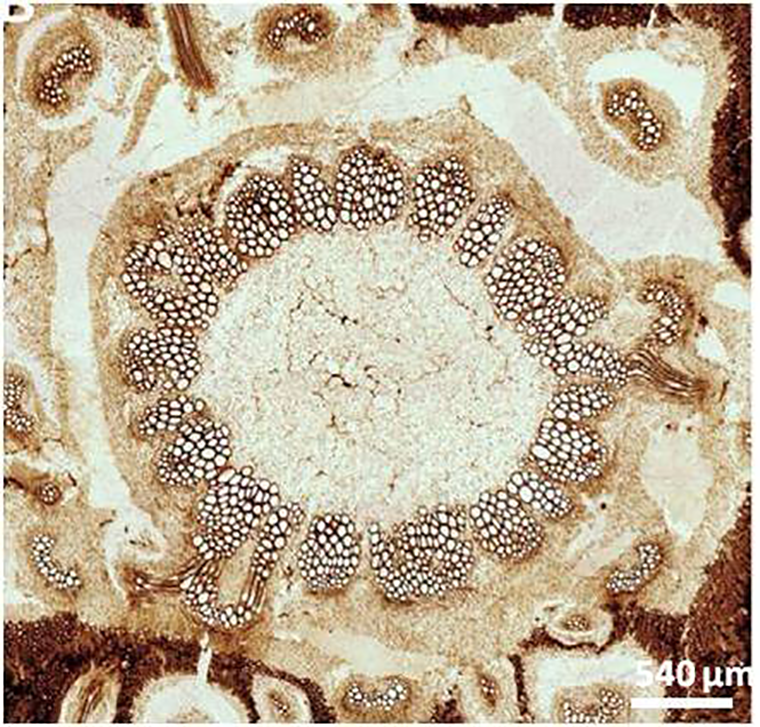
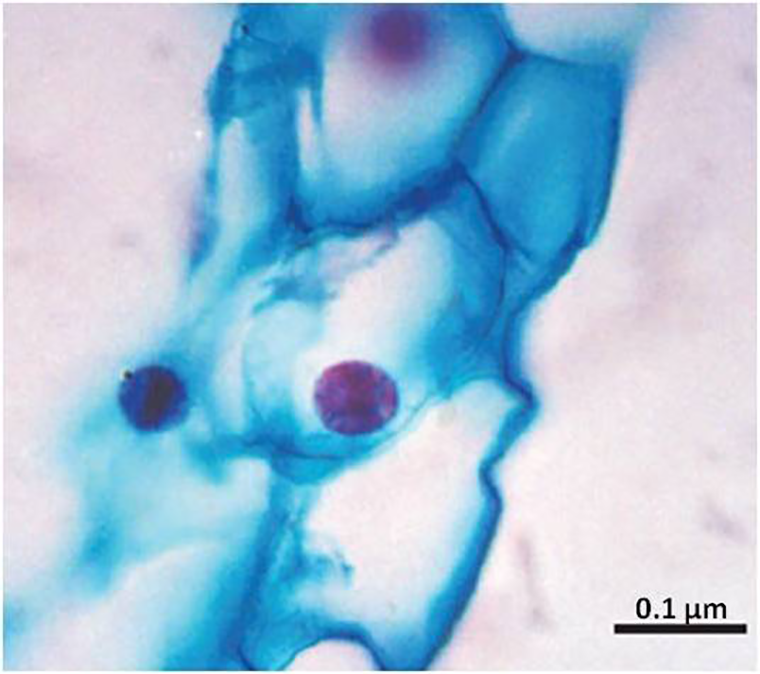
Другим примером являются эоценовые листья и плоды миртовых Myrtaceae, собранные на севере Хара-Улахских гор [26]. Как и в случае с папоротником, клетки ископаемых видов Paramyrtaciphyllum agapovii Ozerov и P. plurilocularis имели ядра с ядрышками. Согласно гистохимическому окрашиванию, от первоначальной двухцепочечной ДНК остался только дезоксирибозный остов, а в клеточных стенках — полисахариды [26]. Помимо них, в цитоплазме клеток были выявлены танины (рис. 8). Они подавляют рост микробов и защищают растения от поедания животными. Эти вещества способны образовывать прочные химические связи с биополимерами, в том числе и с ДНК. По-видимому, хорошее состояние клеточных ядер у ископаемых миртовых связано с высоким содержанием танинов [26].
Окаменевшие кости как источник древних биомолекул
Окаменевшие скелетные части древних позвоночных — наиболее популярные объекты молекулярной палеонтологии последних десяти лет. Кости могут сохранять высокую детализацию, начиная с прижизненных внешних деформаций, соответствующих переломам или вызванных болезнями, и заканчивая каналами из-под кровеносных сосудов, клеточными полостями, а иногда самими клетками (рис. 9) [27–31].
Кости относятся к соединительной ткани и на 60% от сухой массы состоят из неорганических соединений, главное из которых — гидроксиапатит кальция. Вместе с коллагеном 1 типа, он образует твердый матрикс. Именно матрикс ответственен за прочность костей. В него погружены остеоциты — клетки костной ткани, отвечающие за механорецепцию и синтез коллагена. Остеоциты сообщаются друг с другом посредством цитоплазматических выростов и питаются от кровеносных сосудов, пронизывающих костный матрикс.
Костная ткань непосредственно связана с хрящевой; в процессе роста организма она замещает некоторые участки хрящевой ткани. Хрящ состоит из минерализованного матрикса, в котором присутствует коллаген 2 типа и округлые хондроциты [32], [33].
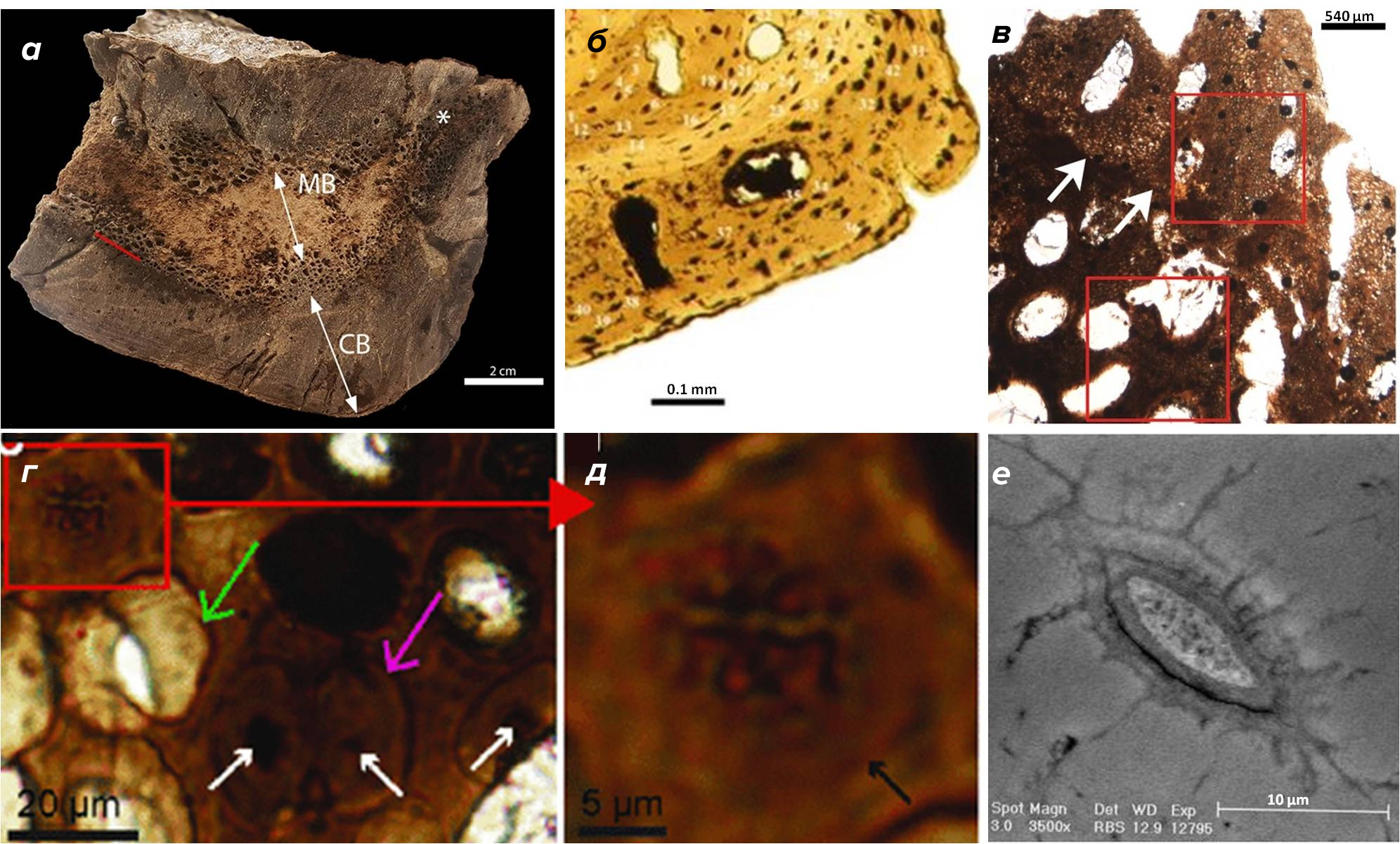
Рисунок 9. Степень детализации ископаемых костей.
(а) — бедренная кость Tyrannosaurus rex из мелового периода в поперечном сечении: граница между внешней (CB) ) и внутренней (MB) зонами обозначена красной линией.
(б) — плечевая кость амфибии Marmorerpeton из юрского периода; в поперечном сечении под микроскопом: видны полости из-под остеоцитов и каналы кровеносных сосудов; полости остеоцитов пронумерованы.
(в) — череп утконосого динозавра Hypacrosaurus stebingeri из мелового периода под микроскопом. Граница между хрящевой и костной тканями обозначена белыми стрелками.
(г) — хрящевая ткань утконосого динозавра Hypacrosaurus stebingeri под микроскопом; различимы полости (зеленая стрелка) и округлые клетки (розовая стрелка). Внутри клеток есть затемненные области, похожие на ядра (белые стрелки), и конденсированный хроматин (выделен красным).
(д) — конденсированный хроматин под микроскопом.
(е) — окаменевший остеоцит в косточке крота, датированной 5 млн лет; различимы плазматическая мембрана, выросты и гранулообразное содержимое.
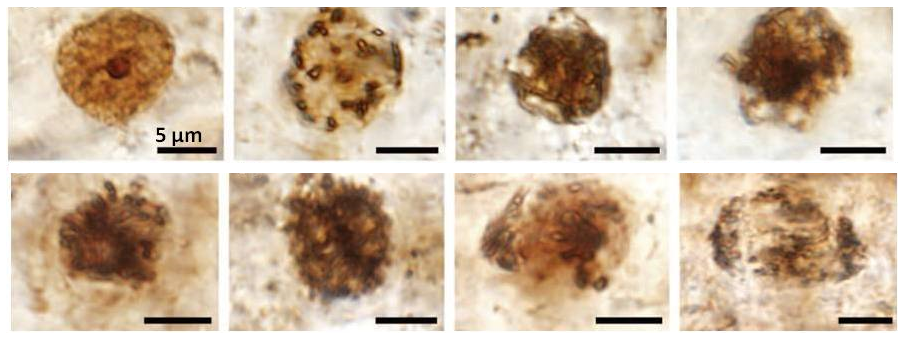
Ископаемые кости проверяют на органические соединения методами масс-спектрометрии и гистохимии. Например, в окаменелостях возрастом более 100 млн лет были обнаружены аминокислоты и короткие пептиды, происходящие из древних коллагеновых белков [32]. Окрашивание препаратов указывает также на наличие кислых муцинов и глюкозаминогликанов, характерных для скелетных тканей полисахаридов (рис. 10) [27], [30].
Перед анализом кости обычно выдерживают в специальных растворах, чтобы удалить из них большую часть минеральных соединений [34]. В таких деминерализованных образцах можно найти исключительно сохранившиеся мягкие ткани. К ним относятся гибкие и эластичные структуры, похожие на фибриллярный костный матрикс, кровеносные сосуды и клетки (рис. 10). Они встречаются в ископаемых остатках из разных геологических эпох, вплоть до позднемелового периода [35]. Молекулярным палеонтологам предстояло понять, имеют ли данные структуры оригинальное происхождение и не являются ли они бактериальными биопленками [36]. Бактерии могут жить в окаменелостях и использовать их в качестве источника минералов. По мере роста их сообщества принимают самые разнообразные формы, в том числе в виде тяжей и отдельных фрагментов [37–39].
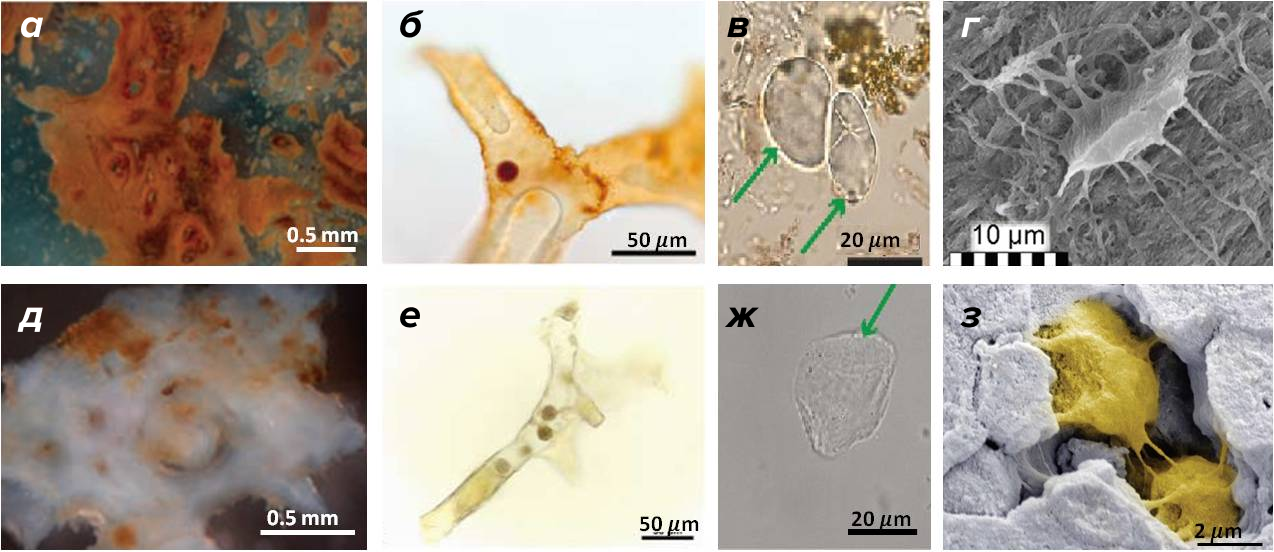
Рисунок 10. Мягкие ткани из деминерализованных костей древних ящеров в сравнении с тканями птиц.
(а) — сосудистые отверстия, окруженные волокнами, из кости Tyrannosaurus rex
(б) — полый сосуд с эритроцитом темно-коричневого цвета из кости Tyrannosaurus rex
(в) — изолированный хондроцит Hypacrosaurus stebingeri
(г) — остеоцит из кости мелового мозазавра Prognathodon
(д) — сосудистые отверстия, окруженные соединительной тканью, в кости страуса
(е) – кровеносный сосуд с эритроцитами из кости страуса
(ж) — изолированный хондроцит из эму
(з) — два современных остеоцита (окрашены желтым) в костном матриксе (окрашен серым)
Сегодня наиболее подробно изучены остеоциты и хондроциты доисторических ящеров.
Как и современные клетки, древние остеоциты имеют выросты и изолируются из костной ткани, а хондроциты выделяют из хрящевой ткани [30], [31], [40]. Их анализируют с помощью гистохимического и иммунофлуоресцентного методов [41]. Последний основан на способности одних биологических молекул, называемых антителами, стойко и специфично связываться с другими биомолекулами, именуемыми эпитопами. Антитела естественным образом вырабатываются в организме и защищают его от вредоносных вирусов и бактерий. Антитело, которое распознает нужную биомолекулу, можно использовать в качестве аналога красителя.
Иммунофлуоресцентное мечение указывало на присутствие тубулина и актина в клетках как Tyrannosaurus rex и Brachylophosaurus canadensis, так и современных птиц, потомков динозавров. Эти молекулы образуют цитоскелет, который отвечает за форму и движение у эукариотических клеток [42]. Их локализация в остеоцитах динозавров и птиц была одинакова: актин располагался нитевидно, а тубулин — диффузно. Стоит отметить, что антитела не давали никакой реакции с бактериальными белками, выполняющими сходные функции. Это доказывает специфичность антител, а также предполагает немикробное происхождение древних клеток [43]. Помимо цитоскелета, в ископаемых остеоцитах был выявлен эпитоп фосфоэндопептидазы (PHEX), фермента, характерного только для позвоночных; у бактерий этот фермент отсутствует [43].
Внутри остеоцитов и хондроцитов присутствовали и соединения, которые по своей структуре схожи с ДНК. Они были представлены двойной спиралью длиной минимум в 6 пар нуклеотидов. Интенсивность их окрашивания значительно ниже по сравнению с таковой у клеток птиц. Тем не менее, они локализовались внутри клеток, а не распределялись по всему объему, что характерно для бактериальных биопленок (рис. 11) [30], [43].
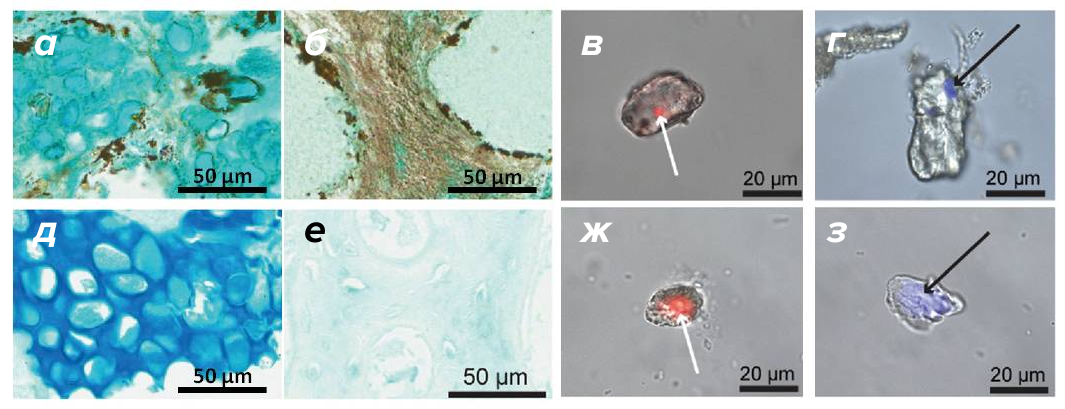
Рисунок 11. Гистохимический анализ тканей и изолированных клеток из динозавра Hypacrosaurus stebingeri в сравнении с эму.
(а), (б) — окрашивание на муцины и глюкозаминогликаны в хрящевой и костной тканях Hypacrosaurus stebingeri
(в), (г) — красители ДНК локализуются внутри хондроцитов Hypacrosaurus stebingeri
(д), (е) — контрольное окрашивание тканей эму
(ж), (з) — окрашивание ДНК в хондроцитах эму
Исследователи пришли к выводу, что ископаемые «мягкие ткани» и биомолекулы имеют оригинальное происхождение и сохраняются в образцах возрастом несколько десятков миллионов лет. В фиксации тонких клеточных структур не последнюю роль может играть ион железа, присутствующий в крови. Он запускает ряд химических реакций, в результате которых между белками и липидами клеточной оболочки образуются перекрестные сшивки, которые их стабилизируют. Остеоциты связаны с кровеносной системой непосредственно через цитоплазматические выросты, а прочный костный матрикс защищает их от микроорганизмов и других внешних факторов. Это позволяет им существовать практически в неизменном состоянии много миллионов лет [43]. Матрикс, по-видимому, важен и для консервации хондроцитов. Хрящ менее вакуолизирован, чем кость, а значит, воде и микробам труднее добраться до клеток. Содержание минералов в нем выше, а самый низкий уровень кислорода наблюдается на стыке хрящевой и костной тканей. Это способствует сохранности не только клеточных структур, но и отдельных биомолекул [30].
Будущее молекулярной палеонтологии
В последнее десятилетие молекулярная палеонтология переживает настоящий подъем. Ее объектами становятся ископаемые белки и аминокислоты, лигнин и целлюлоза, хитин и липиды, порфирины и меланины. Они присутствуют в окаменелостях из разных геологических эпох и периодов. Их извлекают из растений и насекомых, моллюсков и морских червей, амфибий и рептилий, птиц и млекопитающих. Происходит географическое расширение подобных находок: древние биомолекулы находят в окаменелостях из Амазонии, Сахары и Конго. На очереди Антарктида, пустыни Австралии и Африки (рис. 12) [33].
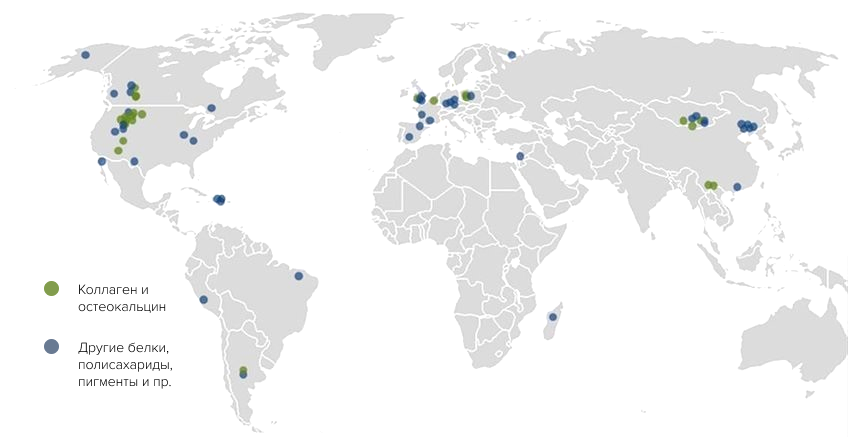
Рисунок 12. Географическое распределение ископаемых биомолекул. Северная Америка и Европа лидируют по количеству молекулярных ископаемых.
Вклад данной дисциплины в другие области обширный и разнообразный. Молекулярные ископаемые могут быть единственным доказательством существования древних форм жизни. В особенности это касается организмов, чьи тела не сохранились из-за малого размера или отсутствия твердого скелета. К ним, в первую очередь, относятся планктон и докембрийские животные [44].
Древние белки — объект внимания эволюционных биологов. По их аминокислотной последовательности устанавливают родственную связь между таксонами или определяют процессы, связанными с видообразованием. Например, во время эволюционного перехода от динозавров к птицам перья претерпели изменения: в их составе появились новые белки, отвечающие за жесткость. Об этом свидетельствуют находки молекулярных палеонтологов: первые белки с такими свойствами появились у динозавра Anchiornis (рис. 13). Он был небольшого размера и по всем анатомическим признакам умел перелетать с дерева на дерево [45]. Его внешний вид был восстановлен по ископаемым меланину и его производным [46]. Данные пигменты широко распространены и встречаются в окаменелостях моллюсков и птиц, наземных и морских рептилий [44].

Рисунок 13. Динозавр Anchiornis Huxleyi из юрского периода.
(а) — внешний вид окаменелости; шкала 5 см; (б) — реконструкция внешнего вида.
Приведенные выше примеры — малая часть того, что хранят в себе окаменелости. Как и любая новая область, молекулярная палеонтология сталкивается с неизвестными ранее проблемами. Они накладывают ограничения и бросают тень на результаты. Поэтому открытия могут восприниматься научным сообществом скептически. Однако дискуссии — это важнейшая часть прогресса, ведь, как говорят, — «В споре рождается истина». Вполне возможно, что новые методы анализа в скором времени предоставят дополнительные данные о прошлых мирах и их обитателях. Ископаемые биомолекулы перестанут быть «иголкой в стоге сена» и станут полноценным источником информации.
Литература
- Svante Pääbo, Hendrik Poinar, David Serre, Viviane Jaenicke-Després, Juliane Hebler, et. al.. (2004). Genetic Analyses from Ancient DNA. Annu. Rev. Genet.. 38, 645-679;
- Как прочитать эволюцию по генам?;
- Структура ДНК;
- Jeffrey L. Bada, Xueyun S. Wang, Hendrik N. Poinar, Svante Pääbo, George O. Poinar. (1994). Amino acid racemization in amber-entombed insects: Implications for DNA preservation. Geochimica et Cosmochimica Acta. 58, 3131-3135;
- Morten E. Allentoft, Matthew Collins, David Harker, James Haile, Charlotte L. Oskam, et. al.. (2012). The half-life of DNA in bone: measuring decay kinetics in 158 dated fossils. Proc. R. Soc. B.. 279, 4724-4733;
- Christina Nielsen-Marsh. (2002). Biomolecules in fossil remains: Multidisciplinary approach to endurance. The Biochemist. 24, 12-14;
- Woodward, N. Weyand, M Bunnell. (1994). DNA sequence from Cretaceous period bone fragments. Science. 266, 1229-1232;
- S. Hedges, M. Schweitzer. (1995). Detecting dinosaur DNA. Science. 268, 1191-1192;
- Evan T Saitta, Renxing Liang, Maggie CY Lau, Caleb M Brown, Nicholas R Longrich, et. al.. (2019). Cretaceous dinosaur bone contains recent organic material and provides an environment conducive to microbial communities. eLife. 8;
- A. Cooper. (2000). Ancient DNA: Do It Right or Not at All. Science. 289, 1139b-1139;
- Tara L. Fulton, Beth Shapiro. (2019). Setting Up an Ancient DNA Laboratory. Methods in Molecular Biology. 1-13;
- Древняя ДНК: привет из прошлого;
- Juan A. Claver, Agustin I.E. Quaglia. (2009). Comparative Morphology, Development, and Function of Blood Cells in Nonmammalian Vertebrates. Journal of Exotic Pet Medicine. 18, 87-97;
- D. E. Greenwalt, Y. S. Goreva, S. M. Siljestrom, T. Rose, R. E. Harbach. (2013). Hemoglobin-derived porphyrins preserved in a Middle Eocene blood-engorged mosquito. Proceedings of the National Academy of Sciences. 110, 18496-18500;
- George Poinar, Roberta Poinar. (2004). Evidence of Vector-Borne Disease of Early Cretaceous Reptiles. Vector-Borne and Zoonotic Diseases. 4, 281-284;
- Barbara Koller, Jürgen M. Schmitt, Gilbert Tischendorf. (2005). Cellular fine structures and histochemical reactions in the tissue of a cypress twig preserved in Baltic amber. Proc. R. Soc. B.. 272, 121-126;
- Tong Bao, Bo Wang, Jianguo Li, David Dilcher. (2019). Pollination of Cretaceous flowers. Proc Natl Acad Sci USA. 116, 24707-24711;
- Lida Xing, Ryan C. McKellar, Jingmai K. O’Connor, Kecheng Niu, Huijuan Mai. (2019). A mid-Cretaceous enantiornithine foot and tail feather preserved in Burmese amber. Sci Rep. 9;
- Jeremy J. Austin, Andrew J. Ross, Andrew B. SMITH, Richard A. Fortey, Richard H. Thomas. (1997). Problems of reproducibility – does geologically ancient DNA survive in amber–preserved insects?. Proc. R. Soc. Lond. B. 264, 467-474;
- H. B. Hopfenberg, L. C. Witchey, G. O. Poinar. (1988). Is the Air in Amber Ancient?. Science. 241, 717-718;
- Victoria E. McCoy, Sarah E. Gabbott, Kirsty Penkman, Matthew J. Collins, Samantha Presslee, et. al.. (2019). Ancient amino acids from fossil feathers in amber. Sci Rep. 9;
- B.A. Stankiewicz, H.N. Poinar, D.E.G. Briggs, R.P. Evershed, G.O. Poinar. (1998). Chemical preservation of plants and insects in natural resins. Proc. R. Soc. Lond. B. 265, 641-647;
- George Mustoe. (2017). Wood Petrifaction: A New View of Permineralization and Replacement. Geosciences. 7, 119;
- B. Bomfleur, S. McLoughlin, V. Vajda. (2014). Fossilized Nuclei and Chromosomes Reveal 180 Million Years of Genomic Stasis in Royal Ferns. Science. 343, 1376-1377;
- Xiaozheng Chen, Wei Wang, Qinghua Shang, Yue Lou, Xinchun Liu, et. al.. (2009). Experimental evidence for eukaryotic fossil preservation: Onion skin cells in silica solution. Precambrian Research. 170, 223-230;
- IGOR A. OZEROV, NADEZHDA A. ZHINKINA, ALEXANDER M. EFIMOV, EDWARD M. MACHS, ALEXANDER V. RODIONOV. (2006). Feulgen-positive staining of the cell nuclei in fossilized leaf and fruit tissues of the Lower Eocene Myrtaceae. Botanical Journal of the Linnean Society. 150, 315-321;
- Mary Higby Schweitzer, Wenxia Zheng, Lindsay Zanno, Sarah Werning, Toshie Sugiyama. (2016). Chemistry supports the identification of gender-specific reproductive tissue in Tyrannosaurus rex. Sci Rep. 6;
- Michel Laurin, Aurore Canoville, Mikayla Struble, Chris Organ, Vivian de Buffrénil. (2016). Early genome size increase in urodeles. Comptes Rendus Palevol. 15, 74-82;
- Alida M. Bailleul, Brian K. Hall, John R. Horner. (2012). First Evidence of Dinosaurian Secondary Cartilage in the Post-Hatching Skull of Hypacrosaurus stebingeri (Dinosauria, Ornithischia). PLoS ONE. 7, e36112;
- Alida M Bailleul, Wenxia Zheng, John R Horner, Brian K Hall, Casey M Holliday, Mary H Schweitzer. (2020). Evidence of proteins, chromosomes and chemical markers of DNA in exceptionally preserved dinosaur cartilage. National Science Review. 7, 815-822;
- Lynne S. Bell, Mike Kayser, Chris Jones. (2008). The mineralized osteocyte: A living fossil. Am. J. Phys. Anthropol.. 137, 449-456;
- Rinaldo Florencio-Silva, Gisela Rodrigues da Silva Sasso, Estela Sasso-Cerri, Manuel Jesus Simões, Paulo Sérgio Cerri. (2015). Biology of Bone Tissue: Structure, Function, and Factors That Influence Bone Cells. BioMed Research International. 2015, 1-17;
- Brian Thomas, Stephen Taylor. (2019). Proteomes of the past: the pursuit of proteins in paleontology. Expert Review of Proteomics. 16, 881-895;
- Timothy P. Cleland, Deepak Vashishth. (2015). Bone protein extraction without demineralization using principles from hydroxyapatite chromatography. Analytical Biochemistry. 472, 62-66;
- Mary Higby Schweitzer, Jennifer L Wittmeyer, John R Horner. (2007). Soft tissue and cellular preservation in vertebrate skeletal elements from the Cretaceous to the present. Proc. R. Soc. B.. 274, 183-197;
- Thomas G. Kaye, Gary Gaugler, Zbigniew Sawlowicz. (2008). Dinosaurian Soft Tissues Interpreted as Bacterial Biofilms. PLoS ONE. 3, e2808;
- M. H. Schweitzer. (2005). Gender-Specific Reproductive Tissue in Ratites and Tyrannosaurus rex. Science. 308, 1456-1460;
- M. H. Schweitzer. (2005). Soft-Tissue Vessels and Cellular Preservation in Tyrannosaurus rex. Science. 307, 1952-1955;
- Johan Lindgren, Per Uvdal, Anders Engdahl, Andrew H. Lee, Carl Alwmark, et. al.. (2011). Microspectroscopic Evidence of Cretaceous Bone Proteins. PLoS ONE. 6, e19445;
- Edwin A. Cadena, Mary H. Schweitzer. (2012). Variation in osteocytes morphology vs bone type in turtle shell and their exceptional preservation from the Jurassic to the present. Bone. 51, 614-620;
- 12 методов в картинках: иммунологические технологии;
- Опасные связи. Новый взгляд на происхождение эукариотических химер, подмявших под себя весь мир;
- Mary Higby Schweitzer, Wenxia Zheng, Timothy P. Cleland, Marshall Bern. (2013). Molecular analyses of dinosaur osteocytes support the presence of endogenous molecules. Bone. 52, 414-423;
- Derek E. G. Briggs, Roger E. Summons. (2014). Ancient biomolecules: Their origins, fossilization, and role in revealing the history of life. BioEssays. 36, 482-490;
- Yanhong Pan, Wenxia Zheng, Roger H. Sawyer, Michael W. Pennington, Xiaoting Zheng, et. al.. (2019). The molecular evolution of feathers with direct evidence from fossils. Proc Natl Acad Sci USA. 116, 3018-3023;
- Q. Li, K.-Q. Gao, J. Vinther, M. D. Shawkey, J. A. Clarke, et. al.. (2010). Plumage Color Patterns of an Extinct Dinosaur. Science. 327, 1369-1372.