
Как кальмары реагируют на поляризованный свет?
02 июля 2008
Как кальмары реагируют на поляризованный свет?
- 835
- 0
- 1
Фоторецепторы в разных группах живых организмов имеют разную природу и разные названия: у растений это фитохромы и криптохромы, у жгутиконосцев — флавопротеины, у бактерий — бактериородопсины и бактериофитохромы, у животных же — опсины(родопсин, фотопсин и меланопсин).
fingerstofists@Flickr (кальмар на картинке)
-
Автор
-
Редакторы
В основе зрения лежат светочувствительные белки-пигменты, содержащие изомеризующийся под действием света кофактор. У животных реакция на свет (включая зрение) обусловлена трансмембранными фоторецепторами опсинами, принадлежащими к классу G-белок сопряжённых рецепторов, активация которых запускает внутриклеточный биохимический каскад. До сих пор единственным опсином с известной структурой был родопсин, содержащийся в сетчатке быка. Теперь же японские учёные получили структуру родопсина кальмара, раскрыв детали его строения и взаимодействия со своим G-белком (Gq), а также возможный механизм восприятия поляризованного света этими животными.
Многие беспозвоночные обладают хорошим зрением — головоногие моллюски, например, являясь завзятыми хищниками, при охоте полагаются практически исключительно на зрение. Сетчатка глаза кальмара содержит фоторецептор родопсин, который, хотя и отличается по строению и свойствам от своего «позвоночного» аналога (см. «Зрительный родопсин — рецептор, реагирующий на свет» [1]), также принадлежит к семейству рецепторов, действие которых связано с активацией G-белков (GPCR, от англ. G-protein-coupled receptors). Родопсин из сетчатки быка [1] стал первым представителем этого класса, для которого была экспериментально получена пространственная структура (хотя до того уже была информация о строении других фоторецепторов — например, бактериородопсина), и лишь совсем недавно семейство GPCR-рецепторов пополнилось новыми структурными данными, полученными для β1- [2] и β2-адренорецепторов [3] (см. «Новый рубеж: получена пространственная структура β2-адренорецептора»). Теперь же японским исследователям удалось получить новую структуру фоторецептора, принадлежащего к семейству GPCR, — родопсина, полученного из сетчатки тихоокеанского кальмара (Todarodes pacificus) [4].
Родопсин располагается в плазматической мембране клеток-фоторецепторов. Под действием кванта света кофактор ретиналь меняет конформацию, и весь белок претерпевает перестройку, приводящую к запуску биохимического каскада с участием тримéрного G-белка, ассоциированного с внутренней стороной мембраны. Для позвоночных это — трансдуцин (Gt), α-субъединица которого, диссоциировав из состава тримéра, запускает фосфодиэстеразу цГМФ, что в конечном счёте приводит к закрыванию катионных каналов. У беспозвоночных аналогичным целям служит α-субъединица Gq-белкá, активирующая фосфолипазу C и приводящая к открыванию кальциевых каналов.
Другими словами, родопсин кальмара стал первым белком семейства GPCR с известной структурой, действие которого связано с активацией именно Gq-белкá [4]. Важность этой работы подтверждается тем, что рецепторы многих гормонов и нейротрансмиттеров (включая вазопрессин, окситоцин, серотонин и ацетилхолин) действуют именно через Gq. Многие лекарства, такие как антигистаминовые препараты и антагонисты ангиотензина, также действуют через Gq-сопряжённые рецепторы.
Кристаллическая структура родопсина кальмара (пространственное разрешение 2,5 Å) [4] показала, что, хотя общий план строения родопсинов позвоночных и беспозвоночных животных — «пучок» из приблизительно ортогональных плоскости мембраны трансмембранных (ТМ) семи α-спиралей — и сохраняется, но присутствуют и заметные отличия (рис. 1) [5]. В частности, ТМ спирали V и VI родопсина кальмара выступают в цитоплазму на ≈25 Å (чего не наблюдается у родопсина позвоночных), и появляется дополнительная короткая цитоплазматическая спираль IX. Эти особенности строения, наверняка определяющие специфику взаимодействия с Gq-белком, являются довольно неожиданными и вряд ли могли быть предсказаны по последовательности (используя методику моделирования по гомологии [6]).
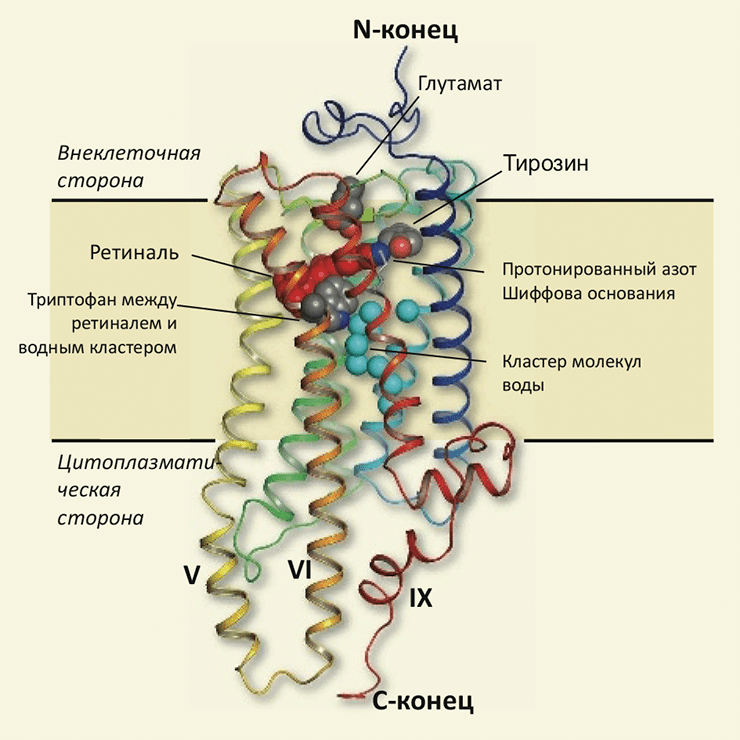
Рисунок 1. Строение родопсина кальмара. Основная структурная особенность (как и для других рецепторов семейства GPCR) — семь трансмембранных α-спиралей, собранных в «пучок» так, чтобы N-конец белкá находился вне клетки, а C-конец — в цитоплазме. Из этих спиралей V и VI существенно выступают в цитоплазму (по сравнению с бычьим родопсином), а «дополнительная» спираль IX также вносит свой вклад в отличия, свойственные цитоплазматическому домену. (Предположительно, эти особенности определяют механизм взаимодействия с Gq-белком.) Светочувствительный кофактор ретиналь (красным) ковалентно связан с атомом азота (синим) остатка лизина, находящегося в VII спирали; вблизи этого атома также находятся остатки глутаминовой кислоты и тирозина, определяющие особенности регенерации исходной («темновой») формы родопсина. Остаток триптофана, находящийся в непосредственном контакте с ретиналем, а также внутримолекулярный консервативный кластер связанных молекул воды (голубым), могут участвовать в передаче конформационных изменений от трансмембранного «ядра» белка на поверхность контакта с цитоплазмой.
Определение особенностей строения Gq-сопряжённого родопсина важно ещё и тем, что они лягут в основу для более точного моделирования структуры рецепторов, действующих по тому же механизму, и в особенности это касается деталей взаимодействия с G-белком. Эти знания могут использоваться и для дизайна лекарственных препаратов, действие которых будет связано с коррекцией связывания Gq-белков с их рецепторами.
Отличия в строении присутствуют не только в цитоплазматическом домене, но и в непосредственной близи сайта связывания ретиналя, — в частности, остаток глутаминовой кислоты, который, судя по аминокислотной последовательности, должен служить противоионом, стабилизирующим шиффово основание, находится в пространстве слишком далеко, чтобы выполнять эту функцию. Это может служить объяснением тому, что регенерация родопсина беспозвоночных (в отличие от своего аналога из сетчатки быка) происходит без диссоциации ретиналя от опсина — возвращая последний в рабочую («темновую») форму прямо «на месте», без разрушения шиффова основания.
Структура родопсина кальмара может будет полезна и при изучении человеческого меланопсина — фоторецептора сетчатки глаза, отвечающего за регуляцию циркадного ритма и за зрачковый рефлекс. Судя по аминокислотной последовательности, меланопсин человека ближе к родопсинам беспозвоночных, нежели к своему «соседу» по сетчатке, и появление структурного шаблона представляет несомненный интерес для изучения этого сенсора.
Кроме того, в результате анализа строения кристаллической ячейки родопсина кальмара было обнаружено, что молекулы ретиналя в молекулах фоторецепторов, образующих тетрамер, практически параллельны друг другу, что определяет также параллельность соответствующих дипольных моментов для хромофора. Видимо, именно эта особенность позволяет кальмарам с высокой чувствительностью реагировать на поляризованный свет, как и некоторым другим беспозвоночным (см. «Креветки видят по-другому» [7]).
Литература
- Зрительный родопсин — рецептор, реагирующий на свет;
- Tony Warne, Maria J. Serrano-Vega, Jillian G. Baker, Rouslan Moukhametzianov, Patricia C. Edwards, et. al.. (2008). Structure of a β1-adrenergic G-protein-coupled receptor. Nature. 454, 486-491;
- Новый рубеж: получена пространственная структура β2-адренорецептора;
- Midori Murakami, Tsutomu Kouyama. (2008). Crystal structure of squid rhodopsin. Nature. 453, 363-367;
- Gebhard F. X. Schertler. (2008). Signal transduction: The rhodopsin story continued. Nature. 453, 292-293;
- Торжество компьютерных методов: предсказание строения белков;
- Креветки видят по-другому.





