
Хромотрипсис: разобрать и собрать хромосому
25 июня 2015
Хромотрипсис: разобрать и собрать хромосому
- 1731
- 1
- 2
Моделируя хромотрипсис, ученые полагают, что хромосома сначала разрывается на десятки и даже тысячи частей, а потом эти части соединяются в случайном порядке, что-то при этом утрачивается. Иногда в перестройке участвует несколько хромосом. В результате формируются мутантные зоны генома, провоцирующие развитие онкологических и врожденных заболеваний.
рисунок с сайта contactcenterworld.com (немного изменен)
-
Автор
-
Редакторы
Хромотрипсис — недавно открытый тип комплексных геномных изменений, для которого характерны множественные случайные перестройки в хромосомах; чаще всего он встречается в раковых клетках. Механизм хромотрипсиса неизвестен, но полагают, что катастрофические изменения могут происходить в особой клеточной структуре — микроядре. С помощью комбинации методов — визуализации живых клеток и секвенирования геномов отдельных клеток — ученые продемонстрировали, что формирование микроядра может генерировать перестройки в геноме, которые воспроизводят все известные черты хромотрипсиса.
Геном раковых клеток отличается от нормального — он сильно изменен за счет появления точечных мутаций и хромосомных перестроек. Долгое время считали, что рак развивается из-за постепенного накопления ошибок в геноме. Однако последние исследования ставят под сомнение универсальность такой гипотезы. По крайней мере в 2–3% образцов различных злокачественных опухолей и почти в 25% случаев рака костей (остеосарком и хордом) найден хромотрипсис [1]. Хромотрипсис (греч. thripsis — разрушение на мелкие части) — это радикальная перестройка хромосомы (рис. 1). В результате взамен старой образуется практически новая хромосома [2], причем всё происходит «одномоментно» в ходе одного клеточного цикла [3]. Хромотрипсис был впервые обнаружен в клетках лимфоцитарного лейкоза: значительные перестройки нашли в хромосомах 1, 4, 12 и 15 [4]. Затем такие изменения обнаружили и в других раковых клетках: меланомы, саркомы, карциномы кишечника (чуть ли не в каждом исследованном случае выявили хромотрипсис разного масштаба) и т.д. [5].
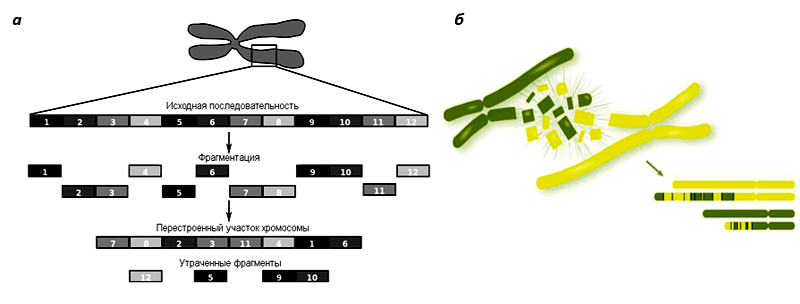
Рисунок 1. Принцип хромотрипсиса. а — Хромотрипсис плеча хромосомы. Исходная структура хромосомы радикально перестраивается: многие ее части меняются местами, а некоторые теряются. В результате хромотрипсиса происходят глобальные изменения в геноме: по сути, появляется новая хромосома взамен старой. б — Хромотрипсис двух хромосом. Довольно редкое событие. Очевидно, что хромотрипсис резко отличается от более известного принципа изменения генетической информации — постепенного накопления мутаций.
(а) — из «Википедии», (б) — с сайта www.science20.com
Механизм хромотрипсиса неизвестен. Складывается впечатление, что хромосому разрывают на части, а затем объединяют ее фрагменты между собой в случайном порядке и ориентации. При этом некоторые участки хромосомы вообще теряются . Попытки моделирования хромотрипсиса указывают на то, что в его основе должно лежать единичное катастрофическое событие, а не последовательность хромосомных перестроек [6]. Одной из особенностей хромотрипсиса является то, что он затрагивает только одну хромосому (редко — несколько). Поэтому такое изменение генетического материала происходит, скорее всего, во время митоза, когда хромосомы плотно упакованы и не пересекаются друг с другом в пространстве. В статье, опубликованной в журнале Nature, ученые из США показали, что хромотрипсис может происходить, когда в результате нарушенного клеточного деления формируются микроядра — структуры, содержащие одну изолированную хромосому [7].
Поскольку всё происходит случайно, «знак» последствий тоже случаен. Конечно, минусы делеций для организма очевидны — утрата опухолевых супрессоров и иных полезных продуктов, нарушение регуляции экспрессии генов... Однако наблюдали и положительные последствия хромотрипсиса: например, у пациентки с врожденным комбинированным иммунодефицитом после 30 лет страданий полностью исчезла симптоматика. Оказалось, что в процессе хромотрипсиса в гемопоэтической стволовой клетке ее хромосома 2 случайно «излечилась» от мутантной аллели CXCR4 (R334X), которая и была причиной болезни [8]. — Ред.
Итак, ключ к пониманию механизмов хромотрипсиса, видимо, лежит в процессе митоза. Некоторые нарушения в клетке могут мешать хромосомам правильно закрепляться на веретене деления. Тогда они не расходятся к полюсам клетки, как это происходит в норме, а обособляются от других хромосом. Затем отделившиеся хромосомы-нарушители изолируются, образуя «собственное» ядро — микроядро (не путать с ядрышком — центром синтеза и сборки компонентов рибосом!).
Микроядро — опасное место для хромосомы. Его мембрана местами порвана и ненадежно защищает генетический материал (рис. 2). Также в микроядре недостаточно факторов, которые обеспечивают правильное удвоение ДНК перед делением клетки. О нормальных системах репарации дефектов тоже говорить не приходится [2]. Поэтому хромосома в микроядре может претерпевать и закреплять многочисленные повреждения. Таким образом, микроядро — это подходящая среда для хромотрипсиса. Но прямых данных, подтверждающих это, до сих пор не было представлено.
Подробнее про системы репарации можно прочитать в статьях «На страже ДНК, или функции белка РАХХ» [9], «РНК-зависимая репарация ДНК» [10] и «В лунном свете, или тайная жизнь Ku-антигена» [11]. — Ред.
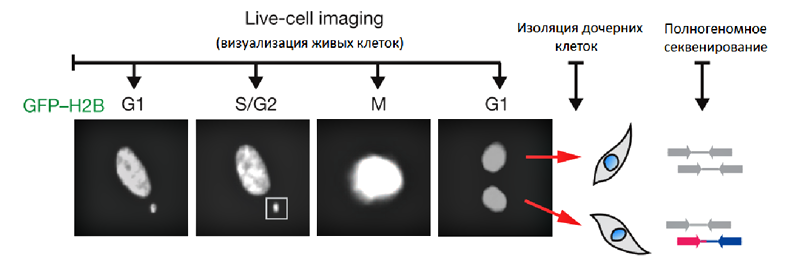
Рисунок 2. Комбинированный анализ повреждений ДНК в микроядрах. Визуализация происходит с помощью GFP — флуоресцирующего белка, который «сшит» с одним из компонентов хромосомы, гистоном Н2В. Стадии клеточного цикла обозначены как G1, S/G2, M и снова G1, светящиеся объекты — ядра клеток и микроядро (выделено рамкой). После митоза микроядра могут объединяться с дочерним ядром — на рисунке на «второй» стадии G1 видно два дочерних ядра, а микроядро отсутствует. Таким образом, те мутации, которые произошли в микроядре, могут становиться частью генома. Секвенирование ДНК дочерних клеток помогло выявить значительные структурные перестройки у таких выпадавших хромосом.
Авторы статьи [7] индуцировали появление микроядер с помощью нокодазола — химического реагента, который дестабилизирует веретено деления и учащает случаи неправильного сцепления с ним хромосом. Ученые наблюдали за делящимися клетками и идентифицировали те, в которых появлялось микроядро (рис. 2). Потомков таких клеток изолировали и по отдельности секвенировали их геномы [12] — с целью проверить, вызвало ли временное присутствие микроядра хромотрипсис.
Характерно, что хромосома в микроядре не может нормально поделиться в S-фазе клеточного цикла. Поэтому те дочерние клетки, в которые она попадает впоследствии, получают аномальный хромосомный набор. То есть у «счастливых» обладателей генетического материала из микроядра будет хромосом больше или меньше, чем в норме. Эта особенность и помогла отличить их от нормальных клеток. Анализ последовательности нуклеотидов хромосом, побывавших в микроядре, показал, что у них имеются множественные перестройки. Мутационный процесс, в результате которого изменились хромосомы, в данном случае очень эффективен, практически стопроцентно. Это доказывает, что микроядра могут создавать подходящую среду для хромотрипсиса. Перестроенная хромосома может сохраниться в геноме, если возвратится в состав ядра. Там мутантную структуру стабилизируют системы репарации ДНК.
Отметим, что в раковых клетках присутствуют как нарушения клеточного деления, так и перестройки генома. Оказывается, эти два явления могут быть непосредственно связаны. Подобные исследования способны пролить свет на процесс формирования генома в норме и при патологии.
Литература
- Josep V. Forment, Abderrahmane Kaidi, Stephen P. Jackson. (2012). Chromothripsis and cancer: causes and consequences of chromosome shattering. Nat Rev Cancer. 12, 663-670;
- Kristin A. Knouse, Angelika Amon. (2015). The micronucleus gets its big break. Nature. 522, 162-163;
- Cheng-Zhong Zhang, Mitchell L. Leibowitz, David Pellman. (2013). Chromothripsis and beyond: rapid genome evolution from complex chromosomal rearrangements. Genes Dev.. 27, 2513-2530;
- Philip J. Stephens, Chris D. Greenman, Beiyuan Fu, Fengtang Yang, Graham R. Bignell, et. al.. (2011). Massive Genomic Rearrangement Acquired in a Single Catastrophic Event during Cancer Development. Cell. 144, 27-40;
- Wigard P Kloosterman, Marlous Hoogstraat, Oscar Paling, Masoumeh Tavakoli-Yaraki, Ivo Renkens, et. al.. (2011). Chromothripsis is a common mechanism driving genomic rearrangements in primary and metastatic colorectal cancer. Genome Biol. 12;
- Philip J. Stephens, Chris D. Greenman, Beiyuan Fu, Fengtang Yang, Graham R. Bignell, et. al.. (2011). Massive Genomic Rearrangement Acquired in a Single Catastrophic Event during Cancer Development. Cell. 144, 27-40;
- Cheng-Zhong Zhang, Alexander Spektor, Hauke Cornils, Joshua M. Francis, Emily K. Jackson, et. al.. (2015). Chromothripsis from DNA damage in micronuclei. Nature. 522, 179-184;
- David H. McDermott, Ji-Liang Gao, Qian Liu, Marie Siwicki, Craig Martens, et. al.. (2015). Chromothriptic Cure of WHIM Syndrome. Cell. 160, 686-699;
- На страже ДНК, или функции белка РАХХ;
- РНК-зависимая репарация ДНК;
- В лунном свете, или Тайная жизнь Ku-антигена;
- Секвенирование единичных клеток (версия — Metazoa).






