Кишечная микрофлора: третий нелишний в иммунотерапии рака
29 января 2018
Кишечная микрофлора: третий нелишний в иммунотерапии рака
- 5174
- 0
- 14
сайт ru.depositphotos.com
-
Автор
-
Редактор
В онкологии наступает эра иммунотерапии. У иммунной системы есть мощный потенциал для борьбы со злокачественными опухолями, и науке становится известно все больше способов его реализовать. Однако в противостоянии между иммунитетом и раком есть еще один игрок, с которым приходится считаться, — кишечная микрофлора. В то время как одни микроорганизмы «партизанят» против иммунопрепаратов, другие могут стать ценным источником новых терапевтических подходов.
Более полувека назад двое ученых — Льюис Томас и Фрэнк Макфарлейн Бёрнет — выдвинули гипотезу о роли иммунной системы в контроле развития новообразований [1–3]. Ее суть Бёрнет сформулировал следующим образом:
«У крупных долгоживущих животных, в частности, большинства теплокровных позвоночных, в соматических клетках происходят генетические изменения, и часть этих изменений представляет собой шаг на пути к злокачественности. Существует эволюционная необходимость в каком-либо механизме для устранения или инактивации таких потенциально опасных мутантных клеток, и этот механизм имеет иммунологический характер».
У гипотезы было немало противников, но в последние десятилетия она получила многочисленные подтверждения. Иммунитет защищает человека от рака, и в этих защитных механизмах принимают участие T- и B-лимфоциты, макрофаги и натуральные киллеры (NK-клетки).
T- и B-лимфоциты умеют распознавать мутантные белки раковых клеток, а γδ-Т-клетки (особая популяция T-лимфоцитов, у которых T-клеточный рецептор состоит из γ и δ субъединиц) и NK-клетки «выслеживают» лиганды своего поверхностного белка NKG2D [3].
Вопрос состоит в том, почему иммунитет не всегда справляется со своей функцией? Почему одни мутировавшие клетки ликвидируются, «не успев пикнуть», а другие успешно выживают и дают начало злокачественным опухолям?
В процессе развития иммунологической толерантности по отношению к опухолевым клеткам участвуют разные механизмы [4], [5]. Они не до конца изучены, и все же в последние десятилетия, во многом благодаря достижениям молекулярной биологии и молекулярной генетики, многое стало известно. Полученные знания легли в основу относительного нового направления в лечении онкологических заболеваний — иммунотерапии. Сегодня многие ученые и врачи-онкологи возлагают на нее большие надежды [6].
Существует несколько направлений современной иммунотерапии [7–9]. Для борьбы с раком используют моноклональные антитела [10], цитокины (интерфероны, интерлейкины), противораковые вакцины, онколитические вирусы, перепрограммированные T-клетки (здесь большие перспективы открывает технология редактирования генов CRISPR-Cas9 [11–14]) и даже микобактерии туберкулеза [15–17].
Контрольные точки и их ингибиторы
Важную роль в противоопухолевом иммунитете играет клеточно-опосредованный иммунный ответ. Опухолевые клетки производят антигены, которые могут быть переработаны и представлены примитивным (наивным) T-лимфоцитам антигенпредставляющими клетками (APC) в виде соединений с молекулами главного комплекса гистосовместимости (MHC). В результате наивный T-лимфоцит превращается в эффекторный и запускает цепочку событий, которая в конечном счете приводит к уничтожению опухолевой клетки (рис. 1) [6], [18].
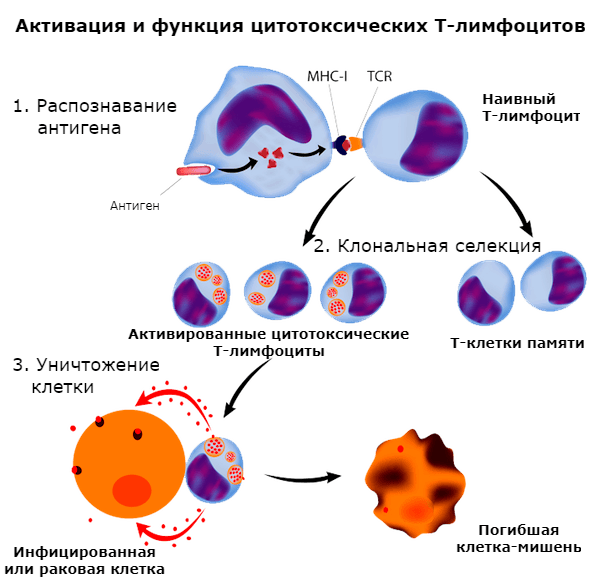
Рисунок 1. Активация T-лимфоцита с участием MHC-I. Наибольшее значение в качестве антигенпрезентирующих клеток имеют специализированные именно на этом дендритные клетки (но также эту функцию могут выполнять и макрофаги и B-клетки). После представления опухолевого антигена наивный T-лимфоцит трансформируется в цитотоксический CD8+ и вызывает гибель опухолевой клетки за счет продукции перфоринов, фрагментинов и индукции апоптоза через Fas-лиганды.
Некоторые опухолевые клетки защищаются от иммунной агрессии еще на стадии этого первичного иммунного ответа. Так, мутационные изменения структуры человеческих лейкоцитарных антигенов (молекул на поверхности клеток, которые извлекают из цитоплазмы куски неправильных или чужеродных, например, вирусных, белков и привлекают ими к себе Т-киллеров) приводят к нарушению их функций и мешает процессу активации иммунных клеток [6], [19].
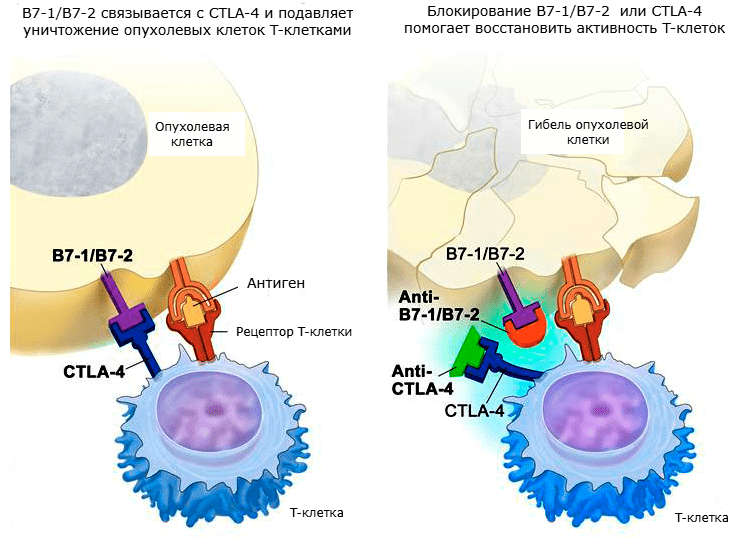
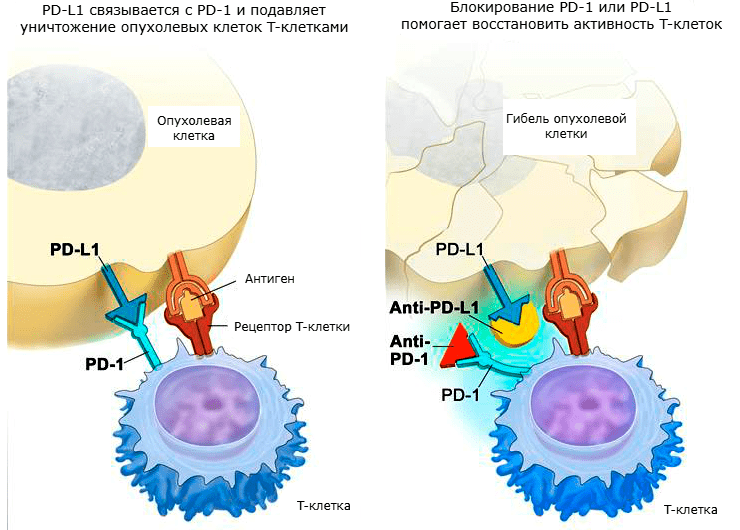
Помимо механизма распознавания и представления антигенов с участием MHC, в противоопухолевом клеточно-опосредованном иммунном ответе важную роль играют дополнительные мембранные корецепторы. Они обеспечивают положительную и отрицательную модуляции иммунного ответа. В онкологических процессах особое значение имеют два таких корецептора: цитотоксический T-лимфоцитарный антиген-4 (CTLA-4, также известный как CD152) и мембранный белок PD-1 (а также его лиганд PD-L1, или CD274). [6]
CTLA-4 — белок, который в основном экспрессируют CD4+ и CD8+ T-лимфоциты (но также его экспрессия обнаружена и в B-лимфоцитах). В экспериментах in vitro и in vivo доказано его ингибирующее воздействие на первичный иммунный ответ [20]. Для начала пролиферации T-лимфоцитов необходимо, чтобы молекула B7-1 (CD80) или B7-2 (CD86) на поверхности APC связалась с CD28 на Т-клетке. При этом происходит передача сигнала. CTLA-4 — гомолог CD28, обладающий более высокой афинностью по отношению к B7. Однако при связывании CTLA-4 с B7 передачи сигнала не происходит. От соотношения количества связей CD28:B7 и CTLA-4:B7 зависит, будет ли T-клетка находиться в состоянии активации или анергии (рис. 2). Кроме того, CTLA-4, по-видимому, оказывает прямое ингибирующее влияние на иммунный синапс TCR, ингибирует CD28 и его сигнальный путь, а также повышает подвижность T-клеток, что снижает их способность к взаимодействию с APC [21].
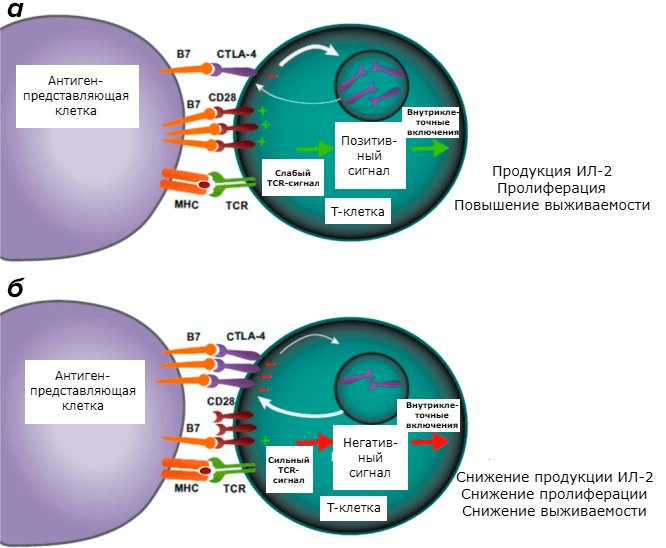
Рисунок 2. CTLA-4-опосредованное ингибирование T-клеток. а — Благодаря связыванию MHC:TCR и CD28:B7 T-лимфоциты продуцируют интерлейкин-2 (ИЛ-2), активируется их пролиферация, повышается выживаемость. б — CTLA-4 конкурирует с CD28 за связывание с B7. Клетка получает негативный сигнал, снижается продукция ИЛ-2, ингибируется пролиферация Т-лимфоцитов и их выживаемость.
В норме в иммунной системе работает обратная связь. Поначалу молекулы CTLA-4 находятся в везикулах внутри клетки в неактивном состоянии. Сигналом к выходу на поверхность служит возникновение связей MHC:TCR и CD28:B7. Кроме того, CTLA-4 содержатся на поверхности регуляторных Т-клеток (Tregs) (рис. 3) [21].
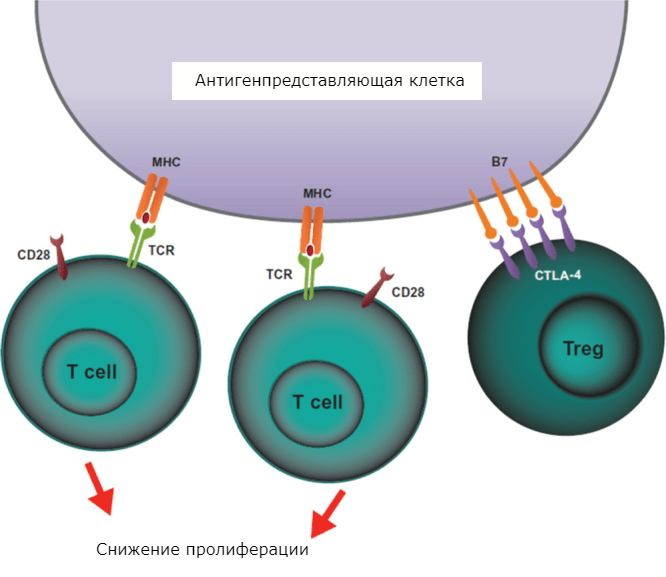
Рисунок 3. CTLA-4-опосредованное ингибирование T-клеток с участием Tregs. Согласно гипотезе, CTLA-4 на поверхности Tregs вступают в связь с B7 на поверхности APC. В итоге CD28 на поверхности T-лимфоцитов не могут вступить в связь с B7, что нарушает активацию клеток.
PD-1 представляет собой мембранный белок семейства костимуляторных рецепторов B7/CD28. Он имеет два лиганда: PD-L1 и PD-L2 (лиганды запрограммированной смерти 1 и 2), которые находятся на поверхности антигенпредставляющих клеток. Как и в случае с CTLA-4, связь PD-1 с лигандом приводит к подавлению пролиферации T-клеток, снижению выживаемости и производства цитокинов. Обычно PD-1 активируется при «истощении» эффекторных T-лимфоцитов, получивших слишком большую стимуляцию, либо при отсутствии поддержки со стороны CD4+ T-лимфоцитов. Как правило, такая ситуация характерна для хронических инфекций и онкологических заболеваний [21].
CTLA-4, PD-1 и подобные им корецепторы, эффекты которых имеют большое значение при онкологических заболеваниях, были названы контрольными точками . Так как они мешают активации T-лимфоцитов и тем самым подавляют противоопухолевый иммунитет, однажды появилась идея создать препараты, которые могли бы ингибировать их. И в настоящее время такие иммунопрепараты созданы, прошли испытания и даже применяются в клинической практике. Называются они ингибиторами контрольных точек [22]. Механизмы действия этих препаратов показаны на рисунках 4 и 5.
Контрольные точки важны для сохранения гомеостаза и предотвращения излишней активации иммунных клеток. По сути, они защищают организм от тяжелых аутоиммунных реакций и саморазрушения. Можно немного перефразировать: иммунная система использует контрольные точки для того, чтобы сдерживать себя, не атаковать нормальные, «родные» ткани. Однако при онкологических заболеваниях излишняя толерантность иммунитета начинает мешать.
По природе ингибиторы контрольных точек являются человеческими моноклональными антителами. Одновременно их можно отнести к группе таргетных препаратов, так как они прицельно связываются с определенными молекулами-мишенями.
Ингибиторы контрольных точек показали высокую эффективность у многих онкологических пациентов, но не обошлось и без проблем. Главная из них состоит в том, что не все пациенты одинаково хорошо отвечают на лечение.
Полезные бактерии, вредные бактерии
Считается, что резистентность к иммунотерапии при онкологических заболеваниях возникает главным образом из-за слабой инфильтрации опухолевой ткани иммунными клетками и иммуносупрессивных эффектов микроокружения опухоли [23], [24]. На иммунный ответ оказывают влияние в том числе и микроорганизмы, населяющие кишечник [25].
Накоплено немало данных, подтверждающих влияние кишечной микрофлоры на обменные процессы и иммунные реакции. Так, известно, что нарушение взаимодействия между хозяином и микробиотой связано с такими патологиями, как сахарный диабет, цирроз печени, воспалительные заболевания кишечника, колоректальный рак [25], [26].
Состав кишечной микрофлоры влияет на эффективность химиотерапии. Так, циклофосфамид (химиопрепарат из группы алкилирующих агентов) изменяет состав микрофлоры тонкого кишечника, заставляет отдельные грамположительные бактерии мигрировать во вторичные лимфоидные органы и стимулировать пролиферацию «патогенных» T-хелперов (pTh17), которые играют важную роль в развитии аутоиммунных процессов [27]. Это усиливает иммунную реакцию на опухолевую ткань. Когда подопытным животным вводили антибактериальные препараты (в частности, ванкомицин), уничтожающие грамположительных бактерий, реакции, связанные с pTh17, ослабевали, и эффективность циклофосфамида снижалась [28].
У животных, которые получают антибиотики или искусственно лишены кишечной микробиоты, развивается резистентность к препаратам платины: снижается цитотоксичность, образование активных форм кислорода [29]. Состав кишечной микрофлоры оказывает влияние на фармакологические эффекты таких препаратов, как 5-фторурацил, иринотекан, оксалиплатин, гемцитабин, метотрексат [30].
Модуляция ответа на химиопрепараты и иммунопрепараты микробиотой кишечника сводится к одному из трех клинических эффектов:
- повышение эффективности препарата;
- ослабление противоопухолевого эффекта;
- повышение токсичности.
Представители микрофлоры используют разные механизмы ответа на препараты. Известные на данный момент объединяет аббревиатура TIMER (табл. 1) [30].
| Механизм ответа | Препараты, активирующие механизм | Бактерии, изпользующие механизм | Эффект взаимодействия бактерий с препаратом |
|---|---|---|---|
| Транслокация (Translocation) | Циклофосфамид Доксорубицин |
Грамположительные микроорганизмы (Lactobacillus johnsonii, L. murinus, Enterococcus hirae) | Бактерии пересекают кишечный барьер и мигрируют во вторичные лимфоидные органы. |
| Иммуномодуляция (Immunomodulation) | Циклофосфамид | Lactobacillus | Грамположительные бактерии стимулируют иммунный ответ с участием клеток Th17 и Th1. |
| Метотрексат | Неизвестно | Бактерии регулируют повреждение кишечника химиопрепаратом через сигнализацию TLR2 и белок множественной лекарственной устойчивости. | |
| Блокаторы CTLA-4 | Bacteroidales | Подавление активации селезеночных эффекторных CD4+ Т-клеток и опухоль-инфильтрирующих лимфоцитов. | |
| Блокаторы PD-L1 | Bifidobacterium | Стимуляция опухолеспецифических Т-клеток и увеличение количества Т-лимфоцитов в микроокружении опухоли. | |
| Метаболизм (Metabolism) | Иринотекан | Неизвестно | Точная роль бактерий не известна, но лечение стрептомицином ингибирует поглощение иринотекана и снижает активность эпителиальной карбоксилэстеразы. |
| Ипилимумаб | Bacteroidetes | Бактериально опосредованная продукция витамина B и дефицит транспорта полиамина, связанные с повышенным рискоминдуцированного блоком CTLA-4 колита. | |
| Ферментная деградация (Enzymatic degradation) | Гемцитабин | Mycoplasma | Микоплазменные нуклеозидные фосфорилазы ограничивают цитостатическую активность. |
| Иринотекан | β-глюкуронидаза-экспрессирующая кишечная бактерия | Бактериальная β-глюкуронидаза расщепляет глюкуронид неактивного иринотекана (SN-38G), высвобождая активный метаболит (SN-38) в кишечнике. | |
| Сокращение разнообразия и функций экологической сети (Reduced diversity and ecological network function) | Комбинации кармустина, этопозида, цитарабина и мелфалана | Firmicutes Actinobacteria Proteobacteria |
Уменьшается количество бактерий, которые подавляют воспаление, и увеличивается число бактерий, которые приводят к колиту. |
| Метотрексат | Анаэробы Стрептококки Bacteroides |
Уменьшается разнообразие микроорганизмов, и сдвиги в составе кишечной микробиоты приводят к диарее. |
Свежие данные
Начало 2018 года ознаменовалось сразу тремя научными работами, посвященными влиянию микрофлоры кишечника на эффективность ингибиторов контрольных точек.
Работа Виары Мэтсон с соавторами посвящена метастатической меланоме. Ученые отобрали 42 пациента, страдавших этим заболеванием, и провели анализ их стула тремя различными методами. В дальнейшем бóльшая часть пациентов (38 человек) получала блокаторы PD-1 (ниволумаб, пембролизумаб), а четверо — блокатор CTLA-4 (ипилимумаб) [31].
Оказалось, что в составе кишечной микрофлоры пациентов, которые хорошо отвечали на терапию ингибиторами контрольных точек, было повышено количество восьми видов бактерий: Enterococcus faecium, Collinsella aerofaciens, Bifidobacterium adolescentis, Klebsiella pneumoniae, Veillonella parvula, Parabacteroides merdae, Lactobacillus sp. и Bifidobacterium longum. В кишечной микробиоте испытуемых, не ответивших на терапию, были многочисленны два микроорганизма: Ruminococcus obeum и Roseburia intestinalis.
Затем представителей кишечной микрофлоры пациентов с помощью метода трансплантации фекальной микробиоты (fecal microbiota transplantation, FMT) пересадили в кишечник стерильных (безмикробных) мышей [32]. Спустя некоторое время животным имплантировали клетки меланомы. Опухоли в теле мышей, которым пересадили бактерий от людей, ответивших на иммунотерапию, в целом росли медленнее. У них оказались более эффективны блокаторы PD-1 [31], [33].
Ванчесваран Гопалакришнан с коллегами также изучил микрофлору пациентов, страдающих распространенной меланомой, причем, не только в кишечнике, но и в полости рта [34]. Участники исследования получали лечение ингибиторами PD-1. Наилучший ответ наблюдался среди людей, у которых в стуле преобладали микроорганизмы рода Faecalibacterium. Преобладание группы Bacteroidales, напротив, оказалось связано с более низкой активностью препаратов. Ученые не обнаружили корреляции между составом микрофлоры полости рта и ответом пациентов на иммунотерапию.
Затем провели фекотрансплантацию микрофлоры пациентов стерильным мышам, после чего животным имплантировали опухолевые клетки и начали вводить блокаторы PD-1 (рис. 6). У мышей, получивших микробиоту людей, хорошо ответивших на терапию, отмечалось более существенное сокращение роста опухолей. В их стуле также преобладали бактерии рода Faecalibacterium [33], [34].
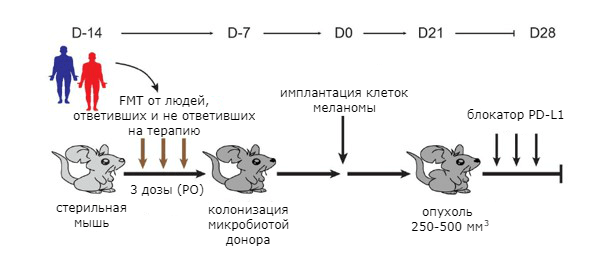
Рисунок 6. Эксперимент с трансплантацией фекальной микробиоты мышам от пациентов, по-разному ответивших на лечение блокаторами PD-1.
Работа Бертрана Роути с соавторами посвящена взаимосвязи состава кишечной микрофлоры и эффективности блокаторов PD-1 при немелкоклеточном раке легких, карциноме почек и уротелиальной карциноме [35]. Исследователи отметили, что прием антибактериальных препаратов для лечения инфекции во время онкологического заболевания ухудшает ответ на введение ингибиторов контрольных точек. Причем, в стуле у людей, хорошо отвечавших на терапию, авторы обнаружили повышенное количество микроорганизмов Akkermansia muciniphila.
Кишечную микрофлору пациентов при помощи FMT перенесли в кишечник стерильных мышей, затем имплантировали животным опухолевые клетки (рис. 7). Как и в экспериментах Мэтсон и Гопалакришнана, животные, получившие «благополучную» микрофлору, демонстрировали более выраженный ответ на лечение блокаторами PD-1 [33], [35].
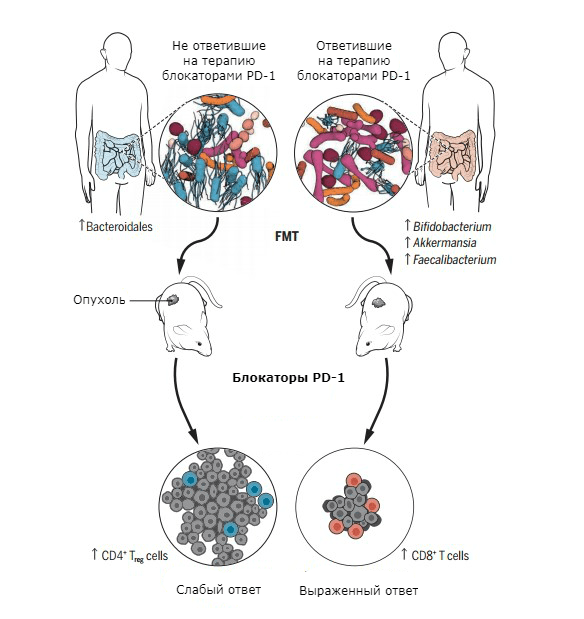
Рисунок 7. FMT и имплантация опухолевых клеток в тело лабораторных мышей. Слева — пациент, не ответивший на лечение блокаторами PD-1. Справа — пациент, хорошо ответивший на иммунотерапию.
Проблемы
Авторы всех трех исследований сходятся на том, что кишечная микрофлора — важный фактор, влияющий на эффективность ингибиторов контрольных точек, и с ним однозначно нужно считаться. Тем не менее результаты расходятся: в качестве предикторов названы разные группы микроорганизмов. Возможно, это зависит от типа злокачественной опухоли или индивидуальных особенностей пациентов. Вероятно, в этом загадочном треугольнике — микрофлора—хозяин—иммунопрепарат — существуют общие механизмы и закономерности, но ученым они пока неизвестны. Главная проблема состоит в том, что знания в этой сфере пока немногочисленны и фрагментарны [33].
Перспективы
Есть надежда, что дальнейшее изучение влияния микрофлоры на эффективность противоопухолевых препаратов поможет решить две проблемы:
- Прогнозирование реакции конкретного пациента на те или иные виды терапии в зависимости от состава и свойств его кишечной микробиоты.
- Повышение эффективности лечения путем манипуляций с микрофлорой с помощью «полезных» бактерий и микробных компонентов.
Эти подходы могут открыть новые возможности для персонализированной терапии онкологических заболеваний.
В других сферах медицины с помощью FMT уже достигнуты определенные успехи. В частности, в лечении рецидивирующей инфекции Clostridium difficile (CDI) [32]. Это одна из ведущих причин диареи, вызванной антибактериальными препаратами. В последнее время отмечается тревожный рост заболеваемости в Европе, Америке и Азии. «Трансплантация кала» от здоровых доноров помогла добиться выраженного клинического ответа у 90% пациентов (рис. 8) [36].
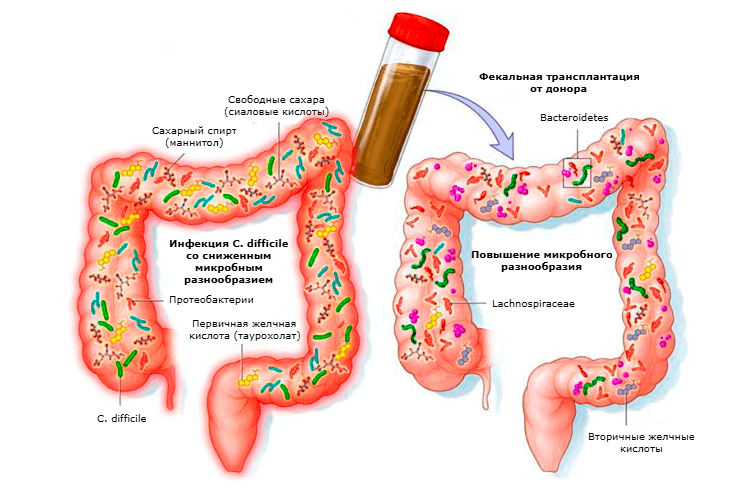
Рисунок 8. Схема FMT-терапии при рецидивирующей инфекции Clostridium difficile.
Но FMT — неспецифический метод. Дальнейшее изучение запутанных взаимосвязей в системе «хозяин—микроорганизм» может привести к появлению более «прицельных» подходов к лечению онкологических и других заболеваний. И в этом смысле кишечная микрофлора — самый настоящий «остров сокровищ». Вопрос в том, кому и как скоро удастся раскопать очередной клад [33].
Литература
- F. M. Burnet. (). The Concept of Immunological Surveillance. Progress in Tumor Research. 1-27;
- Thomas L. Discussion. In: Cellular and humoral aspects of the hypersensitive states / ed. by Lawrence H.S. NY: Hoeber-Harper, 1959. P. 529–532;
- Alexandre Corthay. (2014). Does the Immune System Naturally Protect Against Cancer?. Front. Immunol.. 5;
- Антиген — невидимка;
- Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет;
- Rodrigo Ramella Munhoz, Michael Andrew Postow. (2016). Recent advances in understanding antitumor immunity. F1000Res. 5, 2545;
- Дендритные клетки: профессиональные разведчики в «Опухолевой войне»;
- Иммуностимулирующие вакцины;
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Моноклональные антитела;
- I. M. Slaymaker, L. Gao, B. Zetsche, D. A. Scott, W. X. Yan, F. Zhang. (2016). Rationally engineered Cas9 nucleases with improved specificity. Science. 351, 84-88;
- CRISPR-эпопея и ее герои;
- Просто о сложном: CRISPR/Cas;
- David Cyranoski. (2016). CRISPR gene-editing tested in a person for the first time. Nature. 539, 479-479;
- H W Herr, D M Schwalb, Z F Zhang, P C Sogani, W R Fair, et. al.. (1995). Intravesical bacillus Calmette-Guérin therapy prevents tumor progression and death from superficial bladder cancer: ten-year follow-up of a prospective randomized trial.. JCO. 13, 1404-1408;
- Immunotherapy to treat cancer. (2017). National Cancer Institute (NCI);
- Emens L.A. (2016). How is immunotherapy changing the outlook for patients with breast cancer? Cancer Research Institute;
- Janeway C.A. Jr., Travers P., Walport M. et al. Chapter 8T: cell-mediated immunity. In: Immunobiology: the immune system in health and disease (5th edition). NY: Garland Science, 2001;
- Sachet A Shukla, Michael S Rooney, Mohini Rajasagi, Grace Tiao, Philip M Dixon, et. al.. (2015). Comprehensive analysis of cancer-associated somatic mutations in class I HLA genes. Nat Biotechnol. 33, 1152-1158;
- Kathy D McCoy, Graham Le Gros. (1999). The role of CTLA-4 in the regulation of T cell immune responses. Immunol Cell Biol. 77, 1-10;
- Elizabeth I. Buchbinder, Anupam Desai. (2016). CTLA-4 and PD-1 Pathways. American Journal of Clinical Oncology. 39, 98-106;
- Jennifer Dine, RuthAnn Gordon, Yelena Shames, MaryKate Kasler, Margaret Barton-Burke. (2017). Immune checkpoint inhibitors: An innovation in immunotherapy for the treatment and management of patients with cancer. Asia Pac J Oncol Nurs. 4, 127;
- Опухолевые разговоры, или Роль микроокружения в развитии рака;
- Во власти опухоли: почему метастазы так сложно остановить?;
- Christian Jobin. (2018). Precision medicine using microbiota. Science. 359, 32-34;
- Edoardo Pasolli, Duy Tin Truong, Faizan Malik, Levi Waldron, Nicola Segata. (2016). Machine Learning Meta-analysis of Large Metagenomic Datasets: Tools and Biological Insights. PLoS Comput Biol. 12, e1004977;
- Youjin Lee, Amit Awasthi, Nir Yosef, Francisco J Quintana, Sheng Xiao, et. al.. (2012). Induction and molecular signature of pathogenic TH17 cells. Nat Immunol. 13, 991-999;
- S. Viaud, F. Saccheri, G. Mignot, T. Yamazaki, R. Daillere, et. al.. (2013). The Intestinal Microbiota Modulates the Anticancer Immune Effects of Cyclophosphamide. Science. 342, 971-976;
- N. Iida, A. Dzutsev, C. A. Stewart, L. Smith, N. Bouladoux, et. al.. (2013). Commensal Bacteria Control Cancer Response to Therapy by Modulating the Tumor Microenvironment. Science. 342, 967-970;
- James L. Alexander, Ian D. Wilson, Julian Teare, Julian R. Marchesi, Jeremy K. Nicholson, James M. Kinross. (2017). Gut microbiota modulation of chemotherapy efficacy and toxicity. Nat Rev Gastroenterol Hepatol. 14, 356-365;
- Vyara Matson, Jessica Fessler, Riyue Bao, Tara Chongsuwat, Yuanyuan Zha, et. al.. (2018). The commensal microbiome is associated with anti–PD-1 efficacy in metastatic melanoma patients. Science. 359, 104-108;
- Чем пахнет здоровье?;
- Christian Jobin. (2018). Precision medicine using microbiota. Science. 359, 32-34;
- V. Gopalakrishnan, C. N. Spencer, L. Nezi, A. Reuben, M. C. Andrews, et. al.. (2018). Gut microbiome modulates response to anti–PD-1 immunotherapy in melanoma patients. Science. 359, 97-103;
- Bertrand Routy, Emmanuelle Le Chatelier, Lisa Derosa, Connie P. M. Duong, Maryam Tidjani Alou, et. al.. (2018). Gut microbiome influences efficacy of PD-1–based immunotherapy against epithelial tumors. Science. 359, 91-97;
- Colleen R. Kelly, Stacy Kahn, Purna Kashyap, Loren Laine, David Rubin, et. al.. (2015). Update on Fecal Microbiota Transplantation 2015: Indications, Methodologies, Mechanisms, and Outlook. Gastroenterology. 149, 223-237.