
Клинические исследования: рыночный вопрос
05 октября 2018
Клинические исследования: рыночный вопрос
- 7213
- 1
- 12
Большое клиническое исследование — дело международное. Над проверкой препаратов трудятся фармкомпании, заказчики, медперсонал, добровольцы и регуляторные органы стран всего мира.
-
Автор
-
Редактор
-
Рецензент
Любое новое активное вещество или медицинский девайс проходит клинические испытания до того, как попасть к пользователю. Однако такая проверка — это не просто отстраненная стандартная процедура, лишенная человеческого фактора. Это высококонкурентная прибыльная рыночная ниша, с множеством игроков, подводных камней и правил, различающихся в разных странах. О том, чем отличаются рынки клинических исследований разных стран, и пойдет речь в этой статье. Российскую ситуацию прокомментировал генеральный директор контрактно-исследовательской организации Atlant Clinical Михаил Грубман.
Клинические исследования

В статьях спецпроекта мы подробно расскажем о том, что такое клинические исследования, кто и как их проводит и с какими трудностями можно столкнуться при выводе нового лекарства на фармацевтический рынок.
Независимый рецензент спецпроекта — Алексей Водовозов, врач-терапевт высшей категории, медицинский журналист. Регулярно выступает с научно-популярными лекциями и ведёт блог «Смотровая военврача».
Партнер спецпроекта — компания «Атлант Клиникал»: международная контрактно-исследовательская организация, занимающаяся проведением клинических исследований.
Клинические исследования (КИ) — незаменимая стадия разработки новых лекарств. К их появлению в современном виде человечество шло долгие века [1], и сейчас нет другого официального способа показать безопасность препаратов и сравнить их эффективность с уже существующей терапией [2], [3]. К сентябрю 2018 года на портале ClinicalTrials.Gov было зарегистрировано 283 303 КИ со всего мира, причем среди регионов лидируют Северная Америка, Европа и Восточная Азия (рис. 1).
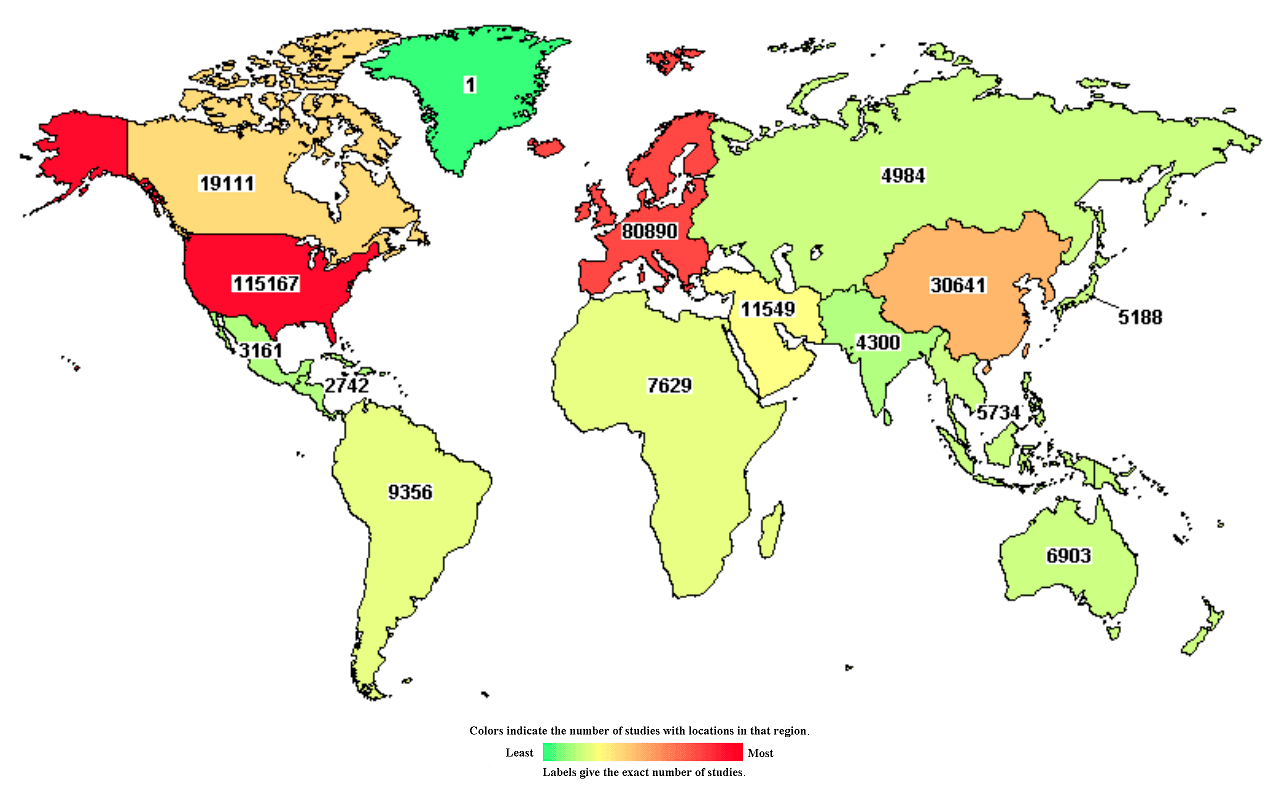
Рисунок 1. Все клинические испытания в мире, зарегистрированные на портале ClinicalTrials.Gov
Мы живем не в идеальном мире, где наука и медицина развиваются на альтруистических началах. В реальности рынок КИ — это прибыльнейшая область, в которой встречаются и сомнительные исследования, и коррупция, и предвзятый анализ данных [4]. Поскольку многое оказывается завязано на финансировании, «заказчики» исследования, то есть обычно фармкомпании, часто фокусируются на прибыльности разработки препарата, отражая «модные» направления в медицине или интересы развитых стран. Денежный интерес оказывает давление на результаты исследований, а отрицательные результаты просто замалчиваются [5]. Университеты, проводящие КИ, как оказывается, отчитываются по испытаниям даже хуже, чем компании, — по крайней мере, в Европе [6]. Даже такие стандартные техники как рандомизация или слепой метод, входящие в «золотой стандарт» проведения рандомизированных контролируемых исследований (РКИ), на практике встречаются пугающе нечасто [7]. Поэтому, чтобы максимально обезопасить потребителя, то есть нас, мировые сообщества совершенствуют правила одобрения лекарств перед тем, как они попадут на рынок: иногда успешно, иногда лишь множа проблемы системы. Из-за этого проверка лекарств превратилась в тяжеловесное бюрократическое мероприятие, вовлекающее людей разных специальностей — от этиков и юристов до бюрократов и врачей. О том, как функционирует эта сложнейшая система, вы и прочтете в этой статье.
Клинические исследования как бизнес
Количество КИ в мире стабильно увеличивается с каждым годом. Однако, например, лишь один из 5–10 тысяч разрабатываемых препаратов в итоге получает одобрение Управления США по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) [8]. При этом полный путь доведения новой молекулы «до ума», то есть до продажи на рынке, для одной из 12 крупнейших фармкомпаний может стоить до $2 млрд [9].
Например, в прошлом году FDA одобрило 46, а Европейское агентство по лекарственным средствам (EMA) рекомендовало к выпуску на рынок 35 новейших препаратов с новым механизмом действия. Количество новых веществ, получивших одобрение главного органа надзора за лекарствами США в последние годы, представлено на рисунке 2.
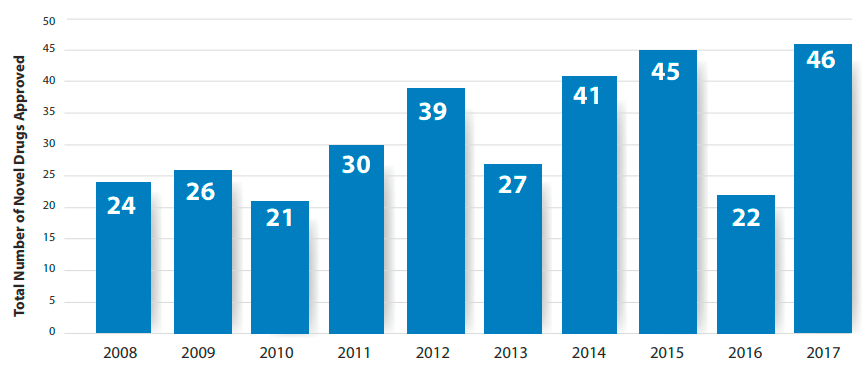
Рисунок 2. Количество новых веществ, одобренных FDA в последние годы
Мировой объем рынка КИ в 2016 году оценивался в $40 млрд. Ожидается, что к 2025 году он превысит $65 млрд [10]. Среди важнейших факторов, влияющих на рост рынка, эксперты называют глобализацию клинических испытаний, разработку новых методов лечения, улучшение технологического оснащения и повышение спроса на услуги контрактных исследовательских организаций (CRO, о которых подробнее пойдет речь ниже). Прогнозируемый рост этого сегмента для США, богатейшей страны мира, представлен на рисунке 3.
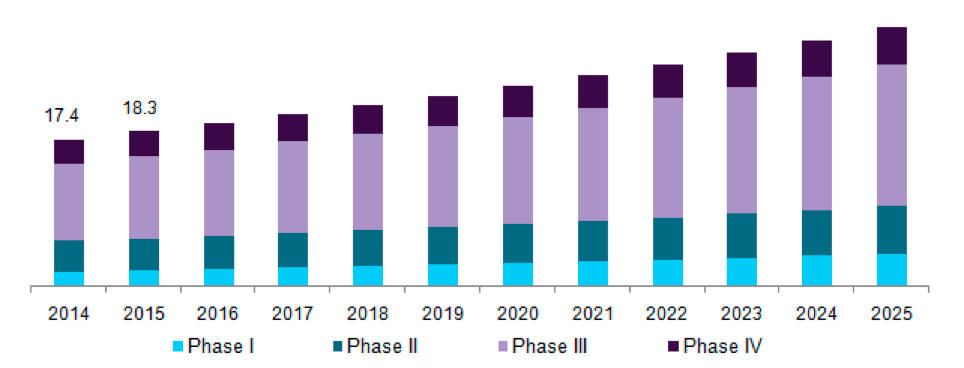
Рисунок 3. Рынок клинических испытаний США, разделенный по фазам КИ, на 2014–2025 гг. (в млрд. долларов США)
Как «Биомолекула» уже писала в предыдущих статьях цикла о клинических исследованиях, разработка каждого нового лекарства состоит из множества этапов [2]. КИ включают в себя несколько фаз, из которых фаза III — самая дорогая. На нее приходится наибольший сегмент рынка (рис. 3 и 4). Стоимость проведения одной стадии среднестатистического исследования от создания начального протокола до завершения написания отчетов, согласно данным за прошлый год, составила $3,4 млн. для I фазы КИ, $8,6 млн. для фазы II и $21,4 млн. для фазы III [11].
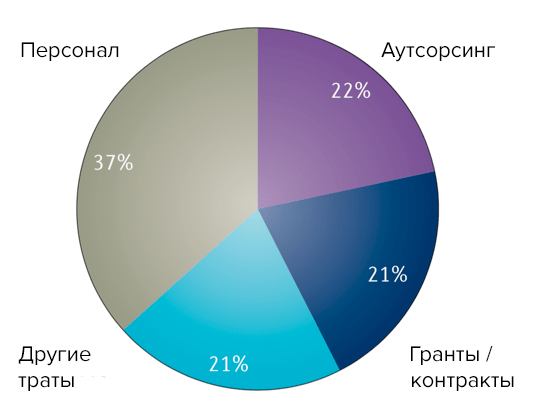
Рисунок 4. Компоненты, из которых складывается стоимость фазы III, самой дорогостоящей стадии КИ, по данным исследований 2010–2015 годов
Фармацевтическая отрасль вовлекает всё больше средств и становится всё более конкурентной. Неудивительно, что фармкомпании оценивают, в каком регионе мира им удобнее и дешевле проводить КИ, не жертвуя при этом качеством исследования (рис. 5). Отчасти это приводит к географическому сдвигу — теперь многие предпочитают набирать пациентов с помощью посредника (CRO), например, в Восточной Европе, Азиатско-Тихоокеанском регионе, Латинской Америке и на Ближнем Востоке [10].
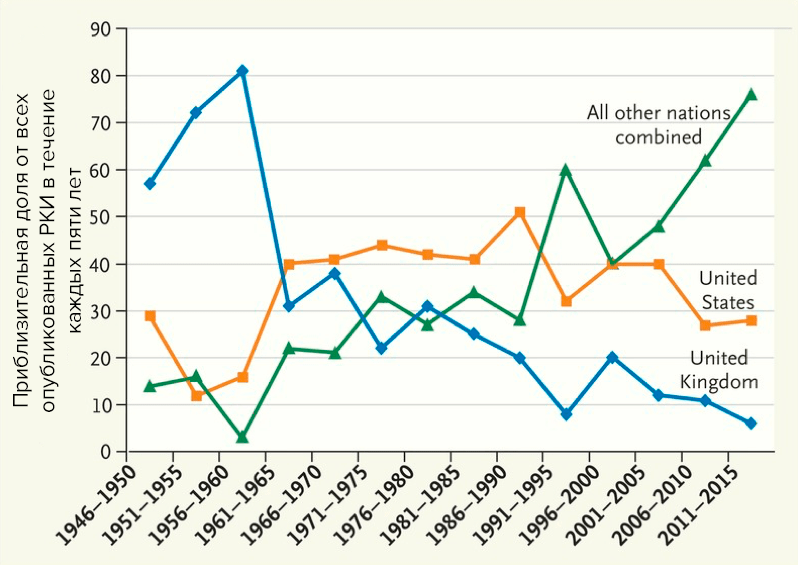
Рисунок 5. Расположение мест проведения рандомизированных КИ (locations of RCT research sites, 1946–2015)
Также крупные фармкомпании фокусируются на определенных сегментах фармацевтического рынка (его структуру можно увидеть на рисунке 6). По этой причине в КИ всё более активную роль принимают правительства государств [12]: они могут направить исследования на малоизученные области медицины и болезни, требующие новых (или хоть каких-то) терапий. Помимо прямого спонсирования у них есть целый арсенал рычагов, которыми можно обеспечить более быстрое и легкое одобрение нужного лекарства. (В качестве примера можно почитать о разработке вакцин от вируса Эбола, которая до вмешательства государственных структур не была финансово выгодной для фармкомпаний [13], [14].) Так, FDA в своем последнем отчете отдельно подчеркивает, что они одобрили не только лекарства по инфекционным, неврологическим, онкологическим болезням, но и терапии редких заболеваний, например, серповидноклеточной анемии и болезни Баттена.
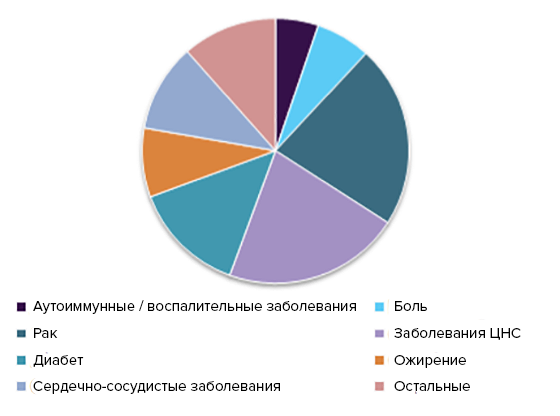
Рисунок 6. Структура общего рынка КИ в 2016 году по разным типам заболеваний
Из вышеприведенных данных очевидно, что КИ нового лекарства должно быть четкой, стандартизированной процедурой, в результате которой потребитель получит действительно эффективное лечение. Так, каждое исследование должно соответствовать стандарту надлежащей клинической практики (GCP), международному своду правил по этическим, научным и практическим вопросам. Как же устроена процедура изучения препарата в КИ и проверки его соответствия стандарту GCP в разных странах, и чем они различаются с точки зрения законодательства?
Проведение КИ в Европейском союзе и США
В ходе КИ должно быть доказано, что новое лекарство безопасно, эффективно и инновационно, то есть имеет преимущества перед уже существующим на рынке. Каждая страна добивается соответствия КИ стандарту GCP с учетом особенностей своего законодательства. И, как показывает практика, от выбора страны, где будет проводиться КИ, может зависеть длительность и стоимость исследования [15]. Процесс одобрения препарата для выхода на рынок после КИ тоже может различаться.
Стоит отметить, что КИ проводятся не только для лекарств, но и для медицинских девайсов («Биомолекула» писала о современных людях-киборгах [16]). Обычно такие приборы не так строго соответствуют стандартам, как препараты, и некоторые можно обнаружить на американском рынке вовсе без всякой предварительной проверки на людях. Иногда это просто трудно сделать, да и регуляторные органы предъявляют менее жесткие требования. В то же время регуляторные органы как в Соединенных Штатах, так и в ЕС недостаточно законодательно мотивируют разработчиков на создание действительно инновационных приборов [15]. С общими параметрами можно ознакомиться на сайте ISO.
Сходства и различия проведения КИ лекарств обусловлены как культурными и историческими причинами, так и результатом деятельности проверяющих органов.
Какая же главная разница в КИ и процессах одобрения медицинских препаратов между Европейским союзом (ЕС) и Соединенными Штатами, если говорить в целом? Большинство процессов в Европе аналогичны процедурам в США, в то же время в Америке процесс централизован, а в Европе нет. Тем не менее соблюдение стандартов GCP в США и Европе, согласно исследованиям, более или менее одинаково [17]. Активно обсуждается разница процесса одобрения лекарств после КИ. С одной стороны регуляторные органы в США все время критикуют, что они не склонны рисковать в своих решениях (и сам процесс получения одобрения длительнее и дороже). Минусом этой системы называют отсрочивание доступа пациентов к инновационной терапии. С другой стороны, по некоторым данным, одобрение лекарств в ЕС проходит быстрее, но при этом привнося потенциальный риск для безопасности пациентов. Однако Директива 2001 года (см. врезку «Стремление к улучшениям») сильно замедлила и «обюрократила» процесс проведения КИ, и существуют исследования, которые демонстрируют, что время рассмотрения заявки на одобрение нового лекарства в США меньше, чем в ЕС, в результате чего лекарства выводятся на рынок раньше в Америке [15].
Теперь разберем чуть подробнее.
В США одобрением всех лекарств занимается одно независимое агентство — FDA, исторически защищающее права потребителей. О его истории «Биомолекула» писала в первой статье этого цикла [1].
Европейское же регулирование в современном виде более молодое, поскольку Европейский союз появился позже. Так, в Европе окончательным одобрением лекарственных препаратов занимается Европейское агентство по лекарственным средствам (European Medicines Agency, EMA), сформированное в 1995 году при финансовой поддержке ЕС, фармпромышленности и стран-членов ЕС (первая попытка стандартизации правил по одобрению лекарств в Европе — это Директивы 65/65/EEC 1965 года). Его первоочередная цель — централизовать и синхронизировать процедуру между национальными агентствами 28 стран, входящих в ЕС. После Брексита их останется 27, да и сам офис EMA перенесут из Лондона.
Обе организации пытаются бороться со своими недостатками. Также для фармкомпаний дешевле проводить КИ в Европе, чем в США [18].
Многие из процессов одобрения медицинских препаратов в ЕС аналогичны процедурам FDA. Сначала исследователь предлагаемого фармацевтического препарата получает предварительную авторизацию на использование препарата в клинических испытаниях. Все европейские КИ первоначально регулировались Директивой о клинических испытаниях Европейской комиссии (2001/20/EC), затем в 2014 году ее заменил Регламент № 536/2014 Европейского парламента (Regulation (EU) No 536/2014 of the European Parliament and of the Council on clinical trials on medicinal products for human use) (см. врезку ниже).
В Европе многие пациенты получают информацию о наборе в КИ от врачей и через пациентские сообщества, а в Америке в основном из общественной рекламы. Важное отличие есть в системе страхования пациентов. Все страны, кроме США, требуют от спонсоров страхования участников КИ — в Америке даже нет национальных стандартов по ущербу, полученному в результате проведении КИ [17].
Бытует мнение, что европейские врачи лучше в профессиональном плане и более открыты к использованию новых технологий. Однако и вовлечь их в КИ труднее, чем в США: производителям существенно сложнее найти врачей и клиники требуемого уровня, способные соблюдать все требования и процедуры КИ. Кроме того, у европейских врачей есть склонность отдавать практическую часть КИ младшим врачам, а самим только почетно числиться в исследовании. Справедливости ради надо заметить, что в США чаще всего непосредственным наблюдением за пациентами занимаются помощники врача и медсестры [17].
При контроле самого исследования и в США, и в ЕС наблюдатели проверяют все доступные документы: как общие медицинские записи, так и «теневые заметки» — shadow notes (вид исходных заметок (source notes), содержащий только конкретные данные по конкретным исследованиям).
В Европе лекарство не обязательно одобряется EMA, в отличие от Америки, где все препараты проходят через руки FDA. Путь одобрения лекарства в Европе зависит от класса препарата и предпочтения производителя [15]. Так, через EMA обязаны подаваться на утверждение лекарства для таких заболеваний как ВИЧ/СПИД, рак, диабет, нейрогенеративные расстройства, аутоиммунные и вирусные. Есть еще три пути, например: производитель имеет право подать заявку на одновременное утверждение в несколько европейских стран, и препараты, государственно одобренные в одной стране ЕС, могут получить разрешение на продажу в другой стране ЕС через EMA. Однако у каждой страны внутри ЕС есть право устанавливать более строгие правила для одобрения лекарств.
Касательно финального отчета об исследовании — каждый наблюдатель КИ в США составляет отчет по своей «зоне ответственности». Их отчеты отсылаются этическим комитетам и заказчику, составляющему общий финальный документ, который и будет представлен в FDA.
В Европе ситуация обратная: спонсор сам готовит окончательный отчет об исследовании и направляет его каждому наблюдателю для подписания, что иногда отнимает очень много времени. После получения подписей отчет отправляется на одобрение регуляторного органа, например, EMA. Считается, что в Европе, по историческим причинам, более чувствительно относятся к публикации всех клинических данных, по сравнению с Америкой [18].
Что же случается после одобрения лекарства? В США врачи, производители и пациенты могут сообщать о побочных действиях лекарств прямо в FDA, где данные централизованно обрабатываются. В ЕС также недавно была создана общая система мониторинга побочных реакций под названием EudraVigilance. Необходимость мониторинга лекарства уже после его выпуска, который осуществляют особые европейские системы надзора, прописана в законе ЕС о фармаконадзоре 2012 года (EC pharmacovigilance legislation (EU/20/2012).
Итак, эксперты сходятся, что глобального преимущества нет ни у США, ни у Европы, однако региональные особенности в проведении КИ надо учитывать [17]. Важно, что сейчас и там, и там предпринимаются законодательные попытки увеличения прозрачности и взаимной стандартизации процессов одобрения новых лекарств [15].
CRO как важный игрок фармацевтического рынка
Контрактно-исследовательские организации (CRO) уже давно стали полноправными игроками рынка клинических исследований. В 2015 году международный совет ICH (International council for harmonisation of technical requirements for pharmaceuticals for human use) описал их как организации или людей, которые выполняют часть обязанностей и функций спонсора, то есть обычно заказчика-фармкомпании, по проведению КИ.
Начало роста CRO пришлось на 1980-е. В 1992 году в этих организациях уже работало 12 000 человек, вовлекающих в КИ 7 миллионов добровольцев. В 2001 году эти цифры составляли 94 000 и 20 миллионов соответственно. Сейчас это уже прибыльная часть фармацевтического бизнеса, со своими подразделениями и с сильным влиянием в странах второго и третьего мира. Объем рынка на 2017 год оценивается в более чем $36 миллиардов, и ожидается, что к 2023 году эта сумма вырастет до $56,34 млрд. Таких компаний в мире уже больше 1100, и доход первой десятки в 2017 году составил $34,5 млрд.
Как уже говорилось в первой статье цикла, 85 из 88 новых лекарств, которые были одобрены в 2014 году, испытывались в КИ, организованных через CRO.
Уже прошло несколько десятилетий с того момента, как они заменили академические медицинские центры в роли посредника между пациентами и фармкомпаниями при проведении исследований. Что же способствовало успеху CRO? Это их непривязанность к определенному заведению, географическая гибкость и взятие на себя всех трудностей по проведению КИ. В результате, такая организация может оперативно набрать большое количество добровольцев из разных стран в кратчайшие сроки. Такие большие страны как Китай и Индия уже предлагают CRO финансовые субсидии для проведения фармакологических исследований [22].
Поскольку навыки, необходимые для проведения КИ, очень специфичны, фармкомпании могут не беспокоиться о принятии на работу целого штаба новых сотрудников под проведение исследования. Сегодня CRO предлагают целый спектр услуг, фактически избавляя заказчиков от всей головной боли по исследованию. В целом, CRO могут управлять проведением КИ, обеспечивать клинический и медицинский мониторинг и контроль безопасности исследования, подготавливать всю бумажную отчетность по КИ и документы для подачи заявок на одобрение потенциального нового средства в FDA в виде NDA (New Drug Application — заявки на одобрение нового лекарства для продажи) или ANDA (Abbreviated New Drug Application — заявки на одобрение дженерика для продажи). Также они предоставляют услуги доклинического, токсикологического и клинического лабораторных анализов пробных образцов. Более того, CRO сейчас даже включены в процесс разработки и производства новых лекарств — например, они могут проводить скрининг тысяч соединений на протяжении многих лет [23].
Услуги CRO включают в себя разработку, составление формулы и производство лекарства, клинические испытания, мониторинг медицинских показателей и безопасности, надзор над производством образцов и подготовка любых формальных документов для регистрации препаратов.
Среди контрактно-исследовательских организаций уже вырисовались свои гиганты, которые, по аналогии с Большой фармой, уже вполне можно окрестить Big CRO (рис. 7). Самые топовые из них — американские, по большей части образовавшиеся в сегодняшнем виде после покупки нескольких компаний поменьше, имеющие офисы в более чем 100 странах, а их многомиллиардная прибыль, по оценкам, будет только расти в ближайшие годы.
Итак, ведущие пять CRO в мире — это Laboratory Corporation of America Holdings (купившая Covance в 2015 году и Chiltern в 2017-м; США; выручка $10,4 млрд), IQVIA (слияние Quintiles и IMSHealth; США; выручка $9,7 млрд), Syneos Health (слияние INC Research и Inventiv Health; США; выручка $2,7 млрд), Parexel International Corporation (США; выручка $2,4 млрд) и PRA Health Sciences (США; $2,3 млрд).
Завершают топ-10 компании Pharmaceutical Product Development (PPD) (США; выручка $1,9 млрд), Charles River Laboratories International Inc. (CRL) (США; выручка $1,86 млрд), ICON Public Limited Corporation (Ирландия; $1,76 млрд), Wuxi Apptec (Китай; $1 млрд) и Medpace Holdings, Inc. (США; $0,4 млрд) [24].
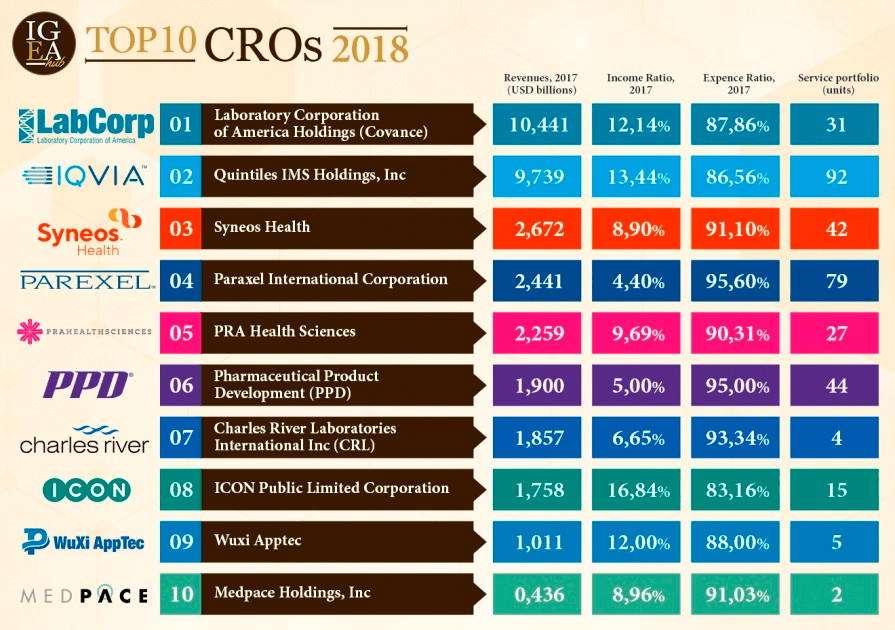
Рисунок 7. Топ-10 крупнейших контрактно-исследовательских организаций в 2018 году, по версии IgeaHub
Выделяется среди других компаний, по крайней мере по своим заявлениям, британская компания Synexus, часть PPD, выбравшая другую модель поведения на рынке. Она позиционирует себя как компанию-посредника между CRO, пациентами и заказчиками исследований. Их привлечение пациентов бесплатными проверками состояния здоровья и тестированиями на наличие рисков определенных заболеваний через рекламу в общественных местах — например, на автобусах в Глазго, — некоторые сочли некорректным, поскольку цели, то есть вовлечение в КИ, не были очевидны из рекламы, а оценить риски заболевания можно не только через компанию Synexus, но и бесплатно через Национальную систему здравоохранения Великобритании (NHS). Например, свою позицию описывала на сайте British Medical Journal одна из жалующихся на агрессивную политику компании активистка [25]. Тем не менее большинство добровольцев попадают в их КИ все же по рекомендации врача.
Отечественный рынок клинических исследований
Россия — довольно молодая, но перспективная страна для проведения международных КИ [27]. В 1998 году Россия присоединилась к программе ВОЗ по международному контролю лекарственных средств, хотя внутренняя система Фармаконадзора функционировала в СССР с 1969 по 1991 годы [28]. Активно в проведении международных КИ РФ участвует около 20 лет.
У контроля за лекарственными средствами в России есть свои особенности. Например, по законодательству, одобренные зарубежные препараты должны были пройти дополнительные клинические испытания в России: заявлялось, что это повысит качество препаратов, приходящих из других стран. Подобные ограничения существуют и в некоторых азиатских странах, но там это выглядит более логично: метаболизм лекарств может быть другим [29]. В России же на практике это откладывает, а то и вовсе лишает пациентов доступа к новым лекарствам. Сейчас появилась вероятность, что препараты, которые прошли клинические испытания в Евросоюзе, США или Японии, все-таки могут допустить на отечественный фармацевтический рынок, хоть и с особой маркировкой.
Если говорить непосредственно про проведение КИ, то, как и на других фармацевтических рынках, в России взаимодействуют три «игрока»: заказчик исследования (часто их называют спонсорами), местные и международные CRO и медучреждения, где проходят исследования. О регуляции исследования лекарств уже шла речь в предыдущих двух статьях цикла [1], [2], поэтому, если вкратце, то контролем над соблюдением стандартов GCP и одобрением проведения КИ занимается Министерство здравоохранения, фармаконадзор же поручен Росздравнадзору. Стоимость проведения КИ в России оценивалась в 2012 году в $1,3 миллиона [29].
Регулярную статистику и анализ российского рынка КИ публикует Ассоциация организаций по клиническим исследованиям (АОКИ), поэтому за более подробной информацией можно обратиться к их последнему бюллетеню — или подождать следующей статьи «Биомолекулы», которая полностью будет посвящена российской ситуации. Здесь же мы перечислим основные параметры рынка.
По данным российского CRO Atlant Clinical, рынок КИ в РФ составляет около 1 млрд. долларов США в год. Структура проводимых КИ представлена на рисунке 8. Как следует из данных АОКИ, доля многоцентровых клинических исследований (ММКИ), которая является неким показателем привлекательности и вовлеченности России в проведение крупных международных исследований, в последние годы уменьшается. Увеличение количества исследований по биоэквивалентности, как говорит Михаил Грубман (генеральный директор «Атлант Клиникал»), обусловлено как тенденцией роста импортозамещения внутри РФ, так и увеличением количества дженериков по всему миру.
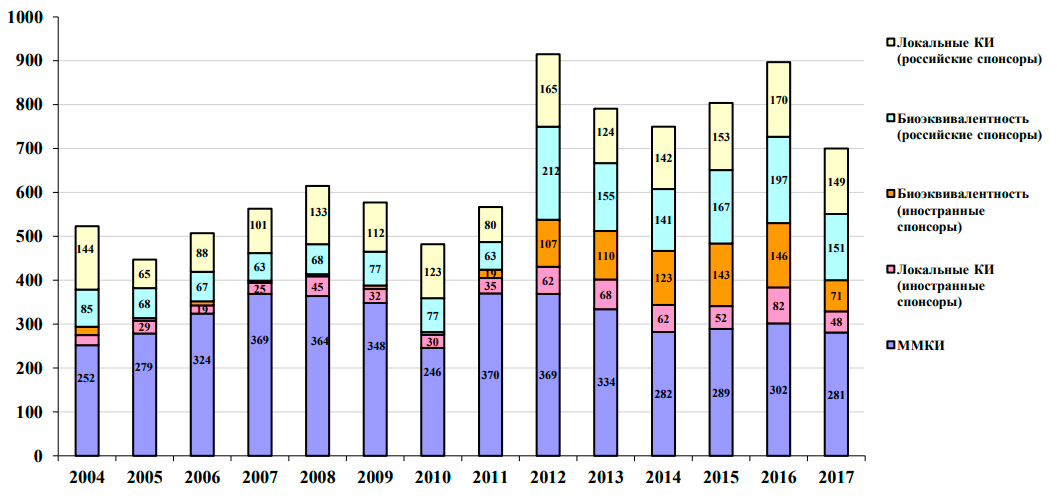
Рисунок 8. Динамика выданных разрешений на КИ за 2004–2017 годы
Согласно последним отчетам АОКИ, чаще всего международные многоцентровые клинические исследования (ММКИ) проводятся в Центральном федеральном округе, в частности, в Москве, Ярославской и Рязанской областях, а также в Санкт-Петербурге, Приволжском и Сибирском округах. Больше всего — 69% — ММКИ ожидаемо приходятся на исследования фазы III (рис. 9).
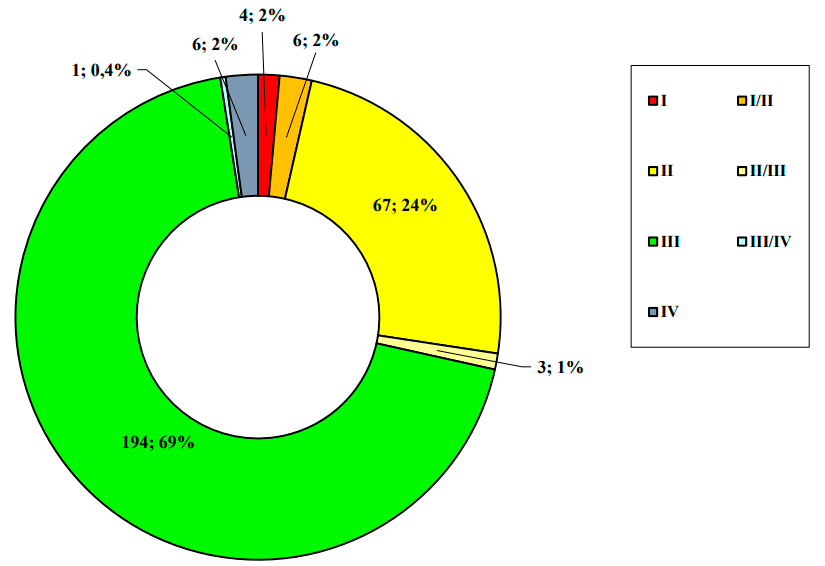
Рисунок 9. Распределение проводимых в РФ ММКИ по фазам, данные АОКИ на 2017 год
Больше всего востребовано проведение исследований в областях, которые активно изучаются на мировой арене. Это онкология, ревматология, неврология, онкогематология, гематология, кардиология и изучение сердечно-сосудистых заболеваний. Сокращения же по количеству исследований наблюдается в психиатрии и дерматологии, изучении ВИЧ, гепатита С и туберкулеза. «Конечно, мы находимся под влиянием мировых трендов: например, доминирующей терапевтической областью в мировой практике сегодня является онкология, соответственно, и наша страна не исключение. Однако, как и в любой другой стране, в России есть ряд регуляторных ограничений в индустрии. Например, у нас запрещены некоторые виды исследований, а в соответствии с регуляторным законодательством, регистрация нового лекарственного средства в стране требует КИ непосредственно в России. Этот факт тоже задает определенный тренд на внутреннем рынке», — рассказывает «Биомолекуле» генеральный директор российского CRO Atlant Clinical Михаил Грубман.
«Атлант Клиникал» на рынке с 2007 года. Они выросли из российской локальной компании в международную организацию с офисами в Великобритании, Германии, США, России, Литве и Украине. Чаще всего заказы им поступают из стран центральной Европы, России, Индии и США, и в этом году компания выиграла тендер на проведение фазы III ММКИ по исследованиям заболеваний сосудов, для которого они набирают пациентов с заболеванием периферических артерий.
Как уже упоминалось, Россия — потенциально перспективная страна для проведения международных КИ.
Во-первых, испытуемых обычно можно набрать быстро, и в основном это происходит через врачей. Согласно данным специализированного исследования, добровольцы в России принимают участие в КИ отнюдь не только из-за альтруизма, а из-за того, что в целом услуги системы здравоохранения их не устраивают. А участие в международном КИ автоматически означает доступ к новым лекарствам и просто регулярное наблюдение у врача [32]. Поэтому недостатка в испытуемых у исследователей̆ в России нет.
Во-вторых, согласно данным Atlant Clinical, российские врачи, участвующие в проведении КИ, — профессионалы с мотивацией сделать хорошее исследования, свободно владеющие английским языком и проходившие тренинги по стандарту GCP. «Российские исследователи с бóльшим энтузиазмом и интересом относятся к проведению КИ, чем зарубежные коллеги. Это связано с особенностями системы здравоохранения», — рассказывает Михаил Грубман.
В-третьих, в целом считается, что себестоимость проведения исследования в нашей стране ниже: например, ниже выплаты персоналу. Особенно понижению стоимости благоволит обвал рубля, поскольку традиционно все цены рассчитываются в долларах или другой зарубежной валюте. Однако, как отмечают специалисты, логистика все же может быть довольно дорогой [33]. Россия — страна большая, с не самой быстрой транспортной системой в мире. По этой причине доставка препаратов, требующих особых условий хранения, на дальние расстояния может оказаться долгой и дорогой.
Как рассказывает Михаил Грубман, все участники КИ в России застрахованы: «Система страхования участников клинических исследований в РФ определяется Постановлением Правительства Российской Федерации от 13 сентября 2010 г. № 714 “Об утверждении Типовых правил обязательного страхования жизни и здоровья пациента, участвующего в клинических исследованиях лекарственного препарата”. Между компанией спонсора (или CRO) и страховой компанией заключается договор страхования. Каждый субъект исследования при подписании формы информированного согласия получает оригинал страхового полиса с уникальным идентификационным номером. При возникновении страхового случая субъект может обратиться в страховую компанию, предъявив этот документ, а также еще некоторые документы, описанные в типовых правилах».
Сроки получения основных разрешений на проведение КИ сильно варьируют на практике: если законодательно суммарный срок получения такого разрешения вместе с разрешением на ввоз/вывоз составляет 54 рабочих / 76 календарных дней, то на практике в среднем это занимает значительно больше времени — 115 календарных дней [34]. Подробные данные представлены ниже в таблице 2.
| Сроки получения основных разрешений на проведение КИ, 2017 | |||||
|---|---|---|---|---|---|
| Тип разрешения | Законодательство: срок (рабочие/календ. дни) | Практика: средний срок (календ. дни) | Практика: минимальный срок (календ. дни) | Практика: максимальный срок (календ. дни) | Величина выборки |
| Разрешение на проведение КИ | 41/57** | 95* | 53* | 401* | 252 |
| Разрешение на ввоз лекарственных препаратов для КИ | 8/12 | 14 | 2 | 58 | 427 |
| Разрешение на ввоз/вывоз биообразцов | 13/19 | 20 | 4 | 49 | 913 |
| Разрешение на внесение изменений в протокол | 34/48 | 42 | 8 | 103 | 439 |
| Иные подачи (продление КИ, доп. центры, доп. пациенты, пр.) | 25/35 | 26 | 4 | 112 | 815 |
| Суммарный срок получения разрешения на КИ + разрешения на ввоз/вывоз | 54/76 | 115 | — | — | — |
* — По всем заявлениям, вне зависимости от наличия запросов экспертных организаций или Минздрава. Время, затраченное на отправку запроса и ответ на него, не вычиталось из расчётов. ** — При отсутствии запросов экспертных организаций или Минздрава. | |||||
Несмотря на перечисленные плюсы, Россия теряет свои позиции как удобная площадка для проведения международных КИ. Если «выкинуть» из рассмотрения исследования биоэквивалентности, которые представляют только локальный интерес, то, по данным авторов журнала АОКИ за 2016 год, на миллион человек населения в РФ проводят 3,5 КИ в год. Для сравнения с другими странами: во Франции это 57 КИ в год на миллион человек, в США — 55, в Великобритании почти 38,9, в Германии — 30,6 и больше 10 в Польше [33].
Кроме того, согласно данным АОКИ, наблюдается падение числа выданных Минздравом разрешений на проведение КИ. Так, разница между 2017 и 2016 годами составила 22% (700 против 897), причем снижение затронуло все области: исследования биоэквивалентности иностранных дженериков, локальные исследования эффективности и безопасности иностранных препаратов, локальные исследования отечественных разработчиков.
На это повлияло изменение законодательства относительно проведения клинических исследований, в частности, введенный в 2010 году закон «Об обращении лекарственных средств». В 2014 году в него внесли поправки, согласно которым многим дженерикам больше не требовалось предъявлять результаты терапевтической эквивалентности. Однако теперь необходима инспекция производственной площадки российскими проверяющими — результаты этой проверки надо предоставлять при регистрации нового лекарства. Это еще больше осложняет и затягивает бюрократический процесс [34].
«...норма /№61-ФЗ «Об обращении лекарственных средств» — авт./ противоречит международным подходам и этическим принципам проведения клинических исследований, а также не приносит выгоды ни с точки зрения инфраструктурных улучшений сферы КИ, ни с точки зрения эффективности лекарственного обеспечения российских пациентов. Статистика проводимых в России клинических исследований свидетельствует о том, что эти требования не только не привели к ожидаемому увеличению количества ММКИ в РФ, но, наоборот, отрицательно сказались на их динамике», — пишет Ассоциация международных фармацевтических производителей (AIPM), представляющая интересы ведущих международных фармкомпаний в России. «Закон фактически затруднил клинические испытания», — констатируют зарубежные эксперты [29].
Кроме того, обстановка в России нестабильна: как внутри, так и за ее границами. Например, внезапно могут ввести запрет на вывоз биоматериалов, как произошло в 2007 году. Тогда журналисты это связывали с тем, что в «верхах» посчитали, что на их базе можно разрабатывать «генно-биологическое оружие, направленное против нашей страны». Такие прецеденты, конечно, нарушают весь ход исследования. «Текущая международная обстановка, безусловно, сказывается на нашей работе. Мы видим сокращение числа международных проектов, в которых российские компании помогают международным спонсорам проводить КИ в РФ. Также небольшие биотехнологические компании стараются проводить исследования в других регионах, так как видят определенные риски, связанные с нестабильной геополитической обстановкой», — комментирует генеральный директор «Атлант Клиникал» Михаил Грубман.
Сейчас также вышел приказ Минздрава «Об утверждении Правил надлежащей клинической практики биомедицинских клеточных продуктов», который еще не вступил в силу. Согласно этому документу, «организация, проводящая клинические исследования, должна представлять в Минздрав России отчет о результатах исследования в срок, не превышающий 3 мес. со дня его завершения, приостановления или прекращения».
О всевозможных препятствиях можно услышать и от представителей фармкомпаний. Например, в интервью «Газете» Всеволод Горностаев, менеджер по клиническим исследованиям крупной международной фармкомпании «АстраЗенека», рассказывал, что для развития подобного рынка в России нужно изменить подход к изъятию таможенных сборов, повысить прозрачность взаимодействия с регуляторами, внести поправки в законодательство, улучшить соблюдение GCP, международных стандартов лечения и международных требований, включая закон о противодействии коррупции за рубежом, и доступность квалифицированных и опытных исследователей.
Интересно, что длительность различных бюрократических процессов в РФ избирательно гибкая. Так, судя по имеющимся данным, разрешение на проведение КИ российская вакцина против вируса Эбола (говоря о прозрачности данных — в открытом доступе документов по ней немного, об этом мы писали в статье по недавней вспышке Эбола в Демократической Республике Конго [14]) получила за день, «в 90 раз быстрее, чем в среднем по отрасли» [33].
Пойдет ли Россия по пути других стран, которые привлекают в страну международные КИ, остается вопросом будущего.
Заключение
Рынок клинических исследований — растущая, прибыльная, хоть и высоко конкурентная с точки зрения бизнеса область рынка, вовлекающая всё больше игроков. Регуляторные органы отдельных стран и союзов государств с переменным успехом пытаются увеличить прозрачность КИ законодательно и направить некоторые из них на те области медицины, которыми фармкомпании пренебрегают.
Отечественный рынок КИ молод и перспективен. Теоретически он мог бы стать важным пунктом международных исследований, но в последние годы скорее сокращается. Подробнее о российской ситуации читайте в следующей статье «Биомолекулы», целиком посвященной теме клинических исследований в РФ.
Литература
- С миру по нитке: как соединились компоненты клинического исследования;
- Путь к тысячам аптек начинается с одной молекулы;
- Shoibal Mukherjee. (2012). Clinical Trials and Contract Research Organizations in India. Clinics in Laboratory Medicine. 32, 315-320;
- Kanu Okike, Mininder S. Kocher, Charles T. Mehlman, Mohit Bhandari. (2008). Industry-sponsored research. Injury. 39, 666-680;
- Laura E. Bothwell, Jeremy A. Greene, Scott H. Podolsky, David S. Jones. (2016). Assessing the Gold Standard — Lessons from the History of RCTs. N Engl J Med. 374, 2175-2181;
- Tania Rabesandratana. (2018). Universities are worse than drug companies at reporting clinical trial results. Science;
- Brennan C. Kahan, Sunita Rehal, Suzie Cro. (2015). Risk of selection bias in randomised trials. Trials. 16;
- Галеева А.А. и Семенина Ю.В. (2014). Рынок клинических исследований в России и мире. «Ремедиум»;
- A new future for R&D? (2017). Deloitte;
- Clinical trials market size, share, growth, analysis report, 2018–2025. (2018). Grand View Research;
- Linda Martin, Melissa Hutchens, Conrad Hawkins, Alaina Radnov. (2017). How much do clinical trials cost?. Nat Rev Drug Discov. 16, 381-382;
- Stefan Elbe, Anne Roemer-Mahler, Christopher Long. (2015). Medical countermeasures for national security: A new government role in the pharmaceuticalization of society. Social Science & Medicine. 131, 263-271;
- Петренко А. (2018). Опередить смерть: гонка вооружений в борьбе с вирусом Эболы. Forbes;
- Возвращение домой: вирус Эбола снова атакует ДРК;
- Gail A. Van Norman. (2016). Drugs and Devices. JACC: Basic to Translational Science. 1, 399-412;
- Киборги среди нас;
- Douglas R. Mackintosh, Vernette Molloy. (2001). Differences in clinical trial conduct in US and EU investigational sites. Qual. Assur. J.. 5, 13-17;
- Stark Т. (2004). Clinical studies: Europe or the United States? MD+DI;
- Pamela Kearns. (2013). The need for proportionate regulation of clinical trials. The Lancet Oncology. 14, 454-455;
- Glenis Willmott. (2013). Regulating clinical trials in Europe. The Lancet Oncology. 14, 453-454;
- Clinical trials. (2018). NHS european office;
- Darby Hull. (2015). Reining in the Commercialized Foreign Clinical Trial. Journal of Legal Medicine. 36, 367-401;
- Sushma Drabu, Alka Gupta, Anupama Bhadauria. (2010). Emerging trends in contract research industry in India. Contemporary Clinical Trials. 31, 419-422;
- Dezzani L. (2018). Top 10 global CROs 2018. IgeaHub;
- Margaret McCartney: Clinical trial company tempts patients with free health screening. (2013). BMJ Opinion;
- Kathleen M. Hayden, Oksana A. Makeeva, L. Kristin Newby, Brenda L. Plassman, Valentina V. Markova, et. al.. (2014). A comparison of neuropsychological performance between US and Russia: Preparing for a global clinical trial. Alzheimer's & Dementia. 10, 760-768.e1;
- Olga Zvonareva, Natalia Kutishenko, Evgeny Kulikov, Sergey Martsevich. (2015). Risks and benefits of trial participation: A qualitative study of participants’ perspectives in Russia. Clinical Trials. 12, 646-653;
- Ksenia Zagorodnikova, Aleksandra Burbello, Dmitry Sychev, Maxim Frolov, Vladimir Kukes, Vladimir Petrov. (2015). Clinical pharmacology in Russia—historical development and current state. Eur J Clin Pharmacol. 71, 159-163;
- Alla Katsnelson. (2012). Russian drug law hinders clinical trials. Nature. 481, 250-250;
- С миру по нитке: как соединились компоненты клинического исследования;
- Путь к тысячам аптек начинается с одной молекулы;
- Olga Zvonareva, Natalia Kutishenko, Evgeny Kulikov, Sergey Martsevich. (2015). Risks and benefits of trial participation: A qualitative study of participants’ perspectives in Russia. Clinical Trials. 12, 646-653;
- Каменский А. (2016). Пробный шарм. VADEMECUM. 14, 12–29;
- «Информационно-аналитический бюллетень № 16». (2018). АОКИ.







