Путь к тысячам аптек начинается с одной молекулы
29 июня 2018
Путь к тысячам аптек начинается с одной молекулы
- 4359
- 7
- 16
Клинические исследования — очень важный, но далеко не единственный этап жизненного цикла лекарственного препарата
сайт depositphotos.com
-
Автор
-
Редактор
-
Рецензент
В первой статье цикла, посвященного клиническим исследованиям, рассматривался долгий и непростой исторический процесс, в ходе которого сформировалась четкая и надежная, но вместе с тем весьма сложная система разработки и вывода на рынок новых лекарственных препаратов. Клинические исследования — важная, но не единственная часть этой системы. В этой статье мы коснемся каждого этапа и попробуем разобраться, как молекула «из пробирки» превращается в официально зарегистрированное лекарство. В основном речь пойдет о клинических исследованиях.
Клинические исследования

В статьях спецпроекта мы подробно расскажем о том, что такое клинические исследования, кто и как их проводит и с какими трудностями можно столкнуться при выводе нового лекарства на фармацевтический рынок.
Независимый рецензент спецпроекта — Алексей Водовозов, врач-терапевт высшей категории, медицинский журналист. Регулярно выступает с научно-популярными лекциями и ведёт блог «Смотровая военврача».
Партнер спецпроекта — компания «Атлант Клиникал»: международная контрактно-исследовательская организация, занимающаяся проведением клинических исследований.
В первой статье цикла — «С миру по нитке: как соединились компоненты клинического исследования» — мы рассказали о том, как постепенно выкристаллизовывалась современная концепция клинических исследований, формировались их методологическая и этическая составляющие [1]. В современной фармацевтике существует такое понятие как «жизненный цикл лекарственного препарата». Оно включает в себя не только клинические исследования, но и другие важные этапы:
- Разработка. На этом этапе исследователи в лабораториях ищут молекулы, которые могли бы решать те или иные терапевтические задачи и стать в будущем лекарством.
- Доклинические исследования (ДИ). Полученные на предыдущем этапе молекулы тестируют на животных и клеточных культурах, моделируют эксперименты на компьютерах.
- Получение патента. Этот документ защищает новый препарат от копирования, дает компании эксклюзивное право на его производство.
- Клинические исследования (КИ). Отобранные молекулы тестируют на здоровых добровольцах и пациентах.
- Регистрация. Фармкомпания получает разрешение на продажи препарата.
- Производство. После того как новое лекарство прошло необходимые исследования и было зарегистрировано, начинают его массовый выпуск.
- Маркетинг и продажи. Препарат, наконец, поступает в аптеки и становится доступен для всех пациентов. Лишь на этом этапе фармацевтическая компания начинает получать прибыль, окупая прежние вложения.
- Создание и вывод на рынок дженериков. Патентная защита распространяется на препарат в течение 20 лет, после чего другие фармацевтические компании получают возможность выпускать аналоги — дженерики.
Будем разбираться с самого начала.
От идеи до готового препарата
Путь от молекулы в лабораторной пробирке до препарата, который продается под разными названиями в каждой аптеке, невероятно тернист и долог. Он может прерваться на любом этапе, и чаще всего прерывается: из всех веществ, участвующих в доклинических разработках, лишь 2% становятся зарегистрированными препаратами. Остальные оказываются недостаточно эффективными или вызывают слишком тяжелые побочные эффекты.
Но даже кандидаты, успешно прошедшие жесткий «кастинг», далеко не сразу попадают в клиники и на аптечные витрины. По данным Европейской академии пациентов (EUPATI), для того чтобы новый препарат стал доступен покупателям, в среднем требуется 12 лет и затраты в размере миллиарда евро [2]. Такая сложность и дороговизна делают разработку новых лекарственных препаратов весьма рискованным бизнесом. Но если такие звезды зажигают — значит, это кому-то очень нужно.
Обычно на создание нового лекарства исследователей толкает так называемая неудовлетворенная потребность: если против какого-либо заболевания нет эффективных препаратов либо существующие лекарства недостаточно эффективны или вызывают тяжелые побочные эффекты. Стимулом может стать появление новых технологий, открытия в этиологии и патогенезе заболеваний [2], [3]. Например, сочетание неудовлетворенной потребности с появлением новых технологий в последние годы привело к появлению многих новых противоопухолевых препаратов.
В реалиях современного мира есть еще два фактора, влияющие на принятие решения о разработке новых лекарственных препаратов: коммерческая целесообразность и политические интересы. Яркий пример — вакцина против вируса Зика, о которой шла речь в первой статье цикла «С миру по нитке: как соединились компоненты клинического исследования» [14], [15]. Правительства разных стран пытаются бороться с этой проблемой. Например, на территории Европейского Союза предусмотрена система наград и стимулов для компаний, разрабатывающих педиатрические препараты [16]. В России действует программа «Фарма-2020», задействованы институты развития и поддержки инноваций, различные фонды [17].
Этапы разработки новых лекарственных препаратов показаны на рисунке 1. В этой статье мы попытаемся проследить весь путь, разберемся, что происходит на каждом этапе, кто это регулирует и с какими сложностями сталкиваются стороны, принимающие участие.
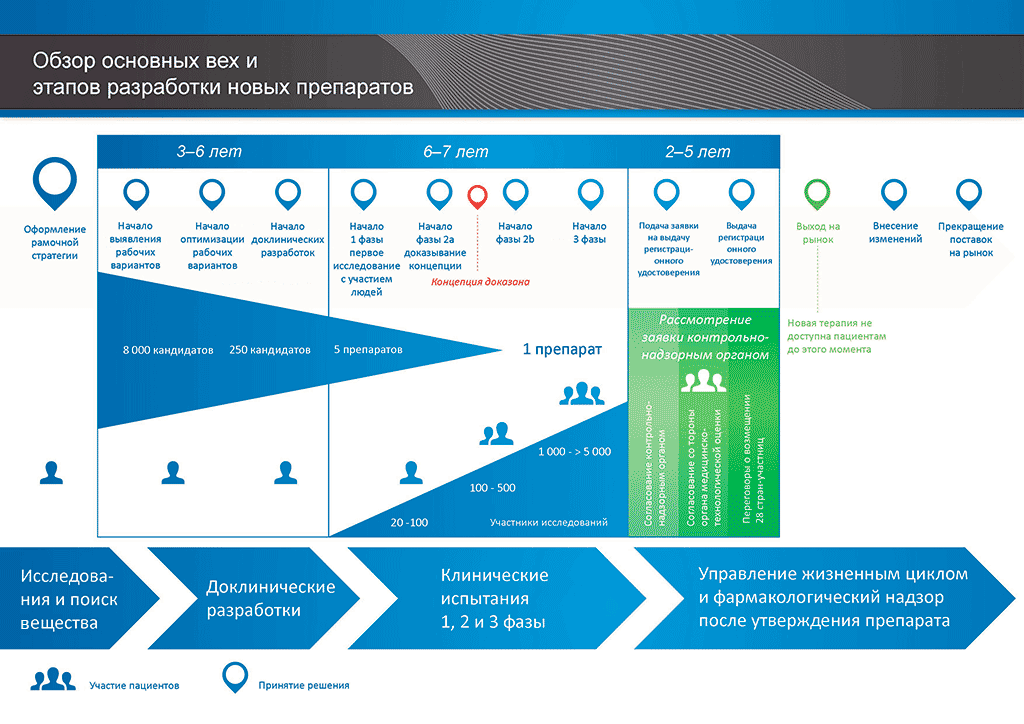
Рисунок 1. Основные этапы разработки новых препаратов.
Откуда берутся новые лекарства?
Чаще всего поиск новых препаратов ведут «от болезни». Каждое заболевание характеризуется определенным патогенезом: некие процессы в организме происходят неправильно. Определенные молекулы вырабатываются в чрезмерно большом или малом количествах, их функция нарушена из-за «поломок» в генах, или в ткани проник патоген и вызвал ответную реакцию. Так или иначе, есть молекулы-мишени, воздействие на которые помогает исправить ситуацию. Задача ученых — выявить эти мишени и найти вещества, с помощью которых на них можно воздействовать.
Чаще всего мишенью для нового препарата становится рецептор — белок на поверхности клетки, который при активации вызывает определенные биохимические и физиологические эффекты, либо лиганд — сигнальная молекула, которая связывается с рецептором (или ДНК) и меняет его активность [18]. Один из примеров таких рецепторов-мишеней — подсемейство белков ErbB из семейства рецепторных тирозинкиназ.
Другая стратегия предполагает движение «от потенциального препарата». Есть вещество, обладающее свойствами, которые могут быть полезны в медицине. Задача — найти точки приложения. Один из примеров недавно обнаруженного потенциального препарата — соединение в составе яда паука Hadronyche infensa.
Есть и третья «стратегия» — непредсказуемая. Иногда лекарства создают случайно. Пожалуй, самый показательный случай — тот, что произошел с ученым, не любившим наводить порядок в лаборатории, Александром Флемингом (рис. 4) . 3 сентября 1928 года, вернувшись из отпуска, микробиолог заметил, что в некоторых чашках со стафилококками выросли плесневые грибы, а сами бактерии погибли. Так был открыт пенициллин, и наступила эра антибиотиков [24].
Краткая биография Александра Флеминга и история открытия пенициллина изложены в нашей статье «Победитель бактерий» [25]. А еще на «Биомолекуле» есть интересный спецпроект «Антибиотики и антибиотикорезистентность».

Рисунок 4. Александр Флеминг — ученый, который не любил убирать в лаборатории, благодаря чему стал «отцом» первого антибиотика.
Кастинг и предварительная проверка
Итак, потребность в новом препарате налицо, найдены мишени и соединения, которые могут на них воздействовать. Что дальше? Среди потенциальных лекарственных веществ отбирают наиболее подходящие, их химическую структуру оптимизируют, стараются максимально повысить эффективность и безопасность, оценивают фармакодинамику и фармакокинетику. Проводят эксперименты на клеточных культурах «в пробирке» (in vitro), на лабораторных животных (in vivo) и с помощью компьютерного моделирования (in silico). И на каждом этапе нужно ответить на вопросы: «Стоит ли двигаться дальше?» и «Стоит ли инвестировать в разработку нового препарата время, деньги, ресурсы?». Если ответы отрицательные, работу прекращают [26–28].
Все перечисленные мероприятия — это доклинические исследования. Прежде чем начинать испытания с участием людей, нужно тщательно оценить все минусы нового препарата: системные и местные токсические эффекты, влияние на мужскую и женскую репродуктивные функции, способность вызывать реакции гиперчувствительности, генотоксичность, канцерогенность. Оценивают процесс попадания препарата в организм, распределение, особенности метаболизма, процесс выведения.
Направленная разработка лекарственных препаратов называется драг-дизайном (drug design). О нем у нас есть отдельная подробная статья [29]. О тестировании in silico можно подробнее узнать из статей: «in vivo — in vitro — in silico», «12 методов в картинках: „сухая“ биология», «Виртуальные тропы реальных лекарств» [30–32].
Впрочем, не всегда удается заранее проанализировать все нюансы. Например, оценка канцерогенности занимает длительное время и может продолжаться параллельно с клиническими исследованиями [28].
Важно, чтобы все процессы на стадии доклинических исследований были четко спланированы и соответствовали некоторым стандартам:
- Для того чтобы провести опыты над клеточными культурами и животными, нужно произвести достаточное количество экспериментального препарата. Обеспечить соответствующее качество помогает стандарт GMP (Good Manufacturing Practice, «Надлежащая производственная практика»). В этом документе указаны требования к персоналу, оборудованию, технологическому процессу, рекомендации по предотвращению загрязнения, смешивания разных веществ и совершения ошибок [28], [33]. На территории России действуют: ГОСТ Р 52249-2009 «Правила производства и контроля качества лекарственных средств», приказ Министерства промышленности и торговли РФ от 14.06.2013 г. № 916 (в ред. от 18.12.2015 г.) «Об утверждении правил надлежащей производственной практики» (фактически перевод GMP Евросоюза), приказ Минпромторга РФ № от 12.12.2013 г. № 1997 «Об утверждении рекомендаций по организации производства и контроля качества лекарственных средств» и «Правила надлежащей производственной практики Евразийского экономического союза». В дальнейшем при производстве лекарственного препарата все эти нормативные акты также нужно соблюдать.
- Доклинические исследования на животных (рис. 5) проводят в соответствии со стандартом GLP (Good Laboratory Practice, «Надлежащая лабораторная практика»). На территории России действует идентичный ГОСТ 33044-2014 «Принципы надлежащей лабораторной практики».

Рисунок 5. Лабораторная мышь — один из главных героев доклинических исследований [79]. Ей даже установили памятник в новосибирском Академгородке, около Института цитологии и генетики (ИЦиГ) Сибирского отделения РАН.
Клинические исследования
Теперь будущий лекарственный препарат уже прошел большой путь: его отобрали, возможно, среди тысяч других кандидатов, всячески изучили, проверили на лабораторных животных. Но самое интересное только начинается.
Мы, наконец, добрались до главной темы нашей статьи. Пришло время проверить новое лекарство на людях.
Кто и за чей счет проводит клинические исследования?
В качестве организатора КИ могут выступать разработчик лекарственного препарата или уполномоченное им лицо, образовательные организации (высшего или дополнительного профессионального образования — различные вузы), научно-исследовательские организации. Организатор может проводить клинические исследования за свой счет либо с привлечением средств различных фондов. Чаще всего организатором и спонсором является частная компания, которая планирует производить препарат и представлять его на рынке [34].
Естественно, фармкомпании хочется, чтобы ее детище показало себя только с лучшей стороны. В конце концов, тратятся огромные суммы, и их нужно окупать. Это может повлиять на непредвзятость результатов, стать причиной смещения в пользу преимуществ препарата и замалчивания недостатков, побочных эффектов.
Важно, чтобы в процессе принимала участие независимая контролирующая структура, которая могла бы гарантировать честность и прозрачность. В США эта функция возложена на FDA, в Европе — на EMA (European Medicines Agency) [35]. В России аналогичную функцию выполняют Департамент государственного регулирования обращения лекарственных средств Минздрава и Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор) [36].
Раньше фармкомпании зачастую проводили исследования самостоятельно. Хотя в качестве исполнителя могли задействовать медицинское учреждение, которое прошло аккредитацию и соответствует определенным требованиям [37]. В современном мире в роли исполнителя все чаще выступают профессиональные контрактные исследовательские организации — CRO (Contract research organization) [38], [39]. От такого аутсорсинга выигрывают все. С одной стороны, процесс для фармкомпании сильно упрощается и ускоряется. Сотрудничество с CRO открывает доступ к современным технологиям и помогает завершать клинические исследования в среднем на 30% быстрее [38]. В то же время результаты таких исследований являются более надежными и непредвзятыми.
В России дело обстоит несколько иначе. Многие фармкомпании предпочитают проводить клинические исследования своими силами. Так, в 2013 году Минздрав России выдал 791 разрешение на проведение клинических исследований, и лишь в каждом третьем из них были задействованы CRO. Однако ситуация постепенно меняется. Очевидно, что аутсорсинг с участием CRO — это удобно и выгодно, а значит, он все больше будет набирать обороты [40].
Что такое протокол клинического исследования?
Составление протокола клинического исследования — один из самых сложных и трудоемких этапов. Протокол — это особый документ, и от того, насколько корректно он сформулирован, зависит достоверность результатов исследования. Вот основные данные, которые должен содержать этот документ [41]:
- дизайн исследования (о нем речь пойдет ниже);
- цель и значение исследования;
- место и время проведения;
- размер выборки пациентов, критерии включения и исключения;
- методология, процедуры, которые планируется использовать;
- методы сбора и анализа данных;
- график процедур;
- этические вопросы;
- необходимые технические, финансовые, научные и прочие ресурсы.
Без протокола нельзя получить разрешение на проведение клинического исследования и пройти этическую экспертизу [42], [43]. Протокол исследования просто так изменить нельзя, для этого придется подавать в уполномоченный государственный орган заявление по установленной форме [42].
Строго по закону
Основной стандарт, регулирующий проведение клинических исследований в мире — GCP (Good Clinical Practice, «Надлежащая клиническая практика»). Он составляет научную, этическую и организационную основу. О нем уже рассказано в первой статье цикла.
Регулирующие документы в России:
- Федеральный закон от 12 апреля 2010 г. № 61-ФЗ «Об обращении лекарственных средств»;
- Национальный стандарт Российской Федерации ГОСТ Р 52379-2005 «Надлежащая клиническая практика»;
- Приказ МЗ РФ № 200н от 1 апреля 2016 г. «Об утверждении правил надлежащей клинической практики»;
- Решение № 79 от 3 ноября 2016 г. «Об утверждении правил Надлежащей клинической практики Евразийского экономического союза»;
- Приказ Росздравнадзора № 1071 от 15 февраля 2017 г. «Об утверждении порядка осуществления фармаконадзора».
Соблюдение установленных правил в России контролирует Министерство здравоохранения, на территории Евросоюза — EMA, в США — FDA.
Типы клинических исследований
В ходе клинических исследований можно изучать не только новые лекарственные препараты, но и методы профилактики, диагностики, скрининга, способы улучшения качества жизни пациента, эпидемиологию, связь между генетическими дефектами и различными заболеваниями.
В первой статье цикла уже говорилось о двух типах клинических исследований: обсервационных (наблюдательных) и клинических интервенционных. В свою очередь, они делятся на подтипы [44].
Наблюдательные исследования бывают описательными, когда описывают какое-либо явление (клиническую картину, заболеваемость, смертность), и аналитическими, когда на основе описательных данных делают вывод о причинных факторах.
Еще исследования бывают ретроспективными, в ходе которых изучают исходы, полученные до начала исследования (по архивным данным), и проспективными, когда исходы у участников наступают в ходе или по завершении исследования.
В зависимости от длительности наблюдения и количества участников, наблюдательные исследования делят на три разновидности:
- Одномоментные эпидемиологические исследования (исследования распространенности) представляют собой, по сути, «моментальный снимок». Их проводят в течение короткого времени. У участников исследования констатируют наличие заболевания и определенных факторов и делают вывод о взаимосвязи между ними.
- Когортные исследования занимают больше времени, они помогают оценить ситуацию в динамике, вклад, который вносят различные факторы в развитие и прогрессирование заболеваний. За испытуемыми наблюдают в течение некоторого времени, исследование может предполагать периодические обследования и осмотры врачей, заполнение опросников и анкет. В конечном итоге регистрируют исходы, например, случаи развития заболеваний, осложнений, выздоровления и смертность.
- Исследование случай—контроль предполагает сравнение людей, страдающих теми или иными заболеваниями, со здоровыми людьми из той же популяции [44–47].
Для нас сейчас наибольший интерес представляет вторая группа — клинические интервенционные исследования. Именно они позволяют наиболее эффективно установить причинно-следственные связи и оценить работу нового препарата на людях. В таких исследованиях большое значение имеют три принципа: плацебо-контроль, рандомизация и двойное ослепление. Поговорим о них подробнее, и тут самое время вспомнить о том, что такое дизайн клинического исследования.
Фундамент, без которого никак
Дизайн клинического исследования — это описание того, как исследование будет проводиться. Важно заранее продумать каждую мелочь. Если дизайн исследования некорректен, вся работа будет загублена на корню.
Принцип собаки Павлова
В своей книге «Лекции о работе больших полушарий головного мозга» Иван Петрович Павлов описал эксперимент, во время которого собакам под кожу вводили морфий. Первой реакцией при этом была рвота, затем наступал сон. Регулярно повторяя процедуру, исследователи добились того, что рвоту у животных вызывало введение под кожу любой индифферентной жидкости [48].
Это явление известно как эффект плацебо. Представителям псевдомедицины оно помогает успешно вести бизнес, а ученым — проверять, обусловлены ли положительные эффекты препарата реальным действием или условным рефлексом, силой внушения. Пациентов делят на две группы, одним дают новое лекарство, другим — «пустышку». Спустя некоторое время оценивают результат. Схема простая, удобная и эффективная, но есть одна сложность. Иногда, если пациент получает вместо препарата плацебо, это приводит к фатальным последствиям. В таких случаях применять плацебо-контроль неэтично. Но есть альтернативы:
- В некоторых случаях исследуемый препарат и плацебо можно назначать в сочетании со стандартным лечением.
- Пациенты из контрольной группы могут получать вместо плацебо другой препарат. Таким образом, исследование превращается в сравнение эффективности двух лекарств. Такой контроль называется активным или позитивным, в отличие от негативного плацебо-контроля. Если исследуемый препарат оказывается эффективнее контрольного, в дальнейшем это можно использовать в маркетинговых целях. Зачастую регулирующие организации требуют в третьей фазе КИ именно такой активный контроль.
- Когда внешний вид двух препаратов при активном контроле сильно различается, прибегают к маскированию. Например, если исследуемый препарат представляет собой таблетки, а контрольный — ингалятор, то пациент и врач могут легко догадаться, что это за лекарство, и ослепления не получится. Поэтому одни пациенты получают лекарство в таблетках и плацебо в ингаляторе, а другие — лекарство в ингаляторе и «пустышку» в таблетках. Таким образом, комбинация препаратов в каждой из двух групп выглядит совершенно одинаково.
- Если других препаратов для лечения заболевания нет или лекарство нужно сравнить с иными методами лечения (например, хирургическим), можно использовать контроль по архивной статистике (исторический контроль). Исходы пациентов, которые получают новый препарат, сравнивают с уже имеющимися статистическими данными [45].
По воле случая
Делить участников исследования на группу лечения и контрольную группу нужно правильно. Крайне утрированный, но наглядный пример: представим себе фармкомпанию, которая решила вывести на рынок новый препарат для улучшения памяти. В исследовании принимают участие 100 пациентов, их поделили на две группы по 50 человек, одним дают чудо-лекарство, другим — таблетки из мела. Так получилось, что в группу лечения попали преимущественно здоровые молодые люди. В контрольной же оказалось много пожилых людей, у некоторых есть первые симптомы болезни Альцгеймера. Вопрос на засыпку: окажется ли новый препарат «эффективнее», чем плацебо?
В реальной жизни, конечно же, ситуация далеко не всегда настолько проста и очевидна . Иногда кажется, что никакой разницы между группами нет, но из внимания ускользают нюансы, в итоге сильно искажающие картину. Зачастую люди, которые проводят исследования, «отбирают» в группы «нужных» участников неосознанно, особенно когда очень хочется получить положительный результат. Интересный пример с крысами и телепатией приводит в своем блоге популяризатор науки Александр Панчин.
О том, почему в клинических исследованиях предпочитают задействовать мужчин, а не женщин, рассказывает статья «Муж и жена — одна сатана?» [81]. — Ред.
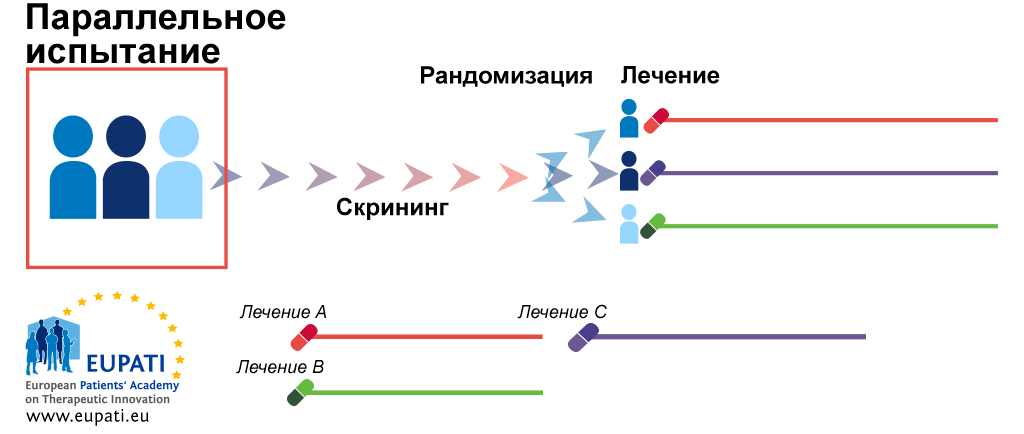
Для того чтобы избежать ошибок, нужно «бросить кости» — распределить участников исследования по группам случайно, вслепую. Этот процесс называется рандомизацией. И она бывает разной (рис. 6) [49]:
- Параллельная рандомизация — самый простой вариант (рис. 6а). Участников делят на две (или больше) группы. Каждой группе делают свои назначения, и они не меняются до конца исследования.
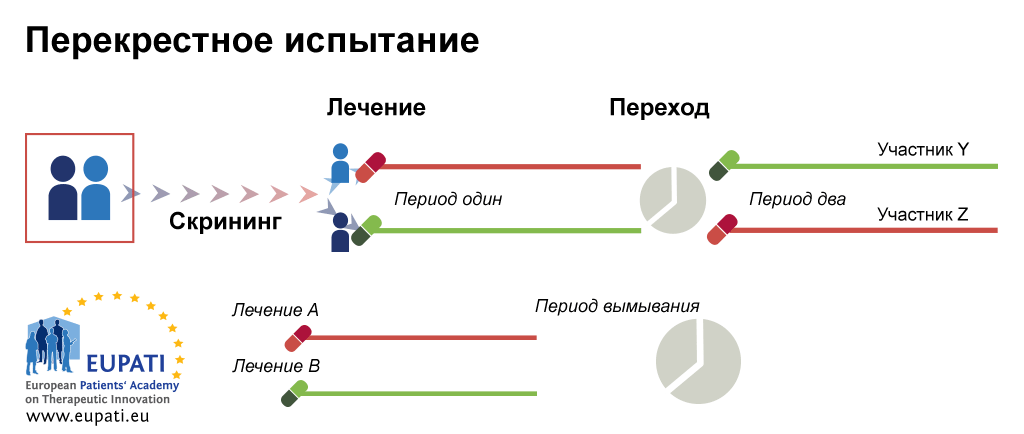
- Перекрестная рандомизация. Снова рассмотрим самый простой случай, когда есть две группы участников: одна получает препарат А, другая — препарат Б. При перекрестной рандомизации на определенном этапе их «меняют местами». Пациентам, прежде получавшим препарат А, начинают вводить препарат Б, а те, кого лечили препаратом Б, отныне получают препарат А (рис. 6б).
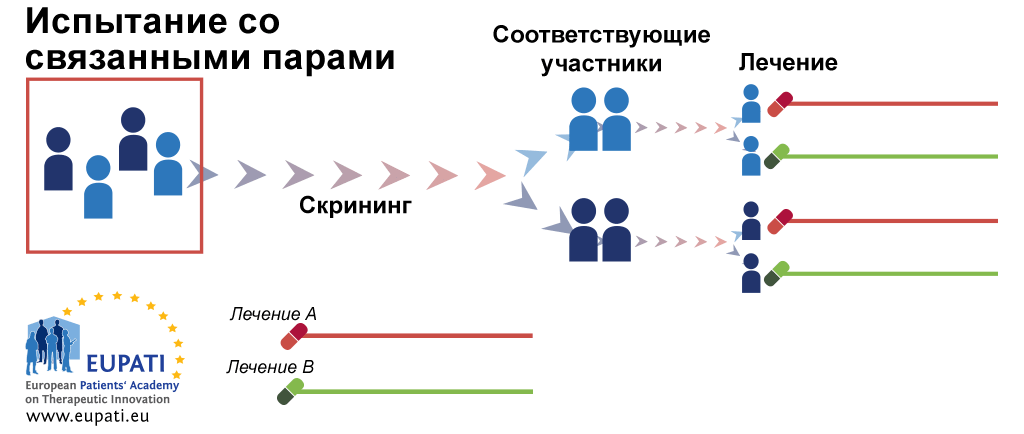
- Рандомизация со связанными парами. В начале участников исследования разбивают на пары, при этом в пару попадают похожие люди. Одному из них случайным образом назначают препарат А, другому — препарат Б (рис. 6в).
- Стратификация — процесс, в ходе которого участников исследования делят на группы, объединенные определенными признаками: возраст, пол, характер питания, образ жизни, вредные привычки. Затем членов каждой группы рандомизируют. Это помогает проверить, как разные виды лечения действуют на людей, объединенных общими признаками.
- Выборочное исследование. Выбирают определенные географические области — например, регион, или город, — в каждой из которых делают выборку участников, затем все выборки объединяют в общую группу.
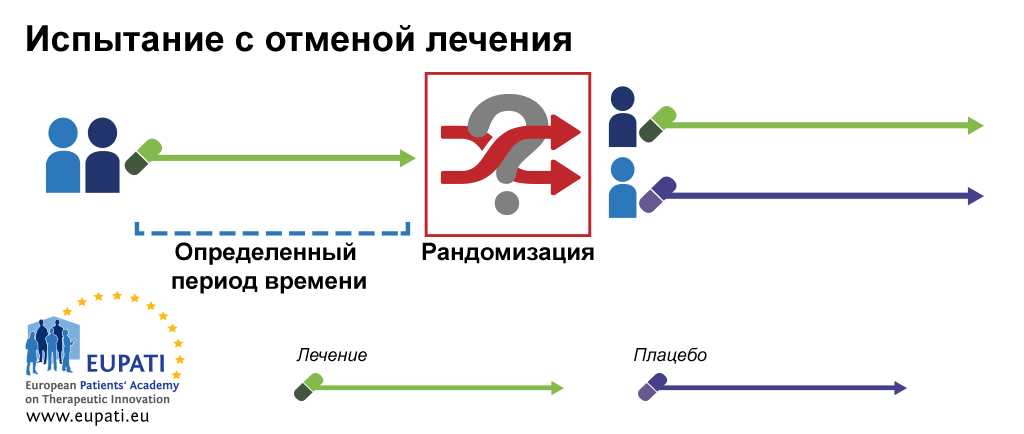
- Исследование с отменой лечения. В течение некоторого времени все участники исследования получают лечение одним препаратам. Затем их рандомизируют, и в одной из групп лечение отменяют (рис. 6г).
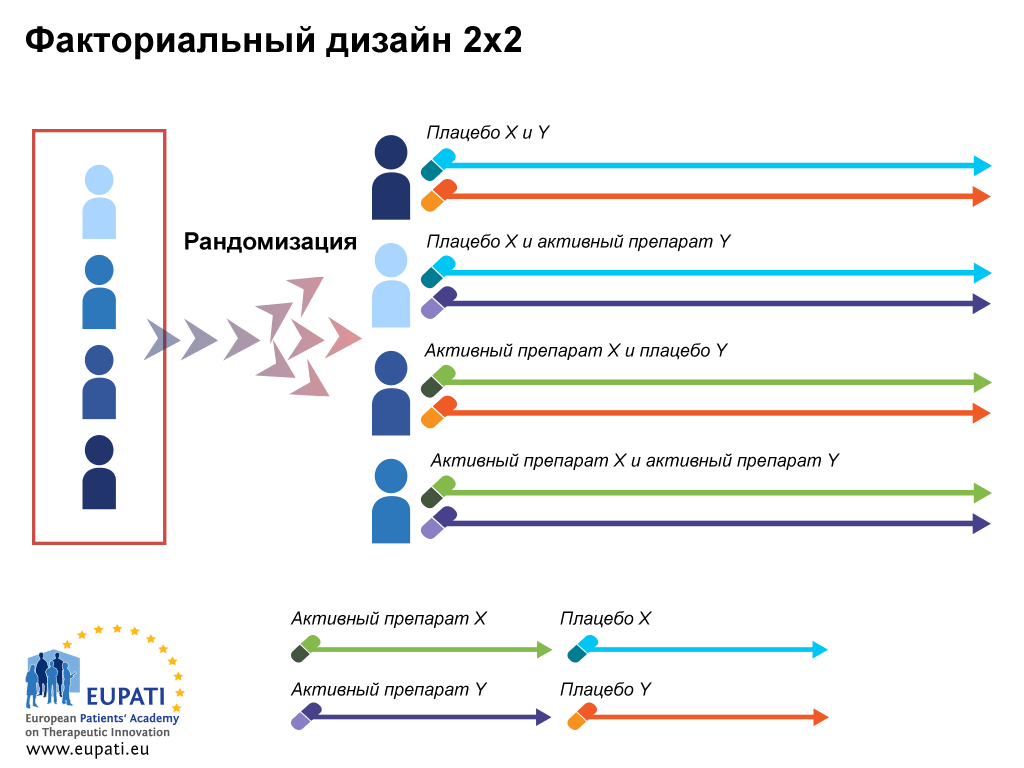
- Факториальный дизайн предполагает исследование с участием разных препаратов. Например, первая группа получает препараты А и Б, вторая — А и В, третья — Б и В. Это дает возможность оценить эффективность комбинированной терапии и взаимодействие между препаратами (рис. 6д).
Действуй как Фемида
От человеческого фактора никуда не спрятаться. Если один пациент знает, что получает новый препарат, а другой в курсе, что ему дают «пустышку», эффект плацебо вполне может сработать в обратном направлении. Этой информацией не должен владеть даже врач, иначе он будет ждать выздоровления пациентов из группы лечения и с грустью поглядывать на пациентов из контрольной группы. Все это может повлиять на результат. Поэтому во время клинических исследований применяют двойной слепой метод. Врач дает пациенту какую-то таблетку, тот ее принимает, и никто не знает, что это такое.
Вообще ослепление бывает трех уровней, выбор зависит от особенностей исследования и возможного влияния разных участников на результат:
- одиночное — «ослеплен» только пациент;
- двойное — «ослеплены» пациент и врач;
- тройное — третьим «ослепленным» становится человек, который собирает и обрабатывает статистические данные [50].
Фазы клинических исследований
Выделяют пять основных фаз клинических исследований (рис. 7). Две из них — 0 и IV — не обязательны. Каждая фаза, по сути, представляет собой отдельное исследование, но одна фаза может подразумевать более одного исследования.
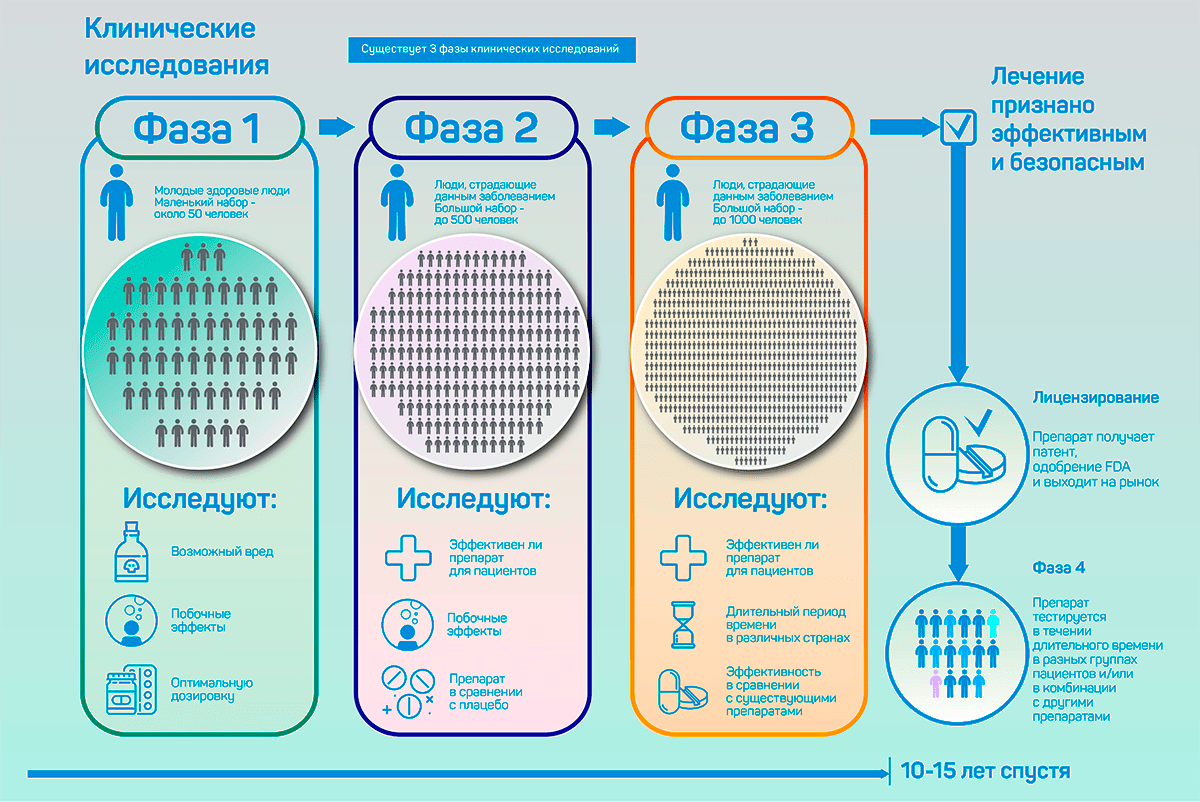
Рисунок 7. Фазы интервенционных клинических исследований.
проект Благотворительного фонда Константина Хабенского, oncobrain.ru
Фаза 0
- Количество участников: обычно менее пятнадцати.
- Продолжительность: несколько дней.
- Цель: оценка фармакокинетики и фармакодинамики препарата [51], [52].
Фазу 0 ввело FDA, чтобы ускорить разработку новых лекарств и на более ранних сроках отсеивать неподходящих кандидатов. Эта фаза имеет некоторые важные особенности. Она требует меньшего объема ДИ по сравнению с фазой I. В исследовании участвует небольшое количество пациентов, они получают субтерапевтические дозы препарата. При этом риск побочных эффектов стремится к нулю, но и терапевтического воздействия тоже не будет. Если препарат окажется эффективным, в фазе 0 пациенты не получат от него пользы.
Фаза 0 помогает быстро разобраться, стоит ли инвестировать средства в дальнейшую работу [51–54].
Фаза I
- Количество участников: обычно несколько десятков.
- Продолжительность: несколько месяцев.
- Цель: выявить максимальную безопасную дозировку [55].
В первой фазе клинического исследования могут участвовать здоровые добровольцы или люди, страдающие каким-либо заболеванием. Сначала участники получают минимальные дозы препарата. Затем, если не наблюдается побочных эффектов, дозы повышают, постепенно доводя до максимально допустимых. Затем проводят исследование с многократными нарастающими дозами, когда каждый испытуемый получает несколько доз препарата. При этом плацебо-контроль не используют.
В ходе фазы I можно изучить фармакодинамику и фармакокинетику, влияние на эффективность и побочные эффекты препарата приемов пищи, других лекарств, сопутствующих заболеваний. Если препарат оказывается достаточно безопасным, он переходит во вторую фазу [53], [54], [56].
По данным FDA, первую фазу КИ успешно проходят 70% препаратов [55].
Фаза II
- Количество участников: от нескольких десятков до нескольких сотен.
- Продолжительность: от нескольких месяцев до двух лет.
- Цель: проверка эффективности и побочных эффектов [55].
Во второй фазе КИ участвуют пациенты, страдающие определенным заболеваниям. Тут, в отличие от первой фазы, как правило, есть и плацебо-контроль, и рандомизация, и двойное ослепление. Нужно проверить, является ли препарат более эффективным по сравнению с плацебо. Увеличение количества участников дает возможность выявить более редкие побочные эффекты, которые не обнаружили в фазе I [53–55], [57].
Согласно данным FDA, лишь 33% препаратов, принявших участие в фазе II, успешно проходят КИ и переходят в следующую фазу [55].
Фаза III
- Количество участников: от нескольких сотен до нескольких тысяч.
- Продолжительность: от года до нескольких лет.
- Цель: подтверждение эффективности и выявление побочных эффектов, которые не были обнаружены на предыдущих стадиях [55].
Третья фаза клинических исследований — самая сложная и дорогостоящая. В ней могут принимать участие тысячи пациентов из разных стран. Все должно быть спланировано до мелочей. В ходе фазы III окончательно подтверждается эффективность и безопасность нового лекарства, по результатам нужно принять решение о том, можно ли выводить препарат на рынок.
Бóльшая часть препаратов на этом этапе терпит неудачу. По данным FDA, третья фаза клинических исследований заканчивается положительным результатом лишь в 25–30% случаев [53–55], [58].
Фаза IV
- Количество участников: обычно несколько тысяч.
- Продолжительность: разная.
- Цель: дополнительная проверка безопасности и эффективности [55].
Четвертая фаза клинических исследований — это постмаркетинговые исследования, их проводят параллельно с активным использованием препарата. Четвертая фаза не обязательна для вывода препарата на рынок, но в некоторых случаях она важна, например, если препарат прошел процедуру ускоренного утверждения (помните иммунопрепараты ниволумаб и пембролизумаб, о которых мы говорили в начале статьи?) [53–55].
Человек — не лабораторная мышь: о чем должны знать участники клинического исследования?
В России пациенты чаще всего узнают о возможности принять участие в клиническом исследовании от лечащего врача. Информацию можно найти в интернете, например, на clinicaltrials.gov и других зарубежных и российских сайтах. Подробнее об этом рассказывается в первой статье цикла, также в ней можно найти информацию об этических моментах. Здесь же мы поговорим о том, насколько важно правильное понимание пациентом процедуры, в которой он решил принять участие.
Обычно на участие в клинических исследованиях людей толкает одна из двух причин (или обе сразу): отсутствие эффективных методов лечения или желание сделать вклад в развитие науки. В любом случае это исключительно добровольное решение. Специалисты, которые будут проводить исследование, обязаны в письменном виде предоставить пациенту информацию о цели КИ, о том, как оно будет проводиться, какое лекарство будет применяться, насколько оно безопасно, и что делать, если возникли побочные эффекты. Все это отражено в особом документе — информированном согласии. По закону каждый участник исследования должен быть застрахован от причинения вреда жизни и здоровью.
Важным моментом является конфиденциальность. Исследователи не имеют права раскрывать личную информацию испытуемых. Любой пациент на любой стадии может отказаться от дальнейшего участия в исследовании, и он не обязан указывать причину.
Эти моменты регулирует Федеральный закон от 12.04.2010 г. № 61-ФЗ (ред. от 28.12.2017 г.) «Об обращении лекарственных средств» [34].
В настоящее время проблема набора участников для клинических исследований остро стоит во всем мире. Эксперты ведут просветительскую работу, пытаются понять факторы, которые заставляют людей отказываться от участия в КИ. Например, с этой целью в США создан Консультативный комитет по вовлечению пациентов (PEAC) [59].
Причины, по которым люди не хотят участвовать в клинических исследованиях, бывают разными. Кому-то не хочется чувствовать себя «лабораторной мышкой», кто-то боится, что непроверенный препарат навредит. Для пациента важно взвесить все «за» и «против», посоветоваться с родственниками, врачами.
Основные отличия клинического исследования от обычного курса лечения представлены в таблице на сайте FDA, мы приведем ее частично здесь [60].
| Клиническое исследование | Обычный курс лечения | |
|---|---|---|
| Цель | Изучить свойства, эффективность и безопасность нового препарата. | Вылечить пациента, уменьшить симптомы, повысить качество жизни. |
| Продолжительность | Определяется протоколом исследования, но пациент может отказаться от дальнейшего участия в любое время. | В зависимости от заболевания и индивидуальных особенностей пациента. |
| Согласие пациента | Обязательно информированное согласие, подписанное пациентом. | Не всегда. |
| Эффективность | Эффективность и безопасность не доказаны. Пациент может попасть в контрольную группу и получать плацебо. Новый препарат может оказаться неэффективным, привести к неизвестным побочным эффектам. | Применяют препараты, для которых уже доказана безопасность и эффективность. Врач ожидает определенного эффекта. |
| Для кого доступно? | Люди, соответствующие критериям выборки. | Люди, у которых есть показания. |
Уровни доказательности — что это такое?
Не все результаты клинических исследований одинаково надежны. Для того чтобы их ранжировать, были разработаны уровни доказательности. От того, насколько убедительно доказана эффективность и безопасность препарата, зависит его дальнейшая судьба. Например, в России это влияет на включение препаратов в официальные перечни [61].
Первая система уровней доказательности предложена в 1979 году Канадской целевой группой по периодическим медицинским осмотрам. Затем неоднократно подвергалась модификациям.
Уровни доказательности, принятые на территории России, описаны в Постановлении Правительства РФ от 28.08.2014 г. № 871 (ред. от 12.06.2017 г.) «Об утверждении Правил формирования перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи» (табл. 2) [61].
| Характеристика исследований | Уровни доказательности результатов | Шкала оценки (баллы) |
|---|---|---|
| Систематические обзоры и метаанализы | I | 10 |
| Рандомизированные слепые клинические исследования | II | 9 |
| Рандомизированные открытые клинические исследования | II | 8 |
| Квазиэкспериментальные исследования | III | 7 |
| Когортные исследования | IV | 6 |
| Исследования «случай-контроль» | V | 5 |
| Описание случаев и серии случаев | VI | 4 |
| Мнение экспертов | VII | 3 |
Кроме того, используют шкалу оценки уровней убедительности доказательств клинических исследований (табл. 3) [61]:
| Уровень убедительности доказательств | Характеристика показателя | Шкала оценки (баллы) |
|---|---|---|
| A | Доказательства убедительны: имеются веские доказательства предлагаемого утверждения | 3 |
| B | Относительная убедительность доказательств: имеются достаточные доказательства в пользу того, чтобы рекомендовать предложенный лекарственный препарат для включения (исключения) в соответствующий перечень лекарственных препаратов | 2 |
| C | Достаточных доказательств нет: имеющихся доказательств недостаточно для вынесения рекомендации, но рекомендации могут быть даны с учетом иных обстоятельств | 1 |
В обеих таблицах есть баллы — их используют для подсчета интегральной количественной оценки качества клинического исследования. Для того чтобы получить итоговую оценку, нужно разобраться, какой строчке из первой и второй таблицы соответствует исследование, и перемножить баллы. Например, при уровне доказательности результатов II и уровне убедительности доказательств A общая оценка составит 9 × 3 = 27. Для того чтобы препарат был включен в официальный перечень, он должен получить не менее 18 баллов. В случае с препаратами для лечения орфанных заболеваний порог снижен до 12 баллов [61].
Защита на 20 лет
Все новые лекарства защищены патентом — документом, который дает производителю эксклюзивное право на создание и продажу препарата. В России выдачей патентов занимается Федеральная служба по интеллектуальной собственности (Роспатент), в США — Ведомство по патентам и товарным знакам (United States Patent and Trademark Office, PTO, или USPTO).
Запатентовать можно химическую формулу действующего вещества, способ его получения, способ применения, фармацевтическую композицию, способ лечения с применением нового препарата [71–73].
Патент действует в течение 20 лет. Для компании, которая разработала новый препарат, это золотое время. Никто кроме нее не может производить запатентованное лекарство. По истечении 20 лет препарат переходит в общественное достояние, отныне его аналоги — дженерики — может выпускать любая другая фармкомпания.
Наконец-то в аптеки и больницы
Патент защищает новое лекарство от копирования, но еще не дает права на его продажу. Для этого нужно пройти процедуру регистрации. На территории Европейского союза функции регистрирующего органа выполняет Европейское агентство лекарственных средств (EMA), в США — FDA.
Для того чтобы пройти регистрацию нового препарата в России, нужно подать заявку в Министерство здравоохранения. Процесс регулируется Федеральным законом «Об обращении лекарственных средств». Максимальный срок рассмотрения заявки — 160 дней. Если производитель решит выпускать препарат в виде другой лекарственной формы или в комбинации с другими лекарственными препаратами, процесс регистрации придется проходить снова.
И это еще не все
Новый препарат поступил в аптеки, теперь врачи могут назначать его пациентам, но на этом работа исследователей зачастую не заканчивается. Четвертая фаза клинических исследований — постмаркетинговая — может продолжаться неограниченно долго. Цели бывают разными:
- Мониторинг безопасности препарата и выявление побочных эффектов, которые не были обнаружены в предыдущих фазах. Такая деятельность называется фармаконадзором (pharmacovigilance). Теперь препарат принимает гораздо больше людей, чем во время клинических исследований. Многие пациенты страдают сопутствующими заболеваниями, принимают другие лекарства, а значит, могут всплыть новые подробности, не выявленные ранее.
- Улучшение свойств препарата, выпуск его в новой форме (например, специально для детей), включение в состав комбинированного средства.
- Расширение показаний — препараты могут быть эффективны против болезней, при которых не применялись ранее. Например, многие таргетные препараты и иммунопрепараты изначально были одобрены для лечения одного типа рака, а в дальнейшем они прошли клинические исследования эффективности против других видов злокачественных опухолей. Но, наверное, самое интересное явление — когда препарат «перекочевывает» в другую сферу медицины (см. врезку ниже). Это хороший способ быстро и без лишних затрат получить новое лекарство, не тратя времени и сил на разработку «с нуля» [73].
Сейчас рынок клинических исследований активно развивается и усложняется. В то время как одни страны и представители Большой фармы [80] могут себе позволить регулярно создавать совершенно новые препараты, другие предпочитают специализироваться на дженериках. Об основных игроках и особенностях рынка клинических исследований в разных странах пойдет речь в следующих статьях цикла.
Литература
- С миру по нитке: как соединились компоненты клинического исследования;
- Making a medicine. Step 1: pre-discovery. (2015). EUPATI;
- Step 1: discovery and development. (2018). FDA;
- От медицины для всех — к медицине для каждого!;
- Моноклональные антитела;
- Т-клетки — марионетки, или как перепрограммировать Т-лимфоциты, чтобы вылечить рак;
- Иммуностимулирующие вакцины;
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Fact sheets on cancer. (2018). WHO;
- FDA approves Opdivo. (2014). Drugs.com;
- 12 методов в картинках: иммунологические технологии;
- Meredith K. Chuk, Jennie T. Chang, Marc R. Theoret, Emmanuel Sampene, Kun He, et. al.. (2017). FDA Approval Summary: Accelerated Approval of Pembrolizumab for Second-Line Treatment of Metastatic Melanoma. Clin Cancer Res. 23, 5666-5670;
- Краткая история открытия и применения антител;
- С миру по нитке: как соединились компоненты клинического исследования;
- Вирус Зика — глобальная угроза?;
- Rewards and incentives for paediatric medicines. European Medicines Agency;
- Шустиков В. (2016). Фарминновации — опыт BigPharma и российские инициативы. AstraZeneca;
- Making a medicine. Step 2: target selection. (2015). EUPATI;
- Weltman J.K. (1987). The 1986 Nobel Prize for Physiology or Medicine awarded for discovery of growth factors: Rita Levi-Montalcini, M.D., and Stanley Cohen, Ph.D. N. Engl. Reg. Allergy Proc. 8, 47–48;
- Повелевающая ростом;
- Hongtao Zhang, Alan Berezov, Qiang Wang, Geng Zhang, Jeffrey Drebin, et. al.. (2007). ErbB receptors: from oncogenes to targeted cancer therapies. J. Clin. Invest.. 117, 2051-2058;
- M. H. Cohen. (2003). FDA Drug Approval Summary: Gefitinib (ZD1839) (Iressa(R)) Tablets. The Oncologist. 8, 303-306;
- Irène R. Chassagnon, Claudia A. McCarthy, Yanni K.-Y. Chin, Sandy S. Pineda, Angelo Keramidas, et. al.. (2017). Potent neuroprotection after stroke afforded by a double-knot spider-venom peptide that inhibits acid-sensing ion channel 1a. Proc Natl Acad Sci USA. 114, 3750-3755;
- The true history of the discovery of penicillin by Alexander Fleming. (2003). Biomedical Scientist;
- Победитель бактерий;
- Step 2: preclinical research. (2018). FDA;
- Making a medicine. Step 3 and 4: choosing a molecule or lead. (2015). EUPATI;
- Making a medicine. Step 5: non-clinical safety testing. (2015). EUPATI;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- In vivo — in vitro — in silico;
- 12 методов в картинках: «сухая» биология;
- Виртуальные тропы реальных лекарств;
- What is GMP. ISPE;
- Федеральный закон от 12.04.2010 №61-ФЗ (ред. от 28.12.2017) «Об обращении лекарственных средств». Статья 43. Права пациентов, участвующих в клиническом исследовании лекарственного препарата для медицинского применения;
- Research and development. EMA;
- Clinical trials in Russia. (2017). Atlant Clinical;
- Постановление Правительства Российской Федерации от 3 сентября 2010 г. №683 г. Москва «Об утверждении Правил аккредитации медицинских организаций на право проведения клинических исследований лекарственных препаратов для медицинского применения». (2010). «Российская газета»;
- Reymond E. (2008). CRO market to reach $24bn by 2010. Outsourcing-pharma.com;
- Miseta E. (2016). Clinical outsourcing market to see continued growth through 2020. Clinical Leader;
- Российские фармкомпании доверяют CRO только 14% клинических исследований. (2014). «Ремедиум»;
- Azzam Al Jundi. (2016). Protocol Writing in Clinical Research. JCDR;
- Федеральный закон от 12.04.2010 №61-ФЗ (ред. от 28.12.2017) «Об обращении лекарственных средств». Статья 39. Решение о проведении клинического исследования лекарственного препарата для медицинского применения;
- Приказ Министерства здравоохранения и социального развития Российской Федерации (Минздравсоцразвития России) от 26 августа 2010 г. N 753н г. Москва «Об утверждении порядка организации и проведения этической экспертизы возможности проведения клинического исследования лекарственного препарата для медицинского применения и формы заключения совета по этике». (2010). «Российская газета»;
- What are the different types of clinical research? (2018). FDA;
- D. M. Hartung, D. Touchette. (2009). Overview of clinical research design. American Journal of Health-System Pharmacy. 66, 398-408;
- Основы доказательной медицины / Под ред. академика РАМН, профессора Р.Г.Оганова. Учебное пособие. М.: «Силицея-Полиграф», 2010. — 136 с.;
- ManinderSingh Setia. (2016). Methodology series module 3: Cross-sectional studies. Indian J Dermatol. 61, 261;
- Павлов И.П. Лекции о работе больших полушарий головного мозга. М.: «Эксмо», 2017. — 480 с.;
- Clinical trial designs. (2015). EUPATI;
- Shobha Misra. (2012). Randomized double blind placebo control studies, the "Gold Standard" in intervention based studies. Indian J Sex Transm Dis. 33, 131;
- Shivaani Kummar, Larry Rubinstein, Robert Kinders, Ralph E. Parchment, Martin E. Gutierrez, et. al.. (2008). Phase 0 Clinical Trials: Conceptions and Misconceptions. The Cancer Journal. 14, 133-137;
- Margot J. Fromer. (2006). FDA Introduces New Phase 0 for Clinical Trials. Oncology Times. 28, 18-19;
- Phases of clinical trials. NCCN;
- What are the phases of clinical trials? (2017). American Cancer Society;
- Step 3: clinical research. (2018). FDA;
- Making a medicine. Step 6: phase I — Proof of mechanism. (2015). EUPATI;
- Making a medicine. Step 7: phase II — Proof of concept. (2015). EUPATI;
- Making a medicine. Step 8: confirmatory studies. (2015). EUPATI;
- FDA efforts to increase the number of clinical trial participants. (2017). Atlant Clinical;
- Clinical research versus medical treatment. (2018). FDA;
- Постановление Правительства Российской Федерации от 28 августа 2014 г. №871 «Об утверждении правил формирования перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи»;
- Федеральный закон от 02.01.2000 №29-ФЗ (ред. от 13.07.2015) «О качестве и безопасности пищевых продуктов»;
- Dietary supplements: what you need to know. (2017). FDA;
- Невинная И. (2014). ФАС предлагает приравнять БАДы к лекарствам. «Российская газета»;
- Evidence on the effectiveness of homeopathy for treating health conditions. (2015). NHMRC information paper;
- Homeopathic products and practices. (2017). EASAC;
- В защиту науки. Бюллетень / составители Александров Е.Б. и Сергеев А.Г.; Комиссия РАН по борьбе с лженаукой и фальсификацией научных исследований. Москва, 2018. Бюллетень № 21. М.: «ПРОБЕЛ-2000», 2018. — 140 с.;
- ВОЗ опровергла слова замглавы Минздрава о том, что «гомеопатия признается официально». (2017). Meduza;
- Homeopathic products. (2018). FDA;
- О лженаучности гомеопатии. (2017). Меморандум №2 Комиссии РАН по борьбе с лженаукой и фальсификацией научных исследований;
- Лисовская Л. (2017). Патентование лекарственных препаратов и БАД. «Зуйков и партнеры»;
- Frequently asked questions on patents and exclusivity. (2018). FDA;
- Making a medicine. Step 10: life-cycle management. (2015). EUPATI;
- Тарловская Е.И. (2008). Генерики и оригинальные препараты: взгляд практического врача. РМЖ. 5, 333;
- Паперная Г. (2016). Бюджетная копия. «РБК»;
- Wilson J. (2013). Viagra: the little blue pill that could. CNN;
- Lee-Hwa Tai, Almohanad A. Alkayyal, Amanda L. Leslie, Shalini Sahi, Sean Bennett, et. al.. (2018). Phosphodiesterase-5 inhibition reduces postoperative metastatic disease by targeting surgery-induced myeloid derived suppressor cell-dependent inhibition of Natural Killer cell cytotoxicity. OncoImmunology. 7, e1431082;
- A. A. Armour, C. L. Watkins. (2010). The challenge of targeting EGFR: experience with gefitinib in nonsmall cell lung cancer. European Respiratory Review. 19, 186-196;
- Грызун особого назначения;
- Who Are the Players in the Pharmaceutical Industry (Big Pharma)? (2016). Desert Hope;
- Муж и жена — одна сатана?.