
С миру по нитке: как соединились компоненты клинического исследования
07 мая 2018
С миру по нитке: как соединились компоненты клинического исследования
- 4830
- 11
- 19
За любым клиническим исследованием стоит сложная система взаимодействия ученых, врачей, пациентов, фармкомпаний и государства.
-
Автор
-
Редактор
-
Рецензент
Сейчас невозможно представить, как в прошлом медицина справлялась с лечением больных без клинических испытаний лекарств. Тем не менее рандомизированные плацебо-контролируемые исследования — лишь недавнее изобретение человечества, которому нет и века. Более тысячи лет потребовалось для формирования их методологической и этической составляющих. Эта статья открывает цикл публикаций о клинических исследованиях — и в ней вы узнаете о том, как рандомизированные контролируемые клинические исследования стали такими, какими мы их знаем сегодня.
Клинические исследования

В статьях спецпроекта мы подробно расскажем о том, что такое клинические исследования, кто и как их проводит и с какими трудностями можно столкнуться при выводе нового лекарства на фармацевтический рынок.
Независимый рецензент спецпроекта — Алексей Водовозов, врач-терапевт высшей категории, медицинский журналист. Регулярно выступает с научно-популярными лекциями и ведёт блог «Смотровая военврача».
Партнер спецпроекта — компания «Атлант Клиникал»: международная контрактно-исследовательская организация, занимающаяся проведением клинических исследований.
У одного участника диагностирована смерть мозга и еще пятеро госпитализированы — так прошли клинические исследования обезболивающего средства на основе марихуаны от португальской компании Bial во французской лаборатории Biotrial. Работу тут же прервали, и Агентство по лекарственным средствам Франции (ANSM) начало расследование. Этот трагической инцидент 2016 года отнюдь не первый — и наверняка не последний — в истории создания новых препаратов. Но, к счастью, сейчас такие случаи, как в лаборатории Biotrial, — большая редкость.
Так что же такое клиническое исследование?
Согласно определению Международного комитета редакторов медицинских журналов (International committee of medical journal editors), клиническое исследование/испытание (КИ) — это любой исследовательский проект, в котором проспективно разделяют участников на опытную и контрольную группы для изучения причинно-следственной связи между медицинским вмешательством и реакцией на него организма человека [1]. Проведение КИ строго регулируется и контролируется, протоколы исследований многократно выверяются. Каждая фаза протокола требует много времени и ресурсов, а также динамического сотрудничества не только ученых, врачей и участников исследования, но и зачастую фармкомпаний и государств.
Термин «клиническое исследование» объединяет множество дизайнов эксперимента. Две самые широкие категории — это обсервационные (наблюдательные) и клинические интервенционные исследования. Первые часто ретроспективны и используются для установления причинно-следственной связи между уже оказанным воздействием и результатом. Исследования же из второй группы, напротив, разрабатываются для оценки эффекта будущего лечения или профилактических мер на проявления заболевания [2]. Именно в нее попадают рандомизированные плацебо-контролируемые исследования (randomized controlled trials, RCTs), и о ней в основном пойдет речь в этой статье.
Интервенционному клиническому исследованию предшествует доклиническое изучение препарата в лаборатории, в том числе и на животных. После доклинических исследований проводят три основные фазы изучения препарата на людях, которые и являются интервенционными клиническими исследованиями. Наконец, после выхода лекарства на рынок, проводят мониторинг воздействия препарата, неограниченный по времени, — четвертая фаза клинического исследования [3]. Краткое описание этапов дано на рисунке 1, подробнее же о них будем рассказывать в следующей статье цикла.
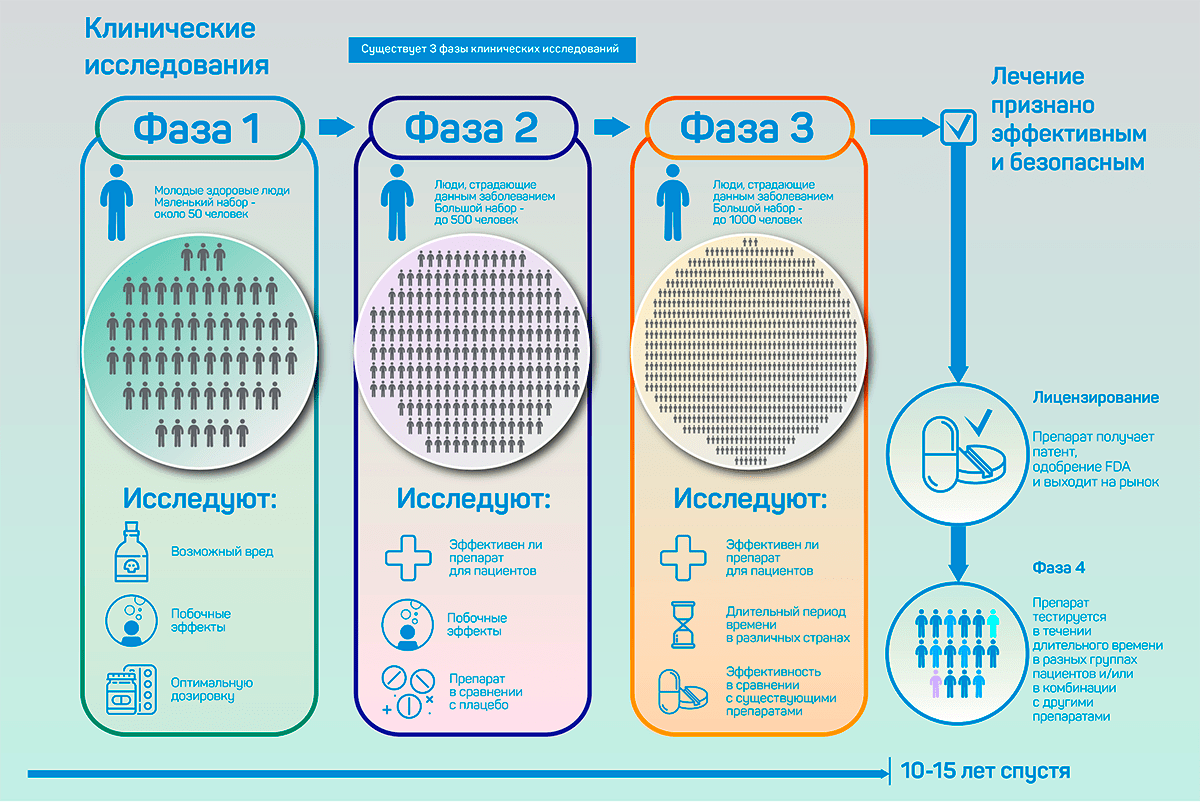
Рисунок 1. Фазы интервенционных клинических исследований.
проект Благотворительного фонда Константина Хабенского, oncobrain.ru
Сразу разрешим законный вопрос: неужели нельзя обойтись опытами на животных и не прибегать к проверке препарата на людях? Нет, нельзя, поскольку, как наглядно показала талидомидовая трагедия, о которой пойдет речь ниже, воздействие одного и того же препарата на представителей разных видов различается. Без тестирования медикаментов на людях нельзя сказать о безопасности и эффективности их применения.
Принципы доказательной медицины и направленного создания лекарственных препаратов — драг-дизайна (о котором мы подробно писали в отдельных статьях на «Биомолекуле» [4], [5]) — кажутся неотъемлемой частью медицины. Но на самом деле клинические исследования в том виде, как мы их знаем, едва отошли от своей колыбели, если сравнивать их с медицинской наукой в целом. Чтобы сформироваться в своем сегодняшнем виде, «золотому стандарту» — рандомизированным плацебо-контролируемым исследованиям, проведенным по этическим нормам, — понадобилось много веков. За это время они вобрали в себя понятия «рандомизация», «плацебо», «группы контроля», «гарантии безопасности участников». Этому способствовали случайные открытия, пошагово продуманные методики, альтруистические порывы, негуманные эксперименты ХХ века, жажда заработать на продажах и халатное отношение к опытам. О непростой истории клинических исследований и пойдет речь ниже.
Как же человечество пришло к разработке безопасного и эффективного тестирования лекарств?
История клинических исследований: библейская диета, врач из романов Дюма-отца, множество войн и... цитрусы
Первое описанное интервенционное клиническое исследование было посвящено насущному и по сей день вопросу — пользе определенного рациона: хуже ли овощи и вода ежедневной пищи с царского стола и вина? Согласно записям, испытание длилось 10 дней, а участники были разделены на контрольную и опытную группы. Найти же его подробное описание вы можете в... Ветхом завете. Книга пророка Даниила начинается рассказом о том, как Даниил и его братья отказались от богатых царских яств и оказались здоровее тех, кто питался, как царь Навуходоносор:
Тогда сказал Даниил Амелсару, которого начальник евнухов приставил к Даниилу, Анании, Мисаилу и Азарии:
сделай опыт над рабами твоими в течение десяти дней; пусть дают нам в пищу овощи и воду для питья;
и потом пусть явятся перед тобою лица наши и лица тех отроков, которые питаются царскою пищею, и затем поступай с рабами твоими, как увидишь.
Он послушался их в этом и испытывал их десять дней.
По истечении же десяти дней лица их оказались красивее, и телом они были полнее всех тех отроков, которые питались царскими яствами.
Тогда Амелсар брал их кушанье и вино для питья и давал им овощи.
Более-менее современный взгляд на медицинские опыты был у известного персидского врача Авиценны. В «Каноне врачебной науки», законченном в 1025 году, он описал метод тестирования лекарств [6], [7]:
- Лекарство не должно содержать случайных примесей.
- Его следует использовать при простой, а не многокомпонентной болезни.
- Лекарство необходимо проверить на двух противоположных типах болезни, поскольку иногда лекарство исцеляет одну болезнь своими основными свойствами, а вторую — случайными эффектами.
- Характеристики лекарства должны соответствовать силе болезни.
- Необходимо отследить время действия лекарства, чтобы не спутать его действительный эффект и случайность.
- Эффект лекарства должен прослеживаться всегда или хотя бы в большинстве случаев, иначе это — случайность.
- Проверку следует проводить в человеческом теле, поскольку проверка на львах и конях ничего не скажет о действии лекарства на человека.
Во времена Ренессанса методика клинических исследований пришла из неожиданного источника. Небезызвестный итальянский поэт Петрарка (1304–1374) очень не любил докторов. Он писал своему не менее знаменитому другу Боккаччо (1313–1375), как один прославленный врач утверждал, что «если сто или тысяча людей одного возраста, темперамента и привычек, совместно с одинаковой окружающей средой, подверглись бы одновременно нападению одной и той же болезни и если бы одна половина следовала предписаниям врачей, практикующих в наши дни, а другая половина бы не принимала никаких лекарств, но полагалась на естественные инстинкты и свое собственное усмотрение, то я не сомневаюсь, что многие из первой половины бы умерли и что многие из второй половины избежали бы смерти». Чем не модель эксперимента?
С переводом этого высказывания с латыни на французский и в итоге на английский случилось много путаницы [8], [9]. Всегда находились индивидуумы, которые, намеренно или нет, чуть меняли смысл письма. Догадаться, какая же половина понесет бóльшие потери, было невозможно. Любопытных отсылаю к чтению литературы.

Рисунок 2. Амбруаз Паре, выдающийся французский медик 16 века. Картина маслом.
Первым задокументированным клиническим исследованием в истории считают эксперимент Амбруаза Паре (рис. 2), провести который его заставили обстоятельства. Будучи французским военным хирургом, он применял стандартную для своего времени практику — прижигал огнестрельные раны от аркебуз кипящим маслом [1]. Считалось, что порох ядовит, и масло нивелирует отравляющее действие. В реальности же, конечно, его применение больше приносило вред, чем пользу.
Как писал Паре, у него закончилось масло, и ему пришлось применить вместо него смесь из яичных желтков, масла розы и скипидара: «В ту ночь я не мог спать спокойно, опасаясь, что из-за отсутствия прижигания я найду раненых, для которых я не использовал масло, умершими из-за отравления. Я рано поднялся, чтобы навестить их, — и, превзойдя все мои надежды, /.../ их раны не были опухшими и воспаленными». Те же, кому хватило масла, чувствовали себя гораздо хуже и мучились от боли [6]. По результатам такого невольного эксперимента французский врач больше никогда не применял прижигание маслом при огнестрельных ранениях.
Паре, однако, знаменит не только этой историей. Он был придворным врачом и многое сделал для развития медицины — о нем даже можно прочесть в нескольких романах Дюма-отца [10]!
История сохранила и упоминание первого исследования на платной основе. Автор известного дневника о жизни Лондона в период Реставрации Стюартов Самуэль Пипс задокументировал, что 21 ноября 1667 года «бедный и развратный человек» получил деньги от одного колледжа за то, чтобы ему перелили овечью кровь. В итоге вроде бы здоровье реципиента не пострадало [11]. (Об истории переливания крови и противостоянии Англии и Франции можно почитать в «Газете.ру» [12].)
Следующая веха в истории клинических исследований — пожалуй, самый известный эпизод в ней. Это первое продуманное преднамеренное испытание лечения 1747 года, в котором было несколько опытных групп. Как часто происходит и сейчас, немедленному внедрению лечения в практику помешал денежный вопрос. Главными участниками этой истории стали цинга, цитрусы и Джеймс Линд — шотландский военно-морской хирург.

Рисунок 3. Титульная страница сочинения Джеймса Линда: «Трактат о цинге. В трех частях. Содержит исследование природы, причины и излечения этого заболевания. Вместе с критическим и хронологическим взглядом на то, что было ранее опубликовано по этой теме. Написана Джеймсом Линдом. Эдинбург: Отпечатано Сэндсом, Мюрреем и Кокраном для А. Кинкейда и А. Дональдсона».
Тысячи британских (и не только) моряков ежегодно погибали от страшной болезни — цинги. То, что ее вызывает недостаток витамина С, известно, конечно, еще не было — это открыли только в 1932 году [13].
Линд подошел к вопросу как любой современный ученый перед новым экспериментом: начал с изучения литературы. Так он выявил шесть предложенных методов борьбы с цингой: разведенная серная кислота, уксус, сидр, морская вода, цитрусовые и мускатный орех. Кроме того, он изучил и опыт членов Общества военно-морской службы (Society of naval services), сталкивавшихся с цингой лично.
Двенадцать больных цингой матросов отделили от остальной команды и перевели в обособленное помещение. Из них составили 6 групп по два человека. Дополнительно к обычному рациону им выдавали продукты, о которых Линд нашел информацию в книгах. Оказалось, что два апельсина и один лимон в день творят чудеса: всего за шесть суток они позволили больным встать на ноги и даже отчасти вернуться к работе. За две недели лечения остальными средствами такого добиться не удалось. Сидр чуть уменьшил слабость и подлечил десны. Серная кислота позволила немного улучшить состояние ротовой полости, но не повлияла на остальные симптомы цинги. Оставшиеся методы очевидно не сработали [1]. Результаты опыта и обработку литературных данных Джеймс Линд описал в книге «Трактат о цинге» 1753 года (рис. 3).
К сожалению, экономические реалии никто не отменял: цитрусы были дороги и малодоступны. Из-за этого их не удалось широко внедрить в рацион моряков еще 40 лет [14].
Работа Джеймса Линда оценена по заслугам и широко известна. Например, его портрет поместили на почтовую марку (рис. 4), а Королевский колледж врачей учредил библиотеку его имени в честь 250-летия публикации «Трактата о цинге» [6].

Рисунок 4. Марка в честь Джеймса Линда и его опытов по поиску лечения цинги.
Постепенно все больше современных характеристик КИ входило в обиход врачей. Например, слово «плацебо» появилось в медицинской литературе в начале 19 века. Согласно медицинскому словарю Хупера 1811 года, это определение для любого лекарства, нужного для того, чтобы угодить пациенту, а не принести ему реальную пользу [6]. Первое же исследование с использованием опытной группы и группы, получающей плацебо, провел Остин Флинт в 1863 году. При сравнении двух групп оказалось, что хоть лечи ревматическую лихорадку тогдашними методами, хоть не лечи, симптомы постепенно проходят не из-за медицинского вмешательства, а естественным путем [1].
Примерно в то же время французский физиолог Клод Бернар агитировал коллег применять экспериментальные методы и научный подход в медицине, а не бездумно использовать традиционное лечение [15].
Время менялось. Стало очевидным, что старые методы не всегда (мягко говоря) эффективны, и требуется предъявлять более строгие критерии к медицинским исследованиям. Больницы расширились, выяснилась роль микробов в патогенезе болезней, появились новые области биологии — и разрослась индустрия, занимающаяся лекарственными агентами. Назрела острая необходимость в борьбе с мошенниками и в новых методах проверки эффективности лекарств [16].
Следующий важнейший этап истории КИ — это 1943–1944 годы, первое двойное слепое исследование: когда ни исследователи, ни пациенты не знали, в какую группу определены участники и получали ли они настоящее лечение [1]. Однако с этим экспериментом связана современная история.

Рисунок 6. Новость в Sunday Express 31 октября 1943 года об эффективности патулина в борьбе с простудой оказалась очередной газетной уткой.
Совет медицинских исследований (Medical research council, MRC) Великобритании в 1940-х годах изучал, хорош ли микотоксин патулин, выделенный из Penicillium patulinum, для лечения простуды.
31 октября 1943 года газета Sunday Express опубликовала громкую новость: найдено новое средство для лечения простуды (рис. 6)! Полученное из плесени, оно убивает микроорганизмы в носу, на языке и в гортани. Как утверждала газетная статья, пресс-секретарь MRC сообщил газете, что положительные результаты исследования будут вскорости обнародованы.
Однако на самом деле результаты большого исследования, опубликованные позже, оказались отрицательными. Патулин не оправдал возложенных на него надежд, а статья Sunday Times оказалась fake news.
Как написал Артур Мортимер из Управления медицинских поставок в министерстве снабжения (Directorate of medical supplies in the Ministry of supply) в письме коллеге, «заявление в Sunday Express было столь же точным, как и большинство новостей в этой газете. /.../ название газеты, ее стоимость и дата выхода — единственные верные данные, которые в ней приведены» [17].
Первое рандомизированное контролируемое исследование не заставило себя долго ждать. Случайное распределение участников в опытную и контрольную группы помогает не только добиться однородности самих групп, но и избежать случайной или предумышленной фальсификации результатов. Ведь кто-то может определить более больных пациентов в группу контроля, а более здоровых — в группу получающих лекарство...
Сама идея рандомизации (случайного распределения) появилась на пару десятков лет раньше, но полноценно воплотилась в жизнь только в 1946 году. Опять Великобритания, опять MRC. Организация поручила Остину Брэдфорду Хиллу (Austin Bradford Hill) и Филиппу Харту (Philip Hart) исследовать действие антибиотика стрептомицина на лечение туберкулеза. На основании случайной последовательности чисел они разделили участников на две группы: опытную S (стрептомицин + постельный режим) и контрольную C (только постельный режим). Информация о распределении была неизвестна ни исследователям, ни координаторам исследования в разных госпиталях. Пациенты же из контрольной группы до определенного момента вообще не знали, что принимали участие в эксперименте, — их просто лечили по всем стандартам того времени [6]. Этот эксперимент и подробное описание рандомизации, опубликованные в 1948 году, были восприняты некоторыми как начало «новой эры медицины» [1].
Наконец, важным пунктом в формировании исследования лекарств в сегодняшнем виде стала громкая трагедия, связанная с талидомидом (рис. 7). Его рекламировали как успокаивающее и снотворное. Производитель в США Chemie Grünenthal сфокусировал рекламу на том, что средство помогает женщинам справиться с неприятными симптомами беременности, и добился крайней популярности. Проверки безопасности были, как выяснилось, недостаточны: полноценно провели только исследования на крысах. Талидомид оказался сильнейшим тератогеном — веществом, вызывающим дефекты развития плода. В Европе, Австралии и Японии около 10 000 детей родились с мальформациями (пороками развития, проявляющимися в виде деформации органов) конечностей. Препарат запретили для широкого использования в большинстве стран в 1961 году.
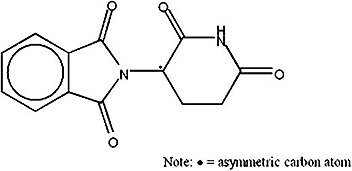
Рисунок 7. Структура талидомида.
После этого печального опыта стало ясно, что лекарства до выпуска на рынок надо очень тщательно изучать. Результаты исследования на животных нельзя напрямую перенести на людей, поскольку виды различаются по чувствительности к активным молекулам. Сейчас обычно до начала исследования на добровольцах эксперимент проводят на двух видах животных [18].
Так методом проб и трагических ошибок сформировалась методологическая часть клинических исследований. Осталось лишь разобраться с этической стороной вопроса...
Принципы гуманности в медицинском исследовании
Кажется, большинство методологических «дыр» клинических исследований были закрыты к середине 20 века. Но для этической стороны все только начиналось...
Конечно, в целом исследования с участием людей проводили с оглядкой на моральные устои, и общие этические принципы были сформулированы (но не прописаны!) давно. Однако 20 век преподнес несколько кровавых и трагических случаев, которые заставили общественность задуматься о создании документов, способных обеспечить безопасность участников клинических исследований с правовой точки зрения.
Самым громким событием стало, конечно, принятие в 1947 году первого международного документа по этике — Нюрнбергского кодекса. Он содержит 10 основных постулатов проведения медицинских испытаний с участием людей. Среди прочего в нем четко указана необходимость добровольного согласия участников и то, что польза от исследования должна перевешивать риски. Нюрнбергский кодекс стал результатом Нюрнбергского процесса, на котором нацистских врачей судили за преступления при проведении экспериментов над людьми [1].
Однако Нюрнбергского кодекса оказалось недостаточно для установления этических принципов проведения КИ. В 1964 году Всемирная медицинская ассоциация (WMA) создала более подробный документ — Хельсинкскую декларацию. Декларация не имеет юридической силы, однако на нее опираются законы, регулирующие медицинские исследования по всему миру. Хельсинкскую декларацию регулярно обновляют — последняя версия опубликована в 2013 году [1].
«Никто не должен подвергаться пыткам или жестокому, бесчеловечному или унижающему достоинство обращению или наказаниям. В частности, никто не может быть подвергнут без его согласия медицинскому или научному лечению», — так сказано в Международном пакте о гражданских и политических правах (International covenant on civil and political rights) 1966 года, который сейчас принят большинством стран [6].
В США, после печальных экспериментов в Таскиги и Гватемале, позиции Хельсинкской декларации подкрепили еще одним документом — Бельмонтским докладом 1979 года. Его подготовила Национальная комиссия по защите прав человека в биомедицинских и поведенческих исследованиях. Три столпа проведения исследований с участием людей, согласно этому документу, это — уважение к людям, благонамеренность и справедливость [1].
Наконец, в 1996 году опубликовали рекомендации по надлежащей клинической практике (Good Clinical Practice), или Стандарт GCP. В нем идет речь не только о правах участников и мерах по соблюдению их безопасности. GCP регламентирует и претворение стандарта исследований в жизнь для улучшения качества самих исследований: например, в нем даны нормы оформления КИ и расписаны роли участников [6]. Одним из основных положений GCP является то, что «права, безопасность и благополучие субъекта исследования имеют первостепенное значение и должны превалировать над интересами науки и общества» [26].
В 1997 году приняли Конвенцию о правах человека и биомедицине, которая имеет юридическую силу и обязательна к исполнению [27].
Сразу оговоримся, что иногда люди с особо тяжелыми болезнями готовы взять на себя дополнительные риски, связанные с текущими исследованиями, ведь это для них лучше, чем верная смерть либо очень тяжелая жизнь. Так, пациенты могут требовать предоставить им экспериментальное лечение быстрее, чем положено по современным правилам проверки препаратов. Это движение получило название «пациентский активизм». Самая громкая история, связанная с ним, — первые разработки антиретровирусных препаратов в 1980-х годах во время эпидемии ВИЧ в США [28]. Пациентам со СПИДом/ВИЧ удалось добиться того, что FDA поменяло правила вывода на рынок новых препаратов для лечения опасных и изнурительных заболеваний [20]. («Биомолекула» подробно писала об этом в статье «Пациентский активизм и борьба с хроническими заболеваниями» [29].)
В этой главе перечислены только основные документы, которые формируют медицинскую этику проведения КИ сегодня.
Отечественные клинические испытания сегодня
В СССР клинические исследования новых лекарств также проводили [30] и даже изредка публиковали книги об отдельных препаратах, однако информации в общедоступных источниках крайне мало. На сайте «Медузы» создатель мельдония — допинга, из-за которого случился скандал с российскими спортсменами, — рассказывает об изобретенных им лекарствах, хотя и не говорит подробно о КИ. Согласно данным РБК, советские проверки лекарств не соответствовали современным (число участников составляло 12–18 человек, что по сегодняшним меркам крайне мало), и поэтому эффективность как минимум части советских препаратов считается недоказанной.
Согласно официальным заявлениям, количество проводимых КИ в России сейчас активно растет: с 2011 по 2015 год выросло больше чем на 40%. В соответствии с российским законодательством их проводит либо сам производитель, либо уполномоченная им организация.
Клинические исследования, проводимые в нашей стране, обязаны соответствовать международным медицинским, этическим и юридическим нормам. Соблюдение же прав человека при участии в КИ в Российской Федерации на регуляторном уровне гарантируется Федеральным законом об обращении лекарственных средств и Конституцией РФ: «Никто не должен подвергаться пыткам, насилию, другому жестокому или унижающему человеческое достоинство обращению или наказанию. Никто не может быть без добровольного согласия подвергнут медицинским, научным или иным опытам» (Конституция РФ, ст. 21, ч. 2) По мнению некоторых экспертов, юридическая сторона проведения медицинских исследований в России требует уточнений в дополнительных документах [27].
Безопасность участников, согласно данным сайта о клинических исследованиях в Российской Федерации, обеспечивается несколькими путями. Во-первых, для проведения КИ необходимо получить одобрение от нескольких инстанций: Федерального этического комитета, Фармакологического комитета и местного независимого Этического комитета при каждом учреждении, участвующем в работе. Росздравнадзор ранее участвовал в процессе одобрения проведения КИ, но сейчас он осуществляет общий надзор за процессом. Протокол исследования тщательно проверяется, и проведение работы четко по протоколу контролируется. Исследователи и испытуемые оперативно получают обновленные данные по исследуемому лекарству: это поможет быстро остановить работу, если потребуется (например, могут появиться данные о ранее неизвестных рисках или о более эффективном лечении, которые сделают текущее исследование опасным или ненужным) [31].
На сайте Минздрава России можно найти реестр выданных разрешений на проведение КИ и реестр главных исследователей, задействованных в проведении КИ сейчас или в прошлом.
Помимо информации от Минздрава Ассоциация организаций по клиническим исследованиям (АОКИ, некоммерческая организация, созданная в 2007 году, которая объединяет юридических лиц — участников отечественного рынка КИ) советует пользоваться и реестром КИ Национального института здоровья США (NIH) с информацией о клинических исследованиях в 203 странах. Кроме того, на сайте АОКИ дан пошаговый алгоритм поиска нужного исследования на обеих платформах.
Информацию можно искать и на более специализированных сайтах. Например, интернет-портал Российского общества клинической онкологии предоставляет список КИ, направленных на борьбу с раком, а сайты крупнейших фармкомпаний Novartis или Roche — данные по их клиническим исследованиям, проводимым в России.
Заключение
Сегодня невозможно представить себе лекарство, для которого не проводилось клиническое исследование перед попаданием к пациенту. Кажется странным, что когда-то результативность лечения можно было пытаться проверить, не вводя понятий рандомизации или слепого метода. Сейчас КИ стало стандартизованной процедурой, в которой важны обе стороны: безопасность и права участника и эффективность препарата, проверенная научными методами.
Впрочем, структура проведения КИ всё еще продолжает меняться. Очень часто непосредственным исследованием на людях занимается не производитель или разработчик препарата, а специальные контрактные исследовательские организации — CROs. Они появились вместе с сильной коммерциализацией фармацевтического рынка в ‘70-х годах. Сейчас же это уже огромная индустрия. Через них, например, прошли 85 из 88 новых лекарств, одобренных в Европе и США в 2013 году [19]. Подробнее о таких организациях пойдет речь в третьей статье.
Медицина непрерывно эволюционирует. Этические, социальные и методологические проблемы продолжают возникать, но на них оперативно реагируют. Стратегия лечения тоже продолжает меняться. Раньше врачи часто вели одних и тех же пациентов долгое время и хорошо знали тех, кого лечат: вспомните, например, семейных врачей или докторов, которые всю жизнь проводили в одной деревне. Затем здравоохранительная система усложнилась, и справляться с большим потоком пациентов старыми методами стало затруднительно. Клинические исследования позволили выработать тактику назначения такого лекарства, которое бы помогло среднестатистическому больному в подобных обстоятельствах. Это удобно, если время на прием каждого человека строго ограничено. Однако оказалось, что в клинической практике такой метод хорошо работает отнюдь не всегда — ведь все люди разные. Теперь же снова возвращаются к персонализации терапии [20], [38], где на первое место выходит индивидуальный подход к каждому пациенту — но уже с опорой на весь багаж знаний, полученный в ходе клинических исследований с участием многочисленных групп людей.
Литература
- Emma M. Nellhaus, Marshall University, Todd H. Davies, Marshall University. (2017). Evolution of Clinical Trials throughout History. mjm. 3;
- Matthew S. Thiese. (2014). Observational and interventional study design types; an overview. Biochem Med. 24, 199-210;
- What are the different types of clinical research? FDA;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Виртуальные тропы реальных лекарств;
- Bhatt A. (2010). Evolution of clinical research: a history before and beyond james lind. Perspect. Clin. Res. 1, 6–10;
- Machin D. and Fayers P.M. Randomized clinical trials: design, practice and reporting. John Wiley & Sons, 2010. — 374 p.;
- IML Donaldson. (2016). Petrarch’s letter to Boccaccio ‘on the proud and presumptuous behaviour of physicians’. J R Soc Med. 109, 347-353;
- Lilienfeld A.M. (1982). The Fielding H. Garrison Lecture: Ceteris paribus: the evolution of the clinical trial. Bull. Hist. Med. 56, 1–18;
- Элементы: «Победы и парадоксы Амбруаза Паре»;
- FDA and clinical drug trials: a short history. FDA;
- Петренко А. (2017). Агнец: первая кровь. «Газета.ру»;
- Scurvy. PubMed Health Glossary;
- James Lind (1716–1794). BBC;
- Daston L. (2005). Scientific error and the ethos of belief. Social Research. 72, 1–28;
- Laura E. Bothwell, Scott H. Podolsky. (2016). The Emergence of the Randomized, Controlled Trial. N Engl J Med. 375, 501-504;
- I. Chalmers. (2004). Commentary: The 1944 patulin trial: the first properly controlled multicentre trial conducted under the aegis of the British Medical Research Council. International Journal of Epidemiology. 33, 253-260;
- James H. Kim, Anthony R. Scialli. (2011). Thalidomide: The Tragedy of Birth Defects and the Effective Treatment of Disease. Toxicological Sciences. 122, 1-6;
- Darby Hull. (2015). Reining in the Commercialized Foreign Clinical Trial. Journal of Legal Medicine. 36, 367-401;
- Laura E. Bothwell, Jeremy A. Greene, Scott H. Podolsky, David S. Jones. (2016). Assessing the Gold Standard — Lessons from the History of RCTs. N Engl J Med. 374, 2175-2181;
- Вирус Зика — глобальная угроза?;
- Вирус Зика: мнимая паника или реальная угроза?;
- The history of Zika virus. WHO;
- Jinbin PARK. (2017). Historical Origins of the Tuskegee Experiment: The Dilemma of Public Health in the United States. Korean J Med Hist. 26, 545-578;
- Charlotte Paul, Barbara Brookes. (2015). The Rationalization of Unethical Research: Revisionist Accounts of the Tuskegee Syphilis Study and the New Zealand “Unfortunate Experiment”. Am J Public Health. 105, e12-e19;
- Национальный стандарт Российской Федерации ГОСТР 52379-2005 «Надлежащая клиническая практика»;
- Рукавишников М.В. (2008). Правовое регулирование биомедицинских исследований с участием человека. Пробелы в российском законодательстве. Юридический журнал. 2, 453–454;
- Связанные одной лентой;
- Пациентский активизм и борьба с хроническими заболеваниями;
- Шатохина А. (2016). Изобретение из Соловков. Как в СССР создавали первые антибиотики. АиФ.ру;
- О клинических исследованиях (вопросы и ответы). Clinical-trials.ru;
- Carl Elliott. (2017). Institutional Pathology and the Death of Dan Markingson. Accountability in Research. 24, 65-79;
- Дебора Блюм, Мэри Кнудсон, Робин Маранц Хениг: «Полевое руководство для научных журналистов». Рецензия;
- Coghlan A. (2006). Mystery over drug trial debacle deepens. New Scientist;
- Matharu H. (2016). The troubled history of clinical drug trials. The Independent;
- H. Jaeschke. (2007). Troglitazone Hepatotoxicity: Are We Getting Closer to Understanding Idiosyncratic Liver Injury?. Toxicological Sciences. 97, 1-3;
- Dan Hu, Chun-qi Wu, Ze-jun Li, Yue Liu, Xing Fan, et. al.. (2015). Characterizing the mechanism of thiazolidinedione-induced hepatotoxicity: An in vitro model in mitochondria. Toxicology and Applied Pharmacology. 284, 134-141;
- От медицины для всех — к медицине для каждого!.







