
Маскировка для чужака, или ПрикреПИИИ белок!
07 ноября 2017
Маскировка для чужака, или ПрикреПИИИ белок!
- 287
- 0
- 0
сайт pixabay.com
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Со времен расцвета киберпанка как жанра фантастики, человечество демонстрирует живой интерес к достижениям имплантологии. Уже сегодня легкой «киборгизацией» никого не удивить. Популярность всевозможных ортопедических, сердечнососудистых, косметических и прочих видов протезов набирает обороты. Однако наши организмы этого энтузиазма не разделяют и к биомедицинским техническим новшествам относятся с заметным подозрением, что порою приводит к весьма неприятным последствиям вроде воспаления, тромбообразования, отторжения и даже «захоронения» объекта в коконе соединительной ткани. А что если обмануть природу, заставив тело считать имплантат «своим»? Достичь такой мимикрии, при которой эти побочные эффекты исчезнут? Да еще при этом ускорить приживление протезов и сделать их неприступными для микробных биопленок. Всё еще фантастика? Похоже, уже нет.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
В теории изобретательства высшим пилотажем считаются те проекты, в которых проблема «решает сама себя». Иначе говоря, источник проблемы становится и способом ее устранения. Так когда-то поступил Альберт Эйнштейн. Он взглянул на безуспешные попытки доказать существование эфира как на подтверждение его отсутствия — и на этом построил свою великую теорию относительности. Так же, по факту, справился с задачей Эдвард Дженнер, когда обернул патогенность микрорганизмов против них же самих, изобретя вакцинацию [1], [2]. Так, в конечном итоге, неоднократно решала проблемы сама природа. Чего стоит одно только «приручение» кислорода, в прошлом — страшнейшего яда, а теперь — жизненно необходимого для нас вещества [3], [4]. И если мы сталкиваемся с тем, что внутренняя среда организма нежелательным образом реагирует на появление чужака, почему бы не одеть его в «овечью шкуру», используя элементы этой самой внутренней среды? Именно так выглядит сегодня один из наиболее перспективных путей разработки так называемых биомиметических материалов. То есть материалов, подражающих нормальным живым тканям и потому неузнаваемых .
C биомиметической керамикой для имплантатов вы можете познакомиться в статье «Инженерная биомеханика: материалы имплантатов в России сегодня» [5].
Вода, вода, кругом вода
За последние 30 лет в деле производства биосовместимых материалов человечество достигло значительного прогресса. Особенный оптимизм внушает направление, связанное с разработкой пригодных для биомедицины полимеров. И пусть на данный момент их число не превышает пары десятков [6], но и этого количества полимеров может хватить надолго, если мы научимся придавать их поверхностям ровно те свойства, которые нам необходимы.
Главная проблема, с которой приходится сталкиваться при использовании полимеров — их гидрофобность [7], [8], то есть водоотталкивающие свойства. Для внутренней среды организма это довольно чуждое явление, которое не остается незамеченным. Дело в том, что все межклеточные взаимодействия внутри наших тел проходят во влажной среде и обусловлены специфическими контактами растворенных, то есть гидрофильных частей белков. Именно за счет них происходит взаимное узнавание клеток, их координация, регуляция и, в конечном итоге, совместное функционирование в качестве ткани организма. Белками насыщено и межклеточное пространство, и все наши жидкие среды. Однако при контакте с гидрофобной поверхностью, они начинают реагировать неадекватно, неспецифически [9], [10]. Прежде всего, «прилипают» к ней своими гидрофобными частями (которые в норме спрятаны внутри молекулы) и при этом неизбежно «разворачиваются», становясь для организма чужими, неузнаваемыми. И вскоре поверхность имплантата оказывается целиком покрытой такими «покалеченными» молекулами. Организм подобного беспорядка стерпеть не может и запускает целый каскад нежелательных процессов, вовлекающих тромбообразование и иммунный ответ, и приводящих к воспалению, отторжению или инкапсуляции, то есть «обрастанию» имплантата соединительной тканью [11], [12]. Все это подрывает функциональность протеза, а нас заставляет искать способы модифицировать поверхность биомедицинских полимеров.
Учимся подражать
При этом одной «войны» с гидрофобностью оказывается мало. Неспецифическое притяжение белков к полимерным поверхностям многогранно и включает сразу несколько видов физико-химических взаимодействий. Поэтому здесь имеет смысл говорить не столько о преодолении гидрофобности, сколько о придании полимеру «белок-отталкивающих» свойств. В попытках достичь этого эффекта пробовали различные пути. В первую очередь — создание на поверхности гидрофобных полимеров слоя гидрофильных. В качестве последних активно используют полиэтиленгликоль (ПЭГ) или полиэтиленоксид (ПЕО). Помимо этого опытным путем установили функциональные группы, которые, будучи размещенными на поверхности, препятствуют налипанию белков (полярные группы, акцепторы водородной связи), либо же способствуют ему (незаряженные группы, доноры водородной связи). И, казалось бы, принципы дизайна «правильного» материала вполне ясны: добавь нужные группы, убери ненужные. Но идеального результата при этом добиться все равно не получается. «Оседание» белков на искусственной поверхности никогда не достигает нулевых показателей. Кроме того, при некоторых вариантах химической модификации возникает опасность незапланированной «утечки» гидрофильных молекул во внутреннюю среду организма, что ставит под сомнение безвредность самого материала [13].
Вдобавок стоит отметить, что клеткам тканей очень важно ощущать «собрата» под боком [14]. И поэтому при отсутствии белковых сигналов со стороны протеза, соседствующие с ним клетки могут «загрустить», теряя свою клеточную «идентичность» и даже совершая клеточный суицид [15] .
О том, насколько важную роль в развитии клеток играет их взаимодействия с окружением, читайте в статье «Опухолевые разговоры, или Роль микроокружения в развитии рака» [16].
Постепенно складывается противоположная концепция со знакомым девизом: «не можешь победить — возглавь». Формируется идея о так называемых биомиметических материалах [17]. Если мы не способны биомолекулам «запретить» контактировать с поверхностью, стало быть, надо сделать так, чтоб они контактировали, но по нашим собственным правилам. И здесь помогут, прежде всего, специализированные белки самого организма или хотя бы их функциональные кусочки — пептиды с активными центрами [13]. Сперва в этих целях стали использовать гирудин (препятствующий сворачиванию крови белок пиявок), гепарин (наш собственный антикоагулянт) [18] и антитромбин. Они блокируют тромбообразование и потому в существенной степени смягчают побочные эффекты имплантации [13].
Однако наиболее прогрессивным ответвлением биомиметического направления явились поиски в области «наступательной стратегии». То есть попытки активизировать взаимодействие поверхности имплантата с окружающими клетками так, чтобы добиваться желаемого результата. В этих целях успешно опробовали разнообразные белки из межклеточной среды и с поверхности клеток организма. В их числе фибронектин, коллаген, ламинин и их функциональные фрагменты, ряд факторов роста клеток, а также пептиды, содержащие особый домен RGD [13]. Последний узнается интегринами — специальными белками, участвующими во взаимной координации клеток ткани [19].
Пошив камуфляжного костюмчика
Только закрепить такие молекулы на полимере, сохранив их объемную структуру и активность — задача весьма незаурядная. Проще всего, конечно же, просто наслоить нужный белок, удерживая его за счет комплекса физико-химических взаимодействий с поверхностью [13]. Правда, это самый ненадежный вариант, поскольку может пострадать конформация сорбированных белков. Кроме того, за счет непрочной связи они способны открепляться и мигрировать в среду, оставляя поверхность полимера неприкрытой. «Пришить» же белок или пептид накрепко, не нарушая его конформации, можно только с помощью ковалентной связи между одним из его оснований и поверхностью полимера [10], [13], [20]. Связи, при которой атомы двух разных молекул объединят свои электроны, создав прочный молекулярный мостик.
Правда, с химически инертными биомедицинскими полимерами это не так-то просто сделать. У них нет «лишних» электронов, которыми можно было бы поделиться. Поэтому возникает необходимость каким-то образом изменить реактивность поверхностного слоя. Покрыть его своеобразными химическими «крючочками», способными легко формировать ковалентную связь. И при этом сделать гидрофильным — чтобы «пришитые» биомолекулы не потеряли своей формы [13].
Технологии ковалентной иммобилизации белков разнообразны. Наиболее распространенный подход подразумевает их присоединение к специальным посредникам — линкерам. Линкеры «крепятся» к поверхности с помощью разнообразных химических реакций [13], [15]. И уже потом с ними ковалентно связываются необходимые агенты. Многостадийность и сложность этих процессов затрудняют их широкое использование, при этом некоторые линкеры могут нарушать стабильность и функциональность пришитых биомолекул. Да и плотность такого белкового покрытия, как правило, не высока, и большая часть поверхности полимера по-прежнему остается незащищенной [21], [22].
За помощью — к физикам
Помощь пришла со стороны физики плазмы. И в деле иммобилизации белков неожиданно пригодился метод плазменно-иммерсионной имплантации ионов (ПИИИ), изобретенный еще в конце 80-х годов прошлого века [23]. Метод основывается на том, что в вакуумной камере, заполненной разреженной плазмой, между самой плазмой (чаще всего, ионизированных азота или инертных газов) и электродом, на котором лежит образец, создается пульс высокого напряжения с варьирующей амплитудой (рис. 1). За счет высоковольтного импульса ионы плазмы разгоняются и «врезаются» в поверхность вещества (рис. 2a). А из-за вариаций амплитуды напряжения они проникают на различную глубину.
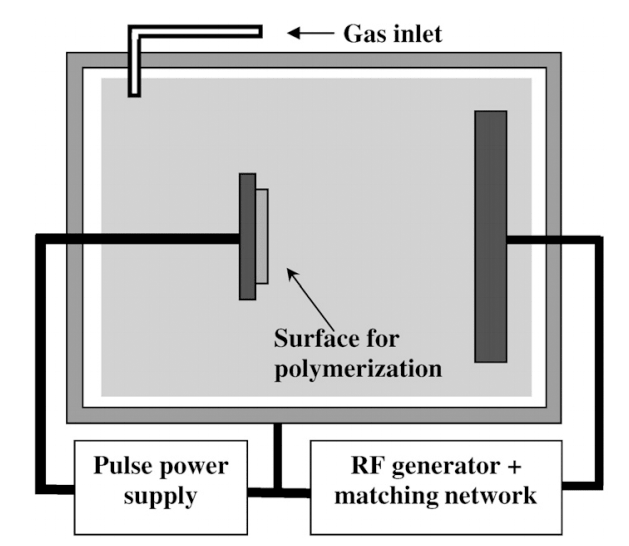
Рисунок 1. Метод плазменно-иммерсионной имплантации ионов. Газ поступает в вакуумную камеру, где ионизируется с помощью радиочастотного электрода. Полученная плазма выполняет функцию анода, тогда как роль катода играет подставка для подлежащего обработке образца. На катод от специального пульсового генератора подается пульсовое напряжение, противоположное по знаку напряжению плазмы. Под действием генерируемой разницы потенциалов ионы «бомбардируют» поверхность образца.
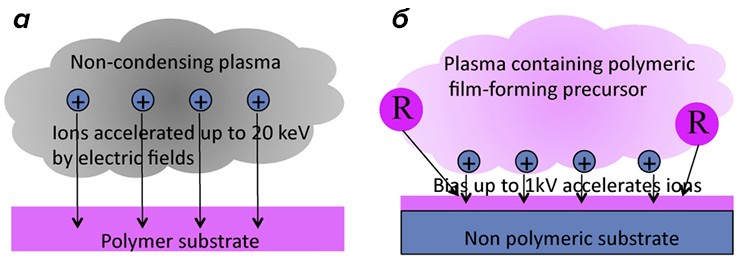
Рисунок 2. Схема процессов плазменно-иммерсионной имплантации ионов (ПИИИ) (а) и плазмоактивированного покрытия (ПАП) (б). В первом случае в вакуумной камере находится только ионизированный газ, ионы которого под действием пульсового напряжения проникают в верхний слой полимера. Во втором случае вместе с газом в камеру подаются органические предшественники полимера, и полимеризация проходит прямо на поверхности обрабатываемого образца.
Конечно, в самом использовании плазмы [24] (а также УФ- и гамма-лучей, электростатических разрядов и других физических факторов [2]) для модификации разнообразных материалов нет ничего нового: этим занимаются по меньшей мере лет 50. Но, в отличие от других видов плазменной обработки, ПИИИ позволяет очень густо (1016 и более ионов на 1 см2) пронизать своим воздействием довольно глубокий слой полимера — до 100 нанометров [23].
Кроме того, плазменно-иммерсионный подход дает возможность нарастить поверхность любого материала тончайшим слоем необходимого полимера. В этом случае исходные вещества-мономеры поставляются прямо в камеру с плазмой и тоже участвуют в «бомбардировке» поверхности. Таким образом, синтез и обработка полимера проходят одновременно [25] (рис. 2б), а сила его связывания с материалом «подложки» оказывается гораздо выше, чем при обычных методах полимеризации [24]. Полученный же в результате такого плазмоактивированного покрытия (ПАП) слой будет демонстрировать те же химические чудеса, что и слои полимеров после имплантации ионов.
Радикалы — долгожители
Эти чудеса впервые дали о себе знать еще в 90-х годах прошлого века в работах исследователей Института технической химии УрО РАН в Перми. Они заметили, что после обработки поверхности тефлона с помощью ПИИИ, на выходе возникал потрясающий эффект. А именно: химически инертный материал вдруг становился химически «липким», приобретая способность ковалентно связывать другие вещества. Причем это свойство не исчезало сразу после «бомбардировки» ионами и сохранялось на протяжении долгого времени после нее [26]. Тогда сотрудник института Алексей Кондюрин, чьи работы с листовой резиной предваряли это открытие [27], сделал и экспериментально обосновал очень смелое предположение: полученная «суперспособность» обязана своим происхождением миллионам свободных радикалов, возникающих в результате бомбардировки материала ионами.
Согласно его модели, во время ионной имплантации заряженные частицы с большой энергией врываются в толщу полимера, разрывая химические связи и приводя к появлению свободных радикалов. Свободные радикалы — это атомы с неспаренными электронами, крайне реактивные, а потому чрезвычайно короткоживущие частицы. Едва появившись, они тут же «хватаются» за соседние атомы углерода, заставляя их «отпустить» ковалентно связанный водород. В результате чего верхний слой полимера дегидрогенизируется (теряет водород), карбонизируется (обогащается углеродом), превращаясь при интенсивной «бомбардировке» ионов в плотную сеть из так называемых ароматических колец и сопряженных двойных связей. Эта структура оказывается превосходным средством размещения и распределения новых поступлений неспаренных электронов, возникающих при имплантации ионов. В результате мы получаем материал с беспрецедентной плотностью свободных радикалов. А эти свободные радикалы, в свою очередь, обретают беспрецедентно долгую «жизнь». Как показывают измерения, обработанные ПИИИ образцы сохраняют свою способность ковалентно связывать вещества даже через годы хранения [28], [29].
Особые свойства сопряженных двойных углеродных связей и, в частности, ароматических колец, известны давно. В таких образованиях три электрона каждого углерода заняты прочными ковалентными связями, а четвертый электрон обладает высокой подвижностью и участвует в формировании единой распределенной системы π-электронных облаков [30]. Классическим примером подобной структуры является молекула бензола, кольцо из шести атомов углерода, надежно «укрепленное» единым π-электронным облаком. В нашем случае появление свободного радикала (неспаренного электрона) в слое карбонизированного плазмой полимера приводит к тому, что он как бы «размазывается» по всей этой системе сопряженных двойных связей, «растворяется» в едином облаке подвижных π-электронов. И пока в округе нет веществ, с которыми можно было бы прореагировать, он остается в пределах этой «сети». Причем отлично сохраняется там на протяжении многих месяцев и даже лет. В то время как время жизни обычных свободных радикалов составляет 10−3–10−4 с, изредка достигая нескольких секунд.
Конечно, о том, что во время плазменной обработки возникают свободные радикалы, было известно и ранее. Но жизнь их, как это и полагается, всегда была бурной и мимолетной. Метод ПИИИ позволил шагнуть гораздо дальше, сделав физическое явление способом кардинально изменить химические свойства вещества. И что особенно важно: эти изменения сосредотачивались всего лишь в тончайшем поверхностном слое и потому не «портили» нам образец.
Феноменальная «ворсистость»
Практически сразу предложили использовать обнаруженное явление для решения проблемы иммобилизации белков на поверхности полимеров, над которой уже вовсю трудились химики. Эти работы успешно стартовали еще в Перми, развернулись в германском Центре им. Гельмгольца Дрезден-Россендорф [31], а затем получили полноценное всестороннее развитие в лабораториях Сиднейского университета [28], [29]. Эффект был потрясающим: после применения плазменно-иммерсионных методов (ПИИИ и ПАП) удавалось в один прием добиться повышения и гидрофильности полимера, и его способности ковалентно связывать белки (рис. 3). Причем плотность итогового покрытия сразу составляла десятки процентов, и по мере отработки метода уверенно достигла 100%. Можно сказать, нанояблоку негде упасть!
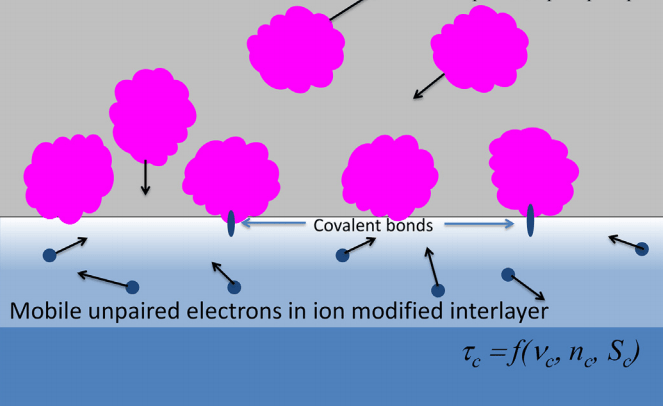
Рисунок 3. Взаимодействие растворенных в водной среде белков с поверхностью полимера, обработанной ПИИИ. При контакте с поверхностью молекулы белков необратимо реагируют со свободными радикалами, циркулирующими в толще карбонизированного слоя полимера. По мере ковалентного связывания биомолекул пул свободных радикалов сокращается, и те из них, что находились прежде в глубине карбонизированного слоя, мигрируют к его поверхности.
Чтобы удостовериться в полученном результате, полимер-белковые слои тестировали самыми разнообразными способами. Эллипсометрия и спектроскопия нарушенного полного внутреннего отражения помогали определить толщину слоя. Она была сопоставима с диаметром одной белковой молекулы, подтверждая то, что мы имеем дело с монослоем. Атомно-силовая микроскопия [32], [33] позволяла получить точное изображение белкового покрытия в наномасштабах и убедиться, что образованный монослой обладает чрезвычайно высокой плотностью. После обработки полимер отмывали, не жалея детергентов, доказывая, что это действительно ковалентное связывание, и оно действительно покрывает обработанную поверхность сплошным ковром [28], [29].
«Этого не может быть, потому что этого не может быть никогда!»
Разумеется, поверить в такое было трудно. И, как поделился с нами Алексей Кондюрин, посетивший проходившую в Перми конференцию «Наукоемкие биомедицинские технологии», многие авторитетные исследователи до сих пор горячо отрицают возможность получения и стабилизации свободных радикалов с помощью ПИИИ. Основное возражение сводится к тому, что свободные радикалы живут крайне активно и весьма недолго, и никакими воздействиями этого не изменить.
Однако существование в обработанном слое свободных радикалов подтверждается как косвенно, с помощью измерений поверхностной энергии, так и напрямую, с помощью электронного парамагнитного резонанса (ЭПР), главного и универсального метода определения свободных радикалов.
Поверхностная энергия характеризует активность физико-химического взаимодействия материала с водой, то есть его гидрофильность. Она зависит от полярности молекул вещества, а полярность возможна только в случае наличия зарядов. Молекулы углеводородных полимеров зарядов не несут. Однако после ПИИИ или ПАП поверхностная энергия полимера существенно возрастает. По общепринятой версии, этот эффект обязан своим происхождением кислородным группам, возникающим в результате реакции короткоживущих свободных радикалов с кислородом воздуха. Однако в действительности кислородные группы дают ничтожный эффект. Куда вероятнее, что столь значительное возрастание полярности поверхности, а, следовательно, ее поверхностной энергии и степени гидрофильности, возникает в результате накопления в толще полимера неспаренных электронов, то есть долгоживущих свободных радикалов.
Но главным аргументом в деле доказательства предложенной модели служит, конечно же, метод ЭПР. Он основан на определении суммарного спина вещества. Спин равен нулю в обычном состоянии, когда электроны атомов образуют пары, и отличается от нуля, если появляется неспаренный электрон (читай — свободный радикал). Соответственно, этот показатель тем выше, чем больше в материале неспаренных электронов. В нашем случае метод позволяет напрямую обнаружить чрезвычайно высокие уровни углеродных и других (в зависимости от химического состава полимера) свободных радикалов [28]. И иначе эти данные трактовать практически невозможно.
Впрочем, долгоживущие свободные радикалы совсем не новость. Мы можем обнаружить их в составе целого ряда соединений, к слову, вполне доступных для приобретения в качестве химических реактивов. Общим свойством таких соединений как раз является наличие одного или нескольких ароматических колец, в которых свободный электрон может быть «делокализован», то есть распределен [30]. И ПИИИ не первый и не единственный метод, позволивший получить такой результат. В прошлом долгоживущие свободные радикалы обнаруживали, к примеру, после обработки поверхности материалов гамма-излучением [34].
Плазма животворящая
И хотя волшебный эффект ПИИИ и ПАП принимают далеко не все, практика его применения продвигается семимильными шагами [35]. После отработки метода на моделях с каталазой [29] и пероксидазой хрена [25], [30] последовали эксперименты с иммобилизацией таких биомедицински значимых биомолекул, как плазмин [31] и аполипопротеин А1 [34], препятствующих тромбообразованию (рис. 4), фибриллин-1 (фрагмент) [36] и тропоэластин [37–39], участвующих во взаимодействии клеток с межклеточной средой и между собой, и других компонентов с необходимыми свойствами.

Рисунок 4. Тромбообразование на поверхности нержавеющей стали (SS), нержавеющей стали, обработанной плазмоактивированным покрытием (PAC), и нержавеющей стали, обработанной плазмоактивированным покрытием с последующей иммобилизацией белка плазмина.
Какой бы полимерный материал ни подвергался обработке: тефлон, полиуретан, полиэтилен, полипиррол, полипропилен, полистирол, полиэфирсульфон и т.д., — методы ПИИИ и ПАП неизменно показывали высокую эффективность. Биополимеры прочно и плотно связывались с поверхностью, не теряя своей активности и приобретая исключительную стойкость к биодеградации: ведь местные белки-утилизаторы не могут до них добраться. Более того, успешными оказались попытки управлять иммобилизацией белков, определенным образом ориентируя их на поверхности так, чтоб их активные центры были обращены вовне. Это особенно важно для работы связанных рецепторов, ферментов и антител [40].
Тестирование подобных полимер-белковых слоев с культурами клеток и in vivo воодушевляет. К примеру, в экспериментах на мышах ПАП с последующей «посадкой» аполипопротеина предотвращает тромбообразование и нарастание клеток гладкой мускулатуры на поверхностях стентов (имплантатов, призванных расширять просвет сосуда). Стало быть, можно полностью устранить причину, по которой эти устройства чаще всего приходят в негодность [34].
Отличные результаты показывает иммобилизация тропоэластина. Этот белок межклеточной среды обладает чрезвычайно широкой функциональностью и высокой устойчивостью — в том числе, к стерилизации этиленоксидом. А ведь возможность провести антибактериальную обработку прямо перед внедрением имплантата — это преимущество, которое невозможно переоценить! Тропоэластин взаимодействует с окружающими имплантат клетками и стимулирует их рост и развитие. В составе поверхности стента тропоэластин может стимулировать успешное вживление протеза, что в дальнейшем защитит его от нежелательных контактов с клетками гладкой мускулатуры и тромбоцитами [37–39].
Нельзя не сказать об успешных экспериментах с электропроводящим полимером — полипирролом. После ионной имплантации он не терял своих проводящих свойств и, как и другие полимеры, приобретал способность ковалентно связывать биомолекулы. А значит, открываются неплохие перспективы для разработки биологически совместимых нейро- и миопротезов [41], [42].
Потенциал развития и применения метода очень широк. Возможность управлять реакцией внутренней среды организма на имплантат — это только начало. К примеру, мы могли бы избавиться от второй крупной проблемы имплантологии — заражения поверхности протезов микробными биопленками. Немногочисленные и вполне успешные попытки в этом направлении осуществляли и раньше — с использованием низина (антибактериального пептида стрептококков) [43], [44], хитозана (аминосахара, выделенного из грибов) [9] и синтетического пептида E14LKK. Метод имплантации ионов, без сомнения, способен вдохнуть новую жизнь в эти начинания. О потенциале использования ПИИИ и ПАП в деле производства всевозможных биомедицинских сенсоров, датчиков и диагностических систем даже говорить не приходится [24].
Сложившаяся ситуация отдаленно напоминает историю с двигателем EmDrive, который стал настоящей сенсацией после его успешного тестирования в NASA [45]. Но до этого момента все прототипы и построения не принимались научным сообществом всерьез [46]. К счастью, прогресс не стоит на месте и впереди у нас еще масса изящных решений, вступающих в противоречие с прежними теориями, но стоящих у истоков новых, невообразимых прежде технологий.
Литература
- Вакцины в вопросах и ответах;
- Wong J.Y., Bronzino J.D., Peterson D.R. Biomaterials: principles and practices. CRC Press, 2012. — 281 p.;
- Как появились митохондрии (рассказ, похожий на сказку);
- D L Elbert, J A Hubbell. (1996). Surface Treatments of Polymers for Biocompatibility. Annu. Rev. Mater. Sci.. 26, 365-394;
- Инженерная биомеханика: материалы имплантатов в России сегодня;
- J.M. Goddard, J.H. Hotchkiss. (2007). Polymer surface modification for the attachment of bioactive compounds. Progress in Polymer Science. 32, 698-725;
- Физическая водобоязнь;
- Karen S. Lavery, Candace Rhodes, Adam Mcgraw, Michael J. Eppihimer. (2017). Anti-thrombotic technologies for medical devices. Advanced Drug Delivery Reviews. 112, 2-11;
- Hong Chen, Lin Yuan, Wei Song, Zhongkui Wu, Dan Li. (2008). Biocompatible polymer materials: Role of protein–surface interactions. Progress in Polymer Science. 33, 1059-1087;
- A. J. Garcia, M. D. Vega, D. Boettiger. (1999). Modulation of Cell Proliferation and Differentiation through Substrate-dependent Changes in Fibronectin Conformation. Molecular Biology of the Cell. 10, 785-798;
- Jessica F. Almine, Daniel V. Bax, Suzanne M. Mithieux, Lisa Nivison-Smith, Jelena Rnjak, et. al.. (2010). Elastin-based materials. Chem. Soc. Rev.. 39, 3371;
- Kevin M. Shakesheff, Scott M. Cannizzaro, Robert Langer. (1998). Creating biomimetic micro-environments with synthetic polymer-peptide hybrid molecules. Journal of Biomaterials Science, Polymer Edition. 9, 507-518;
- Young Jin Kim, Inn-Kyu Kang, Man Woo Huh, Sung-Chul Yoon. (2000). Surface characterization and in vitro blood compatibility of poly(ethylene terephthalate) immobilized with insulin and/or heparin using plasma glow discharge. Biomaterials. 21, 121-130;
- Andrés J. García. (2005). Get a grip: integrins in cell–biomaterial interactions. Biomaterials. 26, 7525-7529;
- Daniel V. Bax, David R. McKenzie, Anthony S. Weiss, Marcela M.M. Bilek. (2009). Linker-free covalent attachment of the extracellular matrix protein tropoelastin to a polymer surface for directed cell spreading. Acta Biomaterialia. 5, 3371-3381;
- Опухолевые разговоры, или Роль микроокружения в развитии рака;
- Ivan L. Valuev, Vladimir V. Chupov, Lev I. Valuev. (1998). Chemical modification of polymers with physiologically active species using water-soluble carbodiimides. Biomaterials. 19, 41-43;
- Steven G Wise, Anna Waterhouse, Alexey Kondyurin, Marcela M Bilek, Anthony S Weiss. (2012). Plasma-based biofunctionalization of vascular implants. Nanomedicine. 7, 1907-1916;
- Yongbai Yin, Marcela M.M. Bilek, David R. McKenzie, Neil J. Nosworthy, Alexey Kondyurin, et. al.. (2009). Acetylene plasma polymerized surfaces for covalent immobilization of dense bioactive protein monolayers. Surface and Coatings Technology. 203, 1310-1316;
- J. R. Conrad, J. L. Radtke, R. A. Dodd, Frank J. Worzala, Ngoc C. Tran. (1987). Plasma source ion‐implantation technique for surface modification of materials. Journal of Applied Physics. 62, 4591-4596;
- Tim Desmet, Rino Morent, Nathalie De Geyter, Christophe Leys, Etienne Schacht, Peter Dubruel. (2009). Nonthermal Plasma Technology as a Versatile Strategy for Polymeric Biomaterials Surface Modification: A Review. Biomacromolecules. 10, 2351-2378;
- M. M. M. Bilek, D. V. Bax, A. Kondyurin, Y. Yin, N. J. Nosworthy, et. al.. (2011). Free radical functionalization of surfaces to prevent adverse responses to biomedical devices. Proceedings of the National Academy of Sciences. 108, 14405-14410;
- Marcela M. Bilek, David R. McKenzie. (2010). Plasma modified surfaces for covalent immobilization of functional biomolecules in the absence of chemical linkers: towards better biosensors and a new generation of medical implants. Biophys Rev. 2, 55-65;
- Неницеску К.Д. Органическая химия (т. 1). М.: Изд-во иностранной литературы, 1963. — 862 с.;
- D. Campbell, K. Araki, D. T. Turner. (1966). ESR study of free radicals formed by γ-irradiation of poly(ethylene terephthalate). J. Polym. Sci. A-1 Polym. Chem.. 4, 2597-2606;
- Neil J. Nosworthy, Joan P.Y. Ho, Alexey Kondyurin, David R. McKenzie, Marcela M.M. Bilek. (2007). The attachment of catalase and poly-l-lysine to plasma immersion ion implantation-treated polyethylene. Acta Biomaterialia. 3, 695-704;
- Alexey Kondyurin, Neil J. Nosworthy, Marcela M.M. Bilek. (2008). Attachment of horseradish peroxidase to polytetrafluorethylene (teflon) after plasma immersion ion implantation. Acta Biomaterialia. 4, 1218-1225;
- Steven G. Wise, Praveesuda L. Michael, Anna Waterhouse, Miguel Santos, Elysse Filipe, et. al.. (2015). Immobilization of bioactive plasmin reduces the thrombogenicity of metal surfaces. Colloids and Surfaces B: Biointerfaces. 136, 944-954;
- Laura Z. Vanags, Joanne T.M. Tan, Miguel Santos, Praveesuda S. Michael, Ziad Ali, et. al.. (2017). Plasma activated coating immobilizes apolipoprotein A-I to stainless steel surfaces in its bioactive form and enhances biocompatibility. Nanomedicine: Nanotechnology, Biology and Medicine. 13, 2141-2150;
- Hamid Hajian, Steven G. Wise, Daniel V. Bax, Alexey Kondyurin, Anna Waterhouse, et. al.. (2014). Immobilisation of a fibrillin-1 fragment enhances the biocompatibility of PTFE. Colloids and Surfaces B: Biointerfaces. 116, 544-552;
- Jeff Holst, Sarah Watson, Megan S Lord, Steven S Eamegdool, Daniel V Bax, et. al.. (2010). Substrate elasticity provides mechanical signals for the expansion of hemopoietic stem and progenitor cells. Nat Biotechnol. 28, 1123-1128;
- Атомно-силовая микроскопия: увидеть, прикоснувшись;
- Matti A. Hiob, Steven G. Wise, Alexey Kondyurin, Anna Waterhouse, Marcela M. Bilek, et. al.. (2013). The use of plasma-activated covalent attachment of early domains of tropoelastin to enhance vascular compatibility of surfaces. Biomaterials. 34, 7584-7591;
- Giselle C. Yeo, Alexey Kondyurin, Elena Kosobrodova, Anthony S. Weiss, Marcela M. M. Bilek. (2017). A sterilizable, biocompatible, tropoelastin surface coating immobilized by energetic ion activation. J. R. Soc. Interface. 14, 20160837;
- Kim Shyong Siow, Leanne Britcher, Sunil Kumar, Hans J. Griesser. (2006). Plasma Methods for the Generation of Chemically Reactive Surfaces for Biomolecule Immobilization and Cell Colonization - A Review. Plasma Process. Polym.. 3, 392-418;
- E. Kosobrodova, R.T. Jones, A. Kondyurin, W. Chrzanowski, P.J. Pigram, et. al.. (2015). Orientation and conformation of anti-CD34 antibody immobilised on untreated and plasma treated polycarbonate. Acta Biomaterialia. 19, 128-137;
- Daniel V. Bax, Roxana S. Tipa, Alexey Kondyurin, Michael J. Higgins, Kostadinos Tsoutas, et. al.. (2012). Cell patterning via linker-free protein functionalization of an organic conducting polymer (polypyrrole) electrode. Acta Biomaterialia. 8, 2538-2548;
- Alexey Kondyurin, Kostadinos Tsoutas, Quentin-Xavier Latour, Michael J. Higgins, Simon E. Moulton, et. al.. (2017). Structural Analysis and Protein Functionalization of Electroconductive Polypyrrole Films Modified by Plasma Immersion Ion Implantation. ACS Biomater. Sci. Eng.. 3, 2247-2258;
- Christelle Vreuls, Germaine Zocchi, Benjamin Thierry, Geoffrey Garitte, Stefani S. Griesser, et. al.. (2010). Prevention of bacterial biofilms by covalent immobilization of peptides onto plasma polymer functionalized substrates. J. Mater. Chem.. 20, 8092;
- Jenny Aveyard, James W. Bradley, Kirsty McKay, Fiona McBride, David Donaghy, et. al.. (2017). Linker-free covalent immobilization of nisin using atmospheric pressure plasma induced grafting. J. Mater. Chem. B. 5, 2500-2510;
- Matthew D. Steven, Joseph H. Hotchkiss. (2008). Covalent immobilization of an antimicrobial peptide on poly(ethylene) film. J. Appl. Polym. Sci.. 110, 2665-2670;
- Clara T. H. Tran, Michael Craggs, Lee M. Smith, Keith Stanley, Alexey Kondyurin, et. al.. (2016). Covalent linker-free immobilization of conjugatable oligonucleotides on polypropylene surfaces. RSC Adv.. 6, 83328-83336;
- E. Kosobrodova, A. Mohamed, Y. Su, A. Kondyurin, C.G. dos Remedios, et. al.. (2014). Cluster of differentiation antibody microarrays on plasma immersion ion implanted polycarbonate. Materials Science and Engineering: C. 35, 434-440;
- Marcela M.M. Bilek. (2014). Biofunctionalization of surfaces by energetic ion implantation: Review of progress on applications in implantable biomedical devices and antibody microarrays. Applied Surface Science. 310, 3-10;
- Фам Т. (2017). Невозможный двигатель EmDrive: в космос без топлива. «Популярная механика»;
- Макаров В. (2017). Двигатель, нарушающий законы физики: будущее наступило сегодня. «Популярная механика».







