
Фармакогеномика: изучение генов на службе персонализированной медицины
14 июня 2019
Фармакогеномика: изучение генов на службе персонализированной медицины
- 9935
- 0
- 21
Фармакогеномика — новая и быстро развивающаяся наука, за которой будущее персонализированной медицины. Индивидуальные лекарственные реакции зависят от наследственности и часто различны у представителей разных человеческих популяций. Выявление генетических вариаций в биологических образцах позволяет проводить связь с определенными лекарственными реакциями. Информацию о связи «ген — лекарственная реакция» затем включают в специальные фармакогеномные базы данных, полезные в разработке лекарств и при назначении медикаментозной терапии. И хотя все это пока не стало обыденным, примеры применения фармакогеномики существуют уже сегодня.
-
Автор
-
Редакторы
-
Рецензент
Наблюдения проявлений наследственных различий имеют долгую историю и восходят к античности. Однако о наследственной природе индивидуальных лекарственных реакций стало известно относительно недавно. В нашей статье описана история развития фармакогеномики. Разбирается влияние генетических факторов на действие лекарств: их эффективность и безопасность. Рассматриваются и наиболее важные медицинские приложения фармакогеномики: кардиология, онкология, психиатрия и лечение инфекционных заболеваний. Сейчас фармакогеномика только начинает разбег, но потенциал ее непрерывно растет. И, возможно, придет день, когда при подборе лечения нормой станет учитывать генетические особенности пациента. Это поможет персонализировать медицину и повсеместно реализовать известный постулат: лечить надо не болезнь, а больного.
Роль фармакогеномики в медицине
В современном мире многие лекарства назначают так, как если бы они одинаково хорошо работали у всех людей. Но из-за разного возраста, состояния здоровья, конституции тела, гендерных и генетических различий и других факторов люди не всегда одинаково реагируют на лекарственную терапию. В нашей статье речь пойдет о влиянии на лечение генетических различий. Мы постараемся разобраться, в какой степени такие различия определяют изменения в действии лекарств, и как знание об этом может помочь адаптировать терапию под пациентов, повысив ее результативность и безопасность.
Фармакогеномика зародилась на стыке двух дисциплин: фармакологии (науки о лекарствах и их действии на организм) и геномики (изучении генов и их функций). Ее цель — выявить связь между наследуемым признаком и лекарственной реакцией. Индивидуальные лекарственные реакции зависят от наследственных различий в фармакокинетике (процессах всасывания, распределения, метаболизма и выведения из организма лекарственных молекул) и фармакодинамике (изменениях молекул, участвующих в механизмах действия лекарств).
Существует еще термин «фармакогенетика», под которым понимают изучение влияния отдельных генов на лекарственные реакции, подчеркивая ее отличие от фармакогеномики, изучающей влияние на такие реакции целого генома. Часто эти термины используют взаимозаменяемо, так же поступим и мы: в этой статье в основном будет фигурировать термин фармакогеномика, а фармакогенетика будет упоминаться только в историческом контексте.
Поиск наследственных особенностей, влияющих на эффекты лекарств, проводят с помощью фармакогеномного тестирования. Получаемая информация играет две основные роли:
- Помогает практикующим врачам правильно подбирать препараты и их дозы.
- Помогает фармацевтическим компаниям создавать новые лекарства — более безопасные и эффективные.
История новой науки

Рисунок 1. Уильям Ослер — выдающийся канадский врач, педагог, философ и историк медицины. За вклад в создание современной системы медицинского образования его часто называют «отцом современной медицины».
Еще в конце XIX века известный канадский врач Уильям Ослер отмечал влияние индивидуальных различий пациентов на их лечение (рис. 1). Известно его высказывание: «Если бы пациенты не были такими разными, медицина вполне могла бы быть наукой, а не искусством» [1]. Остроумный афоризм Ослера очень точно отражает характерную для его времени пропасть между необходимостью персонализировать лечение и отсутствием научной базы для этого.
Сейчас известно, что различия в реакциях на терапию во многом обусловлены наследственностью; в частности, до 50% всех побочных реакций определяются генетикой [2]. Однако связь между генами и реакциями на лечение была выявлена далеко не сразу.
Фармакогенетика
Истоки фармакогенетики уходят корнями в античную эпоху. Еще в 510 г. до н.э. Пифагор наблюдал недомогание людей, употреблявших в пищу конские бобы [3]. Болезнь, наблюдаемая древнегреческим мыслителем, ныне известна как фавизм (по латинскому названию конских бобов — Vicia faba), и, как мы увидим, ее причина кроется в наследственности.

Рисунок 2. Арчибальд Эдвард Гаррод — английский врач, первым предположивший, что нарушения в метаболизме могут быть наследственными
Много позже, в начале XX века, английский врач Арчибальд Гаррод наблюдал пациентов с алкаптонурией — редким семейным заболеванием, в основе которого лежит нарушение аминокислотного обмена (рис. 2). У страдающих этой болезнью моча быстро темнеет на воздухе, причем такой симптом проявляется уже у новорожденных, отчего алкаптонурию называют также синдромом черных пеленок. Причиной заболевания является врожденное отсутствие одного из окисляющих ферментов, из-за чего последовательность метаболических превращений тирозина проходит не до конца, останавливаясь на промежуточном продукте — гомогентезиновой кислоте, которая выходит с мочой, вызывая ее потемнение. У взрослых людей эта кислота накапливается в костях, суставах и некоторых органах, вызывая их поражение.
Изучая случаи алкаптонурии в нескольких семьях, Гаррод пришел к выводу, что причина болезни — наследственное изменение метаболизма. На основе сделанных наблюдений он сформулировал гипотезу о химической индивидуальности и предположил, что такая индивидуальность является врожденной. В 1931 году вышла книга «Врожденные факторы болезней», в которой Гаррод изложил свои выводы. Его предположения были очень прогрессивными для времени, когда генетика в ее современном понимании только зарождалась.
В тех же 1930-х годах американский химик Артур Фокс синтезировал различные соединения в поисках сахарозаменителя. Одно из таких соединений — производное мочевины фенилтиокарбамид — оказалось разным на вкус для разных людей. Некоторые считали его горьким, другие — безвкусным. Как выяснилось, причина таких различий — генетически обусловленное наличие или отсутствие одного из рецепторных белков.
Однако подлинное становление фармакогенетики как науки было связано с наблюдениями за различиями в реакциях на лекарственную терапию.
Во время Второй мировой войны у американских солдат, получающих противомалярийный препарат примахин, отмечались острые симптомы: высокая температура, боли в голове и животе, анемия и др. Это были симптомы фавизма — той самой болезни, которую наблюдал еще Пифагор. Что самое интересное — подобные симптомы испытывали исключительно солдаты африканского происхождения, что наталкивало на мысли о генетической природе болезни.
В настоящее время известно, что фавизм вызывает сниженный уровень фермента глюкозо-6-фосфатдегидрогеназы (G6PD) вследствие высокой изменчивости (полиморфизма) гена, кодирующего данный фермент. Как выяснилось, G6PD участвует в нескольких биохимических реакциях, влияющих на восстановление глутатиона — антиоксиданта, защищающего клетки от окисления. У людей с наследственно сниженным уровнем G6PD такая защита нарушена, что приводит к разрушению эритроцитов под действием окислителей, содержащихся в некоторых пищевых продуктах и лекарствах. Именно это и постигло афроамериканских солдат, принимавших примахин (рис. 3) [4].
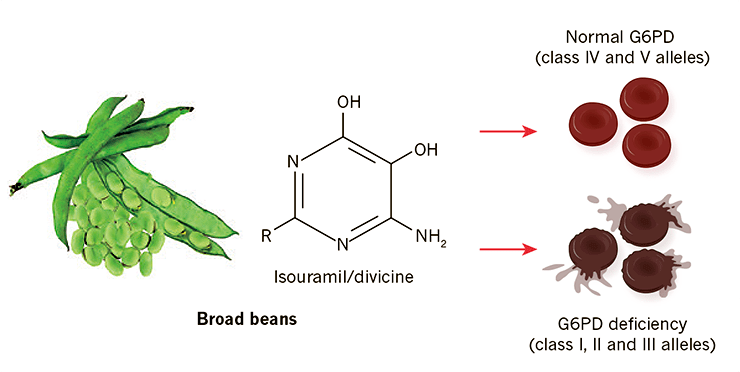
Рисунок 3. Наследственная гемолитическая анемия — фавизм. Считается, что Пифагор запретил употребление бобов своим ученикам, заметив недомогание, ныне известное как фавизм. Болезнь проявляется преимущественно у людей с дефицитом глюкозо-6-фосфатдегидрогеназы (G6PD), унаследовавших так называемый «средиземноморский аллель» класса II, кодирующий G6PD. Эритроциты этих несчастных повреждаются содержащимися в конских бобах алкалоидами: изоурамилом (R = OH в формуле на рисунке) и дивицином (R = NH2). Некоторые лекарственные препараты (в их числе и примахин) вызывают похожее действие — мощный окислительный стресс, приводящий к разрушению эритроцитов.
В дальнейшем наблюдали и другие различия в лекарственных ответах, и впоследствии накапливающиеся данные привели к пониманию наследственной природы таких особенностей. В частности, в 1950-х годах в качестве дополнения к анестезии при операциях применяли миорелаксант суксаметоний, и примерно у одного из 2500 человек это приводило к опасным побочным эффектам ─- значительному увеличению продолжительности действия, что вкупе с сопутствующей остановкой дыхания угрожало жизни больного [1], [5]. Миорелаксант у этих пациентов действовал дольше в связи с наследственной недостаточностью фермента псевдохолинэстеразы, в норме быстро инактивирующего суксаметоний.
Также в 1950-х годах отмечали побочные эффекты противотуберкулезного препарата изониазида, что было связано с наследственным снижением фермента N-ацетилтрансферазы, о чем речь пойдет ниже.
К концу 1950-х накопилось множество наблюдений для закрепления официального статуса фармакогенетики как новой науки. Важной вехой второй половины 1950-х стал выход фундаментальной работы Арно Мотульского под названием «Лекарственные реакции, ферменты и биохимическая генетика» [6], в которой автор обобщил данные о влиянии наследственности на терапию.
Позже, в 1959 году, немецкий врач Фридрих Фогель впервые ввел термин «фармакогенетика», что можно считать официальной датой рождения новой науки. А уже в 1962 году вышел первый учебник по новой дисциплине за авторством Вернера Калова [1], [7].
Открытие цитохромов P450 (CYP450)
Развитие фармакогенетики во многом определило открытие особых ферментов, способных химически модифицировать молекулы лекарств. Такая модификация, известная как метаболизм (или биотрансформация), — естественный процесс, включающий те же механизмы, что используются и для нормального усвоения компонентов пищи.
Главный фермент метаболизма открыли в 1950-х годах в исследовательском фонде Джонсона университета Пенсильвании. И сделал это биохимик Мартин Клингерберг, обнаруживший в клетках печени крысы неизвестный доселе фермент, способный связывать монооксид углерода (угарный газ). Анализируя спектры нового фермента, Клингерберг выявил нехарактерный для других цитохромов пик поглощения при длине волны 450 нм [85].
Несколько лет спустя японские исследователи Цунео Омура и Рио Сато изучали тот же загадочный фермент, выделив его уже из клеток печени кролика. Экспериментальным путем они установили, что этот фермент подобно гемоглобину содержит небелковый компонент — гем, — и именно он связывает молекулу CO. Для необычного белка было предложено название — «P450» («пигмент 450») [86], [87].
В дальнейшем выяснилось, что CYP450 — большое суперсемейство ферментов, участвующее в метаболизме многих лекарств. Причем подобные ферменты обнаружили во всех доменах жизни: от животных, растений, грибов и простейших до бактерий, архей и вирусов. Оказалось, что для генов, кодирующих ферменты CYP450, характерен высокий полиморфизм, приводящий к различиям в метаболизме лекарств, а это, в свою очередь, влияет на эффект лечения.
Сегодня известно, что суперсемейство CYP450 включает более 50 ферментов, причем шесть из них участвуют в метаболизме около 90% существующих препаратов [8]. Первым из ферментов с установленной генетической и функциональной вариабельностью стал CYP2D6 (1977 г.). Это один из главных ферментов биотрансформации, участвующий в метаболизме примерно 25% существующих лекарств [9].
Фармакогеномика
Фармакогенетика изначально изучала влияние отдельных генетических вариаций на действие лекарств, и это накладывало на нее ограничения, ведь лекарственные ответы часто зависят от изменений сразу нескольких генов, и для принятия корректных клинических решений необходимо учитывать их совокупное влияние.
Решение этой проблемы наметилось одновременно с входом в «постгеномную эру», когда после прочтения полной информации человеческой ДНК (проект «геном человека», 2003 г.) было создано несколько общедоступных баз данных генов человека [10], [11], а затем и специальных фармакогеномных баз, содержащих данные о генах, влияющих на лечение.
Термин «фармакогеномика» во многом появился из-за моды на добавление греческого суффикса «омика» к названию новых областей научного знания [12], что в данном случае подчеркивает привлечение геномики для изучения лекарственных ответов.
Молекулярно-биологические основы фармакогеномики
Для персонализации терапии с учетом наследственности требуется знание молекулярно-генетических различий между людьми, а именно — изменения фрагментов ДНК, кодирующих белки, взаимодействующие с молекулами лекарств.
Генетический базис
Носителями наследственной информации в клетках являются хромосомы — сложные молекулярные комплексы, состоящие из ДНК и белков. ДНК хранит и передает наследственную информацию в форме последовательности нуклеотидов (полимера), состоящих из остатков сахара (дезоксирибозы), фосфорной кислоты и одного из четырех азотистых оснований: гуанина, цитозина, аденина и тимина (рис. 4). В определенных последовательностях нуклеотидов — генах — заложена информация о последовательностях аминокислот в белках; правило, по которому происходит это кодирование, называется генетическим кодом.
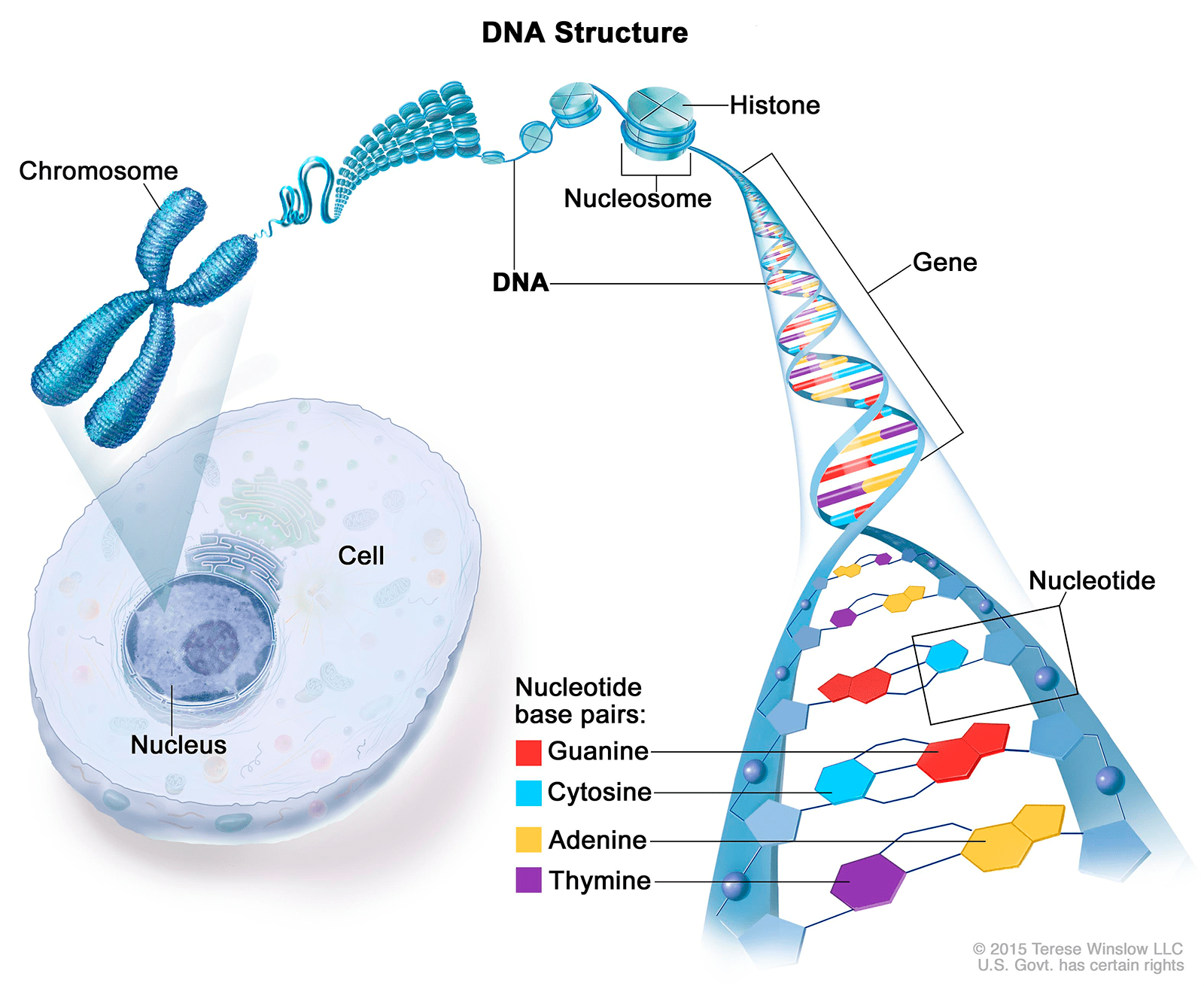
Рисунок 4. Организация генетического материала в клетках. Молекулы ДНК с белками-гистонами образуют структурные единицы — нуклеосомы, которые затем компактизуются в хромосомы, локализованные в ядре клетки. ДНК состоит из двух полинуклеотидных цепей, закрученных друг вокруг друга в знаменитую двойную спираль.
Генетическая вариабельность: различия в последовательностях ДНК
Геном человека состоит примерно из 20–22 тысяч генов [11], [13] длиной от нескольких сотен до нескольких тысяч нуклеотидов (рис. 5). При этом, несмотря на то, что ДНК любых двух индивидов общей длиной >3 млрд пар оснований идентична более чем на 99%, количество возможных сочетаний нуклеотидов настолько велико, что в геноме человека встречаются миллионы различных версий (аллелей) существующих генов [14]. Различия в генах приводят к различиям в аминокислотных последовательностях кодируемых ими белков, определяющих их структуру и функции.
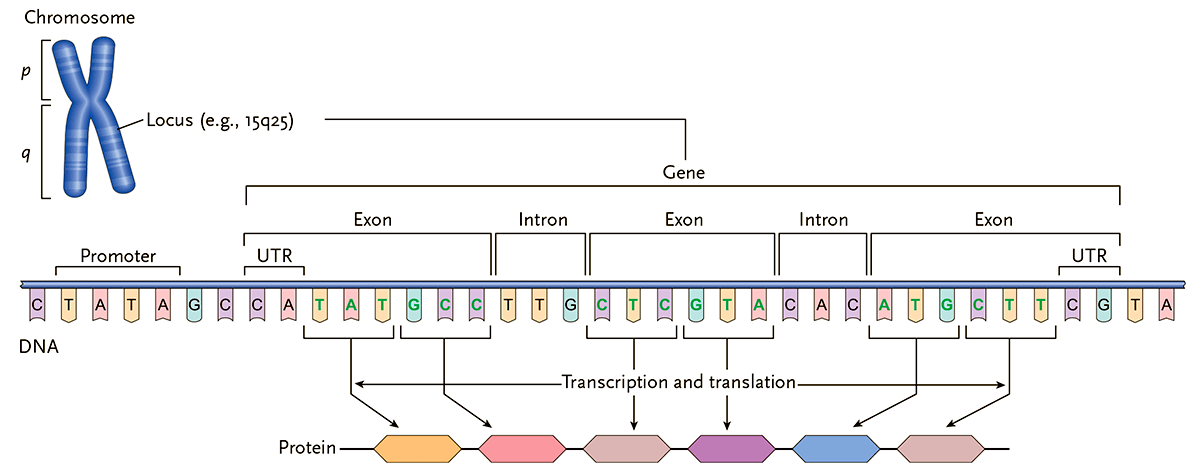
Рисунок 5. Структура гена. Гены локализованы в определенных участках на протяжении молекулы ДНК, «запакованной», в свою очередь, в хромосому. На схеме показана структура условного гена в положении 25 на длинном плече хромосомы 15. Упрощенно отображены основные структурные и функциональные участки: экзоны (кодирующие последовательности), интроны (некодирующие последовательности), UTR — нетранслируемые (регуляторные) участки, промоторы. Структура реальных генов значительно сложнее этой схемы.
Множественный аллелизм: разнообразие генофонда
Люди диплоидны, то есть имеют по две копии каждой из хромосом гаплоидного (одинарного) набора. Удвоение хромосомного набора возникает при слиянии гаплоидных половых клеток в результате оплодотворения. В итоге взрослый организм имеет по две копии каждого гена: одна на хромосоме, унаследованной от отца, вторая — от матери. Именно эти копии называют аллелями в классической генетике (рис. 6).
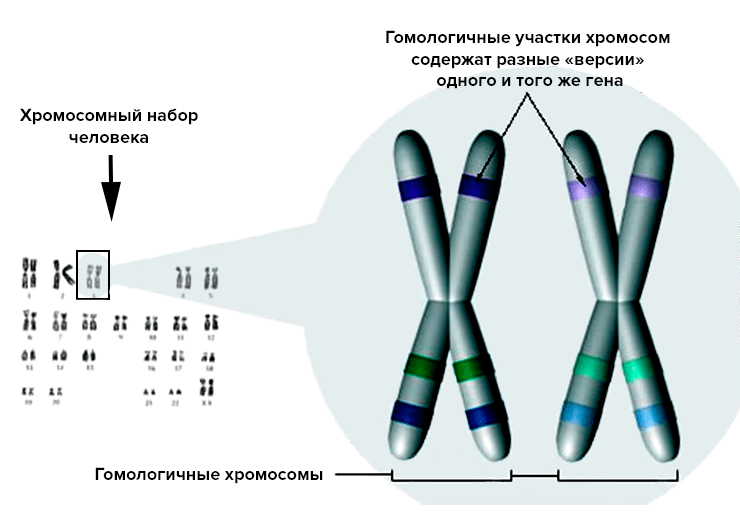
Рисунок 6. Диплоидный набор хромосом у человека. В идентичных участках гомологичных хромосом содержатся аллели: разные «версии» одного и того же гена, наследуемые от отца и матери. Эти версии отвечают за развитие одних и тех же признаков, поэтому от сочетания родительских аллелей зависит проявление кодируемого признака. Явление доминирования (подавление проявления одного аллеля другим) приводит к тому, что в фенотипе проявляется только один вариант гена (доминантный), а второй (рецессивный) как бы «незаметен». Помимо полного доминирования существуют и более сложные типы взаимодействий между аллелями (кодоминирование, сверхдоминирование и др.).
В более широком смысле под аллелями понимают любые альтернативные варианты генов, а их распространенность в человеческих популяциях (множественный аллелизм) — следствие наследственной изменчивости, обеспечивающей разнообразие генофонда. О некоторых типах альтернативных вариантов генов будет сказано ниже.
Классификация типов генетических вариаций
Существует несколько типов генетических вариаций. В их классификации в настоящее время наблюдается некоторая путаница. В частности, к точечным мутациям (замена одного нуклеотида на другой) зачастую относят как собственно однонуклеотидные замены (single nucleotide changes), так и однонуклеотидные вставки (single nucleotide insertions), а также однонуклеотидные делеции (single nucleotide deletions). Аналогично, однонуклеотидные полиморфизмы, или снипы (single nucleotide polymorphism, SNP), — иногда путают с точечными мутациями.
Уточним: снипы и точечные мутации, будучи структурно идентичными, отличаются частотой встречаемости. Снипы широко распространены в популяциях (>1%) и, по сути, являются вариантами нормы. Мутации же встречаются редко (<1%) и, как правило, вредны для здоровья, жизнеспособности и репродуктивных возможностей их носителей. В то же время структурная идентичность снипов и мутаций — не простое совпадение: в каком-то смысле эти вариации действительно одно и то же, и разграничивает их лишь эволюция. Благодаря естественному отбору более удачные для выживания аллели-снипы закрепляются и получают большее распространение, а менее удачные (такие как мутации) рано или поздно выбраковываются и потому менее распространены.
Еще запутанней выглядит классификация крупных структурных генетических вариаций (structural variations) и тандемных повторов (tandem repeats), о чем «Биомолекула» уже писала в статьях: «Под “генную гармошку”» [15], «Повтор, еще повтор!» [16] и «Геномная головоломка: открой в себе мозаика» [17].
В нашей статье мы не будем подробно останавливаться на всех терминологических нюансах классификации генетических вариаций. Ограничимся лишь ссылкой на публикацию из Journal of Human Genetics [18] и представленной на рисунке 7 схемой классификации таких вариаций из этой статьи.
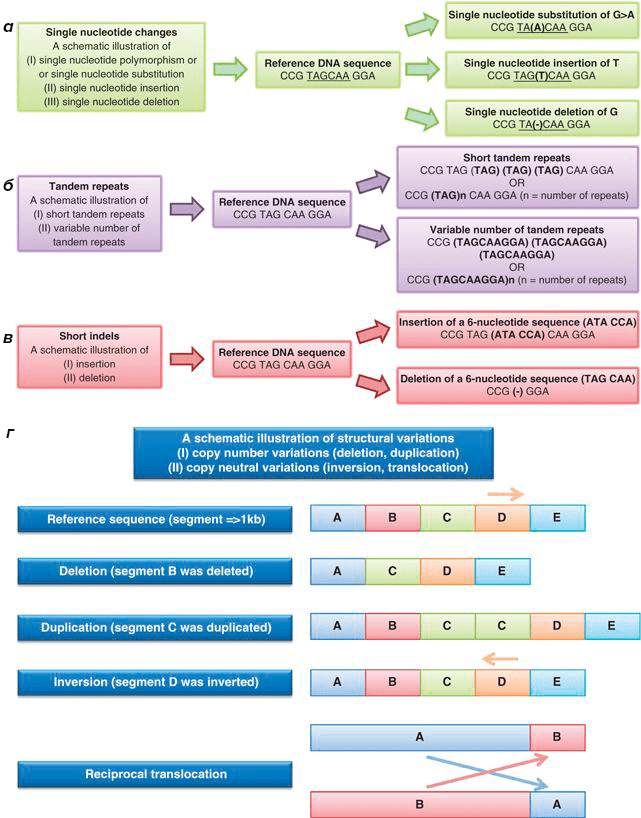
Рисунок 7. Основные типы генетических вариаций. а — Однонуклеотидные замены (single nucleotide changes). б — Тандемные повторы (tandem repeats). в — Короткие вставки и делеции (short indels). г — Крупные структурные генетические вариации (structural variations).
Фармакогеномная номенклатура
В фармакогеномике существует собственная номенклатура для обозначения генетических изменений, определяющих лекарственные ответы. При этом, как и в классификации генетических вариаций на основе их структуры, в фармакогеномной номенклатуре наблюдается некоторая путаница, и зачастую одни и те же изменения в генотипе обозначаются по-разному [19]. Мы собрали в таблице 1 несколько используемых в нашей статье и достаточно распространенных способов обозначения фармакогеномных маркеров.
| Система фармакогеномной номенклатуры | Описание | Примеры обозначений | Расшифровка обозначений |
|---|---|---|---|
| Номенклатура для обозначения однонуклеотидных полиморфизмов (SNP nomenclature) | Однонуклеотидные полиморфизмы (снипы — замены в ДНК одного нуклеотида другим) — наиболее частые генетические вариации. В геноме человека обнаружено приблизительно 11 миллионов снипов [20]. | ABCB1 3435 C > T | Первые несколько букв/цифр обозначают определенный ген (ABCB1).Последующие числа обозначают нуклеотидную позицию в гене (3435). Далее идет обозначение замены нуклеотида, характерного для нормального («дикого») аллеля* (С), на нуклеотид, описывающий данный снип (T) |
| Номенклатура для обозначения гаплотипов (Haplotype nomenclature) | Под гаплотипом подразумевается совокупность сцепленных аллелей на локусах одной хромосомы, обычно наследуемых вместе | Гаплотип A Гаплотип B |
Гаплотип (A или B) включает несколько сцепленных снипов в разных участках одной хромосомы, которые наследуются совместно |
| «Звездная» номенклатура (Star nomenclature) | «Звездная» номенклатура была введена еще в 1990-х годах и получила широкое распространение до наших дней. При этом под «звездным» аллелем может скрываться как снип, так и несколько сцепленных вместе генетических вариаций в составе гаплотипа. | CYP2C9*1 CYP2C9*2 |
Первые несколько букв/цифр обозначают определенный ген (CYP2C9). Звезда (*) и номер после гена обозначают аллель. Как правило, *1 обозначает аллель дикого типа, а другие числа (например, *2 или *3) — альтернативные аллели. Однако *1 обычно присваивают первому изученному в той или иной популяции аллелю, а он не всегда самый распространенный во всех популяциях. Например, для NAT2 эталонный аллель — NAT2*4, который встречается у человека чаще других. |
| * — Под «диким» (или нормальным) типом подразумевают наиболее распространенный аллель в популяции, нуклеотидная последовательность которого используется в качестве эталонной, — ее изменения идентифицируют как полиморфизмы. | |||
Методы генотипирования
Для идентификации генетических вариаций доступны различные методы. Для выявления снипов ген чаще «размножают» с помощью ПЦР с последующей идентификацией уже известных генетических вариаций — такой подход используется в рутинной клинической практике ввиду его относительной бюджетности и доступности.
Метод ПЦР подробно описан в статье «Биомолекулы»: «12 методов в картинках: полимеразная цепная реакция» [21].
Также используют ДНК-микрочипы, позволяющие выявлять сразу несколько фармакогеномных маркеров [22], [23]. Эти микрочипы содержат до нескольких сотен тысяч коротких последовательностей ДНК, закрепленных на твердой матрице из кремния или стекла. Гибридизация (связывание) молекул ДНК биологического образца с такими последовательностями позволяет одномоментно выявлять до нескольких десятков генетических изменений (рис. 8).
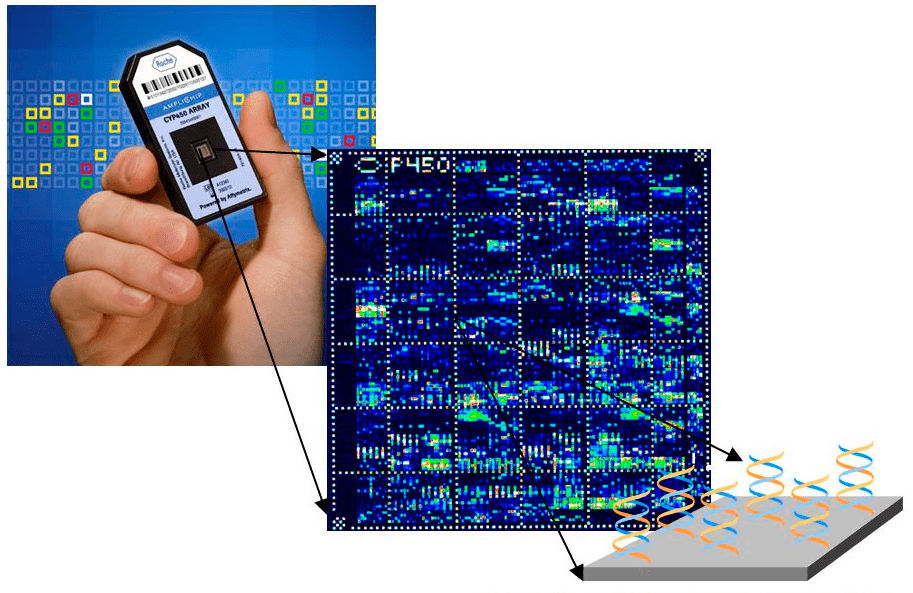
Рисунок 8. AmpliChip P450 — первая фармакогеномная тест-система на основе технологии ДНК-микрочипов (выпущена в 2005 году компанией Roche). AmpliChip P450 идентифицирует вариации генов CYP2D6 и CYP2C19, связанные с вариабельностью лекарственных ответов при терапии нейролептиками и антидепрессантами [24]. Каждые 20 мкм поверхности ДНК-чипа содержат 107 коротких ДНК-сиквенсов для гибридазации с нуклеотидными последовательностями анализируемых биологических образцов.
Кроме того, в фармакогеномных исследованиях используют метод полногеномного поиска ассоциаций (genome-wide association studies, GWAS). В таких исследованиях с помощью ДНК-микрочипов идентифицируют сотни тысяч или даже миллионы снипов у людей в исследуемой и контрольной группах. Затем полученные результаты сравнивают, чтобы выявить достоверную корреляцию между генетическими вариациями и лекарственными реакциями (рис. 9).
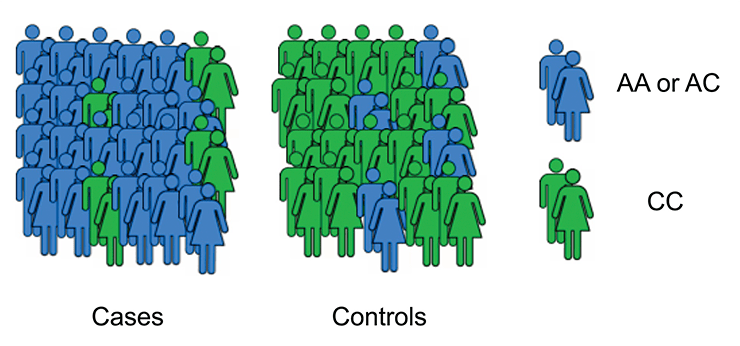
Рисунок 9. Один из методов исследования в фармакогеномике — GWAS. В этом методе сравнивают геномы двух групп людей: исследуемой и контрольной. Исследуемая группа состоит из людей, имеющих определенные реакции на лекарственную терапию, контрольная — из людей, не имеющих таких реакций. После генотипирования с помощью ДНК-микрочипов выявляют статистически значимые различия по идентифицированным маркерам. Наличие таких различий в исследуемой группе в сравнении с контролем говорит о взаимосвязи выявленных изменений и лекарственных ответов. Впрочем, здесь важно помнить формулировку «корреляция еще не означает причинно-следственной связи».
GWAS широко применяют в исследованиях генома, хотя метод и имеет ряд ограничений, накладываемых как его особенностями, так и особенностями исследуемых групп людей [25], [26]. Кроме этого, всё чаще используют технологии высокопроизводительного секвенирования нового поколения (next generation sequencing, NGS) . С помощью таких технологий анализируют большой объем геномной информации, что позволяет более точно идентифицировать снипы, включая редкие полиморфизмы, а также выявлять крупные структурные изменения в геноме. Повышение разрешающей способности вкупе с постоянным удешевлением делают секвенирование перспективным методом генотипирования [5].
«Биомолекула» много и со вкусом писала о секвенировании нуклеиновых кислот: «12 методов в картинках: секвенирование нуклеиновых кислот» [27], «Нанопоровое секвенирование: на пороге третьей геномной революции» [28], «454-секвенирование (высокопроизводительное пиросеквенирование ДНК)» [29] и мн. др. — Ред.
Фармакология: как лекарства работают и почему гены влияют на это?
Фармакология изучает лекарства и их действие на организм человека. Вот два ее основных раздела:
- Фармакокинетика описывает совокупность биохимических и физиологических процессов, происходящих с лекарством после попадания в организм.
- Фармакодинамика описывает влияние лекарств на организм, которое во многом определяется механизмом действия. Механизм действия препаратов часто направлен на определенную мишень (или мишени) в клетках.
Особенности фармакокинетики и фармакодинамики влияют на действие лекарств и, безусловно, должны учитываться при назначении медикаментозной терапии. Эти параметры обязательно тестируют в доклинических и клинических исследованиях при создании новых препаратов [30], [31]. Поговорим об этих процессах подробнее.
Фармакокинетика: что в организме происходит с лекарством?
После приема лекарства его молекулы совершают своего рода путешествие по телу: они должны настигнуть свою «мишень», воздействовать на нее и удалиться из организма. На этом пути им придется преодолеть ряд этапов, известных как ADME, от прохождения которых зависит, как быстро лекарство достигнет своей цели и как долго будет длиться его действие (рис. 10).
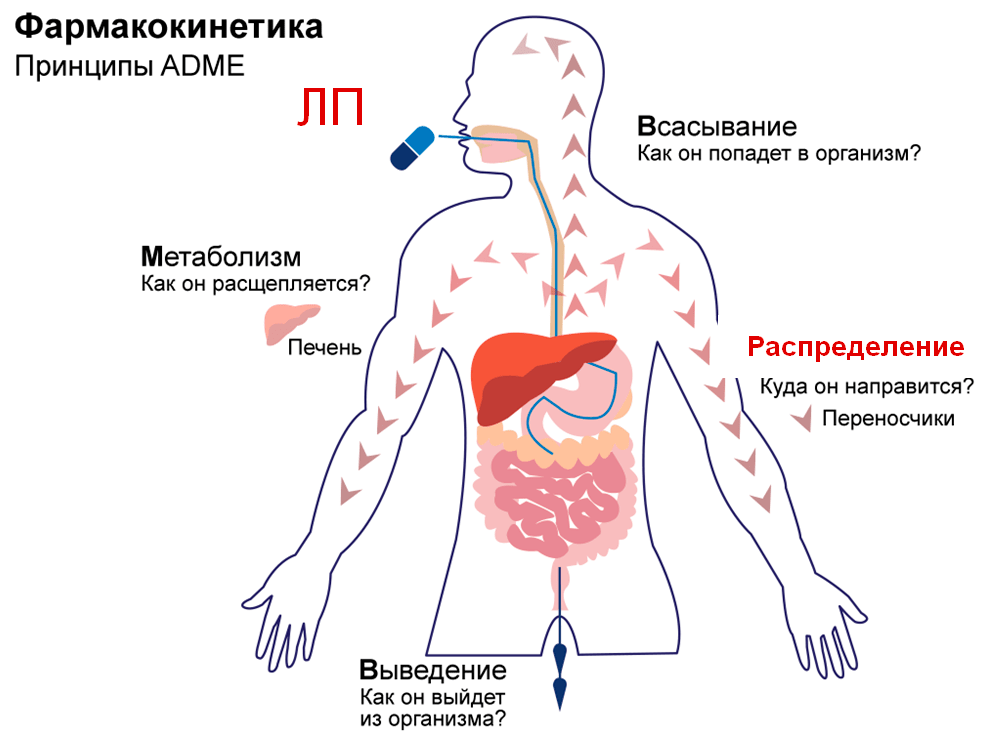
Рисунок 10. Основные фармакокинетические процессы обозначаются аббревиатурой ADME: absorbtion (всасывание), distribution (распределение по органам и тканям), metabolism (метаболизм или биотрансформация), excretion (экскреция или выведение). Лекарства всасываются в желудке или кишечнике и через воротную вену (показана синим цветом) попадают в печень, где подвергаются метаболизму. Из печени лекарства попадают в системный кровоток, в котором и распределяются по органам и тканям. Затем в определенный момент лекарства выводятся через выделительную систему .
Показан путь лекарств, принимаемых перорально (то есть через рот) — их большинство. Путь препаратов с другими способами введения (например, ректальным, сублингвальным, внутривенным и др.) несколько отличается.
Белки участвуют во всех этих процессах, влияя на действие лекарств. Например, белки-переносчики (или транспортёры) участвуют во всасывании и выведении, изменяя концентрацию в крови и биодоступность препаратов. При распределении лекарств с ними связываются белки плазмы крови, изменяя эффективность и время выведения. Наконец, ферменты метаболизма также особым образом влияют на действие лекарств, о чем речь пойдет ниже.
Фармакодинамика: как работают лекарства?
В какой-то момент молекулы лекарства встречаются со своими мишенями, а это часто белки (рецепторы, ферменты, белки-переносчики и др.), и связываются с ними в особых участках — сайтах связывания (рис. 11). Большинство лекарств связывается в этих сайтах за счет слабых межмолекулярных взаимодействий (гидрофобных контактов, ионных мостиков и водородных связей [32]), однако некоторые лекарства (например многие химиотерапевтические агенты) образуют с мишенями и прочные ковалентные связи. Всё это влечет физиологические изменения на клеточном уровне, что и приводит, в конечном счете, к терапевтическому эффекту.
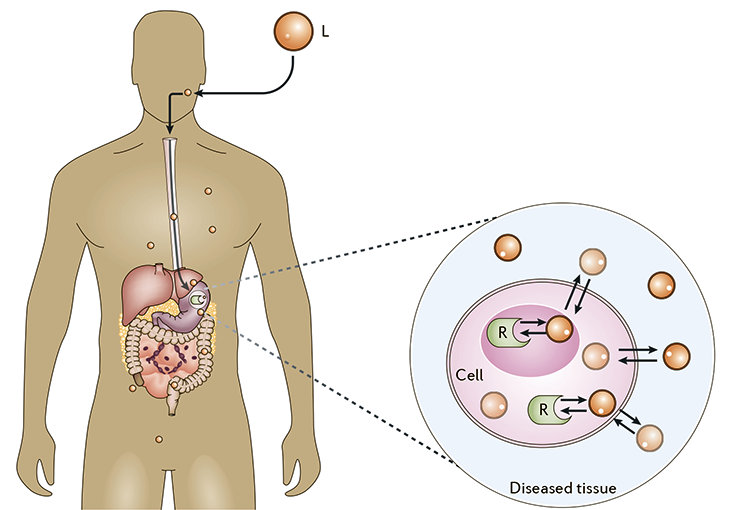
Рисунок 11. Молекулы лекарства доходят до клеток и связываются с мишенями (на картинке — с внутриклеточными рецепторами)
Генетическая вариабельность и действие лекарств
Генетические вариации белков, участвующих в фармакокинетических и фармакодинамических взаимодействиях, изменяют действие лекарств, причем особое значение имеют вариации генов, кодирующих ферменты метаболизма и белки-переносчики, а также белки-мишени лекарств (рис. 12).
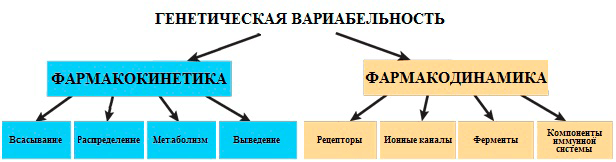
Рисунок 12. Генетическая вариабельность влияет на фармакокинетику и фармакодинамику, и такое влияние может изменять эффективность действия лекарств и увеличивать риск нежелательных побочных реакций
Вариации генов, кодирующих фармакокинетические белки, приводят к различиям в профиле параметров ADME (всасывания, распределения, метаболизма и выведения), а вариации генов, кодирующих мишени, влияют на эффективность лекарств, изменяя количество таких белков в организме или модулируя их молекулярную структуру и затрудняя связывание с лекарством.
Роль метаболизма
Метаболизм в основном проходит в печени — главном органе детоксикации, хотя ферменты, участвующие в этом процессе, присутствуют и в других тканях организма (рис. 14).
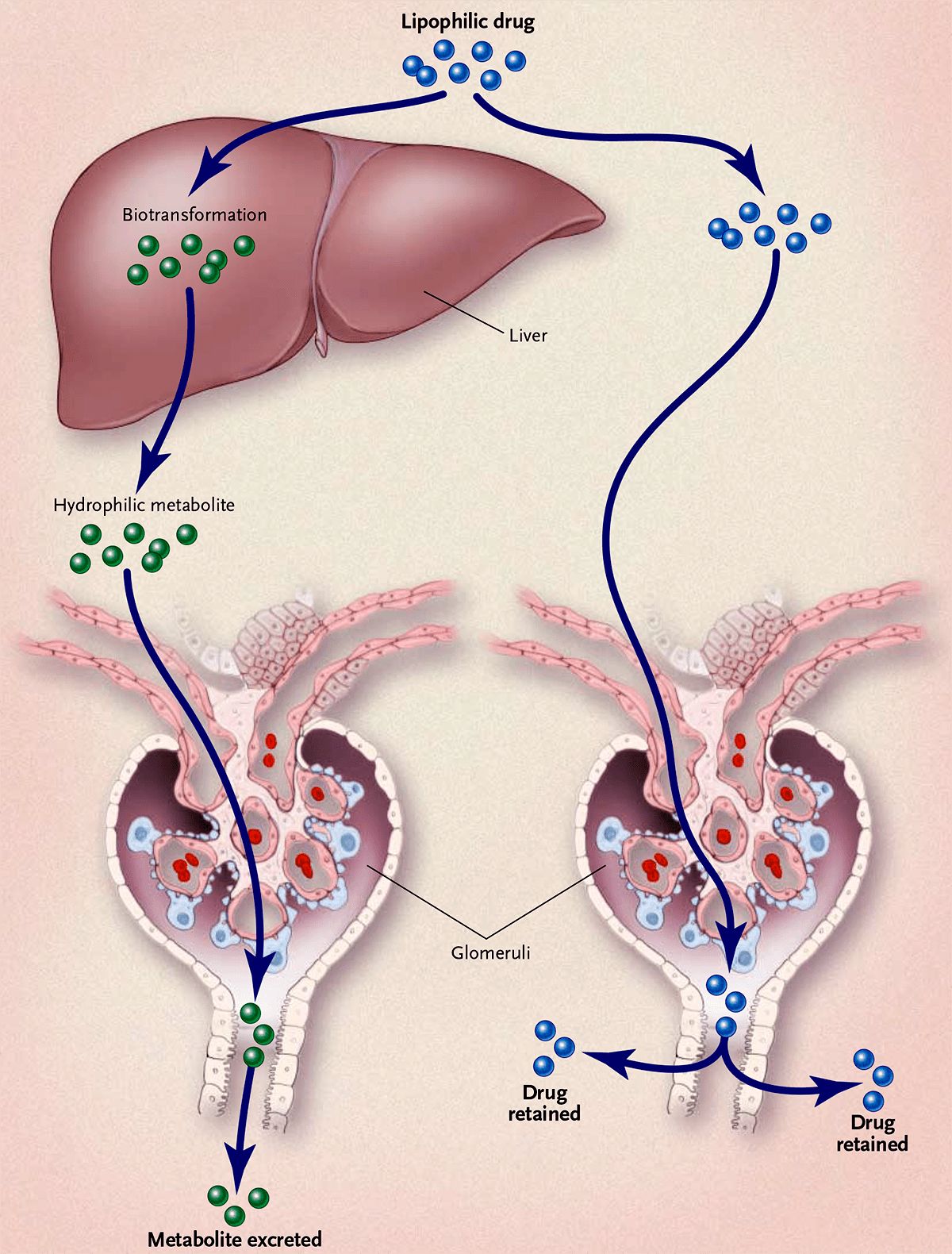
Рисунок 14. Биотрансформация в клетках печени — преобразование жирорастворимых лекарственных веществ в водорастворимые метаболиты, которые затем выводятся через почки
Большинство лекарств гидрофобны : они хорошо растворимы в липидах и плохо — в воде. Ферменты превращают жирорастворимые молекулы в водорастворимые метаболиты, которые лучше выводятся из организма [35]. В основном лекарства выходят с мочой, но иногда также экскретируются через желудочно-кишечный тракт в составе желчи (рис. 15). Помимо основных путей экскреции (через почки и кишечник), лекарства выводятся из организма через потовые и слюнные железы и др. Но доля такого выведения незначительна [36].
Подробнее о таком фундаментальном явлении как гидрофобный эффект можно прочесть в статье «Физическая водобоязнь» [37].
Здесь речь главным образом о метаболизме и выведении малых молекул — терапевтические моноклональные антитела слишком велики для фильтрации почками и в норме с мочой не выходят, а их экскреция с желчью крайне невелика [38].
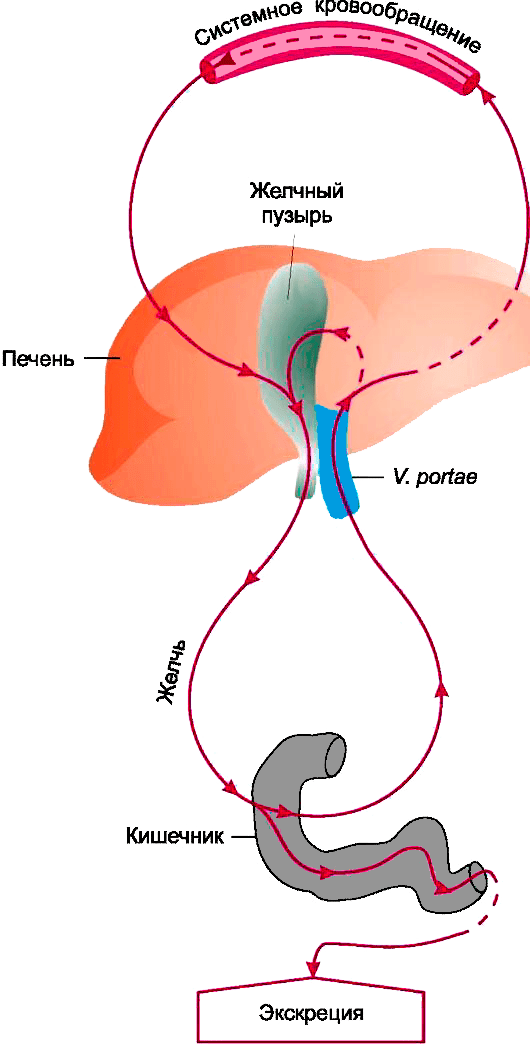
Рисунок 15. Схема кишечной экскреции лекарств. Лекарства секретируются в желчь, затем через желчные протоки попадают в кишечник, после чего выходят из организма. Любопытно, что часть лекарственных молекул, поступающих с желчью в кишечник, подвергается реабсорбции — обратному всасыванию, после которого они поступают через воротную вену в печень, откуда либо снова попадают в желчь и выделяются обратно в кишечник (печеночно-кишечная циркуляция), либо через системный кровоток доходят до почек и удаляются уже через них. Такой «лекарственный круговорот» увеличивает продолжительность действия препаратов.
«Фармакология» Д.А. Харкевича
Как гены меняют метаболизм
Сегодня известно около 30 семейств ферментов, участвующих в метаболизме [39], а полиморфизмы кодирующих их генов модулируют действие многих лекарств.
Как уже упоминалось, CYP2D6 стал первым ферментом суперсемейства CYP450, для которого выявили связь генетической вариабельности с функциональностью при изучении метаболизма дебризохина (лекарства от повышенного кровяного давления) и спартеина (для лечения аритмии). Активность CYP2D6 стали связывать с четырьмя типами метаболизма: сверхбыстрым, быстрым, медленным и промежуточным.
Впоследствии выяснилось, что разделение людей на группы по скорости метаболизма этих двух препаратов справедливо и для метаболизма других лекарств, что послужило основой для использования дебризохина и спартеина в качестве маркеров типа лекарственного метаболизма (табл. 2).
| Фенотип метаболизатора | Генотип | ||
|---|---|---|---|
| Гены, кодирующие ферменты биотрансформации | |||
| Количество функционально активных копий гена | Количество дефектных копий гена | Количество частично дефектных копий гена | |
| Сверхбыстрый (ultrarapid) | 3 или 2 | ─ | ─ |
| Быстрый (extensive) | 2 или 1 | 1 или 0 | ─ |
| Медленный (poor) | 0 | 2 или 1 | ─ |
| Промежуточный (intermediate) | 0 | 1 или 0 | 2 или 1 |
Как видно из таблицы, интенсивность метаболизма зависит от количества и функциональности генов, кодирующих ферменты. Нуклеотидные различия таких генов приводят к появлению альтернативных вариантов кодируемых ими белков (изоформ), отличающихся ферментативной активностью, а различия в количестве копий генов приводят к изменению количества соответствующих ферментов, что также изменяет ферментативную активность.
Разная ферментативная активность у разных людей приводит к различному действию одних и тех же доз лекарств. Например, если активное лекарство слишком быстро метаболизируется, это может снизить его эффективность, однако для пролекарств, напротив, быстрый метаболизм повысит уровень их активных метаболитов в крови и усилит действие.
С другой стороны, замедление метаболизма может приводить к ухудшению выведения и увеличению продолжительности действия препаратов. Учет влияния метаболизма на уровне лекарственных веществ в организме (как исходных форм, так и их метаболитов), особенно важен при лечении препаратами, соединения которых имеют высокую токсичность.
Вариабельность белков-переносчиков меняет действие лекарств
Встроенные в мембрану клетки белки-переносчики служат для переноса различных веществ (в том числе лекарств) между цитоплазмой и окружающей средой. Функциональность этих белков зависит от вариабельности кодирующих их генов. Яркий пример — мутация гена, кодирующего хлоридный канал CFTR, приводящая к муковисцидозу .
О механизме развития муковисцидоза и роли наследственности в этом процессе «Биомолекула» уже писала в статье «Муковисцидоз — первые надежды» [45].
Существуют два суперсемейства белков-переносчиков:
- Транспортеры растворенных веществ (solute carrier transporters) отвечают за пассивный транспорт веществ путем диффузии, без затраты энергии АТФ.
- Транспортеры ABC (ATP-binding cassette), напротив, осуществляют активный транспорт (с затратой энергии АТФ), причем они работают только на выкачивание веществ из клетки.
Транспортеры ABC и устойчивость к терапии
Системы биологической защиты живых организмов формировались под давлением естественного отбора в течение миллионов лет, и энергозависимое выведение веществ белками-переносчиками — одна из таких систем, защищающая клетки от токсичных веществ. Интересно, что транспортеры ABC специфичны к субстрату: выводят строго определенные вещества, среди которых — многие лекарства. Таким образом, заложенный эволюцией механизм защиты продолжает защищать организм уже в новых условиях среды, помогая ему адаптироваться к воздействию лекарств, также бывающих токсичными. Молекулы многих лекарств по химической структуре до определенной степени схожи со структурой природных токсинов, и этой схожести оказывается достаточно, чтобы транспортеры ABC распознавали лекарства как вещества, подлежащие удалению. Это часто приводит к лекарственной резистентности: транспортеры ABC снижают концентрацию лекарств в непосредственной близости от их мишеней, и мишени становятся недоступными лекарству, что снижает терапевтический эффект или даже сводит его к нулю.
P-гликопротеин — наиболее изученный транспортер ABC
Самый хорошо изученный транспортер ABC — P-гликопротеин (P-GP) [46], также известный как белок множественной лекарственной резистентности (multidrug resistance-1, MDR1) (рис. 17). Именно на примере P-GP мы и рассмотрим влияние генетической вариабельности белков-переносчиков на действие лекарств.
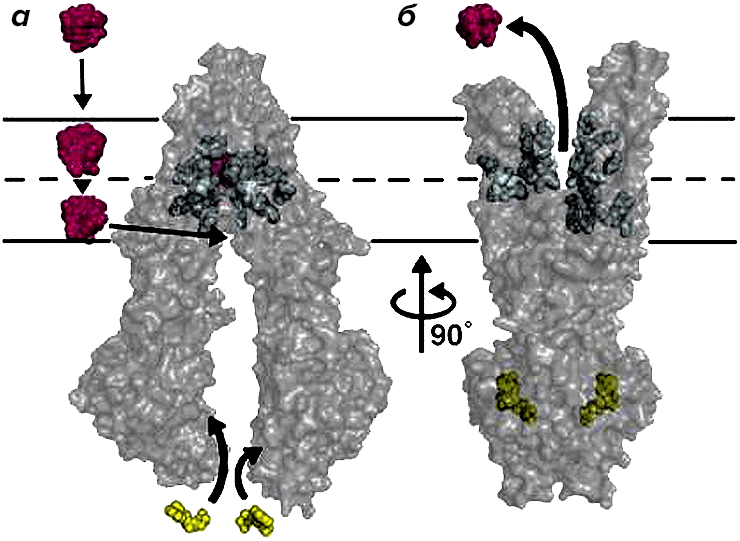
Рисунок 17. Схематическое изображение P-гликопротеина (P-GP) — белка суперсемейства транспортеров ABC. Молекулы АТФ (окрашены желтым цветом) связываются со специфичными участками P-GP (а), что приводит к изменению его конформации и выведению молекул-субстратов (окрашены красным) из клетки (б). К субстратам P-GP относятся вещества с разной химической структурой, но некоторыми общими свойствами — это небольшие гидрофобные молекулы с положительным зарядом и наличием ароматических колец.
Первоначально исследования P-GP были направлены на снижение множественной лекарственной устойчивости при лечении онкологических заболеваний [47]. Такая устойчивость вызвана повышенным выведением химиотерапевтических препаратов из опухолевых клеток вследствие увеличения числа P-GP в ответ на лечение определенным лекарством. При этом появление резистентности к одному лекарству делает опухолевые клетки устойчивыми и к другим препаратам [48].
В дальнейшем выяснили, что P-GP присутствуют в мембранах не только опухолевых, но и нормальных клеток — например, в тонком кишечнике, выделительных клетках печени и почек, клетках гематоэнцефалического барьера. Локализация P-GP влияет на фармакокинетику:
- P-GP клеток тонкого кишечника выводят молекулы лекарств в его просвет, ограничивая всасывание.
- P-GP выделительных клеток печени и почек усиливают выведение лекарств в желчь и мочу, способствуя их удалению из организма.
- P-GP же клеток гематоэнцефалического барьера ограничивают проникновение лекарств в ЦНС, тем самым защищая ее от потенциально опасных веществ [46].
Интересно, что препараты, в выведении которых принимает участие P-GP, зачастую метаболизируются ферментами уже знакомого нам семейства CYP450. Предполагается, что эти белки функционируют как скоординированная защита: CYP450 метаболизируют ксенобиотики до безопасной формы, в то время как P-GP выводят их из клеток и способствуют удалению из организма.
Вариации генов P-GP влияют на фармакокинетику
Генетическое изменение функциональности P-GP может способствовать повышению всасывания и снижению экскреции, а также повышению прохождения молекул через гематоэнцефалический барьер, что влияет на терапевтическую эффективность и вероятность появления побочных реакций ряда лекарств.
P-GP кодирует ген MDR1 (или ABCB1) с высоким полиморфизмом, обусловливающим различия в реакциях на лекарства не только между разными людьми, но и между разными расовыми и этническими группами. На сегодняшний день идентифицировано, по меньшей мере, 28 однонуклеотидных полиморфизмов гена MDR1.
Первым выявили однонуклеотидный полиморфизм ABCB1 3435 C > T [39]. Наряду с полиморфизмом ABCB1 2677 G > C, он влияет на фармакокинетику препарата дигоксина.
Всё лекарство и всё яд; и то и другое зависит от... генов?
Дигоксин — препарат класса сердечных гликозидов, получаемый из листьев наперстянки и применяемый для лечения сердечной недостаточности, а также некоторых видов аритмии. Сердечные гликозиды — вещества, вырабатываемые растениями для защиты от травоядных животных. Это природные яды, из-за чего соком содержащих их растений с давних времен смазывали наконечники стрел и другого оружия .
О сердечных гликозидах и других получаемых из растений лекарствах «Биомолекула» уже писала в статье «Зеленые лекарства будущего» [49].
Дигоксин, как и другие сердечные гликозиды, имеет низкий терапевтический индекс. Это означает, что для него существует достаточно узкий диапазон доз (терапевтическое окно) эффективного и безопасного применения: ниже границы такого диапазона эффективности не будет, а превышение дозы приведет к опасным побочным реакциям.
Подобно тому, как дебризохин и спартеин используют для тестирования типа метаболизма, дигоксин, как типичный субстрат P-GP, используют для «тестирования» этого белка. Такие исследования часто проводят на нокаутных мышах с «выключенным» геном MDR1 .
О технологии, позволяющей создавать генетически модифицированных мышей с «выключенными» генами, можно почитать в материале «Биомолекулы»: «Нобелевскую премию по физиологии и медицине вручили за технологию нокаутирования мышей» [50].
Эксперименты на мышах с отключенным геном MDR1 показали значительное изменение фармакокинетики дигоксина: наблюдалось увеличение всасывания, снижение выведения и более высокие концентрации в плазме крови. Похожий эффект наблюдался и у людей с полиморфизмами ABCB1 3435 C > T и ABCB1 2677 G > C [51].
Поскольку дигоксин имеет узкое терапевтическое окно, резкое увеличение его концентраций в крови чревато опасными побочными эффектами, среди которых: усталость, тошнота, рвота, анорексия, нарушения зрения, фибрилляция желудочков сердца и даже летальный исход. Очевидно, что в этих случаях необходимо снижать терапевтические дозировки как дигоксина, так и других лекарств-субстратов P-GP с низким терапевтическим индексом .
Здесь надо уточнить, что в настоящее время данные о влиянии полиморфизмов MDR1 на фармакокинетику дигоксина разнятся ─ некоторые исследователи говорят об отсутствии такого влияния. Однако ввиду высокого риска интоксикации, очевидна необходимость продолжения исследований.
Варфарин: как гены меняют его действие
Разберем влияние наследственности на терапию на примере варфарина. Его действие зависит от вариабельности молекулярной мишени, а также полиморфизмов ферментов метаболизма, и потому это хороший пример действия множественности генетических изменений на лекарственные ответы.
Варфарин — антикоагулянт непрямого действия, то есть препарат для снижения свертываемости крови, широко используемый для терапии тромботических осложнений при сердечно-сосудистых заболеваниях. Ниже мы рассмотрим механизм его действия, влияние генетических вариаций на фармакокинетику и фармакодинамику, а значит, и на лекарственные ответы.
Механизм действия
Напомним вкратце, как происходит свертывание крови . При нарушении целостности кровеносного сосуда красные кровяные пластинки (тромбоциты) прилипают к его поврежденной стенке, и из них выделяются факторы свертывания. Это в основном белки, главный из которых — тромбин — катализирует переход растворимого белка плазмы крови фибриногена в нерастворимый — фибрин. А он, в свою очередь, формирует сеть волокон, на которую прилипают все новые и новые эритроциты и тромбоциты. Именно так и формируется сгусток крови — тромб (рис. 18).
Более развернуто см. в материале «Биомолекулы» «Как работает свертывание крови?» [52].
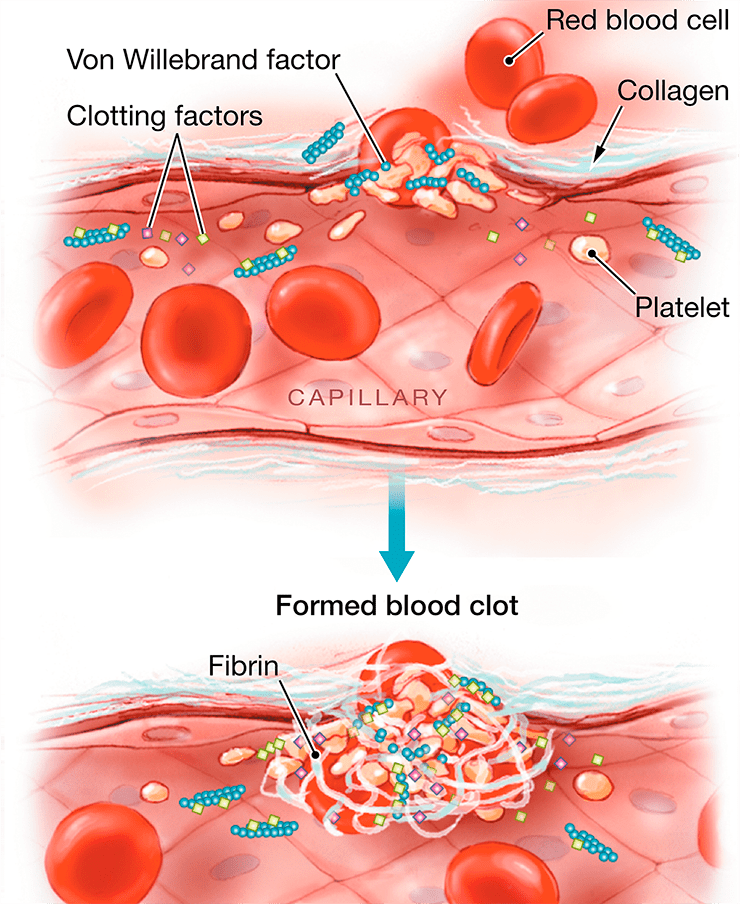
Рисунок 18. Свертывание крови. При нарушении целостности кровеносного сосуда тромбоциты прилипают к эндотелию (стенке кровеносного сосуда), и из них выделяются факторы свертывания, в частности тромбин. Тромбин способствует трансформации фибриногена в фибрин, формирующий сеть для тромбоцитов и эритроцитов, агрегирующих в сгусток крови — тромб.
Протромбин — предшественник тромбина — в цепи биохимических реакций переходит в тромбин под действием фактора свертывания крови Х, продуцируемого в печени при участии витамина K. Присутствие активной формы витамина K необходимо также для синтеза и других факторов свертывания.
Механизм действия варфарина основан на ингибировании активности эпоксидредуктазы витамина K — фермента, отвечающего за трансформацию витамина К из неактивной формы в активную (рис. 19). Отсутствие активной формы витамина K вызывает ингибирование биосинтеза факторов свертывания, что приводит к блокированию трансформации протромбина в тромбин и нарушению коагуляции.
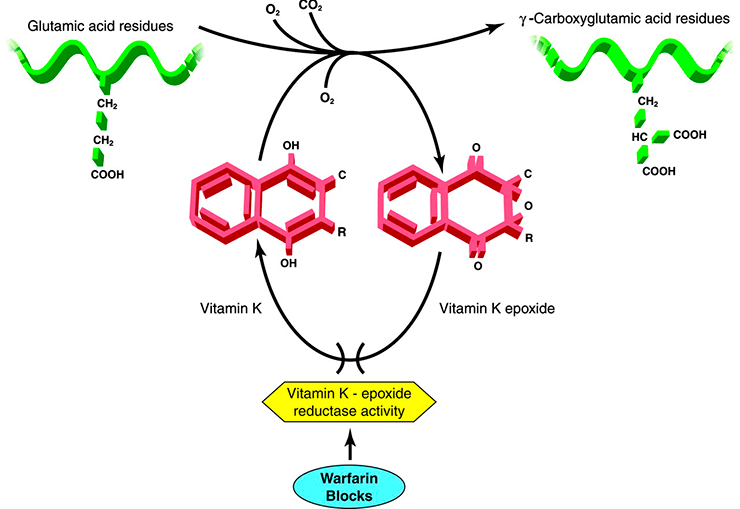
Рисунок 19. Механизм действия варфарина — ингибирование активности фермента эпоксидредуктазы витамина K блокирует трансформацию витамина K из неактивной формы (эпоксида) в активную
Генетические причины различий в реакциях на варфарин
На сегодняшний день известно около тридцати генов, потенциально влияющих на метаболизм и эффективность действия варфарина (рис. 20). Наиболее важные из них: CYP2C9 и VKORC1, кодирующий субъединицу 1 эпоксидредуктазы витамина K. При этом изменения CYP2C9 затрагивают фармакокинетику варфарина, а изменения VKORC1 — фармакодинамику [53].
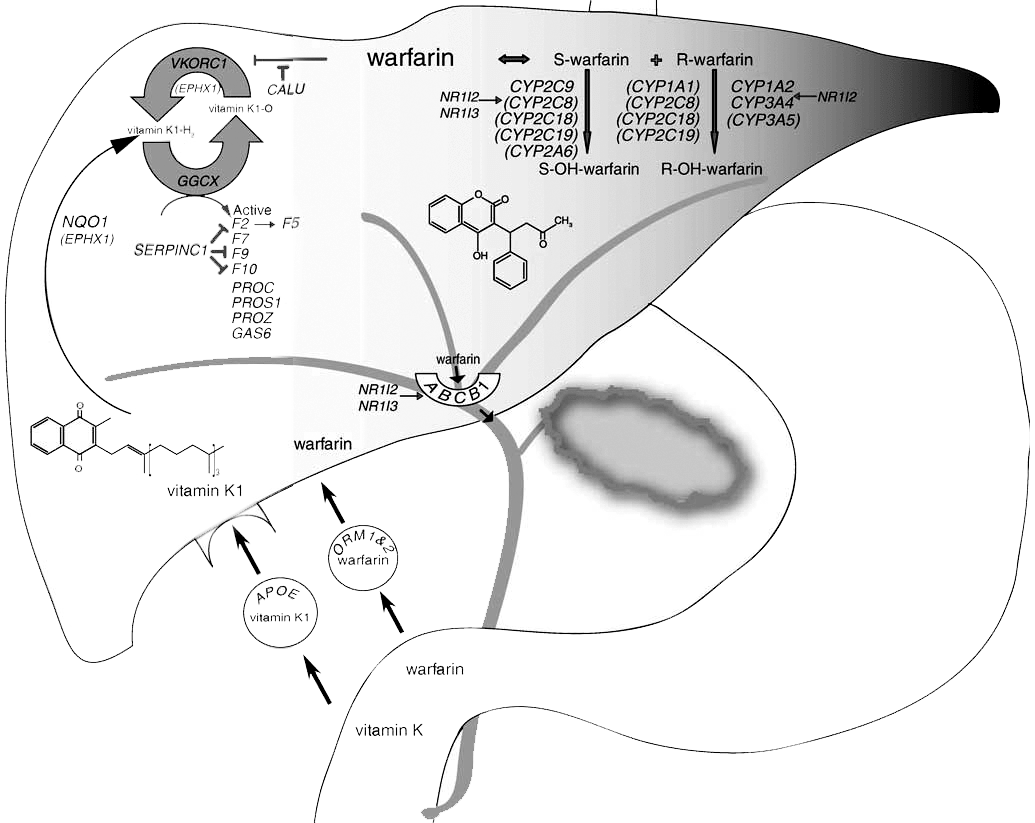
Рисунок 20. Биохимические и физиологические процессы в организме человека, проходящие с участием варфарина, и предположительно задействованные в них гены
CYP2C9: влияние на фармакокинетику
CYP2C9 — основной фермент, трансформирующий терапевтически активную форму варфарина до слабо- или неактивных метаболитов, которые затем выводятся из организма. Альтернативные варианты CYP2C9 кодируются несколькими аллелями, из которых наиболее изучены CYP2C9*2 и CYP2C9*3. У их носителей снижена биотрансформация, повышается уровень активного варфарина в крови, а, следовательно, усиливается его действие. Варфарин имеет низкий терапевтический индекс, и повышение его антикоагулянтного действия чревато опасными осложнениями, в частности сильными кровотечениями.
VKORC1: влияние на фармакодинамику
Взаимодействие варфарина с его мишенью — эпоксидредуктазой витамина K — ключевой механизм действия этого препарата. Поэтому вариации в гене VKORC1 могут влиять на лекарственную чувствительность, хотя точный механизм неизвестен. Предположительно, такие полиморфизмы изменяют интенсивность транскрипции и число копий белков-мишеней в организме. При этом существуют два основных гаплотипа — A и B, — отличающиеся по чувствительности к терапии:
- Гаплотип А, как и аллельные вариации CYP2C9*2 и CYP2C9*3, приводит к повышению лекарственной чувствительности, а его встречаемость варьирует между расовыми и этническими группами: он чаще встречается у азиатов, реже у европейцев и еще реже у лиц с африканскими корнями.
- Для гаплотипа B наблюдается обратная картина: его носители более устойчивы к воздействию варфарина, у них снижена лекарственная чувствительность, и встречается он чаще у лиц африканского происхождения [54].
Фармакогеномика в медицине: настоящее и будущее
Год за годом развитие фармакогеномики расширяет ее возможности в разных областях медицины: кардиологии, онкологии, психиатрии и при лечении инфекционных заболеваний. Рассмотрим применение фармакогеномики в каждой из этих областей.
Кардиология
За последнее время ученые добились значительных успехов в раскрытии влияния наследственности на эффекты кардиотерапии, и сейчас использование фармакогеномных тестов при таком лечении имеет все больше оснований. Особо стоит отметить успехи в прогнозировании эффектов двух антитромбических агентов: клопидогрела и варфарина, для которых в 2011 году консорциум по внедрению клинической фармакогенетики (CPIC) опубликовал подробные руководства по применению генетического тестирования.
На примере варфарина мы уже проиллюстрировали влияние вариабельности генов на лечение, и учет такой вариабельности имеет огромное значение, ведь окно дозирования препарата узкое, а варьирование рабочих доз (эффективных и безопасных) у генетически разных пациентов может отличаться аж в 20 раз [5]! Это было признано и FDA, когда в 2007 году в инструкцию по применению препарата включили информацию о влиянии генетических вариаций на его терапевтический эффект [55].

Рисунок 21. Обрамленное рамкой предупреждение в инструкции к препарату клопидогрела («Плавикс»). Перевод: «ВНИМАНИЕ: СНИЖЕНИЕ ЭФФЕКТИВНОСТИ У МЕДЛЕННЫХ МЕТАБОЛИЗАТОРОВ. Эффективность “Плавикса” зависит от активации системой цитохрома P450, преимущественно, CYP2C19. Медленные метаболизаторы, проходящие лечение “Плавиксом” в рекомендуемых дозах, показывают более высокую частоту сердечно-сосудистых событий после острого коронарного синдрома (ОКС) и чрескожного коронарного вмешательства (ЧКВ), чем пациенты с нормальной функцией CYP2C19. Доступны вспомогательные тесты для идентификации у пациентов генотипов CYP2C19, которые могут использоваться при определении терапевтической стратегии. Рассмотрите альтернативные стратегии лечения пациентов, идентифицированных как медленные метаболизаторы по CYP2C19».
Генетическое тестирование может повысить и эффективность антиагреганта клопидогрела, варьирующую из-за изменчивости гена CYP2C19. Являясь пролекарством, этот препарат активируется за счет биотрансформации, причем у носителей аллелей CYP2C19*2 и CYP2C19*3 этот процесс нарушен, и клопидогрел для них неэффективен. Учет таких аллелей необычайно важен, ведь клопидогрел используют для профилактики сердечных приступов, а значит, от его эффективности зависит жизнь людей.
В марте 2010 года, после публикации множества исследований о генетических факторах риска, FDA добавила в инструкцию к препарату «предупреждение в рамке» о возможном снижении эффективности у пациентов с аллельными вариантами CYP2C19 [56] (рис. 21).
Онкология
В онкологии правильный выбор препаратов и их доз — зачастую в прямом смысле вопрос жизни и смерти, ведь некорректная терапия чрезвычайно опасна как осложнениями, так и отсутствием должного эффекта. При этом важен персонализированный подход, ведь природа рака индивидуальна [57] — гены в раковых клетках могут иметь тысячи нарушений, уникальная сумма которых определяет индивидуальное течение болезни. Эти нарушения — соматические мутации, возникающие в клетках тела и часто проявляющиеся нарушениями в сигнальных путях, запускающих деление клетки. Выше мы уже рассмотрели один из примеров таких нарушений — мутацию BRAF, приводящую к меланоме. Как мы видели, ингибирование BRAF вемурафинибом способно помочь отключить аномально активированный сигнальный каскад, и предотвратить опухолевое перерождение. Похожим образом действуют и другие препараты противораковой таргетной терапии [58].
Большинство клеток в организме постоянно делится, и потому соматические мутации передаются всем потомкам исходной клетки, но не наследуются в ряду поколений. Учет как соматических, так и врожденных генетических изменений очень важен, при этом учет первых более значим для повышения эффективности терапии, тогда как вторых — для выявления пациентов с высоким риском развития опасных осложнений.
Далее мы рассмотрим влияние врожденных генетических изменений на эффективность и безопасность противораковой терапии и разберем для этого пару примеров.
Тиопурины и TPMT
Один из наиболее успешных примеров фармакогеномного тестирования — определение вариаций фермента TPMT (тиопурин-S-метилтрансферазы), влияющих на токсичность препаратов класса тиопуринов: азатиопурина (AZA), 6-меркаптопурина (6-MP) и 6-тиогуанина (6TG).
Тиопурины применяют как противоопухолевые препараты, а также в гастроэнтерологии, дерматологии, ревматологии и при трансплантации органов в качестве подавителей иммунной системы (иммунодепрессантов). Эти препараты эффективны, но также и токсичны, а терапевтическое окно для подбора их доз очень узкое [59], [61].
Вариации TPMT диагностируют для оценки терапевтических доз, так как этот фермент снижает токсичность, трансформируя часть тиопуринов до неактивных метаболитов, причем снижение дозировок у пациентов с дефицитом TPMT не влияет на эффективность действия, но снижает риск осложнений [60] (рис. 22).
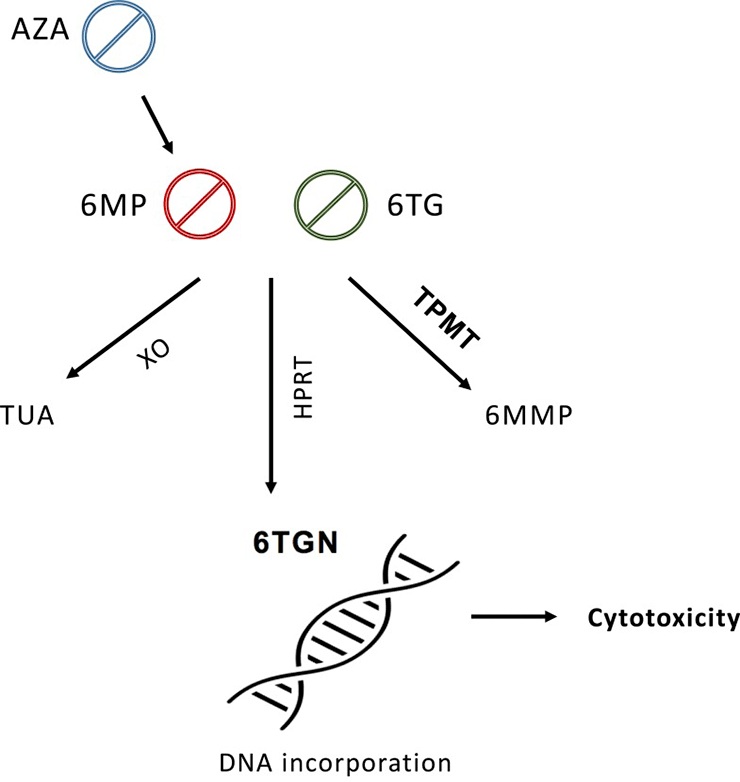
Рисунок 22. Упрощенная схема метаболизма тиопуринов. В организме тиопурины подвергаются сложному многоступенчатому метаболизму: AZA метаболизируется до 6-MP, затем 6-MP через ряд ферментативных превращений переходит в 6TG, а последний за одну стадию, посредством фермента гипоксантинфосфорибозилтрансферазы (HPRT), превращается в активный метаболит (6TGN), который, являясь аналогом гуанинового нуклеотида, способен включаться в ДНК на синтетической фазе клеточного цикла и вызывать его остановку с последующей гибелью клетки (апоптозом), в чем и заключается цитотоксическое действие. Инактивационная трансформация 6-МР (а, следовательно, и AZA) производится главным образом ферментом TPMT до неактивного 6-метилмеркаптопурина (6MMP), и, в незначительной степени, ферментом ксантиноксидазой (XO) до тиоуровой кислоты (TUA). При этом TPMT может инактивировать как сам 6-МР, так и его производные метаболиты (6TG, 6TGN), превращая их в неактивные соединения (на рисунке не показаны). Сокращения: AZA — азатиопурин; 6MP — 6-меркаптопурин; 6TG — 6-тиогуанин; XO — ксантиноксидаза; TUA — тиоуровая кислота; HPRT — гипоксантинфосфорибозилтрансфераза; 6TGN — 6-тиогуаниновые нуклеотиды; TPMT — тиопуринметилтрансфераза; 6MMP — 6-метилмеркаптопурин.
CPIC опубликовал рекомендации по клиническому применению тестирования полиморфизмов TPMT в 2011 году, а FDA — в 2015 г. [59], и сейчас такое тестирование широко используется. Например, в Великобритании оно фактически стало рутинной клинической практикой [62].
«Ириногенетика»
Химиотерапевтический препарат иринотекан используют для лечения рака легких и толстого кишечника, причем активен его метаболит SN-38, инактивируемый рядом ферментов. Наследственная недостаточность этих ферментов приводит к повышению SN-38 в крови и усилению токсичности. Предполагается, что токсичность усиливается и из-за вариабельности белков-переносчиков, участвующих в экскреции (рис. 23).
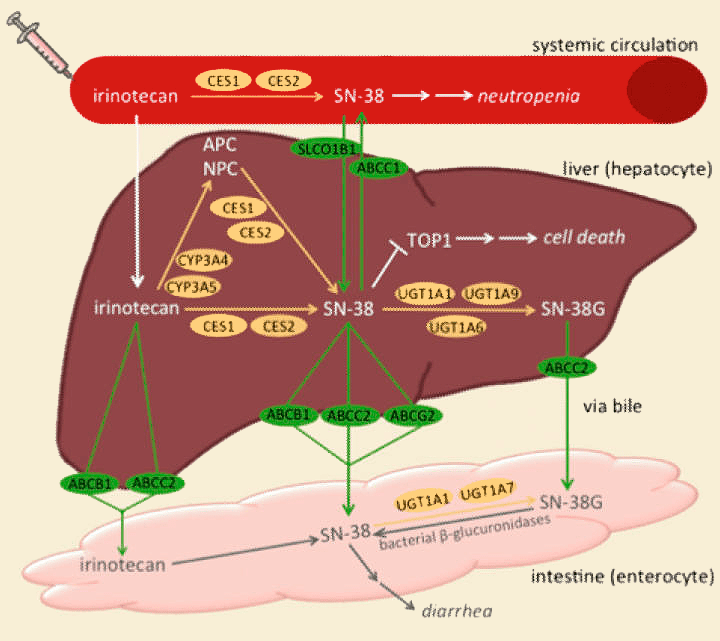
Рисунок 23. Фармакокинетика иринотекана. Активный метаболит SN-38 обладает терапевтическим и токсическим действием. Он ингибирует фермент топоизомеразу I, создающую однонитевые разрывы для расслабления суперскрученной спирали ДНК при репликации и транскрипции. При воздействии SN-38, топоизмераза не может сшить (лигировать) созданные ей разрывы; в результате появляются ошибки в геноме, что приводит к гибели клеток. SN-38 инактивируют несколько ферментов (UGT1A1, UGT1A6, UGT1A7, UGT1A9, CYP3A4 и CYP3A5), и их наследственная недостаточность приводит к повышению токсичности за счет повышения уровня этого метаболита. Аналогично, генетические вариации белков-переносчиков (ABCB1, ABCC2, ABCG2 и SCLO1B1) могут повышать SN-38 и усиливать токсичность, хотя здесь все пока менее точно.
Как видно, на фармакокинетику иринотекана влияет множество белков, и их вариабельность вызывает различия в действии препарата у разных людей. Учет этой вариабельности имеет огромное значение, ведь применение иринотекана ограничено тяжелой токсичностью [63], а сложности в изучении ее генетических факторов даже привели к появлению отдельного термина для таких исследований — «ириногенетика» [64].
Наиболее точно доказанной является связь вариаций гена UGT1A1 с токсичностью препарата, и FDA еще в 2005 году опубликовала рекомендации для проведения тестирования таких аллелей перед началом терапии [64], [65].
Психиатрия
Фармакогеномика — молодая наука, но в психиатрии она скорее на уровне младенчества. Одна из причин — сравнительная юность психофармакологии, ведь применение первых фармсредств в психиатрии пришлось на 1950-е годы, фактически совпав с зарождением фармакогенетики [66]. Другие причины связаны с трудностью изучаемого предмета, ведь психика и поведение человека зависят от многих факторов, и на генетическом уровне в том числе [67]. Симптомы разных психических расстройств могут совпадать между собой, при этом на одно и то же заболевание могут влиять разные гены, а значит и связать конкретные биомаркеры с определенными заболеваниями не так просто.
К наибольшим успехам можно отнести выявление пациентов с риском опасных побочных эффектов при терапии противоэпилептическим препаратом карбамазепином. Такие эффекты проявляются системной аллергической реакцией, известной как синдром Стивенса—Джонсона. Появление этого синдрома у людей, принимающих карбамазепин, совпадает с носительством определенных аллелей генов HLA. Эти гены важны для инициирования иммунного ответа — они кодируют белки главного комплекса гистосовместимости (major histocompatibility complex, MHC), обнаруженные на поверхности клеток. Такие белки связывают чужеродные частицы и презентируют их T-лимфоцитам, запуская иммунный ответ.
Предполагается, что развитие синдрома Стивенса—Джонсона вызвано связыванием лекарственных молекул с антигенпредставляющим сайтом MHC, что активирует иммунный ответ, вызывающий в свою очередь аллергическую реакцию. Этот синдром встречается нечасто, но потенциально он даже смертелен, и чаще проявляются у лиц азиатского происхождения, носящих аллель HLA-B*1502, из-за чего FDA рекомендует тестировать их на наличие этого аллеля до назначения карбамазепина во всех случаях.
Некоторые успехи также связаны с подбором терапии антидепрессантами с учетом вариаций CYP2D6 и CYP2C19, для определения которых FDA в 2005 году рекомендовала уже упоминавшуюся микрочиповую систему AmpliChip P450 [68], [69].
Подробнее о фармакогеномике в психиатрии можно почитать в статье «Биомолекулы»: «Гены и безумие: генетическое тестирование в психиатрии» [69].
Инфекционные заболевания
Применение фармакогеномики при инфекционных заболеваниях требует расшифровки генома не только людей, но и возбудителей заболеваний, поскольку такой подход способствует значительно бóльшей эффективности лечения.
Проиллюстрируем этот тезис на примере влияния генов на эффективность изониазида — одного из ключевых лекарств первой линии лечения туберкулеза [70]. Эффективность этого препарата зависит от генов, кодирующих два фермента: бактериальную каталазу-пероксидазу (продукт гена KatG) и человеческую N-ацетилтрансферазу (NAT). Изменения в гене, кодирующем первый фермент, приводят к отсутствию активации и снижению эффективности изониазида, а во втором — к ускорению или замедлению его биотрансформации. Ускорение биотрансформации приводит к слишком быстрой инактивации и снижению эффективности препарата, а замедление — напротив, к побочным эффектам, регистрировавшимся еще в 50-х годах прошлого столетия (рис. 24). И хотя ныне генетическое тестирование NAT не является рутинным [43], как мы видим, изменения этого гена (как и гена KatG у микобактерий) влияют на действие изониазида.
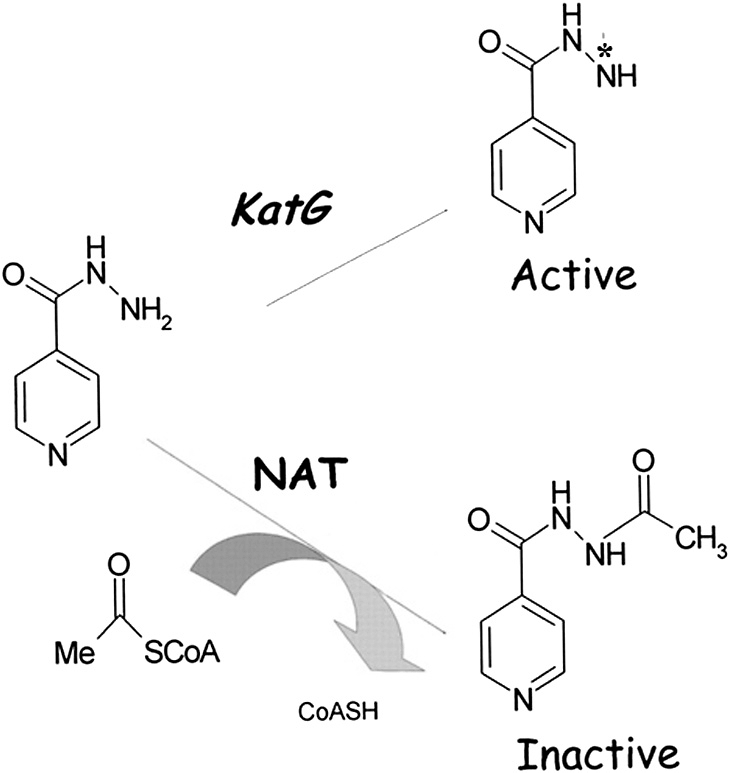
Рисунок 24. Активация и инактивация изониазида. Изониазид подавляет биосинтез миколовых кислот (компонента клеточной стенки микобактерий) после активации бактериальной каталазой-пероксидазой (продуктом гена KatG). В то же время человеческая N-ацетилтрансфераза (NAT) инактивирует изониазид. Сокращения: NAT — N-ацетилтрансфераза; KatG — ген, кодирующий фермент каталазу-пероксидазу.
Приведенный пример далеко не полностью раскрывает возможности, открывающиеся в лечении инфекций при расшифровке геномов человека и патогена. Изучение генома патогенов позволяет диагностировать инфекции и выявлять важные генетические последовательности — например, кодирующие антигены или определяющие устойчивость к антибиотикам. Знание первых можно использовать в разработке так называемых субъединичных вакцин [71], а вторых — в выборе антибиотикотерапии.
С другой стороны, знание о генах иммунной системы человека, определяющих различную восприимчивость к инфекции, используют в прогнозировании реакций не только на патогены, но и на вакцины и лекарства, а это может помочь правильно назначать уже используемые препараты и создавать новые [72].
Фармакогеномика в лечении СПИДа
Фармакогеномика играет важную роль в снижении побочных эффектов, вызванных лечением антиретровирусными препаратами. В частности, реакций гиперчувствительности при применении абакавира — тяжелых и потенциально даже смертельных. Такие реакции связаны с аллелем HLA-B*5701, упреждающее тестирование которого было рекомендовано консультативным советом по исследованиям в области СПИДа национального института здравоохранения США еще в 2008 году.
В 2012 году рекомендации по тестированию HLA-B*5701 выпустил CPIC, а затем FDA (2017 г.) [73], и сейчас такое тестирование — рутинная клиническая практика в США [43].
Перспективы развития фармакогеномики
Фармакогеномная информация имеет большой потенциал для персонализации лечения [44]. Уже сейчас она используется фармацевтическими компаниями при создании новых лекарств, а также практикующими врачами при назначении терапии. Однако сегодня перед фармакогеномикой все еще стоят сложные задачи, решение которых не будет столь быстрым.
Сложности внедрения фармакогеномики в клиническую практику
Как уже упоминалось, большинство ранних исследований в фармакогенетике фокусировались на генах, изменяющих фармакокинетику лекарств. Такие исследования заложили основы и задали направление этой науке, однако с приходом постгеномной эры стало очевидно, что лекарственную эффективность, как и побочные лекарственные реакции, определяют многие гены в фенотипе. Это осложняет интерпретацию данных генетического тестирования, поскольку не всегда известно, сколько и каких генов влияет на многофакторный лекарственный ответ.
Кроме того, внедрение фармакогеномного тестирования затруднено необходимостью подтверждения преимуществ перед традиционным назначением лекарств без учета генетической информации. Собрать доказательства того, что генетическое тестирование приводит к бóльшей эффективности и безопасности терапии, а также является экономически рентабельным не так просто [74]. Для этого требуются длительные, дорогостоящие и ресурсоемкие исследования, что далеко не способствует внедрению фармакогеномики. Осложняют ситуацию и ограничения, накладываемые методами исследования, имеющими не всегда достаточную статистическую мощность и точность. Например, GWAS требует привлечения сотен и тысяч людей в контрольной и исследуемой группах для достижения удовлетворительного размера выборки, причем сравниваемые выборки должны быть сравнительно однородными (по полу, возрасту, этнической принадлежности и т.д.), что, разумеется, возможно далеко не всегда.
В результате, несмотря на то, что благодаря современным методам геномики знание о последовательностях генов, потенциально способных влиять на лекарственные эффекты, непрерывно растет, возможности применения такого знания в клинике сильно запаздывают. Достаточно сказать, что с момента обнаружения генетических полиморфизмов TPMT и CYP2D6, ныне уверенно внедряемых в клиническую практику, прошло уже больше 35 лет, а о клинической полезности их учета до назначения терапии было известно более четверти века назад.
Можно привести и другой пример: для генов CYP2C9 и CYP2C19, влияющих на действие варфарина и клопидогрела, ныне выявлено более сотни изоформ, однако на функциональную активность в отношении соответствующих лекарств проверялись менее 30 вариантов каждого из этих генов.
Из первых успехов GWAS можно отметить связь, обнаруженную между генетическим снижением функциональности белка-переносчика OATP1B1 и развитием миопатии при лечении статинами, а также связь между повреждением печени при лечении антибиотиком флуоклоксацином и носительством аллеля HLA-B*5701 [75], [76]. Но и эти открытия были сделаны более 10 лет назад. Очевидно, что сложность и экономическая затратность исследований функционального и клинического значения выявляемых вариантов генов являются одними из основных «тормозов» внедрения фармакогеномики в клинику.
Вселенная в миниатюре или изучение необъятного
В нашем обзоре мы не разбираем все трудности на пути фармакогеномики в клиническую практику. Их множество: отсутствие общепринятых стандартов фармакогеномных исследований, низкий уровень знания генетики специалистами здравоохранения, социальные и этические вопросы, связанные с использованием геномной информации [77], и др. Отметим только, что именно из-за объективных сложностей, несмотря на достигнутый за последние годы прогресс, внедрение фармакогеномики в качестве стандарта медицинской помощи пока остается делом далекого или нет, но все же будущего...
Фармакогеномика в создании новых лекарств
Еще в 2000 году руководитель американской программы «Геном человека» Френсис Коллинз прогнозировал, что к 2020 году фармакогеномика станет общепринятым подходом при создании лекарств [10]. В 2019 году мы можем констатировать, что в какой-то степени Коллинзу удалось заглянуть в будущее. И хотя пока что фармакогеномика не стала общепринятым подходом, в последние годы крупные игроки фармацевтического рынка все больше инвестируют в фармакогеномные исследования, для чего есть веские основания.
Во всем мире вложения фармацевтических компаний в разработку новых препаратов неуклонно растут. При этом одной из наиболее затратных стадий является фаза III клинических исследований [78], поскольку она часто требует участия тысяч пациентов. В идеале, прежде чем инвестировать средства, руководство фармкомпаний должно быть уверено, что новый препарат успешно пройдет фазу III, сможет выйти на фармацевтический рынок и окупить вложения.
Использование фармакогеномного тестирования в клинических исследованиях фазы II [55] помогает уже на этой стадии отсеивать недостаточно эффективные и безопасные молекулы-кандидаты в новые лекарства, что способствует значительному снижению расходов и помогает создавать более эффективные и безопасные препараты.
Заключение
Сейчас фармакогеномика во многом остается экспериментальной дисциплиной на раннем этапе развития, и ее потенциал в улучшении терапии значительно выше доступных возможностей. Однако персональная медицина — будущее здравоохранения, и использование фармакогеномики, как наиболее важной ее части, несомненно, будет расширяться как в клинической практике, так и в сфере создания новых лекарств.
Преимущества внедрения фармакогеномики очевидны — упреждающее генетическое тестирование позволяет еще до начала терапии предсказывать, какие лекарства будут наиболее эффективными в каждом случае.
При этом для некоторых препаратов такое тестирование уже стало реальностью, и это дает надежду на то, что в будущем фармакогеномика все же станет медицинским стандартом и поможет улучшить лечение самых разных заболеваний.
Литература
- Герасимова К.В. и Сычев Д.А. (2012). Клиническая фармакогенетика: исторический очерк. «Медицинские технологии. Оценка и выбор». 3, 87–94;
- Ташенова А.И., Исмагилов Т.Г., Савельева М.И., Кукес В.Г. (2010). Влияние полиморфизма гена MDR1, кодирующего Р-гликопротеин, на развитие неблагоприятных побочных реакций при применении антидепрессантов в условиях стационара психиатрического профиля. «Биомедицина». 4, 46–50;
- Munir Pirmohamed. (2001). Pharmacogenetics and pharmacogenomics. British Journal of Clinical Pharmacology. 52, 345-347;
- Mary V. Relling, William E. Evans. (2015). Pharmacogenomics in the clinic. Nature. 526, 343-350;
- Konrad J. Karczewski, Roxana Daneshjou, Russ B. Altman. (2012). Chapter 7: Pharmacogenomics. PLoS Comput Biol. 8, e1002817;
- Arno G. Motulsky. (1957). DRUG REACTIONS, ENZYMES, AND BIOCHEMICAL GENETICS. JAMA. 165, 835;
- W Kalow. (2006). Pharmacogenetics and pharmacogenomics: origin, status, and the hope for personalized medicine. Pharmacogenomics J. 6, 162-165;
- Lynch T. and Price A. (2007). The effect of cytochrome P450 metabolism on drug response, interactions, and adverse effects. Am. Fam. Physician. 76, 391–396;
- Mohanan Geetha Gopisankar. (2017). CYP2D6 pharmacogenomics. Egyptian Journal of Medical Human Genetics. 18, 309-313;
- Геном человека: как это было и как это будет;
- Сколько у нас генов?;
- «Омики» — эпоха большой биологии;
- В полку генов убыло;
- Mroziewicz M. and Tyndale R.F. (2010). Pharmacogenetics: a tool for identifying genetic factors in drug dependence and response to treatment. Addict. Sci. Clin. Pract. 5, 17–29;
- Под «генную гармошку»;
- Повтор, еще повтор!;
- Геномная головоломка: открой в себе мозаика;
- Chee Seng Ku, En Yun Loy, Agus Salim, Yudi Pawitan, Kee Seng Chia. (2010). The discovery of human genetic variations and their use as disease markers: past, present and future. J Hum Genet. 55, 403-415;
- LV Kalman, JAG Agúndez, M Lindqvist Appell, JL Black, GC Bell, et. al.. (2016). Pharmacogenetic allele nomenclature: International workgroup recommendations for test result reporting. Clin. Pharmacol. Ther.. 99, 172-185;
- Chandra R. (2017). The role of pharmacogenomics in precision medicine. Medical Laboratory Observer;
- 12 методов в картинках: полимеразная цепная реакция;
- Сычев Д. (2014). Лечить не болезнь, а болезнь у больного, или фармакогенетика в действии. «Фармакогенетика и фармакогеномика»;
- Важнейшие методы молекулярной биологии и генной инженерии;
- Краткая история антидепрессантов;
- Генетика псориаза: иммунитет, барьерная функция кожи и GWAS;
- Kent R Bailey, Cheng Cheng. (2010). Conference Scene: The great debate: genome-wide association studies in pharmacogenetics research, good or bad?. Pharmacogenomics. 11, 305-308;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- Нанопоровое секвенирование: на пороге третьей геномной революции;
- 454-секвенирование (высокопроизводительное пиросеквенирование ДНК);
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Путь к тысячам аптек начинается с одной молекулы;
- Роль слабых взаимодействий в биополимерах;
- Adrienne D. Cox, Channing J. Der. (2012). The RAF Inhibitor Paradox Revisited. Cancer Cell. 21, 147-149;
- Мазуренко Н.Н. (2014). Генетические особенности и маркеры меланомы кожи. «Успехи молекулярной онкологии». 2, 26–35;
- Михеева О.М. (2011). Печень и лекарственный метаболизм. «Экспериментальная и клиническая гастроэнтерология». 2, 121–124;
- Головенко М.Я. Фізико-хімічна фармакологія. Одеса: «Астропринт», 2004. — 720 с.;
- Физическая водобоязнь;
- Josiah T. Ryman, Bernd Meibohm. (2017). Pharmacokinetics of Monoclonal Antibodies. CPT Pharmacometrics Syst. Pharmacol.. 6, 576-588;
- Richard Weinshilboum. (2003). Inheritance and Drug Response. N Engl J Med. 348, 529-537;
- William E. Evans, Howard L. McLeod. (2003). Pharmacogenomics — Drug Disposition, Drug Targets, and Side Effects. N Engl J Med. 348, 538-549;
- 12 методов в картинках: протеомика;
- 12 методов в картинках: очистка молекул и разделение смесей;
- McMillin G.A. (2016). Pharmacogenetics. Basicmedical Key;
- От медицины для всех — к медицине для каждого!;
- Муковисцидоз — первые надежды;
- Jeffrey D. Wessler, Laura T. Grip, Jeanne Mendell, Robert P. Giugliano. (2013). The P-Glycoprotein Transport System and Cardiovascular Drugs. Journal of the American College of Cardiology. 61, 2495-2502;
- Ignacio Rodriguez, Darrell R. Abernethy, Raymond L. Woosley. (1999). P-Glycoprotein in Clinical Cardiology. Circulation. 99, 472-474;
- Чубарова С.В., Крапошина А.Ю., Собко Е.А., Демко И.В., Салмина А.Б. (2012). Физиологические и клинические аспекты Р-гликопротеина. «Бюллетень физиологии и патологии дыхания». 45, 91–97;
- Зеленые лекарства будущего;
- Нобелевскую премию по физиологии или медицине вручили за технологию нокаутирования мышей;
- Elnaz Gozalpour, Hanneke G. M. Wittgen, Jeroen J. M. W. van den Heuvel, Rick Greupink, Frans G. M. Russel, Jan B. Koenderink. (2013). Interaction of Digitalis-Like Compounds with P-Glycoprotein. Toxicological Sciences. 131, 502-511;
- Как работает свертывание крови?;
- M Wadelius, M Pirmohamed. (2007). Pharmacogenetics of warfarin: current status and future challenges. Pharmacogenomics J. 7, 99-111;
- Jubby Marcela Galves, Carlos Martin Restrepo, Nora Constanza Contreras, Clara Alvarado, Carlos-Alberto Calderón-Ospina, et. al.. (2018). Creating and validating a warfarin pharmacogenetic dosing algorithm for Colombian patients. PGPM. Volume 11, 169-178;
- Ventola C.L. (2011). Pharmacogenomics in clinical practice: reality and expectations. P. T. 36, 412–450;
- J. A. Johnson, L. H. Cavallari. (2013). Pharmacogenetics and Cardiovascular Disease--Implications for Personalized Medicine. Pharmacological Reviews. 65, 987-1009;
- Нерешаемые проблемы биологии: нельзя создать два одинаковых организма, нельзя победить рак, нельзя картировать организм на геном;
- Таргетная терапия — прицельный удар по болезни;
- Dean L. Mercaptopurine therapy and TPMT genotype. In: Medical Genetics Summaries / ed. by Pratt V., McLeod H., Rubinstein W. Bethesda: National Center for Biotechnology Information (US), 2012;
- N K Gillis, J N Patel, F Innocenti. (2014). Clinical Implementation of Germ Line Cancer Pharmacogenetic Variants During the Next-Generation Sequencing Era. Clin Pharmacol Ther. 95, 269-280;
- Chingiz Asadov, Gunay Aliyeva, Kamala Mustafayeva. (2017). Thiopurine S-Methyltransferase as a Pharmacogenetic Biomarker: Significance of Testing and Review of Major Methods. CHAMC. 15;
- L. T. Ford, J. D. Berg. (2010). Thiopurine S-methyltransferase (TPMT) assessment prior to starting thiopurine drug treatment; a pharmacogenomic test whose time has come. Journal of Clinical Pathology. 63, 288-295;
- Имянитов Е.Н. (2007). Анализ UGT1A1 для выбора дозировки иринотекана (Кампто®): первый фармакогенетический тест в онкологии. «Эффективная фармакотерапия в онкологии, гематологии и радиологии». 2, 16–20;
- Ron H.J. Mathijssen, Howard Gurney. (2009). Irinogenetics: How Many Stars Are There in the Sky?. JCO. 27, 2578-2579;
- Sharon Marsh, Janelle M Hoskins. (2010). Irinotecan pharmacogenomics. Pharmacogenomics. 11, 1003-1010;
- Иващенко Д.В., Насырова Р.Ф., Иванов М.В., Незнанов Н.Г. (2015). История фармакогенетики в психиатрии. «Фармакогенетика и фармакогеномика». 2;
- Слово о генетике поведения;
- Matthew E. Hirschtritt, Aaron D. Besterman, David A. Ross. (2016). Psychiatric Pharmacogenomics: How Close Are We?. Biological Psychiatry. 80, e63-e65;
- Гены и безумие: генетическое тестирование в психиатрии;
- Болезнь, не думавшая сдаваться;
- Разработка вакцин: чем и как имитировать болезнь?;
- Antonio Aceti. (2016). Pharmacogenomics for Infectious Diseases. J Med Microb Diagn. 05;
- Dean L. Abacavir therapy and HLA-B*57:01 genotype. In: Medical Genetics Summaries / ed. by Pratt V., McLeod H., Rubinstein W. Bethesda: National Center for Biotechnology Information (US), 2015;
- Кукес В.Г., Сычев Д.Л., Игнатьев И.В. (2006). Клиническая фармакогенетика и практические здравоохранение: перспекгивы интеграции. «Биомедицина». 5, 2–15;
- Julia di Iulio, Margalida Rotger. (2012). Pharmacogenomics: What is Next?. Front. Pharmacol.. 2;
- Richard M. Weinshilboum, Liewei Wang. (2017). Pharmacogenomics: Precision Medicine and Drug Response. Mayo Clinic Proceedings. 92, 1711-1722;
- Brice P. and Sanderson S. (2006). Pharmacogenetics: what are the ethical and economic implications? The Pharmaceutical Journal. 277, 113;
- Клинические исследования: рыночный вопрос;
- Urs A. Meyer. (2004). Pharmacogenetics – five decades of therapeutic lessons from genetic diversity. Nat Rev Genet. 5, 669-676;
- Robert A. Copeland. (2016). The drug–target residence time model: a 10-year retrospective. Nat Rev Drug Discov. 15, 87-95;
- Jeffrey D. Wessler, Laura T. Grip, Jeanne Mendell, Robert P. Giugliano. (2013). The P-Glycoprotein Transport System and Cardiovascular Drugs. Journal of the American College of Cardiology. 61, 2495-2502;
- Denise M. Goodman, Alison E. Burke, Edward H. Livingston. (2012). Bleeding Disorders. JAMA. 308, 1492;
- William M. Bennett. (2006). Should Dialysis Patients Ever Receive Warfarin and for What Reasons?. CJASN. 1, 1357-1359;
- Lingaraja Jena, Shraddha Deshmukh, Pranita Waghmare, Satish Kumar, Bhaskar C. Harinath. (2015). Study of mechanism of interaction of truncated isoniazid–nicotinamide adenine dinucleotide adduct against multiple enzymes of Mycobacterium tuberculosis by a computational approach. International Journal of Mycobacteriology. 4, 276-283;
- Martin Klingenberg. (1958). Pigments of rat liver microsomes. Archives of Biochemistry and Biophysics. 75, 376-386;
- Omura T. and Sato R. (1964). The carbon monoxide-binding pigment of liver microsomes I. Evidence for its hemoprotein nature. J. Biol. Chem. 239, 2370–2378;
- Tsuneo Omura. (1999). Forty Years of Cytochrome P450. Biochemical and Biophysical Research Communications. 266, 690-698.





