Многофакторная аутентификация помогает бороться с раком
30 марта 2023
Многофакторная аутентификация помогает бороться с раком
- 1016
- 0
- 10
Рисунок в полном размере.
рисунок автора статьи по материалам [17]
-
Автор
-
Редакторы
Темы
Статья на конкурс «Био/Мол/Текст»: Данный обзор рассказывает, каким образом принцип многофакторного распознавания, широко используемый сегодня в цифровых технологиях, может быть применен для лечения онкологических заболеваний. Прочитав эту статью, вы узнаете, как изобретение логически управляемых Т-клеток позволяет успешно реализовать этот принцип на практике, а также почему борьба с внутренними диверсантами организма, раковыми клетками, все еще ставит столько вызовов перед современной биоинженерной мыслью.
Конкурс «Био/Мол/Текст»-2022/2023
 Эта работа заняла первое место в номинации «Грани жизни» конкурса «Био/Мол/Текст»-2022/2023.
Эта работа заняла первое место в номинации «Грани жизни» конкурса «Био/Мол/Текст»-2022/2023.

Партнер номинации — Сколтех.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Проверки на дорогах. Как и почему ошибаются CAR-T-клетки?
Т-клеточная иммунотерапия — это особо перспективный метод борьбы с онкологическими заболеваниями при помощи Т-лимфоцитов [1]. В классическом ее виде у пациента берут образец опухоли, после чего in vitro многократно размножают и активируют Т-лимфоциты, которые инфильтрируют образец, в надежде, что такие лимфоциты нацелены на раковые клетки. Ученым удается получить этаких «цепных псов», натравленных на раковые клетки-мишени. После обратного введения полученных Т-клеток в организм пациента они буквально «набрасываются» на целевую опухоль. Тем не менее у этого вида Т-клеточной иммунотерапии есть несколько существенных недостатков. Самый важный из них связан с тем, что Т-клеточные рецепторы (ТКР) распознают белки-антигены по их маленьким фрагментам, выставленным на специальной «молекулярной витрине» в виде главного комплекса гистосовместимости (по-английски — major histocompatibility complex, или MHC). Большинство клеток нашего организма обязаны предъявлять как можно более полный репертуар всех имеющихся у них белков на таких «витринах» для регулярной проверки на «нормальность» со стороны иммунной системы. Так вот, уменьшая количество «MHC-витрин» на своей поверхности, хитрые раковые клетки могут как бы «уходить в тень», скрываясь от Т-клеточного надзора [2], [3].
Чтобы не допускать подобного «шулерства» со стороны раковых клеток, ученые научились перепрограммировать Т-клетки, заставляя их производить вместо обычных ТКР специально сконструированные химерные рецепторы антигена (chimeric antigen receptors, CARs). Это чудо генно-инженерной мысли, CAR, получено путем гибридизации функциональных частей различных молекул иммунитета. От противоракового антитела берет начало внеклеточный антигенраспознающий фрагмент CAR, от Т-клеточного рецептора происходит внутриклеточный активационный домен CAR (рис. 1) [4].
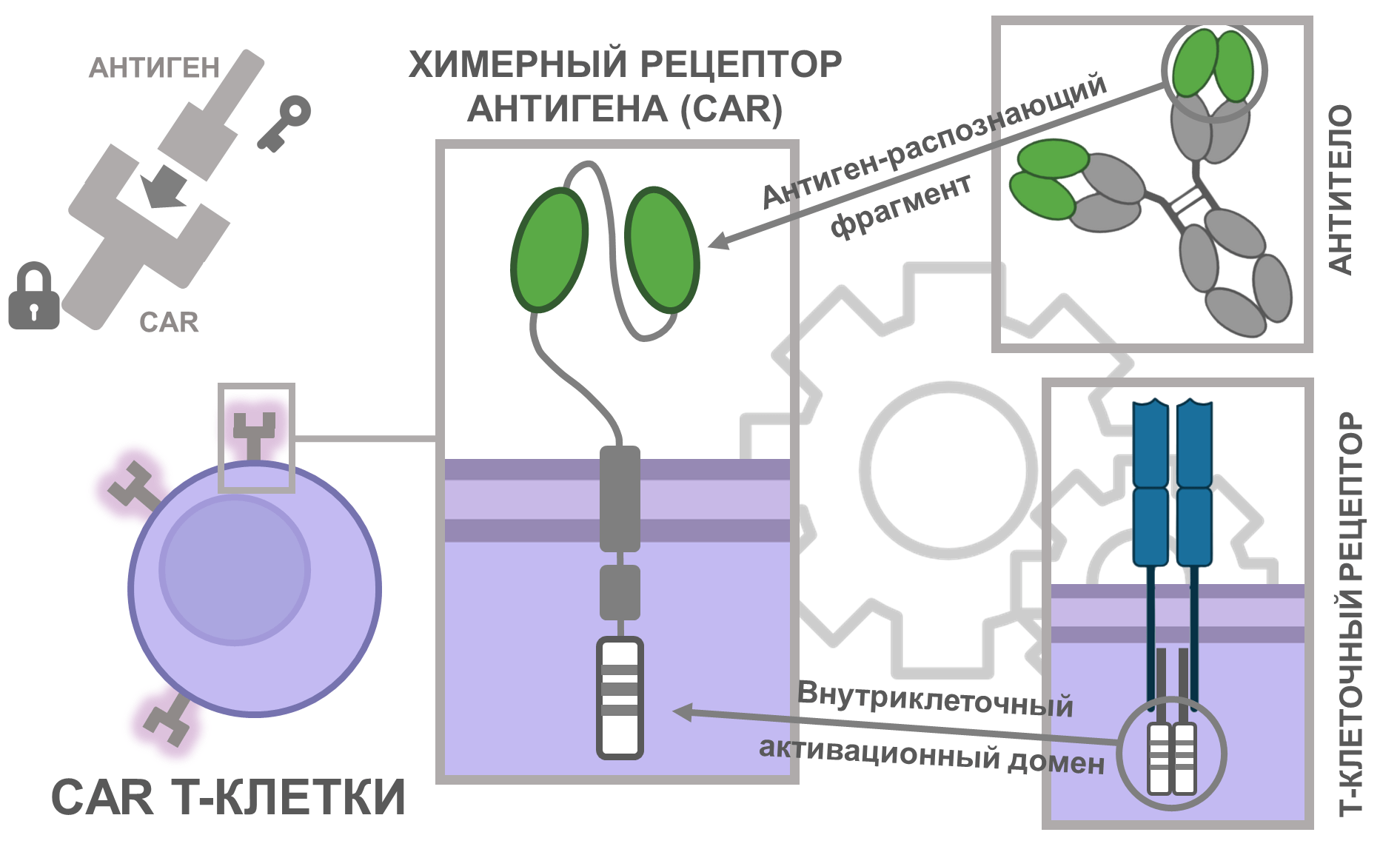
Рисунок 1. Принципиальная схема устройства химерного рецептора антигена (chimeric antigen receptor, CAR). CARs были разработаны путем объединения различных компонентов иммунной системы для прямого распознавания раковых антигенов . Рецепторный фрагмент CAR представляет собой продукт слияния вариабельных доменов легкой и тяжелых цепей противоопухолевого антитела, тогда как внутриклеточный сигнальный домен CAR заимствуют у Т-клеточного рецептора (ТКР). Получается, что CARs способны определить опухолевые антигены напрямую, вне контекста MHC, как и всякое антитело. При этом CAR управляет Т-клеткой точно так же, как и обычный ТКР (например, активирует убийство клетки-мишени).
рисунок автора статьи на основе [4]
Более подробно об устройстве CAR можно прочитать в статьях на «Биомолекуле»: «Способны ли CAR-T-клетки уничтожить опухоль?» [5] и «Клетки, которые лечат людей» [6].
Получается, что Т-лимфоциты с химерными рецепторами имеют двойственную природу: распознают антиген как антитело, а действуют при его обнаружении, как обычные Т-клетки. Например, модифицированные CAR Т-киллеры убивают клетки с целевым антигеном.
Поскольку взаимодействие с антигеном у CAR-Т-клеток определяется свойствами антител, они обладают рядом суперспособностей, недоступных обычным Т-лимфоцитам. В частности, CAR-Т-клетки не нуждаются в MHC-презентации своих антигенов. Так, если получить CAR-T-лимфоциты против какой-либо поверхностной молекулы целевой клетки в качестве антигена, то они будут напрямую «ощупывать» клеточные поверхности в поисках своей мишени, а не проверять специально подобранную «витринную» коллекцию «белков-обрывков» в надежде, что она хорошо описывает белковое разнообразие клетки [7]. Перехитрить такой «спецназ» раковым клеткам уже гораздо сложнее.
На сегодняшний день CAR-T-терапия показала себя исключительно эффективно в ходе лечения так называемых B-клеточных лимфом — самых распространенных вариантов рака крови у взрослых людей [8–10]. Однако широкое использование Т-лимфоцитов с химерными рецепторами антигенов для терапии множества других типов рака к настоящему времени все еще недоступно. Основная проблема заключается в том, что в подавляющем большинстве случаев (что особенно характерно для негемопоэтических, или сóлидных опухолей) опухолевые антигены встречаются и на здоровых тканях, зачастую, правда, в меньшем количестве (рис. 2). По этой причине многие раковые антигены правильно называть не опухоль-специфическими, а опухоль-ассоциированными. Побочное распознавание CAR-T-лимфоцитами таких «черных меток» на здоровых клетках будет приводить к серьезной on-target off-tumour токсичности [11–14]. В случае с B-клеточными лимфомами ученым невероятно повезло с наличием удачного терапевтического антигена: белок CD19 встречается лишь на раковых и здоровых B-лимфоцитах. Так как временная потеря здоровых B-клеток, как правило, не оказывает сильного токсического эффекта, анти-CD19 CAR-T-лимфоциты и смогли обеспечить громкие успехи в лечении B-клеточных лимфом . В случае с множеством других типов рака нам повезло гораздо меньше, так как ассоциированные с ними антигены встречаются на здоровых тканях, неспособных к регенерации. Например, кто захочет вылечить рак, но остаться при этом без клеток эпителия легких?!
Помимо анти-CD19 CAR-T против В-клеточных лимфом одобрены два клеточных препарата для лечения множественной миеломы, направленные против белка BCMA. — прим. ред.
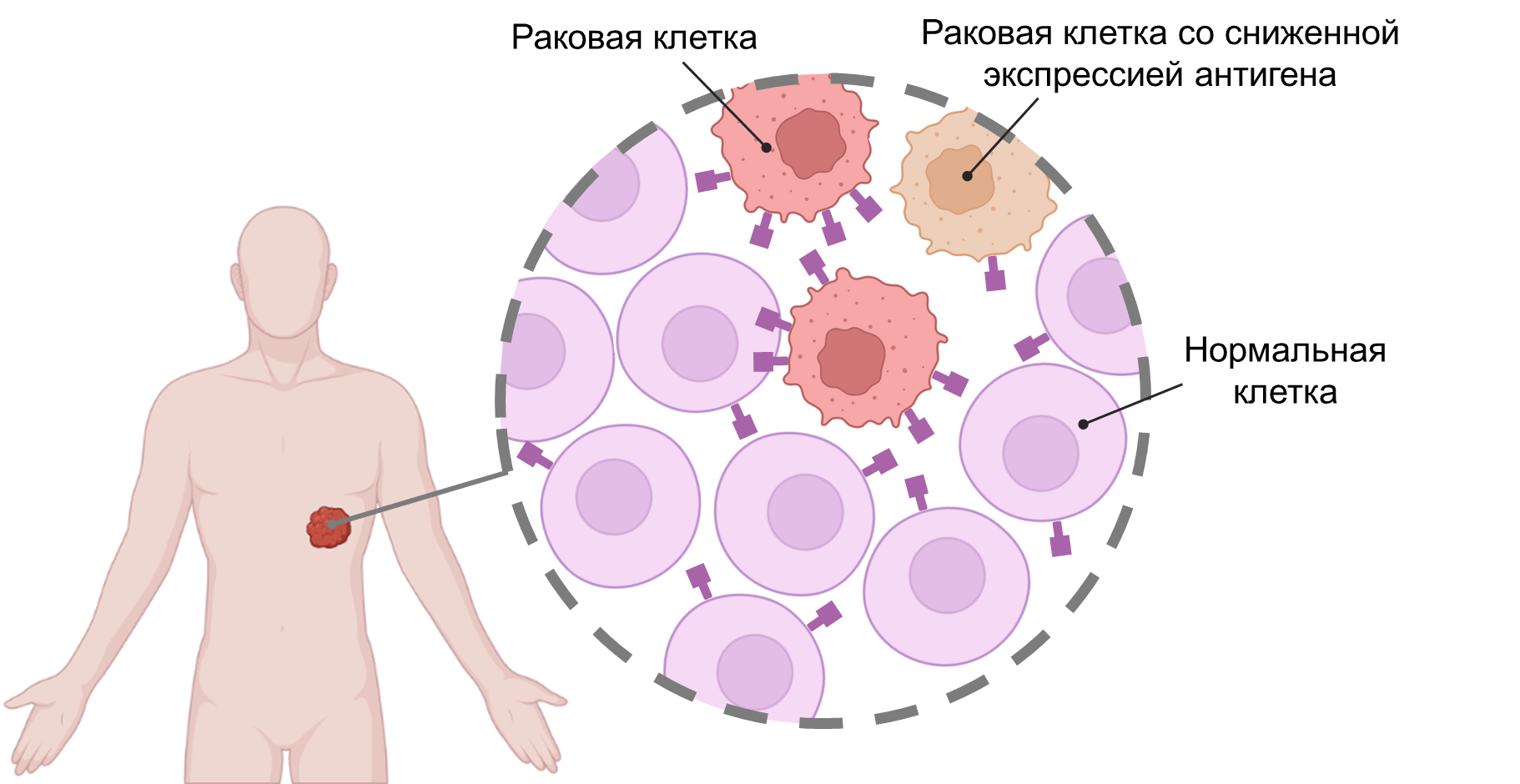
Рисунок 2. Безошибочное определение раковых клеток — задача нетривиальная. Характерные для опухоли антигены зачастую экпонируются и на поверхности нормальных клеток, но в меньшей степени. Применение в иммунотерапии CAR-Т-клеток против любого подобного антигена сопряжено с уничтожением здоровых клеток. Такая побочная активность Т-лимфоцитов грозит тканевой или даже системной токсичностью. Особую проблему представляют раковые клетки с пониженным синтезом терапевтического антигена. Они могут эффективно скрываться от Т-клеточной «облавы», мимикрируя под здоровую ткань, а затем — после окончания курса терапии — вызывать рецидивы.
рисунок автора статьи, созданный с помощью Biorender.com по данным [18]
Надо заметить, что проблема on-target off-tumour токсичности (а также другие нежелательные эффекты CAR-T-терапии вроде нейротоксичности [15] и цитокинового шторма [16]) частично решается путем уменьшения терапевтической дозы Т-клеток или снижения аффинности их рецепторов (то есть сродства к антигену). В этом случае CAR-T-клетки будут в целом хуже распознавать свой антиген, что уменьшит число нежелательных реакций. Однако вместе с тем будет снижена и общая эффективность иммунотерапии, так как некоторые раковые клетки (например, со слабым производством ракового антигена) также избегут уничтожения [17]. Выходит, какие бы хорошие Т-клетки ни придумали биоинженеры, на практике всегда приходится искать компромисс между эффективностью и безопасностью их применения (впрочем, это относится практически ко всем лекарствам. — прим. ред.).
Приведем некоторую аналогию. Задачи по распознаванию своего и чужого стоят не только перед клетками иммунной системы. Даже не замечая этого, мы повседневно решаем их в условиях современной цифровой реальности. Всё — от банковской карты до самого банального приложения по заказу еды — как правило, требует аутентификации, то есть подтверждения личности пользователя. Вся эта сложная цифровая инфраструктура работает как ни странно, на древнейшем принципе замка и ключа. Условным «замком» является система безопасности, а «ключом» — уникальный идентификатор, будь то цифровой пароль, отпечаток пальца или какое-то знание. Тот же механизм мы наблюдаем и в природе: Т-клеточные рецепторы — это своеобразный «замок», тогда как антигены на поверхности клеток-мишеней — «ключик». Подошел «ключ» к «замку» — Т-лимфоцит активировался. Основное отличие природной системы от антропогенной состоит в том, что цифровые системы идентификации нацелены на поиск «своего», а Т-клетки в норме должны искать чужаков (на самом деле всё намного сложнее — есть Т-клетки, настроенные на свои антигены, которые должны защищать их от атак иммунной системы. — прим. ред.).
Заметим, что компьютерные «замки» точно так же далеки от идеальных. С определенной (пусть и низкой) вероятностью и они совершают ошибки. С этим сталкивался каждый, чью электронную почту хоть раз взламывали мошенники. Причем, как и для CAR-T-клеток, в мире цифровых технологий также существует баланс между безопасностью и эффективностью. Кто будет спорить, что 30-значный цифровой пароль куда специфичнее 6-значного? Однако где гарантия, что при использовании такой длиннющей абракадабры теперь уже сам пользователь сможет легко зайти в свой аккаунт?
Один антиген хорошо, а два — лучше!
Проблему однофакторной аутентификации (то есть распознавания только по одному «ключу») герой нашего рассказа, американский биолог и биоинженер Уэнделл Лим, описывает с помощью древнеиндийской притчи о слоне и слепых (см. лекцию «Как программировать сигнальные сети клеток?»). Согласно этой легенде, несколько слепцов, которые до этого никогда не встречались со слоном, пытаются идентифицировать незнакомый им объект, ощупывая его с разных сторон (рис. 3). При этом все приходят к ложным умозаключениям, так как полагаются только на свою точку восприятия и не доверяют остальным. Тот, кто трогает слона за хобот, утверждает, что перед ним змея. Подошедший со стороны слоновьего бока ощущает стену. Примкнувший к ноге животного мнит слона деревом. И так далее... На примере этой притчи философы обычно размышляют о непознаваемом характере истины. Однако в прикладном смысле проблема слепых решается путем банальной интеграции! Требуется только, чтобы «слепые» внимательно выслушали друг друга и совместными усилиями сделали правильные выводы.

Рисунок 3. Скульптура по мотивам древнеиндийской притчи о слоне и слепых
«Если CAR-T-рецепторы по своей природе слепы и склонны делать ошибки, — полагает Лим, — то почему не пытаться нащупать своеобразного “слона” — раковую клетку — при помощи множества таких рецепторов?» Иными словами, американский биоинженер переводит проблему CAR-T-терапии из одномерного в многомерное пространство.
Объясним суть идеи Лима на упрощенной модели (рис. 4). Представим себе, что раковые клетки несут на своей поверхности два условных антигена: А и Б. При этом антиген А также встречается на некоторой здоровой ткани 1, тогда как антиген Б характерен для другой нормальной ткани 2. В этом случае моноспецифические (то есть нацеленные на один антиген) CAR-T-лимфоциты будут представлять опасность, так как в той или иной степени будут поражать и здоровые ткани. Так, анти-А CAR-Т-клетки неизбежно дадут токсическую реакцию с нормальной тканью 1. Аналогичное справедливо для анти-Б CAR-T-клеток, способных поражать здоровую ткань 2.
Чтобы разрубить этот гордиев узел, команда Уэнделла Лима предлагает создать комбинативно управляемые CAR-Т-лимфоциты, нацеленные исключительно на клетки, экспонирующие на поверхности А и Б одновременно [19]. Тем самым такие «умные» СAR-Т-лимфоциты смогут четко распознавать опухолевые клетки, избегая нападения на нормальные ткани.
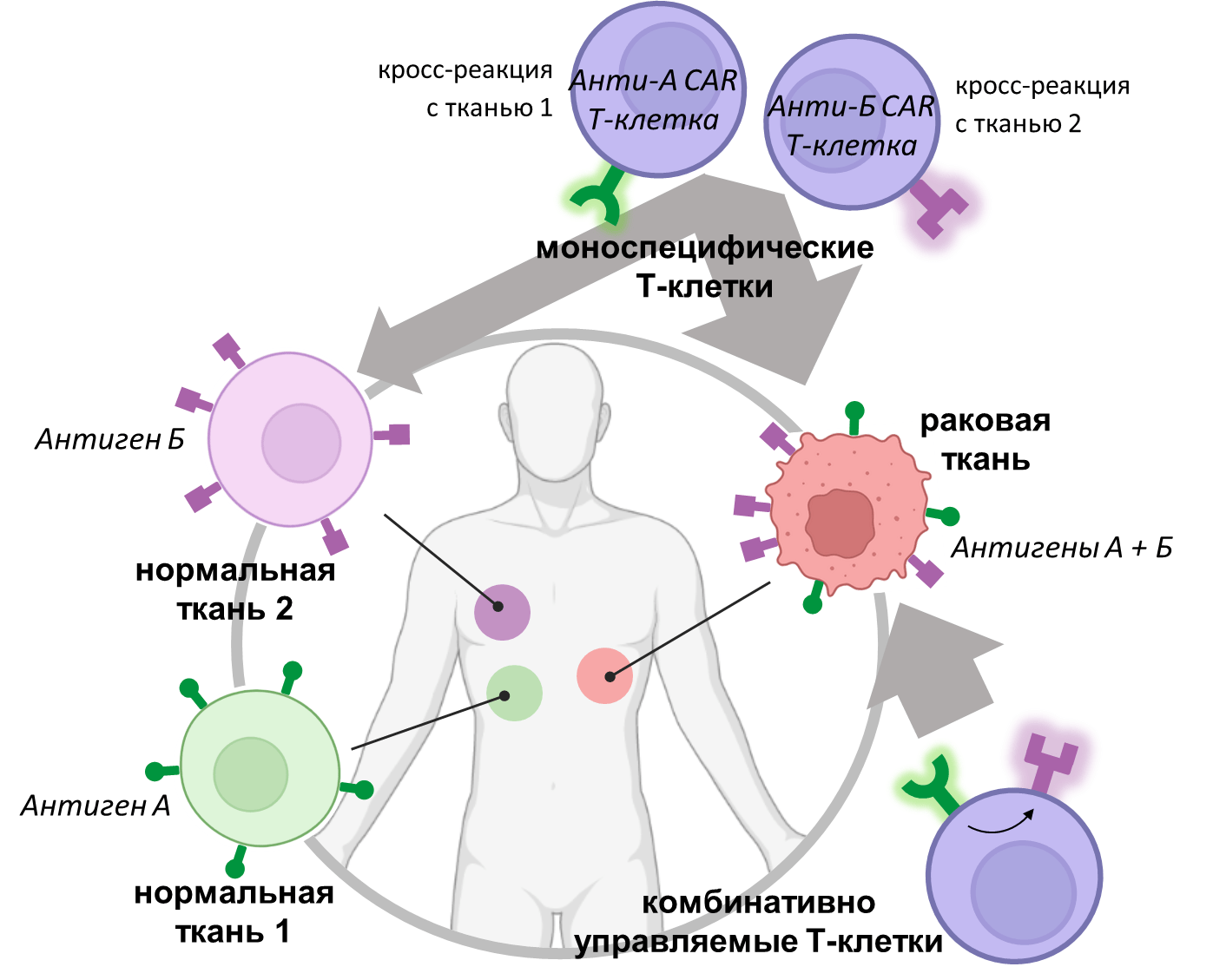
Рисунок 4. Как отличить раковую клетку от здоровой по комбинации антигенов. Моноспецифические противоопухолевые CAR-T-клетки побочно поражают и здоровые ткани, если клетки последних также экспонируют их антигены-мишени. Принципиальное решение данной проблемы заключается в создании комбинативно управляемых Т-лимфоцитов. По задумке авторов такие лимфоциты должны реагировать на уникальную комбинацию антигенов, присущую раковым клеткам, при этом избегая нападения на здоровые клетки, которые обладают только некоторыми антигенами из этого смертоносного «набора».
[19], рисунок с изменениями
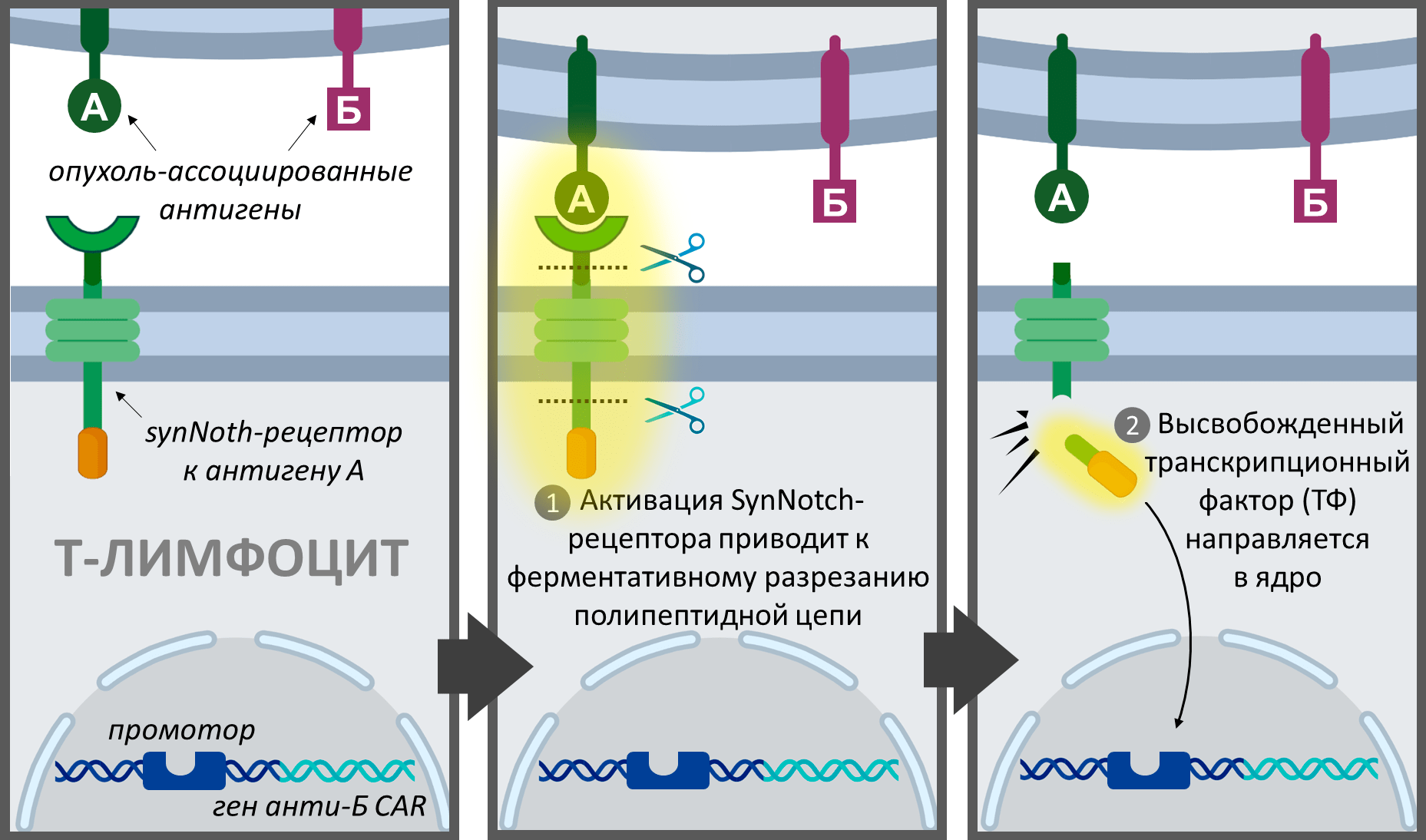
Важно подчеркнуть, что идея ученых не осталась абстрактным размышлением на бумаге, а была детально спроектирована и реализована физически. Здесь команде Лима, конечно, помогли их предыдущие биоинженерные разработки, главным образом, synNotch-рецепторы (сокращение от synthetic Notch) [20]. «Биомолекула» ранее описывала устройство этого удивительного инструмента в статье «Программируемый морфогенез многоклеточных систем» [21]. Здесь отметим только, что synNotch-рецепторы представляют собой химерные белки, где к центральному каркасу, заимствованному у природных Notch-рецепторов, можно присоединять разные сменные модули в зависимости от задачи. Во многом это напоминает игру в детский конструктор типа Lego. Например, можно заменить исходную внеклеточную рецепторную часть природных Notch-белков на фрагмент специфического антитела. Таким образом ученые могут перепрограммировать рецепторы на распознавание любой другой биологической молекулы вместо исходного лиганда (Delta-белка).
Как работают природные Notch-рецепторы? Ученые полагают, что при связывании лиганда они разворачиваются, обнажая до этого скрытый сайт протеолиза на своей поверхности [22]. Это приводит к разрезанию их белковой последовательности некоторыми протеазами и высвобождению внутрь клетки сигнального домена, который является специфическим транскрипционным фактором. Проникая в ядро, этот транскрипционный фактор связывается со специфическими участками промоторов (регуляторных областей) генов-мишеней и тем самым регулирует экспрессию этих генов на уровне транскрипционной активности. Подчеркнем, что в synNotch-рецепторах каркас молекулы остается в неизменном виде, а это означает, что способность к регулируемому протеолизу они сохраняют (рис. 5). А вот внутриклеточный сигнальный домен в synNotch-белках может быть заменен на любой другой белок, например, иной транскрипционный фактор. Таким образом, «подключив» определенный рецепторный и сигнальный домен к своему клеточному «инструменту», биоинженеры могут управлять экспрессией нужных генов в клетках, всего лишь действуя на их рецепторы специфическим лигандом [20].
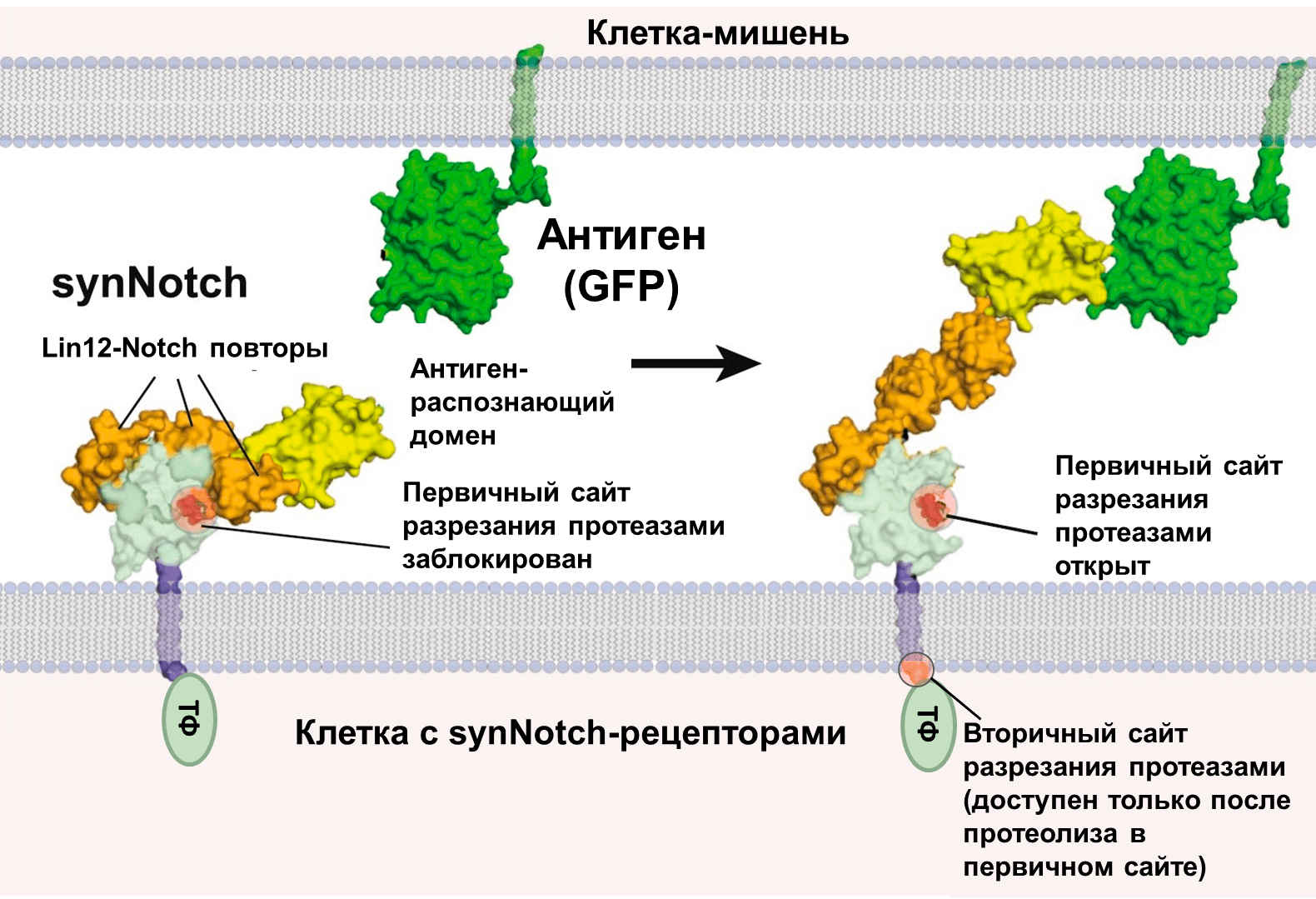
Рисунок 5. Предполагаемый механизм активации synNotch-рецепторов. Как показано в статье [22], в нативных Notch-рецепторах Lin-12-Notch повторяющиеся домены маскируют первичный сайт разрезания протеазами в несвязанной конформации (слева). По всей видимости, когда лиганд взаимодействует с рецептором, конформационные изменения обнажают этот сайт, инициируя пошаговый процесс разрезания белковой молекулы (по первичному, а затем вторичному сайту), приводя в конечном счете к высвобождению транскрипционного фактора (ТФ) внутрь клетки (справа). Авторы предполагают, что аналогичный процесс происходит и в synNotch-рецепторах, в которых внеклеточный домен заменен на новый распознающий домен (например, на анти-GFP нанотело, как показано на рисунке).
[20], рисунок с изменениями
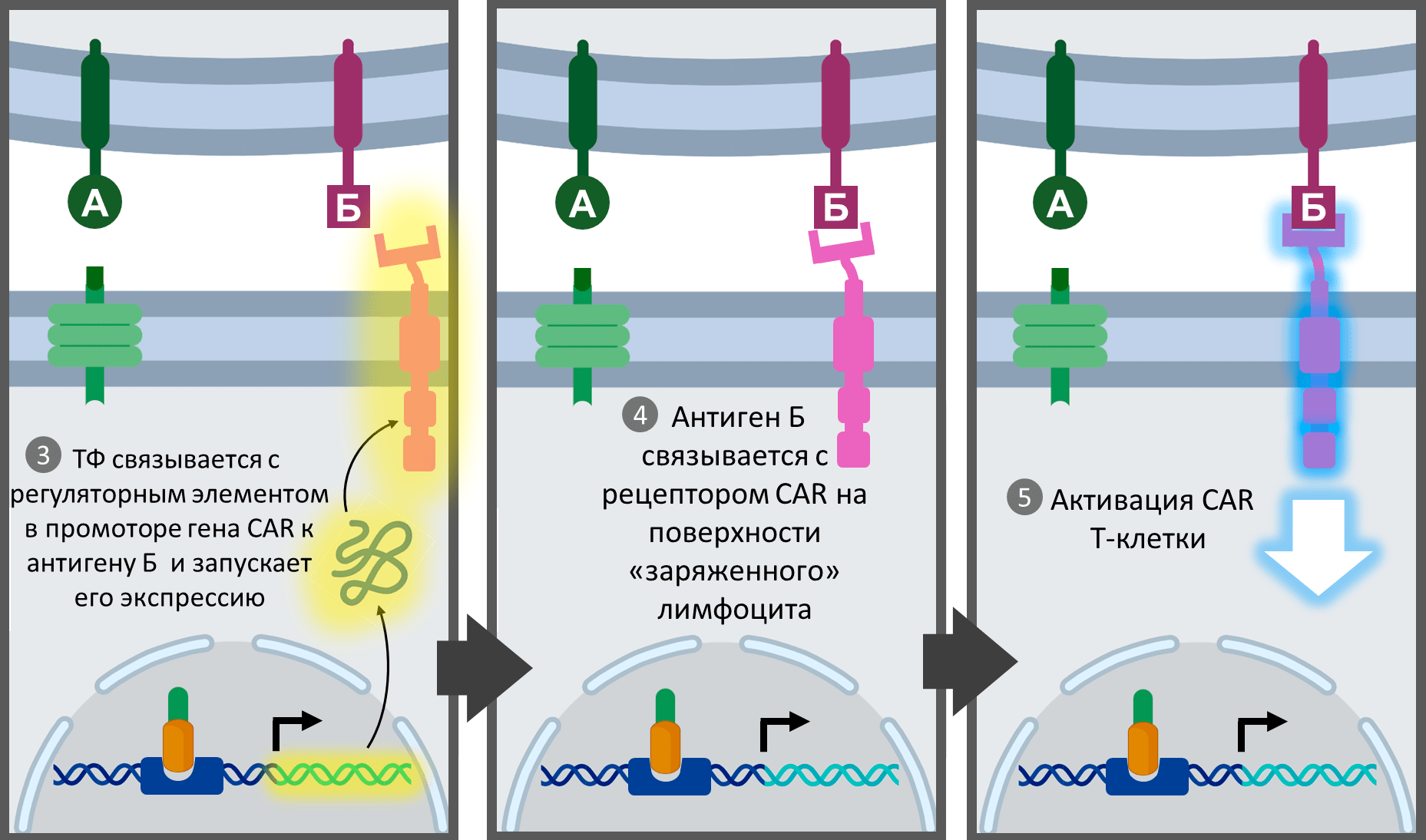
Догадливый читатель, вероятно, уже сообразил, что можно сконструировать synNotch-рецепторы, которые бы реагировали на любой опухоль-ассоциированный антиген. Для этого требуется только «подсоединить» на место рецепторного «блока» в synNotch-рецепторе фрагмент нужного антитела против этого антигена. Однако это еще не все. Ключевая идея биоинженеров заключается в том, чтобы в полученном synNotch-конструкте сигнальная часть была представлена специальным транскрипционным фактором. По задумке ученых этот фактор, подобно заводному ключику, должен активировать транскрипцию CAR к другому опухоль-ассоциированному антигену (рис. 6) [19].
Для этого вместе с synNotch-рецептором (к некоторому условному антигену А) в исходную Т-клетку вводят ген CAR ко второму раковому антигену Б. Искусный замысел состоит в том, что ген анти-Б CAR помещают под управление индуцибельного (то есть регулируемого) промотора [23]. Такой промотор должен быть неактивен, пока не свяжет высвобожденный транскрипционный фактор. Тот самый, что перед этим хитро «вмонтировали» в структуру synNotch-рецептора. Например, если в synNotch-рецептор биоинженеры встраивают широко используемый фактор TetR-VP64 (контролируемый тетрациклином трансактиваторный домен), то для гена анти-Б CAR подбирают промотор с так называемыми элементами ответа на тетрациклин (TRE). TRE-содержащий промотор будет находиться «под замком», пока synNotch-рецептор не активируется и не высвободит «заводной ключ» — TetR-VP64.
Комбинативно управляемые CAR-Т-лимфоциты кардинально отличаются от разработанных ранее мультиспецифичных CAR-Т-клеток, которые несут несколько типов химерных рецепторов к разным антигенам [24]. Если привести еще одну аналогию с IT, только уже в области построения микросхем, мультиспецифичные CAR-T-клетки работают по логическому принципу типа «ИЛИ», то есть активируются любым из своих антигенов по отдельности. Изобретения же Уэнделла Лима обладают уникальным свойством интегративности, действуя по логическому принципу «И»-типа. Иными словами, Т-клетки Лима реагируют исключительно на сумму антигенов (А + Б). В частности, CAR к антигену Б вообще не синтезируется в комбинативно управляемых лимфоцитах, пока они не будут предактивированы антигеном А через synNotch-рецепторы. Однако присутствие на клетке-мишени одного антигена А также недостаточно для запуска смертоносной активности, так как сам по себе synNotch-рецептор не имеет возможности отдавать исполнительные приказы Т-лимфоциту. И только в том случае, если клетка-мишень обладает сразу двумя антигенами А и Б одновременно, умный Т-лимфоцит «проснется» и реализует свою роль палача.
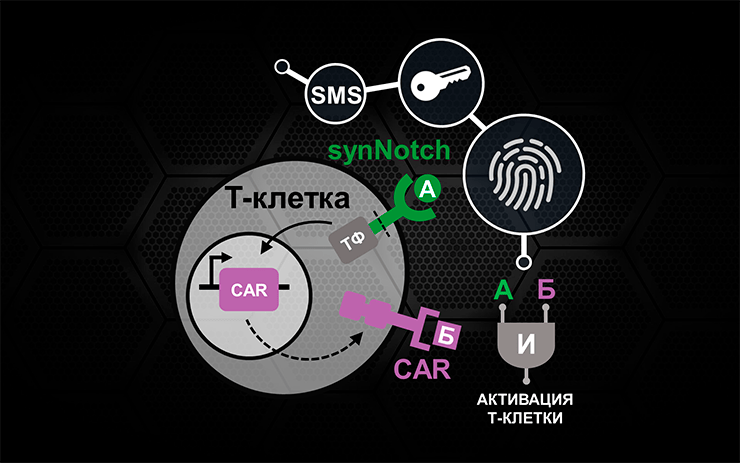
Обратимся вновь к нашей аналогии с цифровой безопасностью. Можно приметить, что комбинативно управляемые Т-лимфоциты принципиально практически воспроизводят идею многофакторной аутентификации, широко используемую сегодня в компьютерных технологиях [25]. Это удивительный пример того, как принципиально схожие проблемы в совершенно разных сферах науки порождают аналогичные решения. Поясним, что многофакторное распознавание — это многоуровневая проверка личности пользователя. С ней мы сталкиваемся, скажем, когда после ввода пароля от банковской карточки нам поступает SMS-код для подтверждения покупки. Другой пример: вы пришли в спортивный клуб, приложили браслет посетителя к валидатору, после чего сканируете папиллярный узор на своем пальце. Только комбинация нескольких правильно предъявленных идентификаторов (например, браслета посетителя и вашего отпечатка пальца) дает заветное право доступа. По сути, здесь разыгрывается та же карта с комбинаторными системами, что и в CAR-T-клетках (рис. 7).
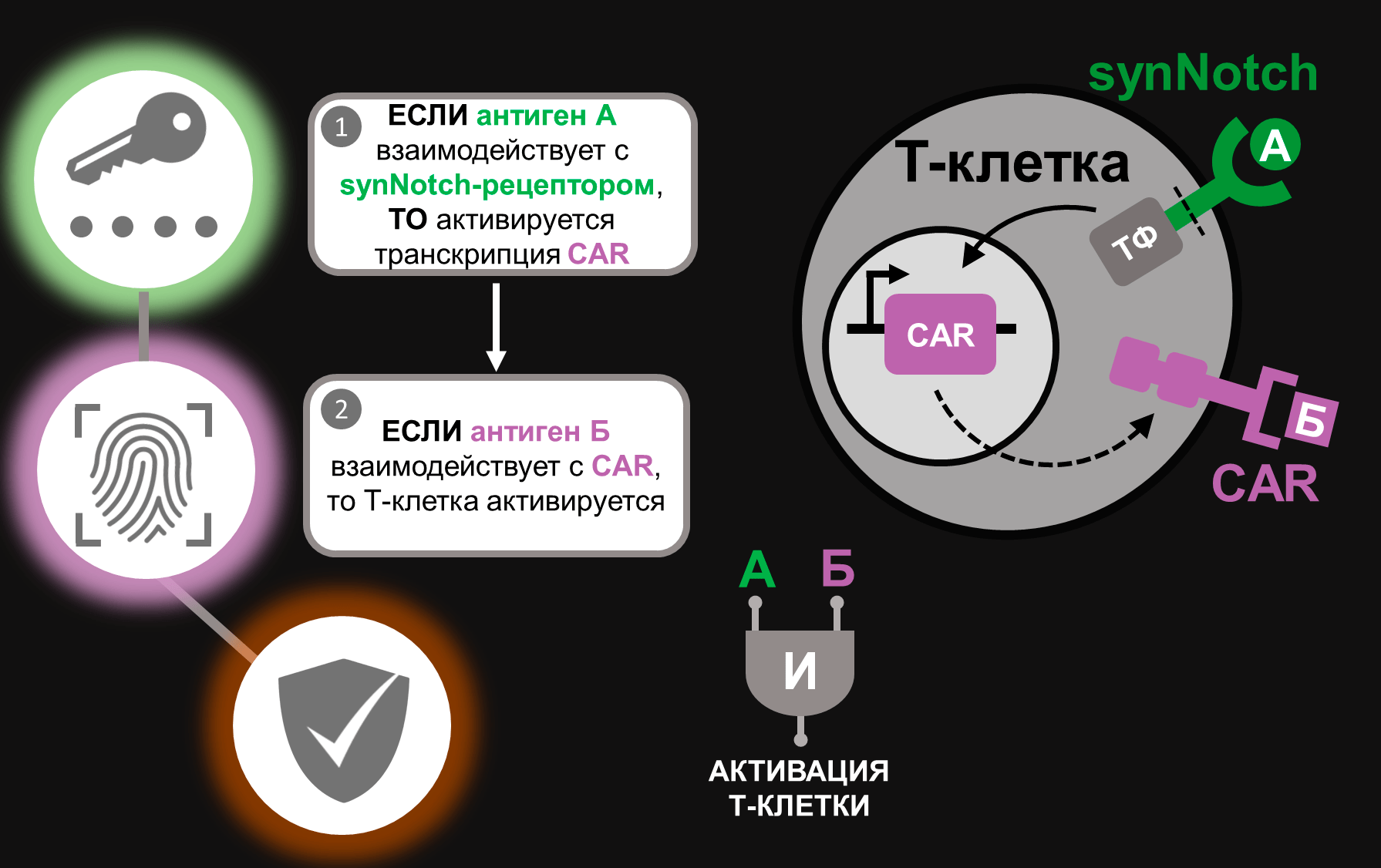
Рисунок 7. Комбинативно управляемые Т-клетки реализуют принцип, схожий с многофакторной аутентификацией. Связывание synNotch-рецептора с антигеном А приводит к синтезу в таких клетках CARs к антигену Б. Взаимодействие антигена Б с CAR, в свою очередь, активирует Т-клетку. Таким образом, только совместное предъявление Т-лимфоциту антигенов А и Б (идентификаторов рака) может возбудить его.
[19], рисунок с изменениями
Всякий лимфоцит в деле познается
Переход к многофакторному распознаванию позволяет совершить качественный переход к высокоточному отбору, при этом сохраняющему свою эффективность. Предположим, что некоторому мошеннику тем или иным способом удалось завладеть данными вашей банковской карты. Но это еще только половина дела, так как при многофакторной проверке для списания средств нужно как-то добыть еще и одноразовый код, поступивший на ваш номер телефона в нужное время.
Однако если успешность многофакторной идентификации в компьютерном пространстве давно не оставляет сомнений, то разработанные комбинативно управляемые CAR-Т-клетки еще предстояло проверить экспериментально. Для этого в лаборатории Лима была реализована двухопухолевая модель (рис. 8А). Согласно плану, иммунодефицитным мышам вживляли с разных боков две разновидности модифицированных раковых клеток. Одна из внедряемых опухолей несла только один изучаемый антиген (CD19), тогда как вторая обладала сразу двумя антигенами (CD19 и GFP). По условной договоренности в этом эксперименте одноантигенные раковые клетки (CD19+) моделировали «здоровую» ткань, а двухантигенные (CD19+, GFP+) — болезнетворную опухоль. После этого мышам вводили Т-клетки с synNotch-рецепторами к GFP, которые при активации запускали производство CAR к CD19. В качестве контроля использовали немодифицированные Т-клетки без рецепторов к CD19 или GFP. Размер опухолей замеряли на 16-й день после введения Т-лимфоцитов.
Опыты с двухопухолевой моделью показали высокую избирательность комбинативно управляемых CAR T-лимфоцитов (рис. 8Б). В полном соответствии с задумкой авторов «умные» Т-клетки эффективно уничтожали двухантигенную «болезнетворную» опухоль (CD18+ GFP+) и не трогали условные «здоровые» клетки только с одним антигеном CD19.
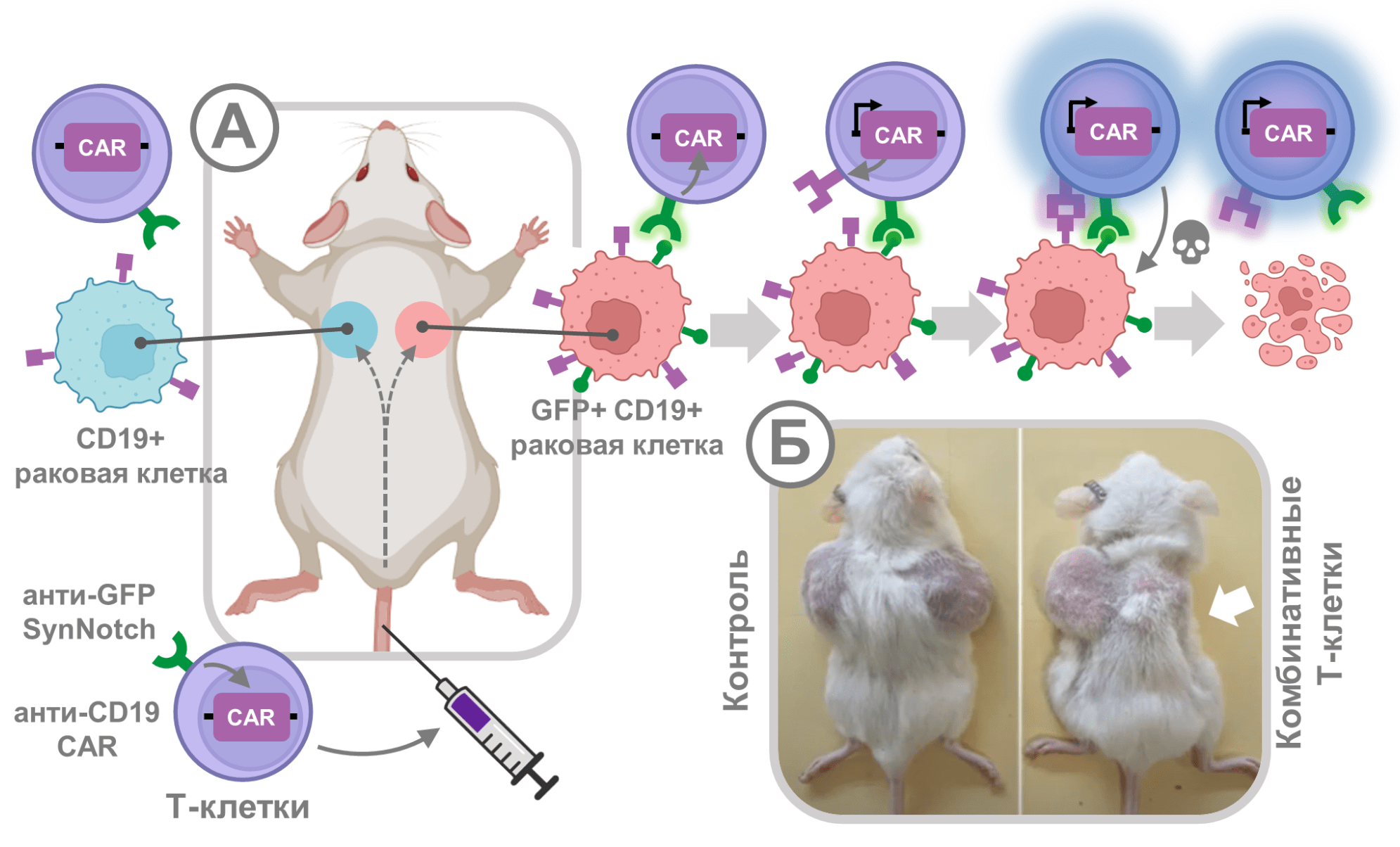
Рисунок 8. Опыт с двухопухолевой моделью, который демонстрирует исключительную специфичность комбинативных synNotch-управляемых СAR-T-лимфоцитов. А — В эксперименте иммунодефицитным мышам с левого бока вводили модифицированные клетки опухоли K562, обладающей CD19-антигеном; с правого бока — те же клетки K562, но синтезирующие два антигена (CD19 и GFP). После этого мышам инъецировали Т-клетки, обладающие synNotch-рецептором к GFP, способным запустить экспрессию гена CAR к антигену CD19 (через высвобождение транскрипционного фактора Gal4VP64). Умные Т-лимфоциты уничтожали двухантигенную CD19+ GFP+ опухоль (справа) и не трогали одноантигенные CD19+ раковые клетки (слева). Б — Результат эксперимента, наблюдаемый на 16-й день после инъекции Т-лимфоцитов. После применения комбинативно управляемых Т-клеток успешно рассосалась только правая опухоль. В контроле, когда вводили нативные Т-лимфоциты (без встроенных рецепторов), прогрессировали обе опухоли.
рисунок автора статьи, созданный с помощью Biorender.com по данным [19]
На самом деле такой замечательный результат был совсем не очевиден, как может показаться с первого взгляда. Основное опасение ученых состояло в том, что Т-клетки, предактивированные на двухантигенной опухоли и уже синтезирующие CAR к CD19, смогут мигрировать в левый бок и поразить CD19+ опухоль. К счастью, это опасение не подтвердилось. Исследователи даже предложили два фактора, которые, вероятно, и обеспечивают такую исключительную избирательность Т-клеток [19].
Во-первых, оказалось, что в отсутствие сигнала от первого антигена через synNotch-рецептор CAR довольно быстро деградирует (с временем полужизни около 8 ч.) на фоне сравнительно медленного процесса активации Т-лимфоцитов (время полуактивации порядка 13 ч.). Иными словами, пока предактивированная Т-клетка доберется до одноантигенной опухоли в условиях «разомкнутой генетической цепи» synNotch-СAR, она с большой вероятностью уже потеряет свои CAR и ей попросту нечем будет распознавать опухоль! В опухоли с двумя антигенами «генетическая цепь» synNotch-СAR постоянно «замкнута», и потому жизнеспособность CAR активно поддерживается.
Во-вторых, есть ряд других факторов, которые многократно усиливают действие Т-клеток в окружении «болезнетворной» двухантигенной опухоли. Например, Т-клетки могут сильнее удерживаться там, так как цепляются сразу двумя типами рецепторов за оба антигена. Но, пожалуй, еще важнее то, что возбуждение Т-лимфоцитов вызывает локальный выброс IL-2 и пролиферацию Т-клеток, запуская таким образом мощную петлю положительной обратной связи. Это, по всей видимости, и приводит к локальному размножению и дальнейшей активации Т-лимфоцитов именно в зоне двухантигенной опухоли.
Теперь нужно только вспомнить, что одноантигенная опухоль олицетворяла в этом эксперименте здоровую ткань, и становится понятно, что у нас в руках оказалось средство умной борьбы с онкологическими заболеваниями.
Разыскиваются. Особо опасны! Как правильно составить антигенный фоторобот опухоли?
На самом деле, комбинативно управляемые Т-клетки представляют собой лишь частный пример так называемых логически управляемых Т-лимфоцитов. По сути своей они воспроизводят простейшее интегративное действие «И»-типа. Ранее были разработаны другие логически управляемые Т-клетки, реализующие операции типа «НЕ» ([26]) и типа «ИЛИ» ([27], [28]). Т-клетки, работающие по схеме «ИЛИ» — это обычные мультиспецифические CAR-Т-лимфоциты (см. выше). А вот если Т-клетку заставить экспонировать одновременно классический CAR к антигену А и особый CAR к антигену Б, в котором внутриклеточный активационный домен заменили на ингибирующий, получится запустить схему «А И НЕ Б». Такая клетка будет реагировать на мишени, обладающие только антигеном А, и обходить стороной клетки, экспонирующие А и Б одновременно. В сфере информационных технологий аналогом логической конструкции типа «НЕ» может является блокирование сеанса при выявлении подозрительной активности пользователя.
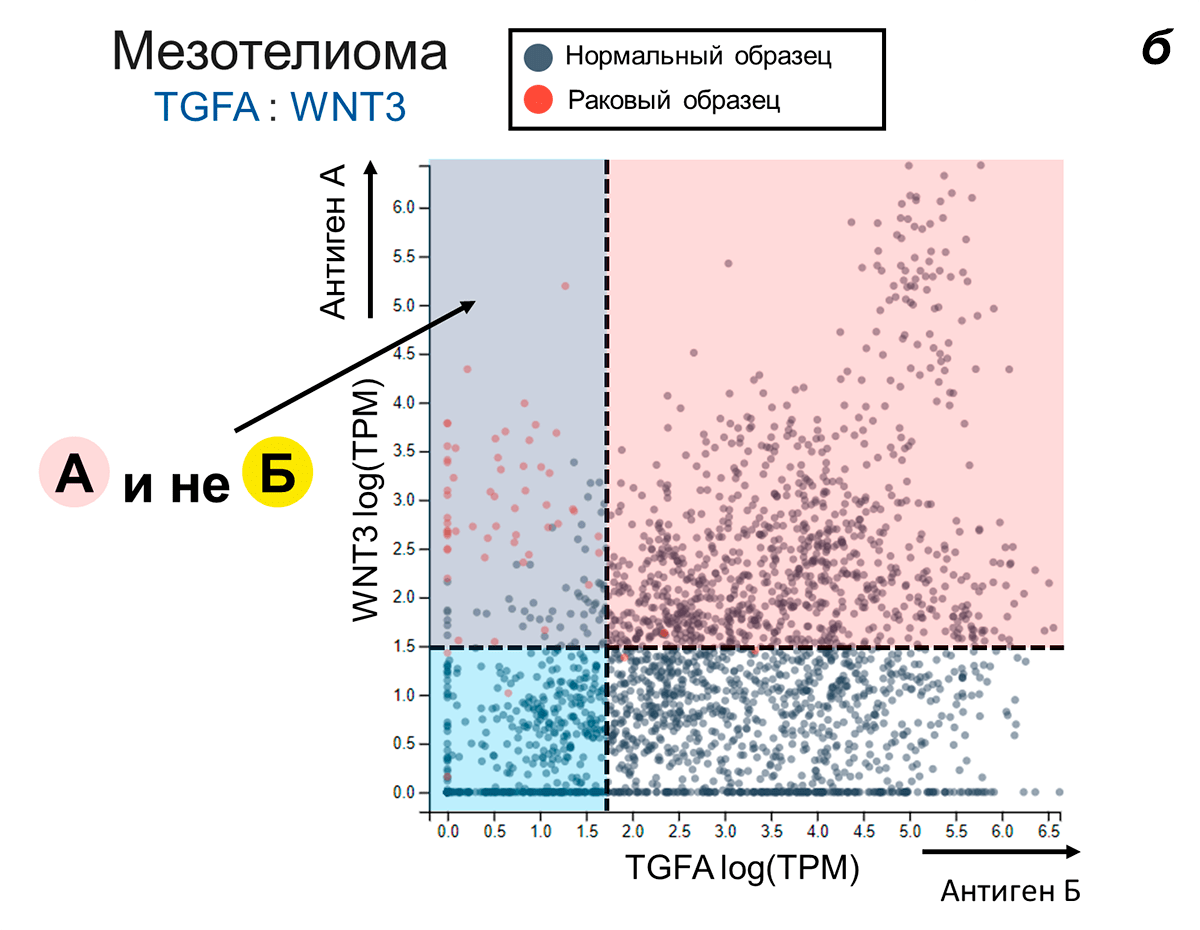
Хорошо. Мы научились создавать «умные» Т-лимфоциты, этакие антидиверсионные бригады, способные находить опухолевых врагов в самом тылу организма и успешно уничтожать их. Однако мы до сих пор не обсуждали, по каким антигенам нужно вообще искать раковые клетки? Как составить «фоторобот» опухолевого диверсанта так, чтобы его могли эффективно использовать Т-клеточные войска? Чтобы ответить на этот существенный вопрос, команда Лима провела огромный биоинформатический скрининг (рис. 9) [18].
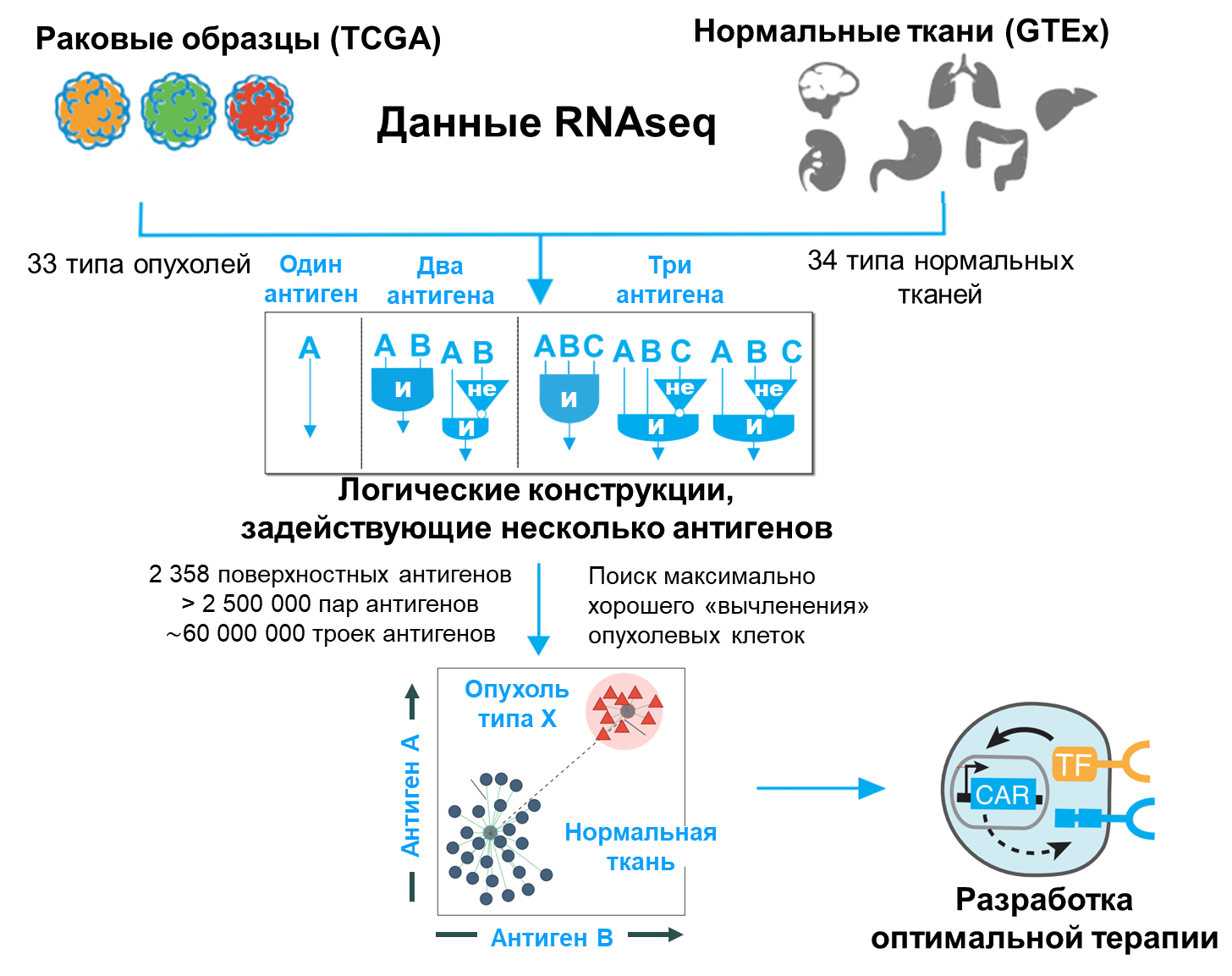
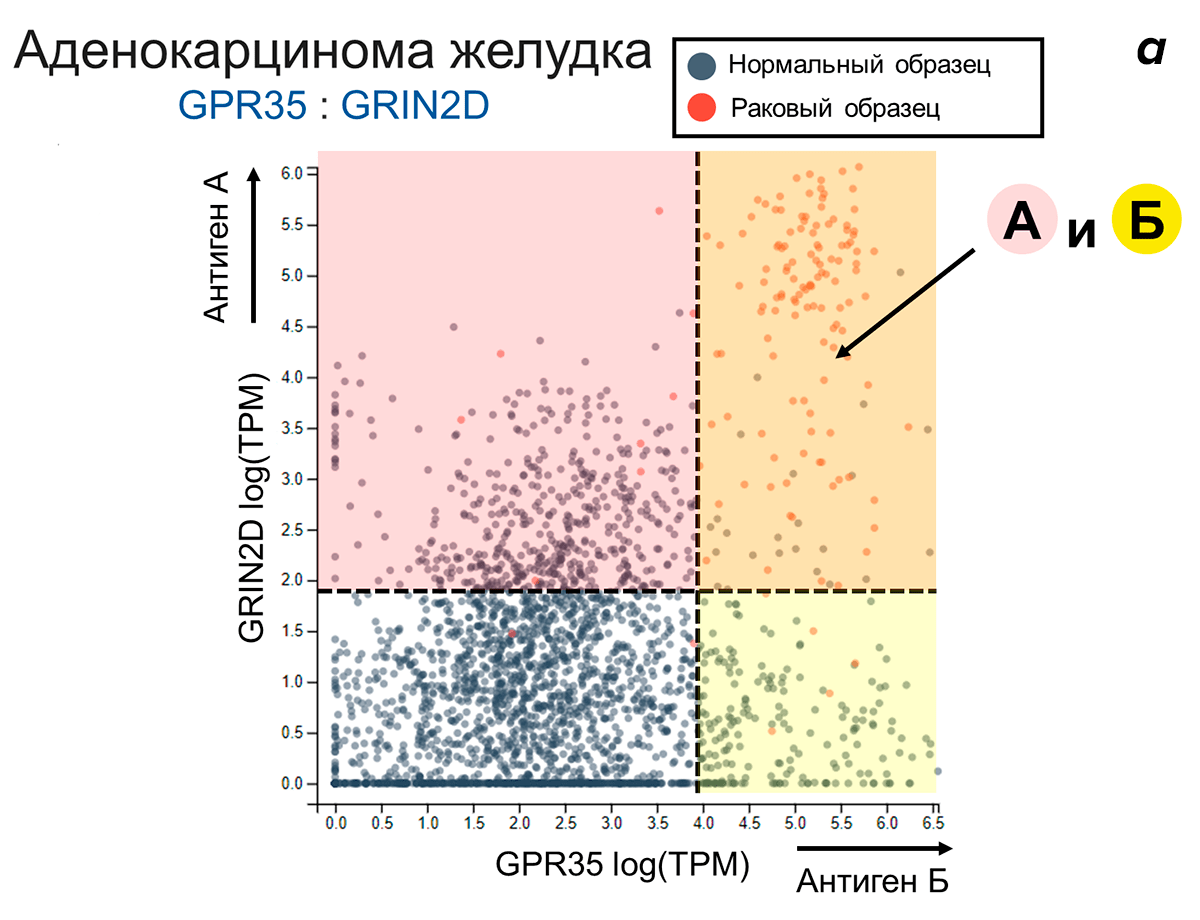
Рисунок 9. Бионформатический подбор антигенов для иммунотерапии опухолей. Были проанализированы данные транскриптомов клеток 33 видов рака из базы данных TCGA (The Cancer Genome Atlas) и 34 видов нормальных тканей из базы данных GTEx (The Genotype-Tissue Expression). Алгоритмы оценивали, насколько одиночные антигены, а также антигенные комбинации позволяют отличить опухолевые образцы от здоровых. Для каждой антигенной комбинации подбирали наиболее выгодную стратегию «программирования» Т-клеток, которой также давали оценку в плане специфичности и чувствительности распознавания.
[16], рисунок с изменениями
Ученые взяли данные транскриптомов (о различных клеточных «-омах» см. статью «“Омики” — эпоха большой биологии» [29]) 33 различных типов раковых клеток, а также клеток из 34 нормальных тканей и вычленили оттуда информацию об уровне экспрессии 2400 генов, продукты которых достоверно являются мембранными белками. Интерес именно к таким белкам очевиден, так как они могут являться потенциальными кандидатами на роль опухоль-ассоциированных антигенов. После этого ученые отобрали >2,5 миллионов пар антигенов и примерно 60 миллионов комбинаций из трех антигенов. Затем компьютерные алгоритмы оценивали, насколько хорошо каждый из этих наборов антигенов позволяет отличить раковые клетки определенного типа от клеток всех здоровых тканей организма.
Графически суть компьютерной оценки можно представить следующим образом. Пусть оси двух- или трехмерного пространства задают уровень синтеза антигенов из выбранного двойного или тройного набора соответственно. Образцы клеток определенного типа рака и всех здоровых тканей отображаются в таком пространстве в виде точек с координатами, равными уровню производства рассматриваемых антигенов в данном образце (рис. 9). На первом этапе оценивается, насколько хорошо в заданном антигенном пространстве «вычленяется» кластер раковых клеток. Чем дальше разнесены друг от друга раковые и здоровые образцы и чем плотнее кластеры, тем выше оценка антигенного «набора». На втором этапе компьютер подбирает рекомендуемую схему логического выбора для Т-лимфоцита. Графически это эквивалентно «проведению» таких границ, которые лучшим способом вычленяют раковые клетки. Например, раковые клетки может характеризовать высокий уровень синтеза одновременно двух антигенов А и Б (рис. 10а), и здесь будут эффективны Т-лимфоциты, работающие по типу «А И Б». В другом случае (рис. 10б), для ракового кластера характерна высокая представленность антигена А и низкая антигена Б. Очевидно, что в такой ситуации компьютер посоветует искать рак по схеме «А И НЕ Б».
Авторы даже создали специальный вебсервер, куда загрузили лучшие антигенные «фотороботы» многих распространенных типов опухолей. Для каждого антигенного портрета приведена информация о его специфичности (какой процент здоровых клеток будет ошибочно узнан Т-лимфоцитами с такими параметрами отбора) и чувствительности (как много раковых клеток будет упущено). Использование данных этого вебсервера учеными и медиками может быть очень полезным для разработки будущих смарт-иммунотерапий.
По результатам этой огромной аналитической работы авторы пришли к двум ключевым выводам. Во-первых, подтвердилась гипотеза, что хорошие комбинации из двух антигенов гораздо лучше вычленяют раковые клетки любого типа, чем это позволяет сделать любой опухолевый антиген поодиночке. Что касается комбинаций из трех антигенов, то здесь наблюдался неоднозначный результат. Использование третьего антигена позволяет лучше распознавать клетки некоторых особенно сложных опухолей (вроде рака желчного протока). Однако для многих других типов рака не было выявлено значительного выигрыша по качеству распознавания при добавлении третьего антигена по сравнению с двумя. Это связано с тем, что при переходе к трем компонентам резко улучшается специфичность распознавания, но может значимо падать и его чувствительность (будут упущены некоторые раковые клетки). Таким образом, для большинства типов рака использование всего двух или трех антигенов достаточно для их прицельного обнаружения. Этот факт не может не радовать, так как чем больше разных генетических конструкций нужно внедрять в клетку (например, с помощью лентивирусов), тем больше методологических сложностей возникает с точки зрения генной инженерии.
Второй важный вывод состоял в том, что благодаря использованию логически управляемых Т-лимфоцитов можно существенно расширить круг потенциальных антигенов-мишеней. В одних случаях речь идет о совместном распознавании нескольких уже изученных или даже применяемых на практике одиночных антигенов. Например, ученые предсказали и даже доказали экспериментально, что Т-лимфоциты, работающие по антигенному комбинаторному принципу «AXL И CD70» более точно распознают клетки рака почки, чем их собратья, имеющие одиночные рецепторы к антигенам CD70 или AXL [16]. В других случаях необычайно точными оказываются комбинации, которые включают совсем новые антигены. Такие белки ранее могли вообще не рассматриваться на роль опухоль-специфичных мишеней, например, в силу их широкой представленности на поверхности клеток других здоровых тканей. Ни один врач до этих расчетов не взялся бы использовать такие антигены в иммунотерапиях по одиночке из-за огромных рисков потенциальной токсичности. Но кто мог догадаться, что совместное использование этих антигенов в тех или иных комбинациях окажется на редкость безопасным способом выявлять раковые клетки! Такое своеобразное биоинформатическое рыболовство: никогда не знаешь заранее, какие диковинки можно поймать в свои компьютерные сети из океана больших данных.
Нерешенные проблемы смарт-иммунотерапии
В этой статье сделана попытка объяснить, почему логически управляемые CAR-T-лимфоциты являются не просто игрушкой биоинженеров, а революционным событием в области раковой терапии. Удивительным образом оказалось, что вызовы, стоящие перед учеными в этой сфере, концептуально пересекаются с проблемами компьютерных технологий. В частности, идея комбинативно управляемых Т-клеток будто воспроизводит принцип многофакторной аутентификации в цифровой реальности. Пришло время заметить, что, несмотря на всю свою эффективность, изобретение мультифакторной идентификации, однако, не уничтожило электронное мошенничество как явление, хотя и сильно усложнило жизнь преступникам. Аналогичным образом и ученые, борющиеся с раком, еще далеки от провозглашения своей победы над этим коварным врагом.
Во-первых, подбор идеальных комбинаций антигенов для каждого из типов рака затруднен в силу неполноты входных данных. В частности, в приведенном выше биоинформатическом анализе учитывают уровень транскрипции тех или иных генов (количество мРНК в клетке), а Т-клетки распознают белковые продукты этих генов, что строго говоря не одно и тоже. На это приходится идти, так как на сегодняшний день мы не обладаем полными протеомами (данными о синтезе белков), которые бы покрывали и все здоровые ткани, и раковые. Кроме того, даже транскриптомные базы данных пока неидеальны и могут не включать данные об экспрессии генов в каких-то специфических тканях. Так что полную безопасность того или иного антигенного набора нельзя полностью гарантировать заранее.
Во-вторых, оптимальное распознавание опухолей требует предельно тонкой чувствительности антигенных рецепторов, что схематически отражено на рисунке 10 в виде прямых, отсекающих пороговые значения детектируемой антигенной плотности. Нужны не просто Т-лимфоциты, способные распознать наличие или отсутствие антигена на клетке-мишени. Необходимы Т-клетки, реагирующие на представленность такого-то антигена выше или ниже определенного конкретного значения. На сегодняшний день мы еще далеки от создания идеальных рецепторов, поэтому так важно, чтобы кластеры раковых клеток и здоровых тканей были как можно дальше «разнесены» друг от друга в заданном «антигенном пространстве». Тем не менее сейчас разрабатываются все новые методики конструирования CAR с очень узкими интервалами распознаваемой антигенной плотности, что в случае успеха, может значительно помочь Т-клеточной иммунотерапии.
В-третьих, очень существенной остается проблема лабильности опухолевых клеток. Например, широко известно, что многие раковые клетки способны давать метастазы, тем самым смешиваясь со здоровыми тканями. Такая опасная близость нормальных и опухолевых клеток может приводить к токсическому эффекту со стороны Т-клеток, предактивированных метастазом. Действительно, эксперименты показывают, что некоторые разработанные логически управляемые Т-клетки могут быть безопасно применены против обособленных опухолей, но давать серьезные кросс-реакции со здоровой тканью, куда эта опухоль дала метастазы [30]. Помимо этого, нужно учитывать способность раковых клеток уходить из-под Т-клеточного надзора при помощи создания специфического микроокружения, подавляющего иммунную систему [31], а также банальной эволюции опухолей в сторону изменения уровня синтеза антигенов под действием искусственного отбора со стороны иммунотерапии.
Наконец, за рамками данного обзора остались другие проблемы CAR-T-терапии, не связанные с точностью их наведения, как то: недостаточная персистенция CAR-T и их истощение, гиперактивация иммунной системы организма (цитокиновый шторм), а также дороговизна и длительность их производства. Последний недостаток пытаются обойти с помощью аллогенных клеток [32], но эти исследования находятся пока на слишком ранней стадии, чтобы говорить об успехе.
Все вышеперечисленные подводные камни иммунотерапии онкологических заболеваний еще предстоит обойти биоинженерам и врачам. И не стоит удивляться, если решить эти сложные задачи помогут успехи в совершенно других сферах человеческой деятельности вроде создания искусственного интеллекта и роботов.
Литература
- Steven A. Rosenberg, Nicholas P. Restifo, James C. Yang, Richard A. Morgan, Mark E. Dudley. (2008). Adoptive cell transfer: a clinical path to effective cancer immunotherapy. Nat Rev Cancer. 8, 299-308;
- Karthik Dhatchinamoorthy, Jeff D. Colbert, Kenneth L. Rock. (2021). Cancer Immune Evasion Through Loss of MHC Class I Antigen Presentation. Front. Immunol.. 12;
- Антиген — невидимка;
- Hannah E. Hughes-Parry, Ryan S. Cross, Misty R. Jenkins. (2019). The Evolving Protein Engineering in the Design of Chimeric Antigen Receptor T Cells. IJMS. 21, 204;
- Способны ли CAR-Т-клетки уничтожить опухоль?;
- Клетки, которые лечат людей;
- Zijun Zhao, Yu Chen, Ngiambudulu M. Francisco, Yuanqing Zhang, Minhao Wu. (2018). The application of CAR-T cell therapy in hematological malignancies: advantages and challenges. Acta Pharmaceutica Sinica B. 8, 539-551;
- Shannon L. Maude, Noelle Frey, Pamela A. Shaw, Richard Aplenc, David M. Barrett, et. al.. (2014). Chimeric Antigen Receptor T Cells for Sustained Remissions in Leukemia. N Engl J Med. 371, 1507-1517;
- Sattva S. Neelapu, Frederick L. Locke, Nancy L. Bartlett, Lazaros J. Lekakis, David B. Miklos, et. al.. (2017). Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma. N Engl J Med. 377, 2531-2544;
- David M. Barrett, Nathan Singh, David L. Porter, Stephan A. Grupp, Carl H. June. (2014). Chimeric Antigen Receptor Therapy for Cancer. Annu. Rev. Med.. 65, 333-347;
- Cor HJ Lamers, Stefan Sleijfer, Sabine van Steenbergen, Pascal van Elzakker, Brigitte van Krimpen, et. al.. (2013). Treatment of Metastatic Renal Cell Carcinoma With CAIX CAR-engineered T cells: Clinical Evaluation and Management of On-target Toxicity. Molecular Therapy. 21, 904-912;
- Richard A Morgan, James C Yang, Mio Kitano, Mark E Dudley, Carolyn M Laurencot, Steven A Rosenberg. (2010). Case Report of a Serious Adverse Event Following the Administration of T Cells Transduced With a Chimeric Antigen Receptor Recognizing ERBB2. Molecular Therapy. 18, 843-851;
- Maria R Parkhurst, James C Yang, Russell C Langan, Mark E Dudley, Debbie-Ann N Nathan, et. al.. (2011). T Cells Targeting Carcinoembryonic Antigen Can Mediate Regression of Metastatic Colorectal Cancer but Induce Severe Transient Colitis. Molecular Therapy. 19, 620-626;
- Fiona C. Thistlethwaite, David E. Gilham, Ryan D. Guest, Dominic G. Rothwell, Manon Pillai, et. al.. (2017). The clinical efficacy of first-generation carcinoembryonic antigen (CEACAM5)-specific CAR T cells is limited by poor persistence and transient pre-conditioning-dependent respiratory toxicity. Cancer Immunol Immunother. 66, 1425-1436;
- Juliane Gust, Rafael Ponce, W. Conrad Liles, Gwenn A. Garden, Cameron J. Turtle. (2020). Cytokines in CAR T Cell–Associated Neurotoxicity. Front. Immunol.. 11;
- David L. Porter, Bruce L. Levine, Michael Kalos, Adam Bagg, Carl H. June. (2011). Chimeric Antigen Receptor–Modified T Cells in Chronic Lymphoid Leukemia. N Engl J Med. 365, 725-733;
- Yanting Duan, Ruoqi Chen, Yanjie Huang, Xianhui Meng, Jiangqing Chen, et. al.. (2022). Tuning the ignition of CAR: optimizing the affinity of scFv to improve CAR-T therapy. Cell. Mol. Life Sci.. 79;
- Ruth Dannenfelser, Gregory M. Allen, Benjamin VanderSluis, Ashley K. Koegel, Sarah Levinson, et. al.. (2020). Discriminatory Power of Combinatorial Antigen Recognition in Cancer T Cell Therapies. Cell Systems. 11, 215-228.e5;
- Kole T. Roybal, Levi J. Rupp, Leonardo Morsut, Whitney J. Walker, Krista A. McNally, et. al.. (2016). Precision Tumor Recognition by T Cells With Combinatorial Antigen-Sensing Circuits. Cell. 164, 770-779;
- Leonardo Morsut, Kole T. Roybal, Xin Xiong, Russell M. Gordley, Scott M. Coyle, et. al.. (2016). Engineering Customized Cell Sensing and Response Behaviors Using Synthetic Notch Receptors. Cell. 164, 780-791;
- Программируемый морфогенез многоклеточных систем;
- Wendy R. Gordon, Brandon Zimmerman, Li He, Laura J. Miles, Jiuhong Huang, et. al.. (2015). Mechanical Allostery: Evidence for a Force Requirement in the Proteolytic Activation of Notch. Developmental Cell. 33, 729-736;
- Helen K. Alexander, Evan P. Booy, Wenyan Xiao, Peyman Ezzati, Heinrich Baust, Marek Los. (2007). Selected technologies to control genes and their products for experimental and clinical purposes. Arch. Immunol. Ther. Exp.. 55, 139-149;
- Christopher C Kloss, Maud Condomines, Marc Cartellieri, Michael Bachmann, Michel Sadelain. (2013). Combinatorial antigen recognition with balanced signaling promotes selective tumor eradication by engineered T cells. Nat Biotechnol. 31, 71-75;
- Dipankar Dasgupta, Arunava Roy, Abhijit Nag. (2017). Multi-Factor Authentication. Infosys Science Foundation Series. 185-233;
- Victor D. Fedorov, Maria Themeli, Michel Sadelain. (2013). PD-1– and CTLA-4–Based Inhibitory Chimeric Antigen Receptors (iCARs) Divert Off-Target Immunotherapy Responses. Sci. Transl. Med.. 5;
- Zakaria Grada, Meenakshi Hegde, Tiara Byrd, Donald R Shaffer, Alexia Ghazi, et. al.. (2013). TanCAR: A Novel Bispecific Chimeric Antigen Receptor for Cancer Immunotherapy. Molecular Therapy - Nucleic Acids. 2, e105;
- Meenakshi Hegde, Amanda Corder, Kevin KH Chow, Malini Mukherjee, Aidin Ashoori, et. al.. (2013). Combinational Targeting Offsets Antigen Escape and Enhances Effector Functions of Adoptively Transferred T Cells in Glioblastoma. Molecular Therapy. 21, 2087-2101;
- «Омики» — эпоха большой биологии;
- Shivani Srivastava, Alexander I. Salter, Denny Liggitt, Sushma Yechan-Gunja, Megha Sarvothama, et. al.. (2019). Logic-Gated ROR1 Chimeric Antigen Receptor Expression Rescues T Cell-Mediated Toxicity to Normal Tissues and Enables Selective Tumor Targeting. Cancer Cell. 35, 489-503.e8;
- David H Munn, Vincenzo Bronte. (2016). Immune suppressive mechanisms in the tumor microenvironment. Current Opinion in Immunology. 39, 1-6;
- Dong Kim, Je-Yoel Cho. (2020). Recent Advances in Allogeneic CAR-T Cells. Biomolecules. 10, 263.