Программируемый морфогенез многоклеточных систем
11 февраля 2021
Программируемый морфогенез многоклеточных систем
- 1377
- 0
- 8
Воздействуя на клетки различными факторами, можно вызвать их дифференцировку в нужном направлении и формирование ими структур заданного строения.
Рисунок в полном размере.
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Последние полвека ознаменованы бурным развитием генных и клеточных технологий. Применение методов вставки чужеродных генов, геномного редактирования, направленной дифференцировки клеток стало рутинным для учёных по всему миру. Ясно, что власть человека над живой материей растёт. Однако для её дальнейшего роста нам нужно научиться не просто придавать живому какие-то отдельные единичные признаки или свойства, а создавать сложные живые системы с нуля, программируя их структурные и функциональные особенности. Каковы же успехи биоинженеров в решении этой нелёгкой задачи? Данный обзор знакомит читателя с достигнутыми к настоящему моменту успехами в воспроизведении природных и создании синтетических многоклеточных систем, состоящих из разных типов клеток.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Сложная трёхмерная структура тканей, органов и организмов определяется скоординированным поведением клеток в ходе процесса, называемого морфогенезом (формирование формы) . Многие годы учёные пытались понять, как форма живых структур определяется геномом. Было показано, что гены в основном кодируют сигнальные пути, определяющие судьбу клеток, но не контролируют непосредственно клеточную и тканевую форму — «паттерн» расположения клеток. Для понимания процессов развития и регенерации необходимо определить, как группа изначально однородных клеток организует себя в структуры и ткани. В ходе регенерации межклеточные взаимодействия опосредуют восстановление ткани, однако ни одна клетка не имеет чёткого плана, как окончательная ткань должна выглядеть в глобальном масштабе. Клеточные «паттерны» определяются не изначально заложенным планом строения формируемых структур, а алгоритмами поведения клеток. Такие алгоритмы в ходе межклеточных взаимодействий позволяют из изначально однородной клеточной популяции получить различные типы клеток с точным расположением компонентов друг относительно друга. Каждые новые межклеточные взаимодействия приводят ко всё более отчетливой информации о взаимном расположении клеток. Этот процесс является скоординированным и самоорганизованным; каждая отдельная клетка имеет молекулярные механизмы, позволяющие ощущать микроокружение и правильно реагировать на повреждения, воссоздавая здоровую ткань [1].
Некоторые базовые концепции морфогенеза можно почерпнуть в статье «Лаборатория молекулярных основ эмбриогенеза: от гена к признаку» [2].
Органоиды: самосборка или контролируемый дизайн?
В попытке воспроизвести процессы морфогенеза и вырастить фрагменты органов животных были получены органоиды — объёмные миниатюрные и упрощённые версии органов [3]. Они формируются in vitro, имеют органоспецифическое строение из разных клеточных типов и выполняют специфическую функцию органа. Органоиды можно получить путём культивирования тканей, изъятых из органов взрослых особей, или же создать более перспективным способом — вырастить их из стволовых клеток. Эмбриональные и индуцированные плюрипотентные стволовые клетки, в отличие от стволовых клеток взрослого организма, способны к дифференцировке в любую ткань тела [4–8]. Воздействуя на них факторами, управляющими органогенезом в ходе эмбрионального развития, можно получить тот или иной органоид или конкретный тип клеток. Используя инструменты синтетической биологии, возможно менять структуру органоидов — например, управляя фенотипом клеток с помощью оптогенетики [9], [10].
Органоиды были получены для большинства органов человека, в том числе для головного мозга, печени, поджелудочной железы, лёгких, а также нашли применение для изучения развития органов, моделирования патологий и скрининга лекарственных препаратов. Сформированные кишечные органоиды включают элементы эпителия, соединительной ткани, гладкой мускулатуры и нервных сплетений. Клетки молочной железы образуют полые сферические структуры, напоминающие молочные ацинусы, в полость которых секретируется молоко. Бронхиально-альвеолярные эпителиальные органоиды имеют просвет в центральной части, образующий ветвящиеся полости, в целом напоминающие легочный эпителий с бронхиальными и альвеолярными доменами. Полученные органоиды почки содержат смесь эпителиальных и мезенхимных клеток предшественников, образующих трубчатые структуры, и формируют зачатки сети нефронов (рис. 1). Органоиды мозга имеют слоистую структуру, которая соответствует самым ранним этапам развития мозга [10].
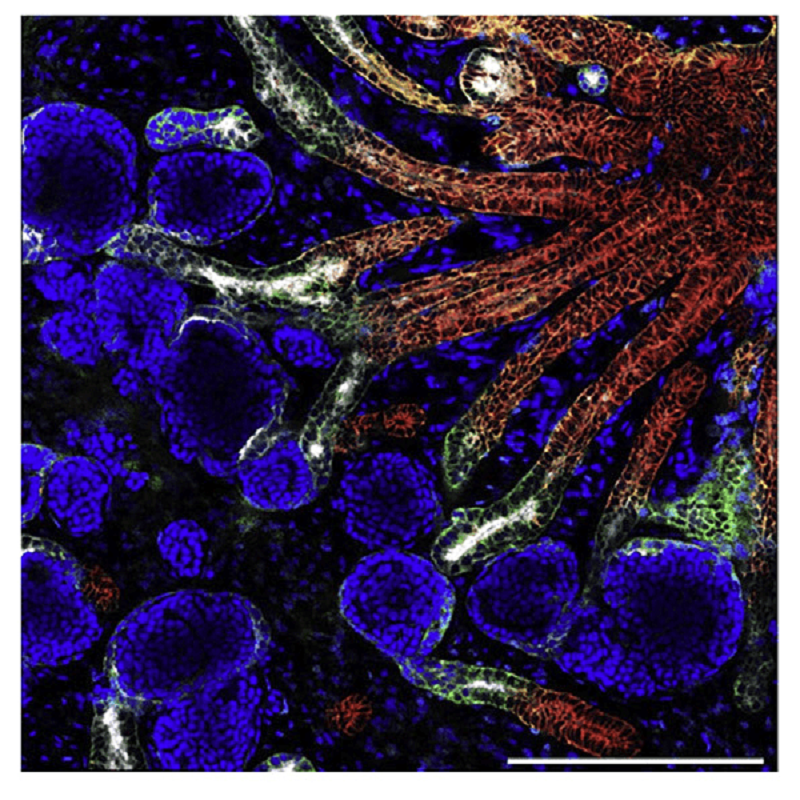
Рисунок 1. Органоид почки на 24 день. В конфокальном микроскопе видно предварительное развитие структур.
Образование органоидов можно представить как процесс генетически закодированной самосборки тканей. Он сопровождается активацией генетических паттерн-формирующих систем, образуя различные группы клеток, которые, взаимодействуя друг с другом, создают ткани. К сожалению, использование органоидов в регенеративной медицине затруднено из-за их незрелости и неоднородности. Это связано с тем, что органоиды развиваются вне естественного контекста — в эмбрионе судьба клеток определяется информацией от соседних клеток: градиентами морфогенов и взаимодействиями с внеклеточным матриксом [11]. В развивающемся организме изменение клеток проходит через последовательные стадии, а сформированный орган приобретает функциональную нагрузку. Без этих процессов органоиды развиваются исключительно на основе местных клеточных взаимодействий, что приводит к упрощённой организации, а не к формированию полноценной зрелой ткани, способной полноценно выполнять свою функцию. Органоиды лишены дополнительных структур, необходимых для нормального развития любой ткани в организме — нервов, сосудистой системы, стромального компонента, иммунных клеток. Это также накладывает ограничение на размер органоидов, ведь без кровеносных сосудов транспорт газов, питательных веществ и других гуморальных факторов в тканях ограничен простой диффузией. К сожалению, на сегодняшний день исследователи не способны контролируемо формировать и изменять определённый план строения органоида. Понимание процессов, лежащих в основе самоорганизации клеток в тканевые структуры, позволит получать органоиды заданной структуры [10]. Было бы возможно менять соотношение клеток разных типов, варьировать количество и толщину слоёв в слоистых органоидах. Так, в случае с органоидами мозга мы могли бы контролируемо изменять количество слоёв нервных клеток и их межклеточные контакты.
Где лежит план строения
Формирование паттернов в многоклеточных организмах определяется морфогенами, представленными малыми молекулами (например, ретиноевая кислота), факторами роста (например, факторы роста фибробластов, FGFs), морфогенетическими белками костей (BMPs, WNT и т. д.) или гормонами [12]. Эти молекулы образуют диффузионные градиенты в тканях, регулирующих судьбу клеток. В таких условиях каждая отдельная клетка в ткани ощущает своё положение вдоль градиента концентрации морфогена. Морфогены активируют генно-регуляторные сети, разграничивающие определенные участки и определяющие судьбу клеток внутри них. Так, например, в кистах нервной трубки и криптах кишечных органоидов, полученных из клеток мыши, присутствуют градиенты белков Sonic Hedgehog и Wnt3 [12]. В качестве индикаторных молекул в синтетической биологии в настоящее время обычно используются флуоресцентные белки, такие как зелёный флуоресцентный белок (GFP) и красный флуоресцентный белок mCherry [13], [14]. Эти белки способны образовывать градиент концентрации и взаимодействовать в нём с мембранными синтетическими рецепторами, а флуоресценция даёт возможность легко этот градиент показать [15].
Состояние и судьба клеток регулируются сетью факторов транскрипции, которые реагируют на внутренние или внешние сигналы и меняют экспрессию генов. Эти «магические» регуляторы тканевой дифференцировки экспрессируются с изысканной пространственно-временной специфичностью и точностью и определяют, когда и где будет происходить процесс формирования ткани. Контроль морфогенетических процессов определяется регуляторными сетями (рис. 2). В этих сетях сигнал переходит от входного к целевому гену разными путями в зависимости от уровня входного сигнала. При этом экспрессия целевого гена возможна лишь при средних значениях концентрации активирующего белка [16].
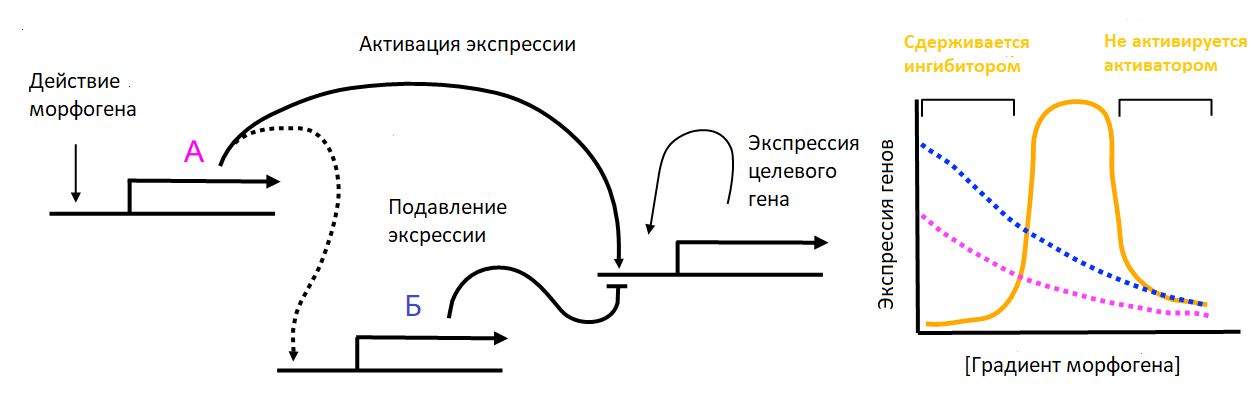
Рисунок 2. Регуляторные сети морфогенов. Морфоген пропорционально своей концентрации определяет продукцию белка A, который, в свою очередь, активирует транскрипцию целевого гена и его ингибитора Б. При низких уровнях морфогена белка А недостаточно для усиления экспрессии целевого гена. При высоких уровнях синтезируется достаточное количество белка Б, чтобы ингибировать экспрессию выходного гена. На промежуточных уровнях имеется достаточное количество белка А для экспрессии выходного гена, но незначительное количество белка Б.
Трудной и важной задачей в тканевой инженерии является формирование упорядоченного паттерна клеток de novo, без ранее существовавших сигналов и структур. Именно синтетическая биология направлена на установление сложного, программируемого контроля над клеточным поведением [17]. Синтетические генные схемы способны обнаруживать метаболическое состояние, биохимические сигналы, свет и даже электрические и магнитные поля. Они используют эту информацию для изменения формы, подвижности, программы дифференцировки клетки или могут привести к её гибели [16].
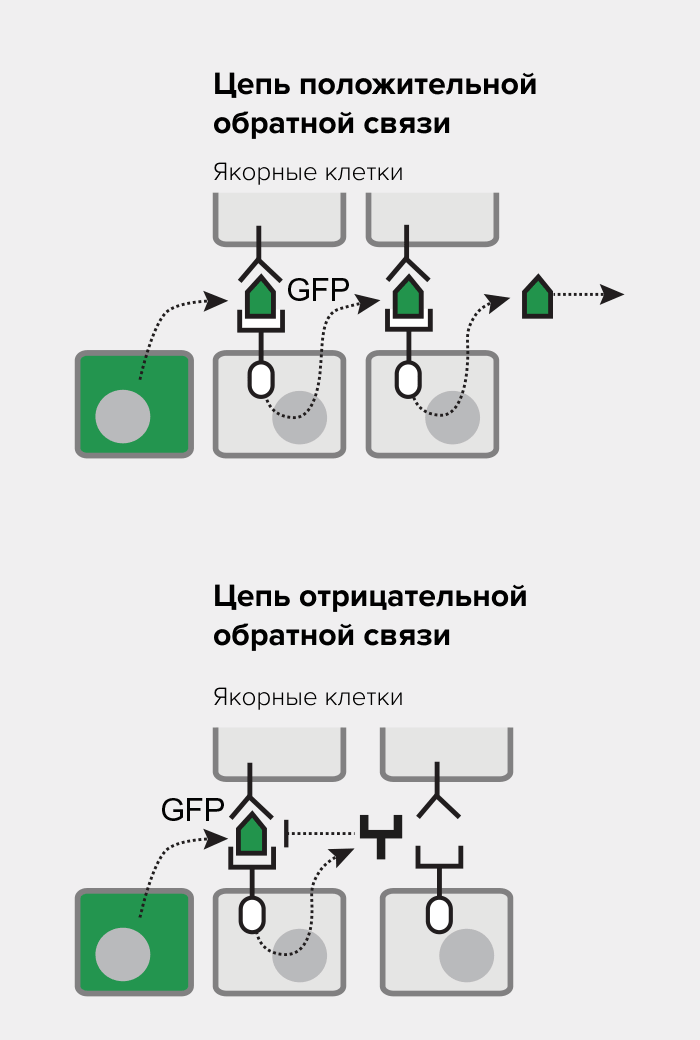
Существует несколько принципов формирования паттернов de novo. В первом варианте на основе принципа отрицательной обратной связи действие одной молекулы приводит к осцилляционным процессам. В ходе этих процессов концентрации вещества то уменьшаются, то увеличиваются (рис. 3). При осцилляционных процессах длительность цикла определяется внутренними задержками ответа обратной связи и чувствительностью системы. Второй вариант включает сочетание влияния отрицательной обратной связи с положительной обратной связью. Такой принцип характерен для систем, использующих латеральное торможение. Изначально идентичные клетки усиливают экспрессию определённых генов соседних клеток, которые, в свою очередь, подавляют экспрессию того же самого гена в прилегающих клетках (рис. 3). Пространственные закономерности могут также возникать на основе реакционно-диффузионных моделей Тьюринга, которые способны генерировать различные паттерны клеток (рис. 3). В этом контексте одна молекула-«активатор» объединяет положительную обратную связь для активации собственного синтеза с отрицательной обратной связью, активируя синтез молекулы, которая подавляет действие активатора [18].
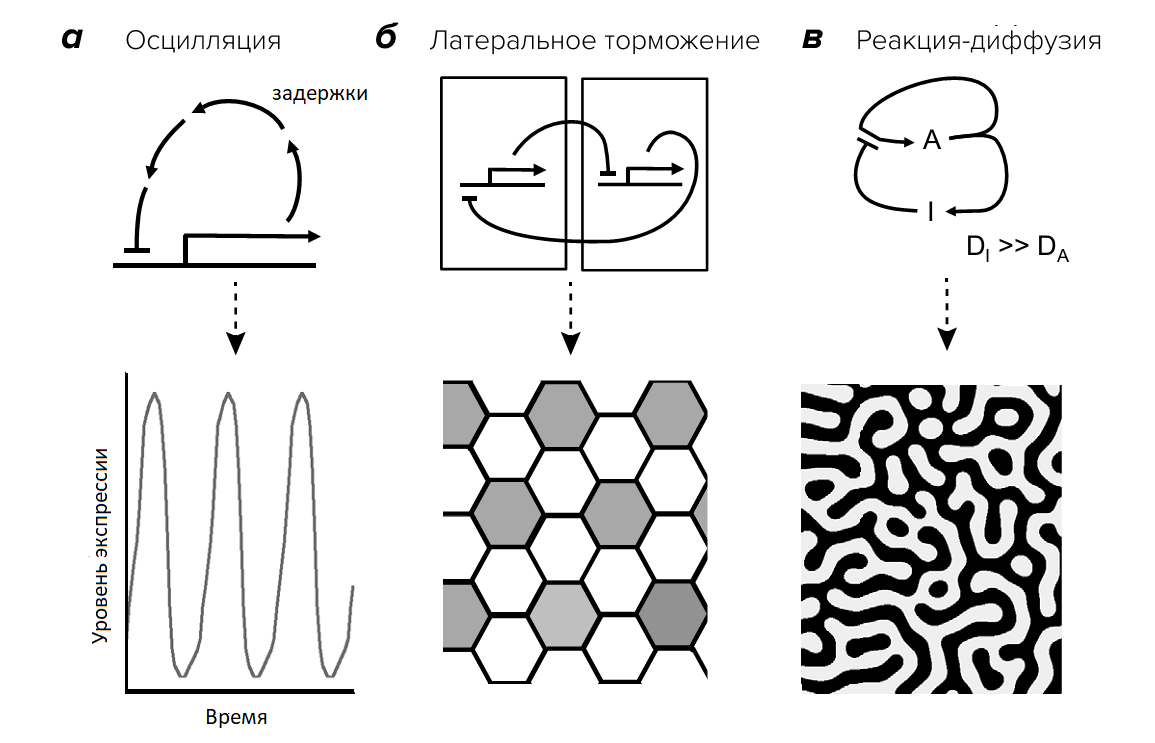
Рисунок 3. Принципы формирования паттернов de novo. (а) Схема биологических осцилляторов, которая может генерировать паттерны в течение времени. Ген, транскрибируемый из промотора, периодически подавляет собственный синтез. (б) Простая система латерального ингибирования, при которой экспрессия гена в одной клетке подавляет экспрессию того же гена в соседней. (в) Простая система реакции-диффузии, в которой плохо диффундирующий активатор (A) активирует собственное производство и продукцию хорошо диффундирующего ингибитора (I). Там, где уровень активатора высок, его активности достаточно для производства активатора, несмотря на действие ингибитора (в связи с тем, что что ингибитор хорошо диффундирует из этой области). В участках, смежных с активатором, уровни ингибитора достаточно высоки и подавляют активацию. Это создаёт разрозненный паттерн областей, в которых преобладают активация и подавление. Константа диффузии для ингибитора DI значительно превышает константу диффузии активатора DA.
В модельной системе на клеточной линии почек (T-REx-293) показано построение паттерна путём разделения фаз на участки одной фазы среди клеток другой фазы, отличающиеся по экспрессии адгезивных молекул (рис. 4). В центральных участках активируется программа гибели клеток, приводя к образованию ситоподобного клеточного пласта с отверстиями [19].
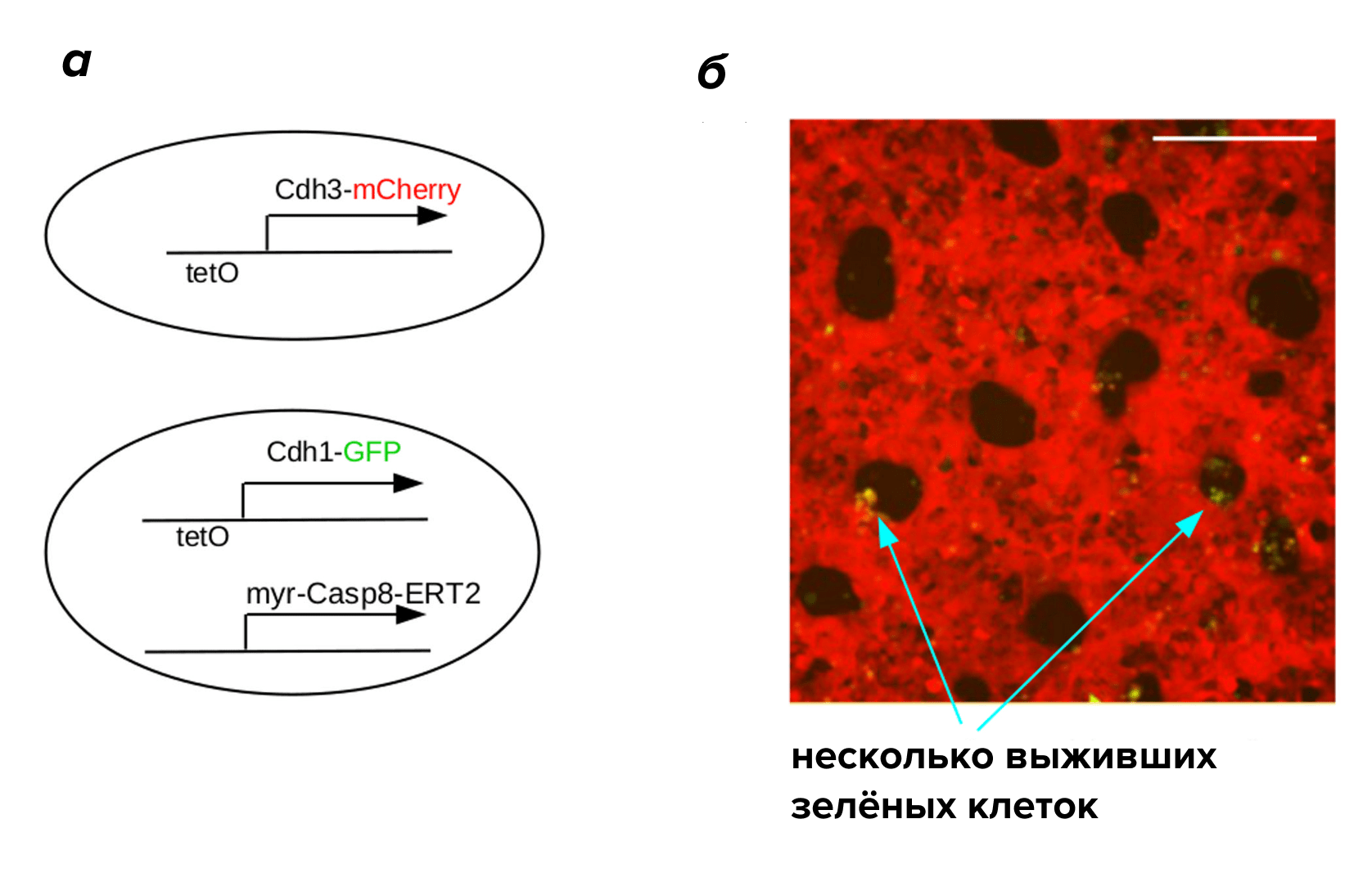
Рисунок 4. Формирование паттерна с последующим морфогенезом. (а) Генетические конструкции двух типов клеток, экспрессирующих разные кадгерины. (б) При индукции тетрациклином клетки формируют разделение фаз, ингибируя репрессорный белок TetR, который конститутивно экспрессируется в этих клетках. При добавлении тамоксифена белок Caspase8-ERT2 вызывает апоптоз в зелёных клетках Cdh1, оставляя дыры в ситоподобной «ткани»; масштабная линейка 200 мкм
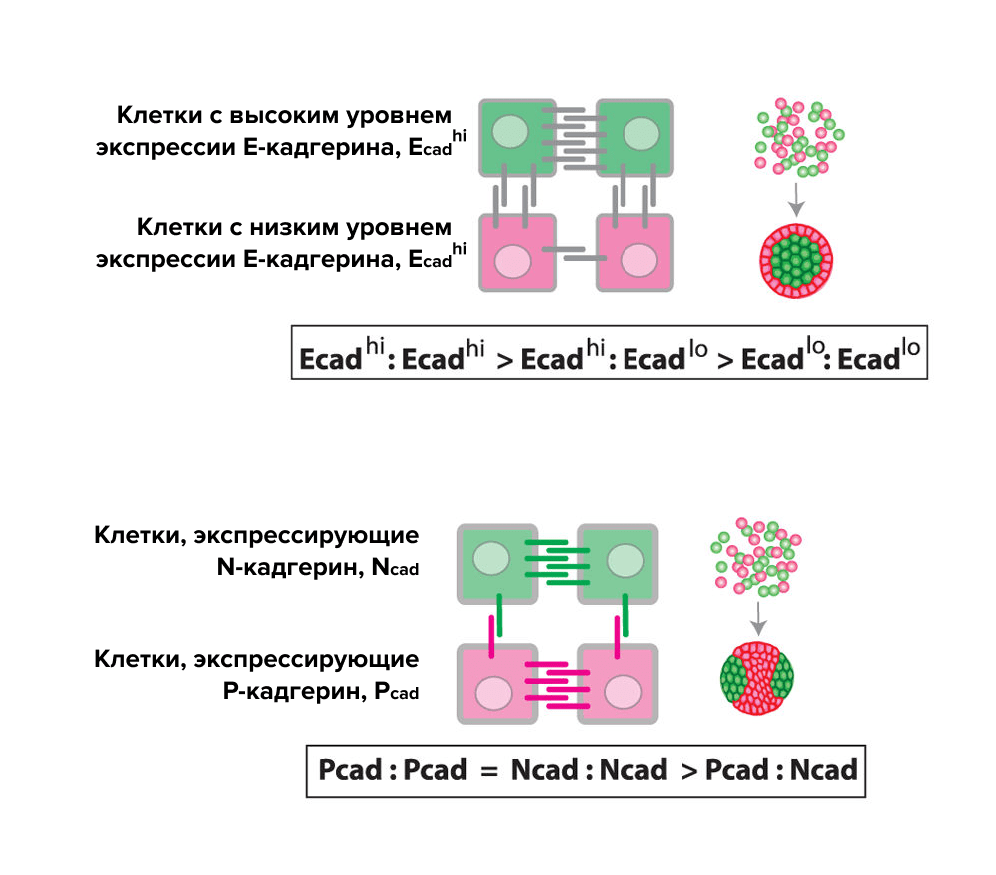
Были сконструированы две популяции слабо адгезивной линии клеток человека HEK239, меченные флуоресцентными белками, которые при добавлении тетрациклина вызывали экспрессию либо E-, либо P-кадгерина [20]. При культивировании в отсутствие тетрациклина клетки не формировали никакого паттерна, а при его добавлении происходило разделение клеток с образованием пятен и линий клеток различного цвета (рис. 5). Для управления сортировкой клеток была использована разница в силе адгезии между гомотипическими и гетеротипическими взаимодействиями E-кадгерина и P-кадгерина. Посредством кадгерин-опосредованного разделения фаз возможно стимулировать клетки млекопитающих генерировать сложные 2D- и 3D-паттерны de novo. Разделение фаз может иметь большое значение для тканевой инженерии, обеспечивая возможность к самоорганизации смешанных популяций клеток [21].
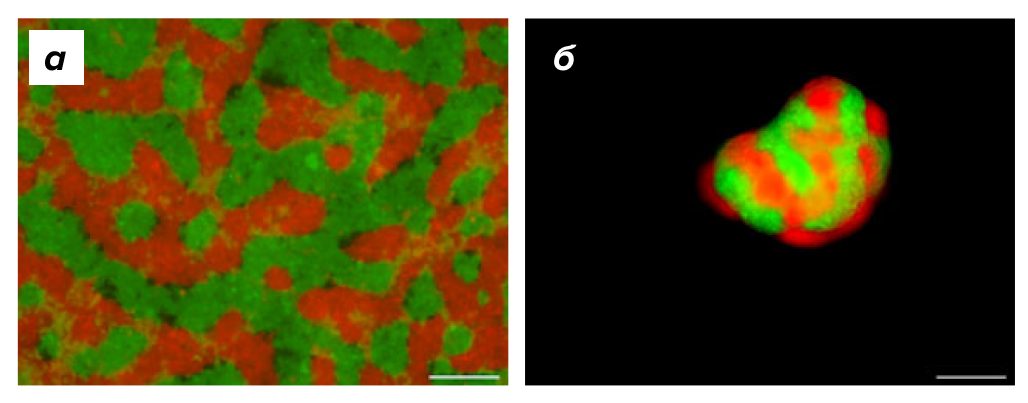
Рисунок 5. Формирование паттерна de novo. Паттерн формируется за счет разделения фаз, управляемого E-кадгерином и P-кадгерином. (а) Двумерная культура клеток. (б) Трёхмерная культура клеток в виде сфероида.
В другом исследовании было показано, как три клеточные популяции, экспрессирующие либо E-, либо N-, либо P-кадгерины, разделяются на отдельные компартменты в связи с предпочтением однотипной самоассоциации этих кадгеринов [22]. В условиях различного уровня экспрессии E-кадгерина клетки с более высокими уровнями связываются друг с другом сильнее и образуют агрегат, тогда как клетки с более низким уровнем экспрессии формируют внешний слой (рис. 6А). При смешивании популяций клеток с N- и P-кадгеринами клетки занимают различные участки сфероида и образуют асимметричные паттерны (рис. 6Б).
Клетки воспринимают сигналы окружения (трансмембранные лиганды и секреторные молекулы) своими рецепторами, обрабатывающими внешнюю информацию внутриклеточными молекулярными сетями, что ведёт к изменению экспрессии генов, перестройке цитоскелета и процессам секреции. Межклеточный сигнальный путь Notch-Delta регулирует экспрессию генов, которые опосредуют дифференцировку клеток. Когда рецептор Notch распознает лиганд Delta на соседней клетке, он претерпевает конформационные изменения и расщепляется трансмембранными протеазами, что приводит к высвобождению внутриклеточного домена Notch (NICD) в цитоплазму. Затем NICD перемещается в ядро и регулирует экспрессию целевого гена.
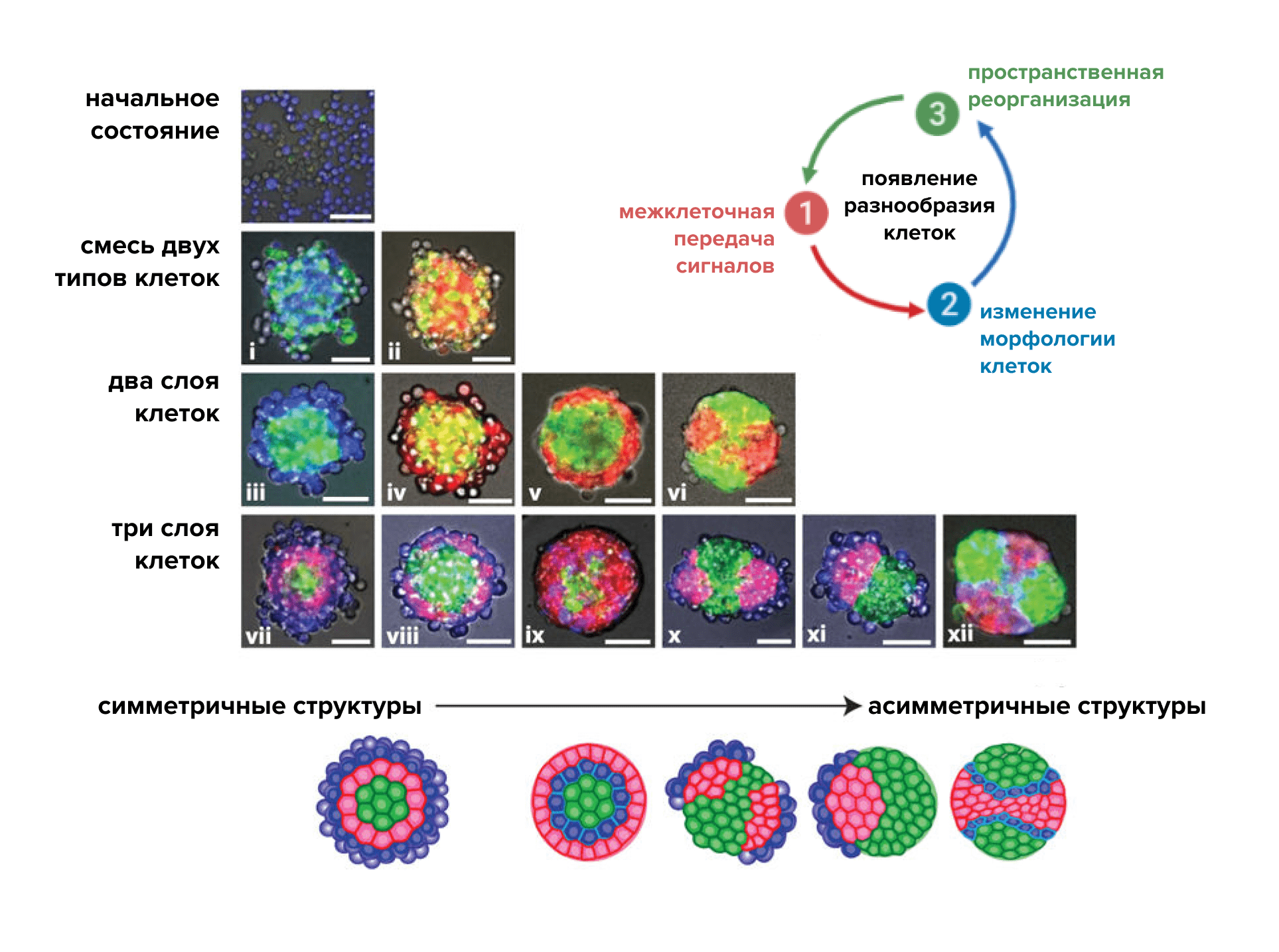
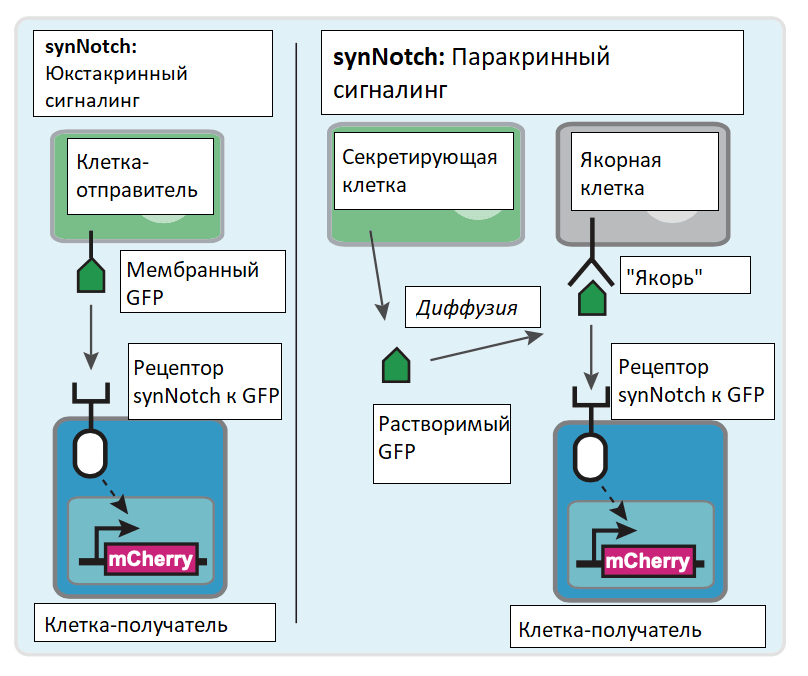
Была разработана искусственная система synNotch (синтетический рецептор Notch), которая включает в себя модифицированные компоненты сигнальных путей Notch в клетках. Благодаря огромному разнообразию антител (участков распознавания лигандов в составе этих рецепторов) и многообразию транскрипционных доменов возможно программировать практически любые межклеточные взаимоотношения под действием большого числа сигналов. Используя такую систему, возможно контролируемо показать формирование самоорганизующихся многослойных структур из изначально однородной популяции клеток (рис. 7) [23].
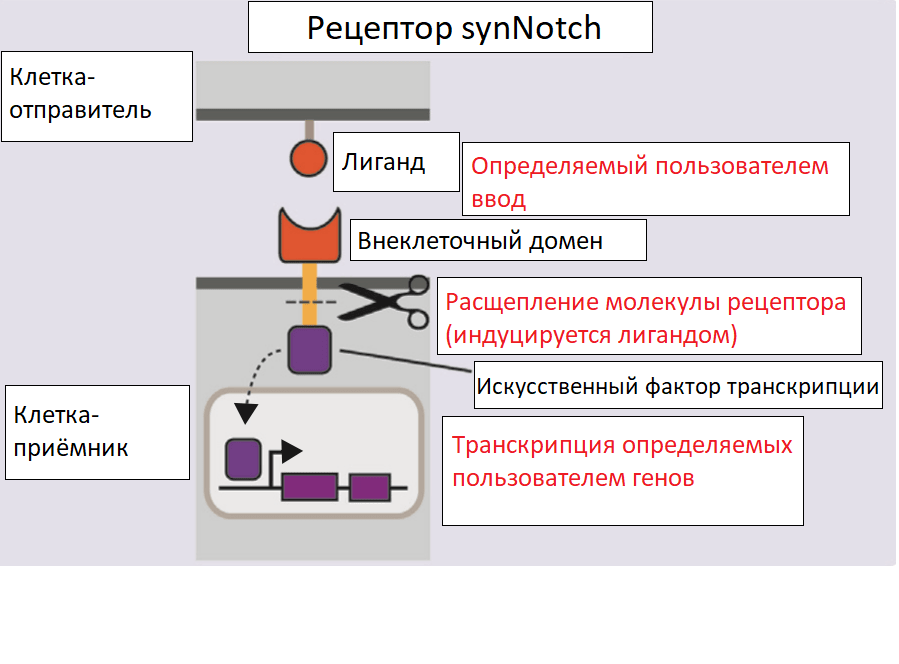
Рисунок 7. Устройство рецептора synNotch. Рецептор включает в себя основной трансмембранный регуляторный домен Notch, связанный с внеклеточным распознающим доменом и химерным внутриклеточным транскрипционным доменом. Лиганд, представленный на поверхности клетки-отправителя, связывается с рецептором synNotch на клетке-приёмнике. Это приводит к расщеплению внутриклеточного домена Notch (NICD) и высвобождению внутриклеточного транскрипционного домена, перемещающегося в ядро и управляющего экспрессией целевых генов. В синтетической системе NICD заменяется искусственным фактором транскрипции, способным активировать транскрипцию заданных биоинженером генов, а внеклеточный домен заменяется одноцепочечным антителом, что позволяет программировать межклеточную коммуникацию.
Системы synNotch способны вызывать экспрессию различных флуоресцентных белков, обозначающих цветом «дифференцировку» клеток на новые типы. Используя такой подход, можно создавать очень наглядные синтетические программы межклеточного взаимодействия со схемами synNotch (рис. 8). Появляется возможность в реальном времени наблюдать за последовательной дифференцировкой клеток и контролировать этот процесс.
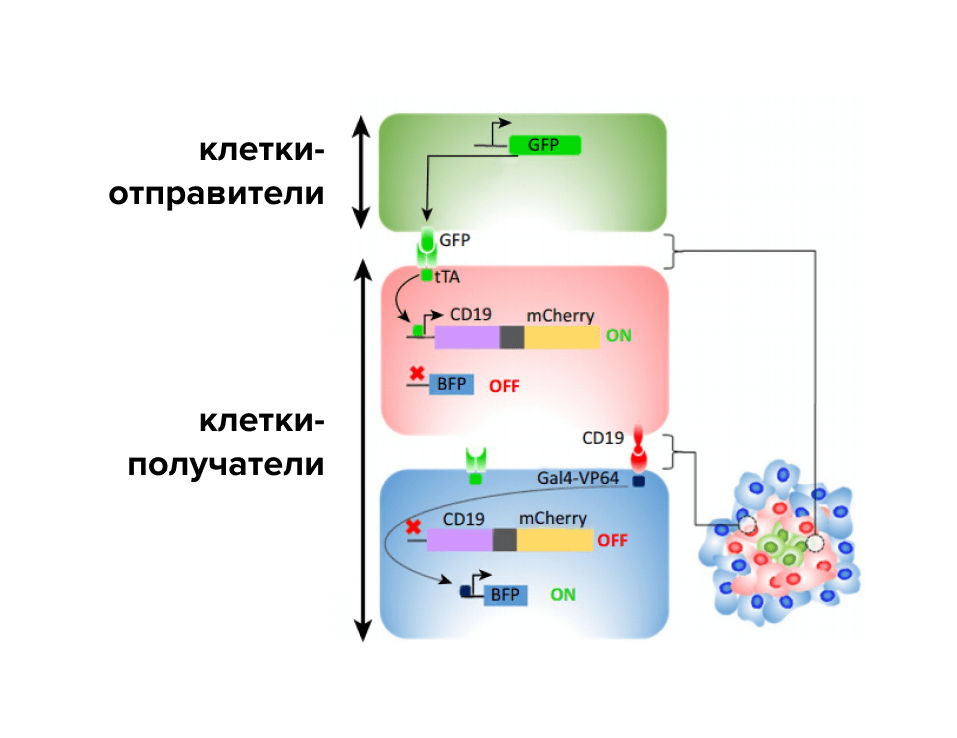
Рисунок 8. Конструирование межклеточных взаимодействий для формирования паттерна клеток. Клетка-отправитель сигнала экспрессирует на своей поверхности E-кадгерин с ассоциированным к нему модифицированным GFP-лигандом, содержащим домен рецептора фактора роста тромбоцитов (PDGFR). GFP-лиганд взаимодействует с анти-GFP synNotch рецептором вторых клеток, что приводит к красной флуоресценции и экспрессии поверхностного лиганда (CD19) для третьей системы synNotch. Третья система synNotch имеет домен, чувствительный к анти-CD19, и домен, способный активировать транскрипцию tagBFP (голубого флуоресцентного белка). Таким образом, первое сигнальное взаимодействие привело к формированию двухслойной структуры, тогда как вторая передача сигнала происходила только в клетках, связанных с клетками, экспрессирующими GFP-лиганд, и вызывала экспрессию mCherry. Конечная структура содержит три слоя: ядро, экспрессирующее GFP, промежуточный уровень, экспрессирующий mCherry, и внешний уровень с BFP.
адаптировано из [23]
По волнам концентраций
Один из важных принципов формирования паттернов заключается в том, что поведение клеток может определяться местными концентрациями морфогена, которые создают в ткани градиент. Поддержание этих градиентов возможно при условии, что период полураспада молекул достаточен для распространения их на нужное расстояние. Возрастание количества морфогена приводит к увеличению градиента, тогда как снижение концентрации не влияет на клетки, которые уже подверглись воздействию высоких концентраций. Предполагается, что градиенты устанавливают довольно грубые паттерны, которые впоследствии корректируются с помощью межклеточной сигнализации и регуляторных сетей.
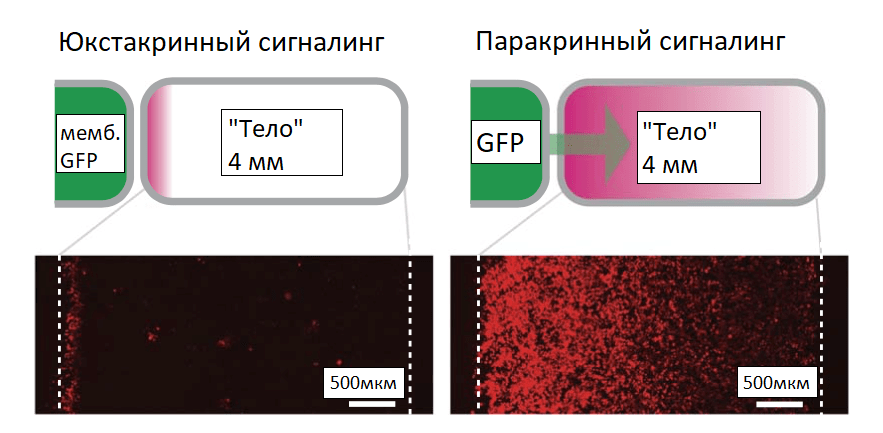
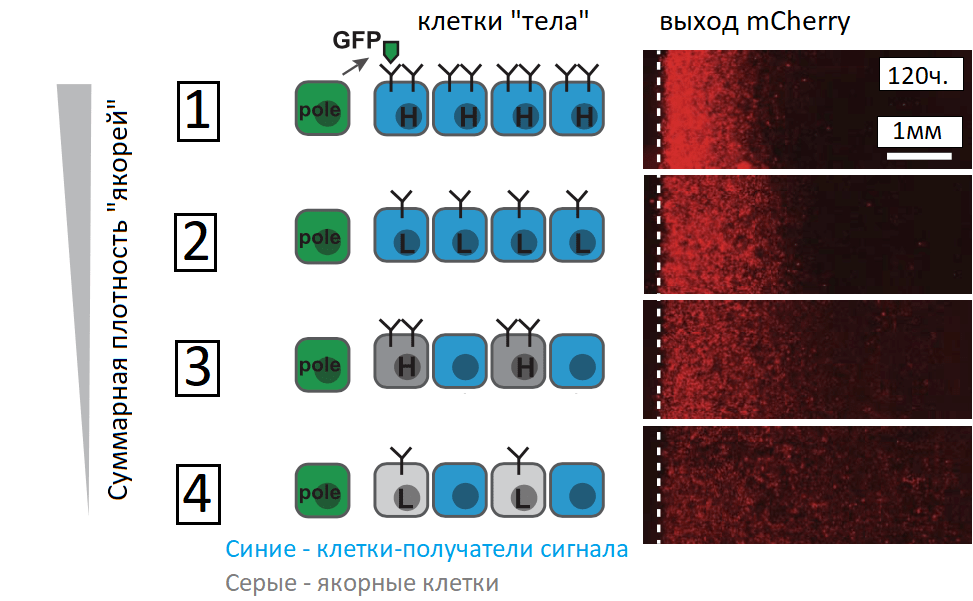
Для обнаружения растворимых факторов была модифицирована система Notch (synNotch) так, что рецептор synNotch приобрёл способность к распознаванию зелёного флуоресцентного белка (GFP). Получены клетки трёх типов: секреторные и два типа клеток, способных распознавать GFP: клетки-приёмники (активирующиеся при контакте с GFP) и якорные клетки (регуляторы, способные связывать GFP и презентировать клеткам-приёмникам). Клетки-приёмники SynNotch активировались растворимым GFP в присутствии якорных клеток. При связывании GFP происходит расщепление synNotch с высвобождением внутриклеточного домена, отправляющегося в ядро, и активация экспрессии целевого гена. Система из GFP-секретирующих и принимающих клеток имела различные уровни плотности расположения рецептора на поверхности мембран (рис. 9). Такая система наглядно показала формирование градиента концентрации морфогена в пространстве и времени. Меняя число распознающих молекул на клетках, можно менять и форму градиента [24].
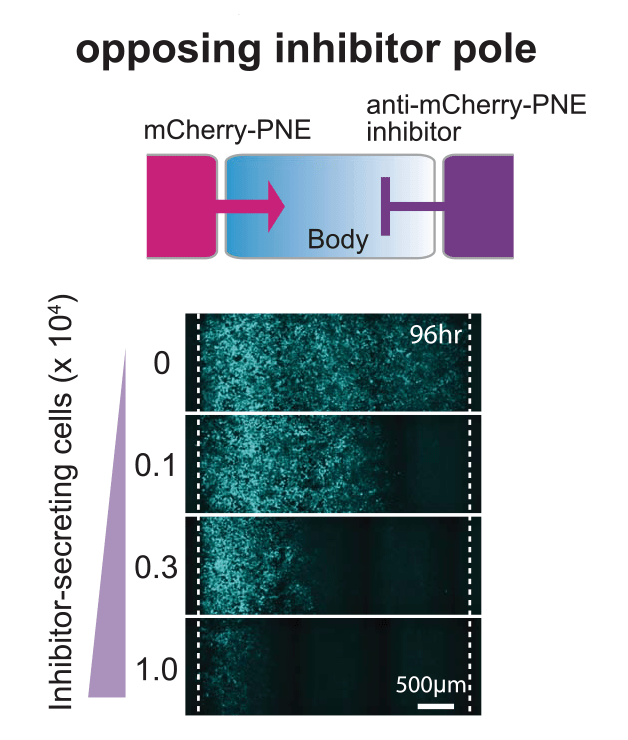
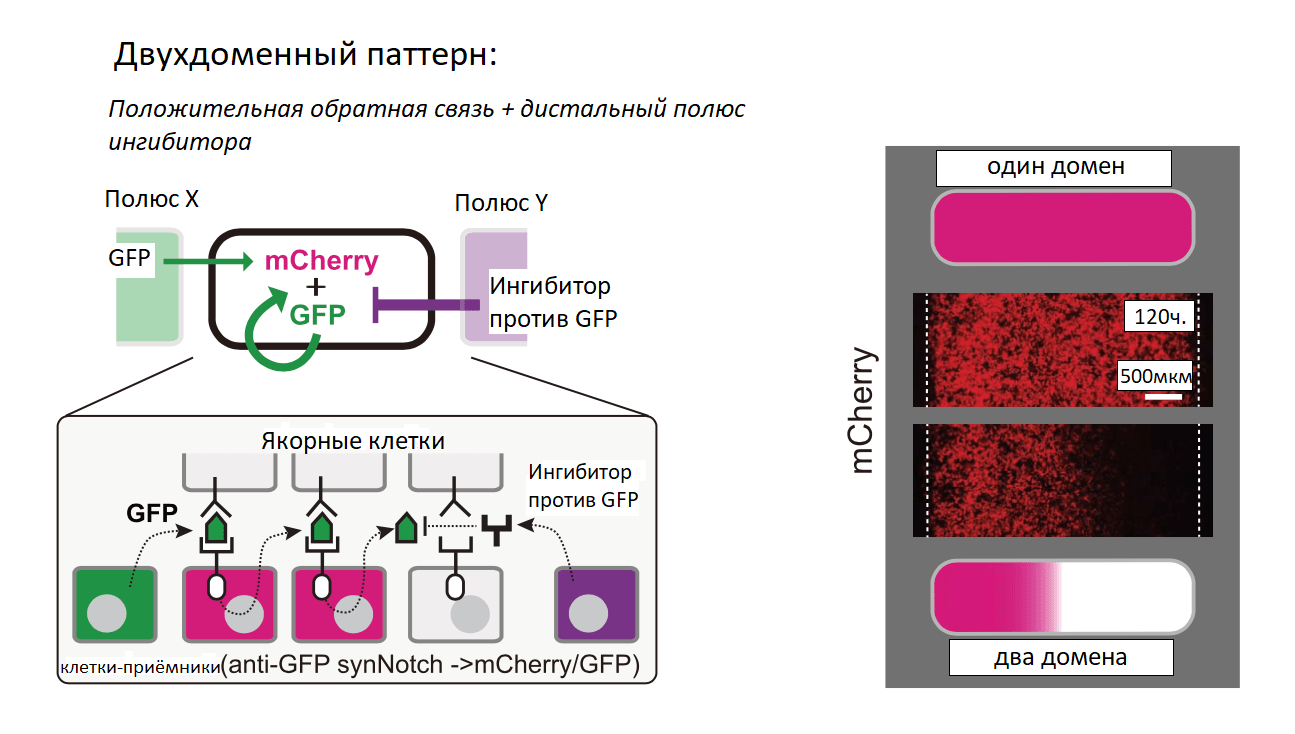
Пространственное распределение морфогенов также может регулироваться их ингибиторами. Для этого была создана система из трёх областей на культуральной чашке: центральная область, расположенная между полюсом, секретирующим морфоген, и полюсом, секретирующим ингибитор (рис. 10А). При секреции ингибитора GFP с противоположного полюса наблюдается снижение амплитуды градиента, формируемого морфогеном GFP. Была разработана цепь положительной обратной связи, в которой клетки-приёмники воспринимают GFP и в ответ вызывают экспрессию большего количества GFP. При изначально высокой экспрессии GFP сигнал быстро распространялся в пространстве и активировал экспрессию целевого гена по всему объёму (рис. 10Б, рис. 10В). Кроме того, была сконструирована межклеточная отрицательная обратная связь, в которой принимающие клетки под действием морфогена GFP продуцируют его растворимый ингибитор (рис. 10В). При наличии этих клеток амплитуда градиента уменьшается, и ответ заметно снижается. Отрицательная обратная связь хорошо работает на малых расстояниях при высоких концентрациях GFP, а на дальних расстояниях от источника GFP её влияние меньше. Такая система способна формировать более широкий и стабильный градиент [24].
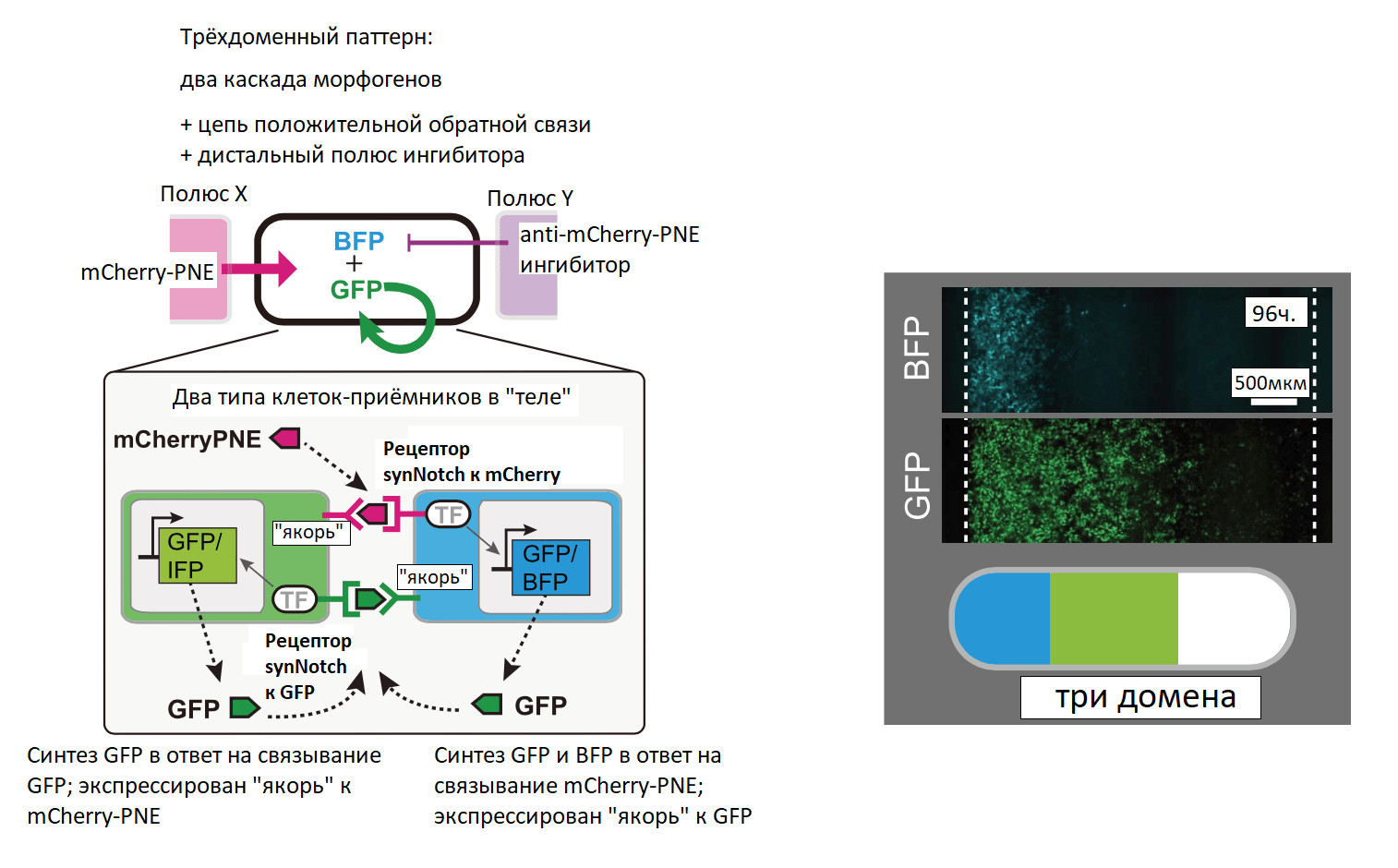
Для формирования сложных паттернов использовалось сочетание положительной и отрицательной обратных связей на разных полюсах. Были сформированы два участка (домена): клетки-получатели, расположенные рядом с источником морфогена, которые инициировали положительную обратную связь с повышенной активацией synNotch, тогда как активация сигнала в области с ингибитором блокировалась (рис. 11А). Для создания трёхдоменной системы с двумя морфогенами (зелёный и синий флуоресцентные белки) использовалась регуляция обратной и прямой связью с противоположных полюсов (рис. 11Б). Сформировалось три домена: домен BFP+GFP+, ближайший к полюсу морфогена mCherry-PNE; средний домен BFP–GFP+ и самый дальний домен BFP–GFP–. Подобная синтетическая морфогенная система может задавать пространственную информацию без взаимодействия с внутриклеточными путями передачи сигналов. Такие искусственные системы градиентов могут быть использованы для исследования и перенаправления процессов развития [24].
И не только морфогены
Другим примером модификации природных систем для обнаружения целевых молекул являются химерные антигенные рецепторы (CAR) [25]. Для распознавания огромного многообразия антигенов в Т-клетках есть система Т-клеточных рецепторов, костимулирующих рецепторов, молекул адгезии и внутриклеточных киназ (рис. 12). Были созданы CAR против конкретных антигенов, клинически значимых для лечения рака. CAR состоят из одноцепочечных антител во внеклеточной области и внутриклеточной части, содержащей сигнальные домены от рецептора Т-клеток (TCR) и костимулирующих рецепторов (последних может быть один или два в зависимости от поколения CAR-Т). CAR могут распознавать родственный антиген клеточной поверхности напрямую без участия основного комплекса гистосовместимости (MHS, major histocompatibility complex)и активировать иммунологические ответы Т-клеток. Это позволяет нацеливать Т-клетки на любой тип раковых клеток, экспрессирующих специфические антигены [26]. В настоящее время технология CAR-Т используется для лечения В-клеточных лимфом и лейкемий. В будущем её применение возможно для терапии других раковых и иных заболеваний, хотя на пути развития этого метода лечения стоит ещё много проблем.
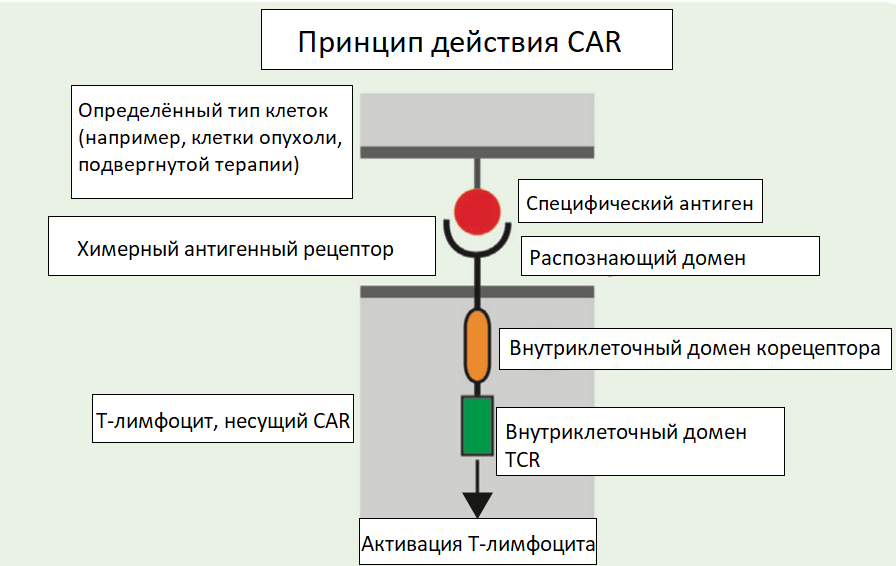
Рисунок 12. Синтетический Т-клеточный рецептор. Т-клетки используют Т-клеточный рецептор (TCR) для восприятия антигенов, помещённых в главный комплекс гистосовместимости (MHC) на антигенпрезентирующих клетках. Для нацеливания Т-клеток на конкретный тип опухолевых клеток были сконструированы химерные антигенные рецепторы (CAR), в которых внеклеточный домен заменён на одноцепочечное антитело, а внутриклеточная часть содержит внутриклеточный домен не только TCR, но и костимулирующего рецептора.
адаптировано из [26]
Межклеточные взаимодействия могут происходить без прямого контакта, посредством растворимых факторов, образующих градиенты концентрации. Были разработаны синтетические ортогональные пары цитокин-рецептор на основе интерлейкина-2 (получил название oIL-2), который способствует пролиферации и активации Т-клеток (рис. 13). Такой oIL-2 активирует свой рецептор, запуская внутриклеточный сигналинг, но при этом не взаимодействует с природным рецептором IL-2 (который, в свою очередь, не воспринимает oIL-2) [27]. Ортогональные системы межклеточной коммуникации обеспечивают платформу для создания инженерных тканей, способных реагировать только на искусственные лиганды (рис. 13).
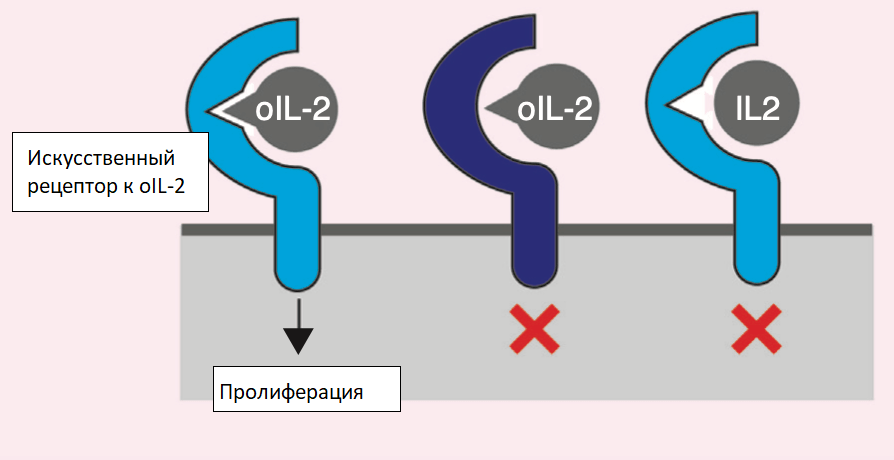
Рисунок 13. Ортогональная пара цитокина и рецептора. Т-клетки воспринимают активирующий цитокин интерлейкин-2 (IL2) с помощью рецептора IL2 b (IL2Rb, тёмно-синий). Ortho-IL2Rb (голубой) имеет мутации, препятствующие связыванию IL-2. Орто-ИЛ-2 (oIL-2) представляет собой мутированный IL2 с плохим связыванием с природным IL2Rb, но связывается с орто-IL2Rb и вызывает пролиферацию клеток.
адаптировано из [26]
На пути к сложности
В биологических системах развивающиеся органы и ткани изначально симметричны, а клетки однородны. В ходе развития происходит нарушение симметрии в расположении клеток, и однородная клеточная популяция становится разнородной. На основе принципов морфогенеза и методов синтетической биологии появляется возможность самоорганизации однородной популяции клеток в многообразие клеточных типов. Патрик Гуй из Лаборатории Вайса (MIT, Massachusetts Institute of Technology) разработал простую генную схему для возникновения пространственных генетических асимметрий в популяции стволовых клеток (рис. 14). Он использовал различные уровни транскрипционного фактора GATA6 в индуцированных плюрипотентных стволовых клетках человека для индукции формирования самоваскуляризующейся фетальной ткани печени. В ней субпопуляции эктодермальных, эндодермальных и мезодермальных клеток развивались дальше в структурированную ткань. В тканях печени проявились не только гепатоцитоподобные клетки, но и стромальные клетки, трубчатые структуры, а также происходили гематопоэтические процессы [28].
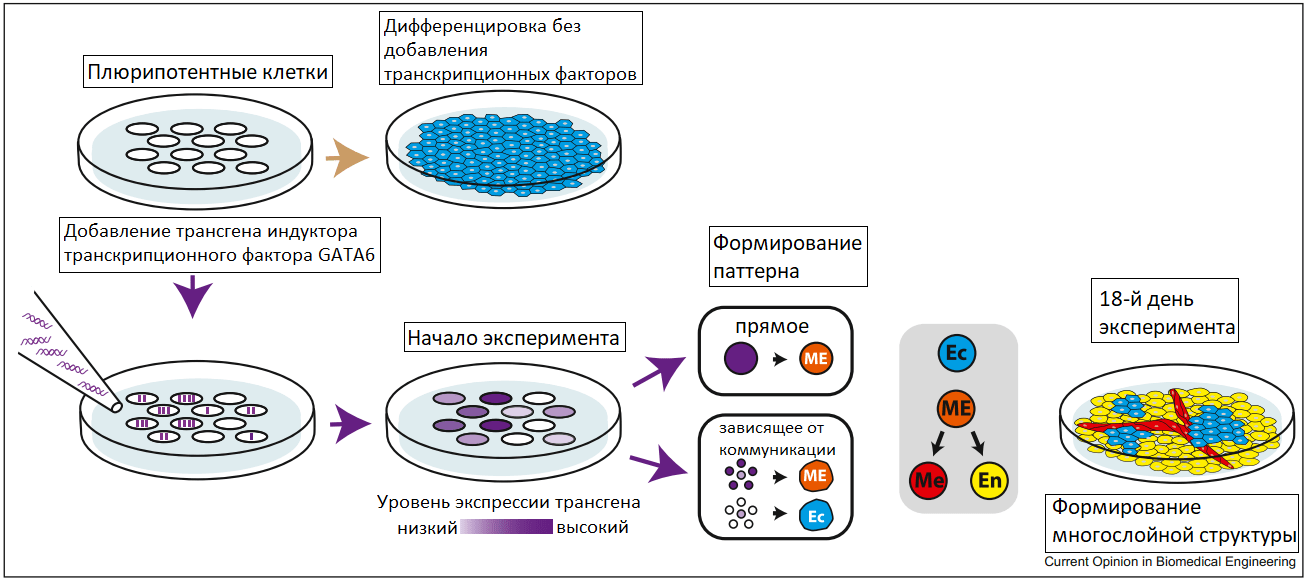
Рисунок 14. Увеличение сложности клеточного состава при дифференцировке стволовых клеток. При добавлении индуктора транскрипционного фактора GATA6 к плюрипотентным стволовым клеткам возникает асимметрия уровней экспрессии белка, связанная с поглощением различного количества копий индуктора гена GATA6. Высокий уровень экспрессии трансгена определяет мезодермальную дифференцировку, в то время как клетки без трансгена поддерживают эктодермальную дифференцировку. В среднем диапазоне уровней экспрессии трансгена клеточная судьба во многом определяется уровнями экспрессии GATA6 соседних клеток. При дальнейшем росте клетки продолжают дифференцироваться в эктодермальные (Ec), мезодермальные (Me) и энтодермальные (En) клетки и, в конечном счёте, самоорганизуются, формируя сложную и многослойную структуру.
Возможность создания тканей de novo затруднена тем, что синтетические генетические сети сложны, а влияние на них генетических и эпигенетических модификаций не изучено полностью. Трудность проектирования новых биологических форм и паттернов определяется сложностью их естественных морфогенных систем. Биологические структуры являются иерархическими, возникающими из взаимодействий на молекулярном, клеточном, тканевом и органном уровнях. Такая иерархическая структура затрудняет разработку новых сигнальных генов, поскольку изменение поведения одного гена или сети генов изменяет поведение или структуру каждого пути, в котором используется этот ген или сеть. Природные межклеточные сигнальные пути переплетены друг с другом, что усложняет анализ отдельных путей в контексте in vivo. Для оптимизации контроля над такими синтетическими генными сетями могут использоваться внутриклеточные датчики, учитывающие состояние клеток. Под влиянием морфогенов, света, магнитного и электрического поля эти датчики смогут настраивать активность генов [29].
Для многих формирующихся структур неизвестна молекулярная основа морфогенеза, но, конструируя in vitro модели различных морфогенных систем, возможно изучить контролирующие их молекулярные сети и синтезировать инструменты для контроля над ними. Знание основных правил межклеточной сигнализации будет способствовать лучшему пониманию принципов управления поведением клеток и созданию терапевтических подходов для иммуноклеточной терапии и восстановления тканей.
Синтетическая биология только начинает изучать дизайн и контроль развития биологических структур, что даёт основу новой области — синтетическому морфогенезу. Пришло время применить этот подход к биологии тканей, контролируя поток информации в многоклеточных организмах. В недалёком будущем появится возможность расширить нормальную функцию ткани, вводя новые типы клеток и меняя их поведение. Появится возможность контролируемо формировать архитектуру нужных тканей и органов для последующего восстановления организма человека. Благодаря изменению типа чувствительности клеток будет возможно улучшить совместимость с бионическими протезами. Так, в модельной системе генетически модифицированного животного можно будет избежать формирования фиброзной капсулы вокруг импланта за счёт подавления роста прилегающих фибробластов. Используя набор синтетических инструментов, можно будет получить большое разнообразие тканей и многоклеточных структур, которое будет ограничено только воображением биоинженера.
Благодарности
Авторы выражают благодарность за многочисленные полезные комментарии и предложения при написании статьи главному редактору «Биомолекулы» Антону Чугунову. Также огромную помощь при написании статьи оказали наши друзья, чьи советы были очень полезны: Полина Фортыгина, Александра Мальцева и Виолетта Исакова. Отдельная благодарность научному иллюстратору Эльмире Якуповой, автору заглавной иллюстрации.
Литература
- Marion B. Johnson, Alexander R. March, Leonardo Morsut. (2017). Engineering multicellular systems: Using synthetic biology to control tissue self-organization. Current Opinion in Biomedical Engineering. 4, 163-173;
- Лаборатория молекулярных основ эмбриогенеза: от гена к признаку;
- Желудок размером с горошину + человеческий кишечник, выращенный в мыши;
- Такие разные стволовые клетки;
- 12 методов в картинках: клеточные технологии;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- Ствол и ветки: стволовые клетки;
- Была клетка простая, стала стволовая;
- Светлая голова;
- Takanori Takebe, James M. Wells. (2019). Organoids by design. Science. 364, 956-959;
- Что такое внеклеточный матрикс и почему его все изучают;
- Важнейшие стрелочники клеток организма: белки Wnt;
- Флуоресцентные белки: разнообразнее, чем вы думали!;
- Флуоресцирующая Нобелевская премия по химии;
- Brian P. Teague, Patrick Guye, Ron Weiss. (2016). Synthetic Morphogenesis. Cold Spring Harb Perspect Biol. 8, a023929;
- Jeremy J. Velazquez, Emily Su, Patrick Cahan, Mo R. Ebrahimkhani. (2018). Programming Morphogenesis through Systems and Synthetic Biology. Trends in Biotechnology. 36, 415-429;
- Синтетическая биология: от программирования компьютеров к программированию клеток;
- Jamie A. Davies, Fokion Glykofrydis. (2020). Engineering pattern formation and morphogenesis. Biochemical Society Transactions. 48, 1177-1185;
- Luis Diambra, Vivek Raj Senthivel, Diego Barcena Menendez, Mark Isalan. (2015). Cooperativity To Increase Turing Pattern Space for Synthetic Biology. ACS Synth. Biol.. 4, 177-186;
- Elise Cachat, Weijia Liu, Kim C. Martin, Xiaofei Yuan, Huabing Yin, et. al.. (2016). 2- and 3-dimensional synthetic large-scale de novo patterning by mammalian cells through phase separation. Sci Rep. 6;
- Jamie Davies. (2017). Using synthetic biology to explore principles of development. Development. 144, 1146-1158;
- Satoshi Toda, Lucas R. Blauch, Sindy K. Y. Tang, Leonardo Morsut, Wendell A. Lim. (2018). Programming self-organizing multicellular structures with synthetic cell-cell signaling. Science. eaat0271;
- Leonardo Morsut, Kole T. Roybal, Xin Xiong, Russell M. Gordley, Scott M. Coyle, et. al.. (2016). Engineering Customized Cell Sensing and Response Behaviors Using Synthetic Notch Receptors. Cell. 164, 780-791;
- Satoshi Toda, Wesley L. McKeithan, Teemu J. Hakkinen, Pilar Lopez, Ophir D. Klein, Wendell A. Lim. (2020). Engineering synthetic morphogen systems that can program multicellular patterning. Science. 370, 327-331;
- Клетки, которые лечат людей;
- National Cancer Institute. (2020) Chimeric Antigen Receptor T-Cell Therapy;
- Jonathan T. Sockolosky, Eleonora Trotta, Giulia Parisi, Lora Picton, Leon L. Su, et. al.. (2018). Selective targeting of engineered T cells using orthogonal IL-2 cytokine-receptor complexes. Science. 359, 1037-1042;
- Patrick Guye, Mohammad R. Ebrahimkhani, Nathan Kipniss, Jeremy J. Velazquez, Eldi Schoenfeld, et. al.. (2016). Genetically engineering self-organization of human pluripotent stem cells into a liver bud-like tissue using Gata6. Nat Commun. 7;
- Satoshi Toda. (2020). Synthetic tissue engineering: Programming multicellular self-organization by designing customized cell-cell communication. BIOPHYSICS. 17, 42-50;
- Jian Hui Low, Pin Li, Elaine Guo Yan Chew, Bingrui Zhou, Keiichiro Suzuki, et. al.. (2019). Generation of Human PSC-Derived Kidney Organoids with Patterned Nephron Segments and a De Novo Vascular Network. Cell Stem Cell. 25, 373-387.e9.