Моложе значит лучше?
27 марта 2025
Моложе значит лучше?
- 379
- 0
- 2
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Как и героиня нашумевшего боди-хоррора «Субстанция», люди с незапамятных времен мечтают о вечной молодости. Однако, в отличие от большинства населения, которые, как героиня Деми Мур, пытались омолодиться, в мире ученых все устроено гораздо сложнее. Иногда исследователям не нужна «лучшая версия тебя», поскольку им крайне важно сохранить возраст изучаемых объектов, чтобы понять, как вылечить заболевание. С возрастом наше тело подвергается множеству изменений, и не все из них касаются внешности. Тем более что с возрастом человеку необходимо сохранить не только и не столько молодое тело, но и ясность ума, без которой уж точно никуда. Одним из важнейших процессов является старение нейронов, которые растут и развиваются на протяжении всей жизни человека, а их гибель приводит к разрушению личности. Поэтому при моделировании возрастных и патологических изменений в нейронах важно учитывать этот фактор. В статье пойдет речь о том, в каких случаях ученым важно сохранить «возраст» клеток, и в особенности, нейронов и как это может помочь в борьбе с нейродегенеративными заболеваниями.
Конкурс «Био/Мол/Текст»-2024/2025
 Эта работа заняла первое место в номинации «Своя работа» конкурса «Био/Мол/Текст»-2024/2025.
Эта работа заняла первое место в номинации «Своя работа» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Омоложение клеток и старение мозга: трудности моделирования нейродегенеративных заболеваний
Все хотят жить долго и счастливо. Если счастье каждый создает себе сам, то долгую жизнь нам дарует современная медицина. Все наверняка читали о современных технологиях регенеративной медицины и стволовых клетках, которые в перспективе помогут людям заменить поврежденные клетки, органы и ткани как в случае патологических изменений, так и при старении. В идеале с помощью современных технологий репрограммирования в будущем можно будет омолодить практически каждую клетку стареющего организма и за счет этого обеспечить здоровое долголетие. Однако омоложение крайне нежелательно для такого типа клеток как нейроны, поскольку это приведет к утрате важной информации, необходимой для функционирования организма, а также утрате навыков и знаний, приобретенных в течение всей жизни. Отличительной особенностью нейронов является неспособность к делению. Этот тип клеток с момента рождения человека развивается вместе с организмом и с возрастом увеличивается лишь количество связей между ними.
Ввиду увеличения средней продолжительности жизни все острее встает проблема нейродегенеративных заболеваний, частота которых увеличивается с каждым годом и поражает нейроны головного и спинного мозга. И для большинства нейродегенеративных заболеваний, таких как болезнь Альцгеймера, основным фактором риска является пожилой возраст. При этом моделирование возрастных изменений в нейронах, и в особенности нейронах человека, методически крайне трудно. В отличие от многих органов, напрямую доступных для молекулярного анализа посредством биопсии, клетки мозга представляет собой заметное исключение. Большинство молекулярных исследований мозга проводится на посмертных образцах, где уже произошла гибель клеток и повреждение ткани, что делает невозможным проведение различных функциональных тестов. Моделирование ассоциированных с возрастом изменений в нейронах на мышиных моделях нейродегенеративных заболеваний может быть искажено за счет наличия зон нейрогенеза у последних, в то время как у взрослого человека формирование нейронов de novo в результате нейрогенеза по-прежнему остается предметом детального изучения [1–4].
Большие надежды возлагались на быстрый прогресс в понимании причин нейродегенеративных заболеваний при появлении технологии репрограммирования, которые позволяют получать индуцированные нейроны от конкретных пациентов с помощью различных генетических манипуляций. В первую очередь это, конечно, применение индуцированных плюрипотентных стволовых клеток (ИПСК). Экспрессия определенных транскрипционных факторов, известных как коктейль Яманаки, способна индуцировать плюрипотентность в соматических клетках [5], таких как фибробласты кожи, и вернуть их в стадию раннего эмбрионального развития. После чего с помощью специальных сред превратить их сначала в предшественники нейронов — нейрональные прогениторы, и далее в нейроны определенного подтипа, что позволяет исследователям проводить различные эксперименты по изучению нейродегенеративных заболеваний и тестировать потенциальные лекарственные агенты. Данный подход ранее был детально описан в различных статьях на «Биомолекуле» [6–8]. Однако довольно быстро стало понятно, что популяции индуцированных нейронов, получаемые через ИПСК, омолаживаются при переходе через плюрипотентное состояние, теряют практически все возраст-ассоциированные маркеры старения, так называемые эпигенетические метки [9]. А изучение нейродегенеративных заболеваний — это тот редкий случай, когда нам важно сохранить возраст клеток, ведь в «молодых» нейронах нейродегенеративные изменения или не возникают, или существует компенсаторный механизм, позволяющий сильно снизить развитие этих изменений. Поэтому многие исследователи вынуждены дополнительно «состаривать» клетки для выявления различий между здоровыми и больными популяциями нейронов [10–12]. Для моделирования процессов клеточного старения с полученными из ИПСК популяциями нейронов производят дополнительные манипуляции, например, укорочение длины теломер [13]. Также ученые вызывают старение нейронов, полученных из ИПСК, путем добавления белка прогерина, который связан с заболеванием, вызывающим ускоренное старение организма [14]. Подробнее об этом заболевании рассказывается в статье [15].
Но несмотря на все старания ученых, «молодые» популяции нейронов, полученные через ИПСК, все же частично моделируют патофизиологические процессы, происходящие в «зрелых» нейронах при старении и при развитии нейродегенеративных изменений. Например, агрегаты мутантных белков, которые накапливаются в головном мозге пациентов с нейродегенеративными заболеваниями, практически не детектируются в индуцированных нейронах пациентов, полученных с помощью технологии ИПСК. В ряде работ все-же показано их формирование, однако это требует либо проведения крайне длительных экспериментов, либо довольно сильных стрессовых факторов. Поэтому ученые стали искать способы, позволяющие в короткие сроки получать популяции «возрастных» нейронов.
Сокращая путь к возрастным нейронам: прямое репрограммирование в обход ИПСК
Принципиально новый подход к моделированию нейродегенеративных заболеваний, основанный на прямом репрограммировании (в англоязычной литературе также применяется термин lineage reprogramming) клеток кожи пациентов — фибробластов в индуцированные нейроны, был предложен в качестве альтернативы ИПСК (рис. 1) [16–18]. Основное преимущество данного метода репрограммирования заключается в том, что при этом подходе нет стадии плюрипотентности, соответственно, клетки не омолаживаются, что подтверждается методом «эпигенетических часов», который представляет собой высокоточный биомаркер старения клеток, основанный на оценке статуса метилирования ДНК [19]. За счет сохранения возраста клеток становится возможным изучать проявления нейродегенеративных заболеваниях на «стареющих» популяциях нейронов [20–23].
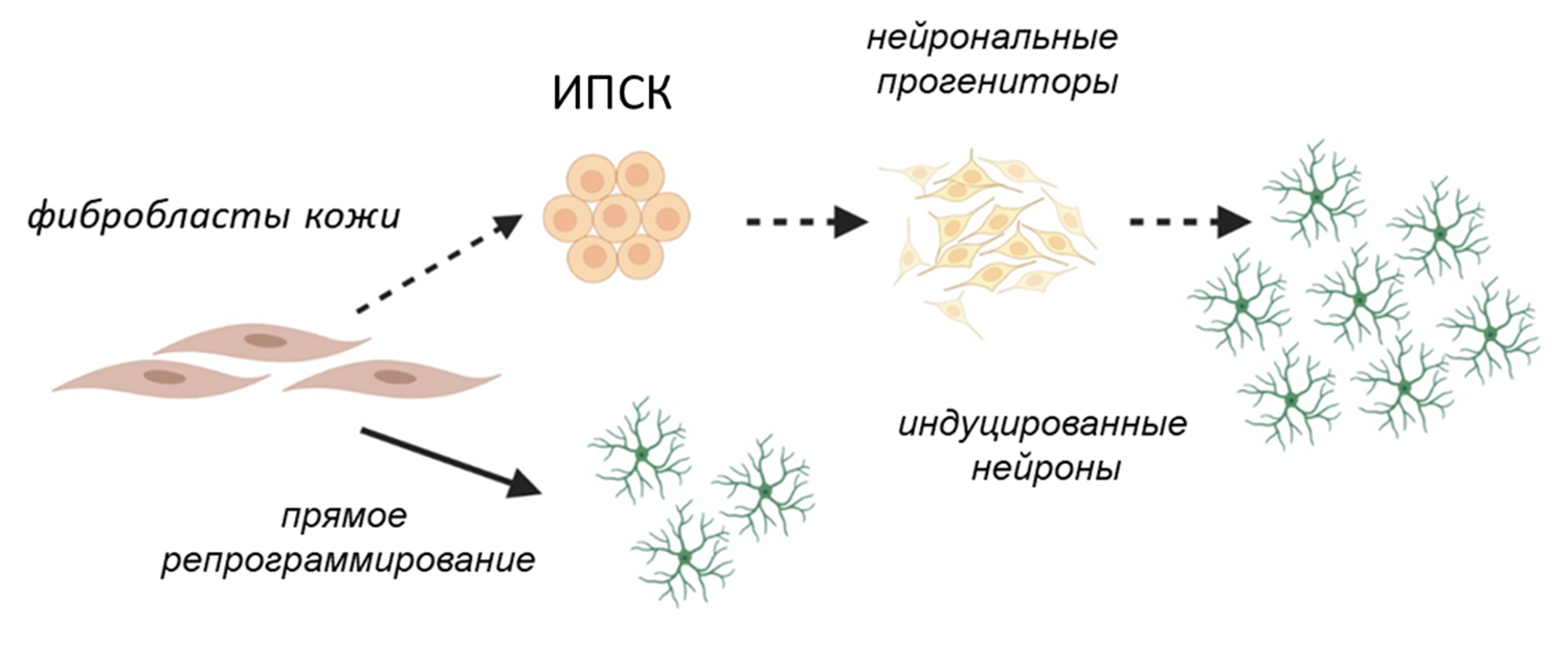
Рисунок 1. Схематичное представление способов получения индуцированных нейронов при помощи технологий репрограммирования.
создано при помощи BioRender
Методика прямого репрограммирования похожа на технологию ИПСК. Чтобы понять, как это работает, нужно вспомнить, что клетки уже имеют свою «предназначенную роль» в организме, и эта роль определяется группами генов. Эти группы генов активируются в клетках в зависимости от их типа: например, в фибробластах работают одни гены, а в нейронах — другие. Но все эти гены есть в каждой клетке организма, они просто не всегда активны. В фибробластах гены, отвечающие за образование нейронов, «выключены». Задача прямого репрограммирования — включить эти гены, чтобы клетка стала нейроном. Это можно сделать, сняв блокировку, которая мешает этим генам работать.
На рисунке 2 схематично показаны основные компоненты коктейля для прямого репрограммирования — транскрипционные факторы и микроРНК, специфичные для нейронов. Эти компоненты не только активируют нейронные гены, но и могут изменять структуру хроматина и влиять на метилирование ДНК, что позволяет «разблокировать» нейрональные гены. Чаще всего транскрипционные факторы и микроРНК доставляются в клетки с помощью вирусных конструкций. Кроме того, в состав коктейля входят малые молекулы и нейротрофические факторы, которые стимулируют дифференцировку клеток в нейронном направлении, а также антибиотики, помогающие отобрать клетки, в которые были доставлены вирусы и в которых активирована новая клеточная программа.
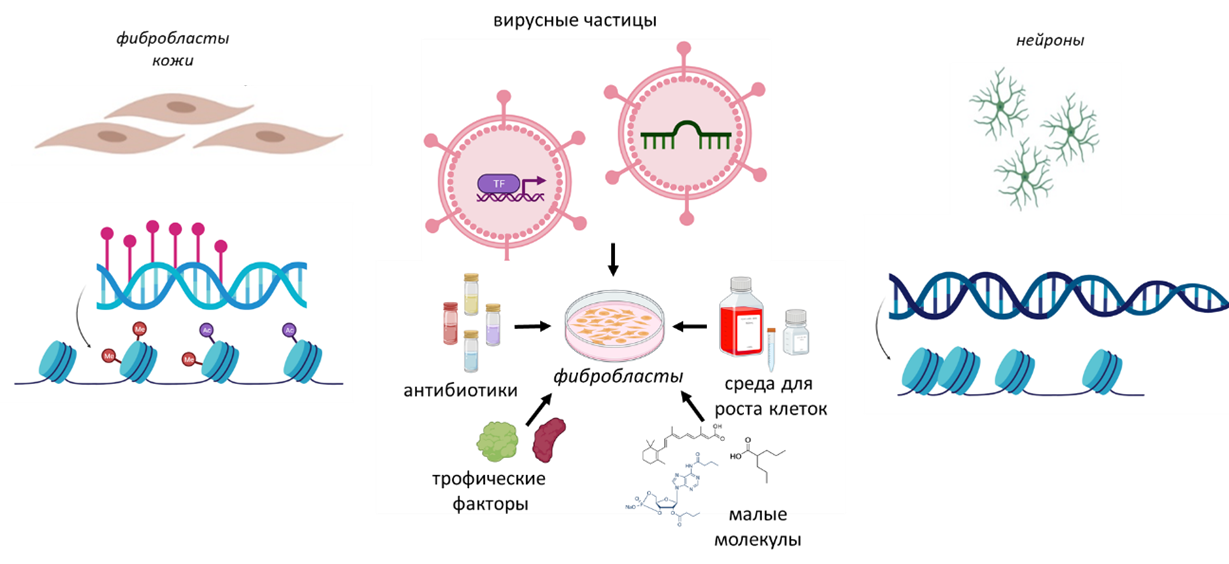
Рисунок 2. Схематичное представление методики прямого репрограммирования.
создано при помощи BioRender
Несмотря на перспективность применения такого подхода для изучения возрастных и дегенеративных изменений в индуцированных нейронах при старении, он пока не получил такого широкого распространения, как технология ИПСК. И существует лишь небольшое количество работ, успешно применяющих данную методику для получения возрастных нейронов и моделирования нейродегенеративных изменений в них. Во-многом это обусловлено крайне низкой эффективностью превращения фибробластов кожи в нейроны. Поскольку нейроны — клетки неделящиеся, то с помощью этого метода нельзя на выходе получить нейронов больше, чем количество фибробластов, которые служат «стартовым» объектом для репрограммирования. Учитывая, что все методики репрограммирования довольно токсичные, и много клеток погибает в ходе процедуры, так как подвергается одновременному воздействию большого количества факторов (вирусы, антибиотики), низкая эффективность оказывается большим препятствием для большинства исследователей. Так, в первой статье, описывающей протокол прямого репрограммирования, фибробласты, выделенные из кончика хвоста новорожденных мышат и мышиные эмбриональные фибробласты, были репрограммированы в нейроны при помощи набора транскрипционных факторов Ascl1, Brn2 и Myt1L [17]. Эффективность процедуры репрограммирования составляла в среднем 1,8–7,7% соответственно, для взрослых и эмбриональных фибробластов. В другом протоколе авторы использовали нокдаун РНК-связывающего белка PTB (polypyrimidine-tract-binding) для репрограммирования мышиных эмбриональных фибробластов в нейрональные клетки с более высокой эффективностью, порядка 20%, однако только половина клеток по окончанию процедуры окрашивалась на нейрональные маркеры [18]. Наиболее перспективным с точки зрения эффективности репрограммирования оказался протокол, основанный на использовании комбинации микроРНК и транскрипционных факторов, предложенный коллективом авторов под руководством Andrew Yoo. В оригинальной статье эффективность репрограммирования тоже была довольно низкой и составляла порядка 5% [16], однако впоследствии авторы доработали протокол и повысили эффективность получения нейронов и специфичность [24], [25].
Собственное исследование
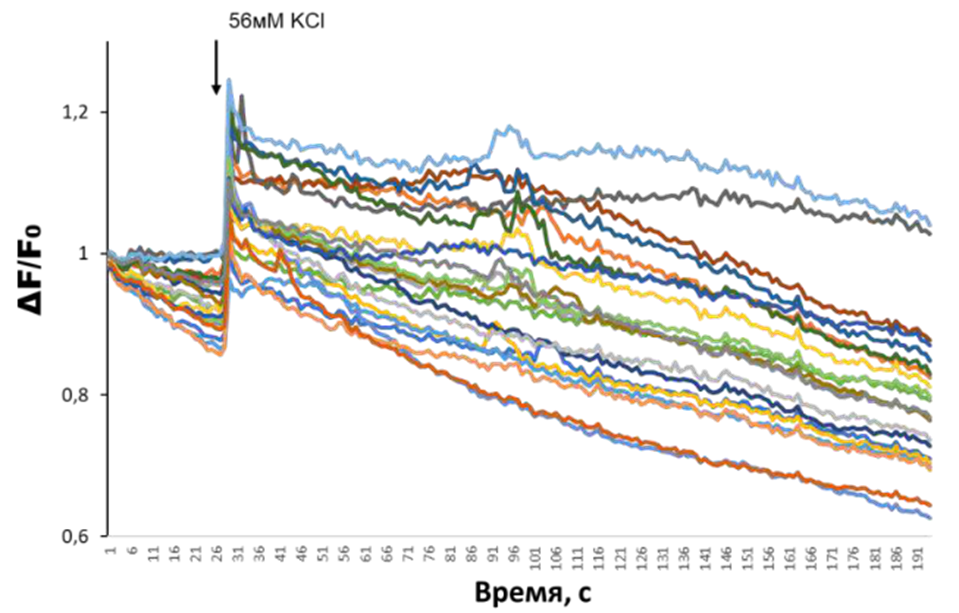
В попытке применить данную методику уже непосредственно в собственных исследованиях, мы также столкнулись с низкой эффективностью и выживаемостью клеток, что побудило нас доработать протокол, предложенный группой Andrew Yoo и добиться более высокой выживаемости клеток в процессе репрограммирования [26]. Несмотря на то, что первоначально мы оптимизировали данный протокол для получения нейронов стриатума, предложенные модификации могут применяться и для получения других типов нейронов, например, кортикальных нейронов, путем выбора специфичных транскрипционных факторов и малых молекул, и речь о которых пойдет далее в статье. Поскольку данная методика подходит для изучения в первую очередь возрастных особенностей нейронов, мы решили проверить, а будут ли различаться популяции нейронов, полученные от молодых и пожилых доноров. Для этого мы сначала отработали технологию получения этих нейронов на фибробластах линии DF3, полученные от женщины 53 лет, поскольку получение нейронов от доноров среднего и старшего возраста является наиболее сложной задачей. Мы показали, что, применяя методику прямого репрограммирования с разработанными модификациями, можно успешно получить популяцию индуцированных кортикальных нейронов (рис. 3А) и что полученные клетки окрашиваются на маркерный белок зрелых нейронов MAP2 (рис. 3Б), причем эффективность репрограммирования составляет от 50 до 90%, в зависимости от возраста донора дермальных фибробластов (пожилые или молодые). Чтобы подтвердить, что клетки действительно стали нейронами, мы провели функциональные эксперименты. Репрограммированные нейроны окрашивали флуоресцентным индикатором «Fluo-4», который светится ярче при повышении уровня кальция в клетке и который вызывает пиковый сигнал в момент входа кальция в клетку. Добавление раствора хлорида калия (56 мМ), вызывающего деполяризацию мембраны, показало, что клетки реагируют, как это характерно для нейронов (рис. 3В).
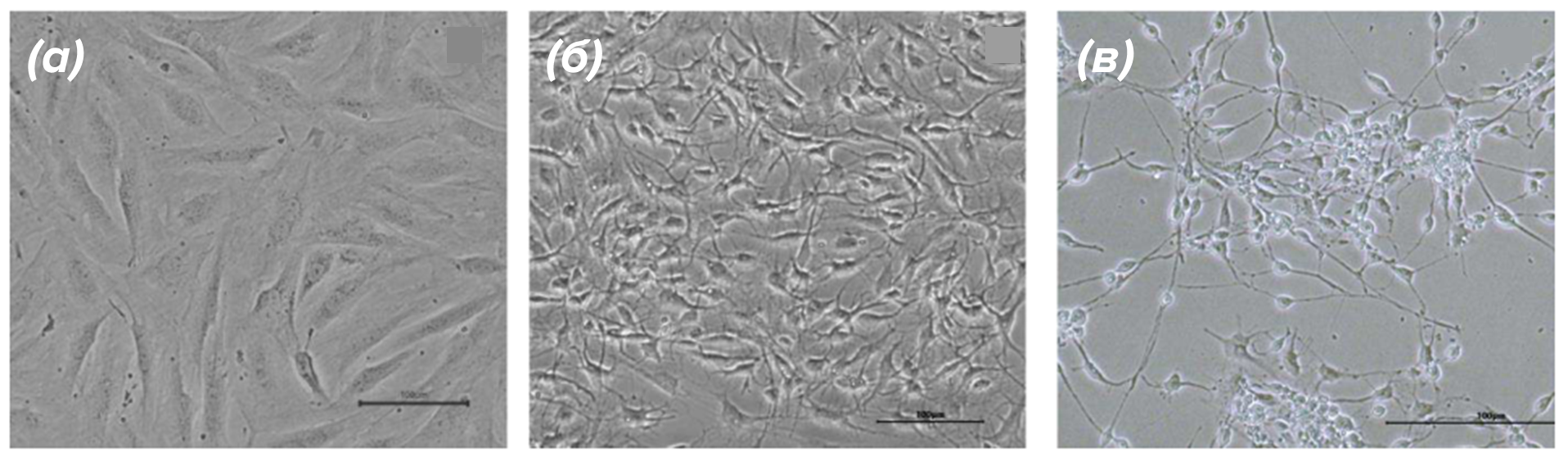
После того, как мы убедились, что разработанный нами протокол работает, мы приступили к сравнительному анализу «молодых» и «пожилых» нейронов. В качестве «стартовых» клеток для получения «молодых» нейронов мы выбрали фетальные мезенхимальные стволовые клетки (МСК), а в качестве стартового материала для получения «пожилых» нейронов — 3 линии дермальных фибробластов от пожилых доноров 61, 66 и 68 лет. На рисунке 4 приведены микрофотографии, иллюстрирующие вид «молодых» и «пожилых» клеток до и после прямого репрограммирования.
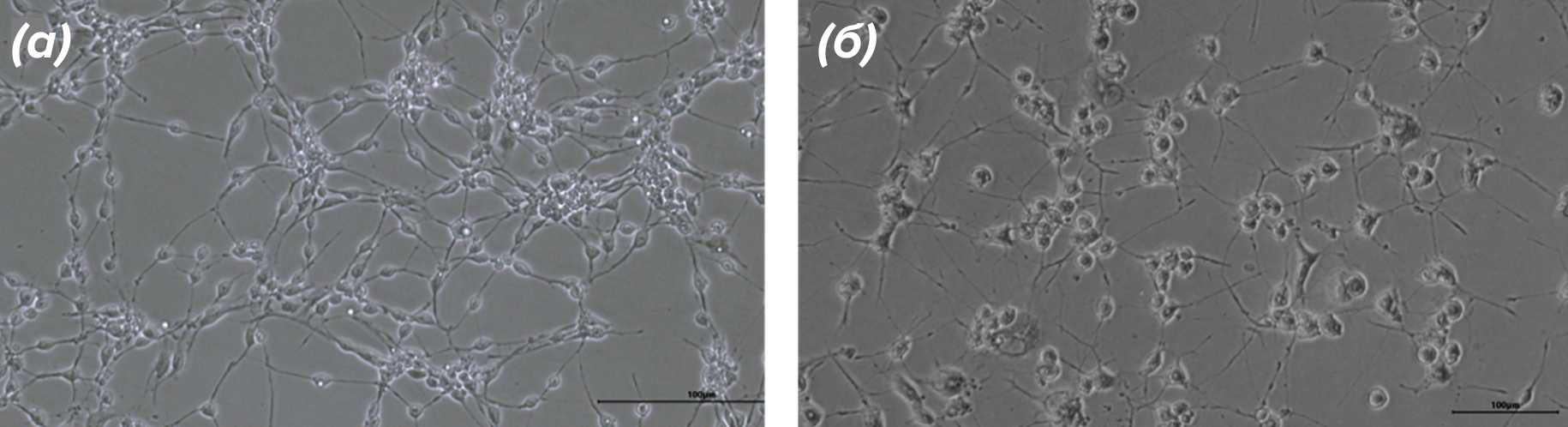
Рисунок 4. Микрофотографии индуцированных возбуждающих кортикальных нейронов в процессе репрограммирования. (а) — нейроны, полученные из клеток МСК. (б) — нейроны, полученные из фибробластов пожилого донора 68 лет.
собственные результаты автора
Для того, чтобы оценить, действительно ли методика позволяет выявлять возрастные различия, мы сравнили основные признаки старения нейронов, такие как окислительное повреждение ДНК и изменения в строении дендритного древа клеток. Сначала мы исследовали уровень окислительного повреждения ДНК, используя антитела к 8-OH-дезоксигуанозину (8-OHdG), который является маркером такого повреждения (рис. 5).
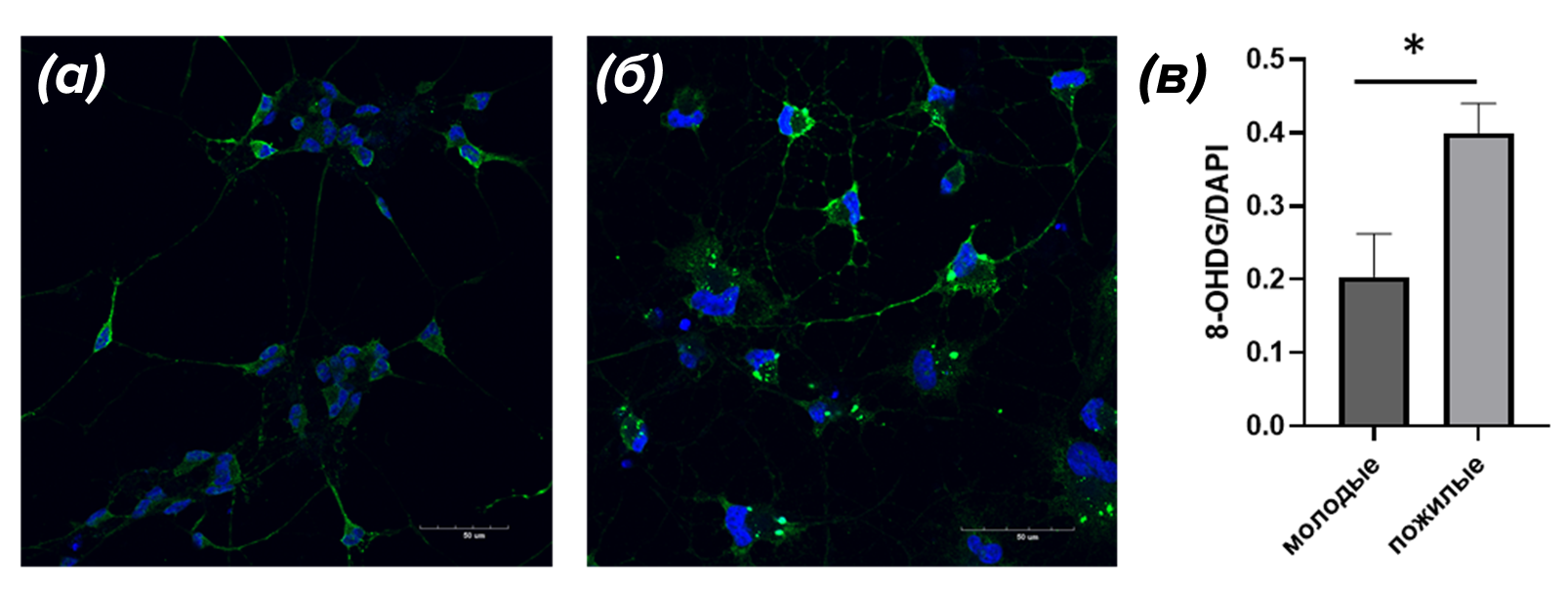
Рисунок 5. Микрофотографии, иллюстрирующие анализ уровня окислительного повреждения ДНК в нейронах (зеленый), полученных из МСК (а) и пожилых (б) доноров. Окрашивание антителами к 8-OHdG (зеленый) и визуализация ядер красителем DAPI (синий). (в) — гистограмма, иллюстрирующая подсчет уровня 8-OHdG в «молодых» (0,194±0,001 отн. ед) и «пожилых» (0,40±0,04 отн. ед) нейронах. Данные представлены как среднее значение ±ошибка среднего. p<0,05.
собственные результаты автора
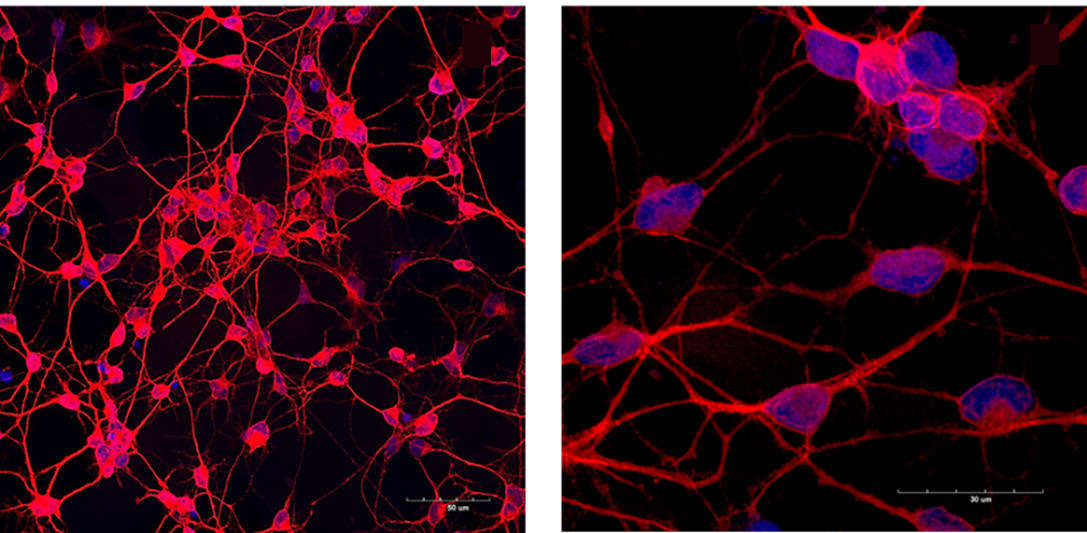
Мы заметили, что нейроны «молодых» и «пожилых» доноров отличаются по внешнему виду, поэтому изучили их строение с помощью специальной программы. Она анализирует фотографии клеток и рассчитывает такие параметры, как количество отростков, их длина и ветвистость. У «молодых» нейронов структура проще: меньше отростков, отходящих от тела клетки, меньше точек ветвления и общее число отростков ниже (рис. 6а). Напротив, у «пожилых» нейронов дендритное древо более развито: больше отростков и точек ветвления, включая как основные, так и конечные отростки (рисунок 6б). На рисунке 6 представлены гистограммы (г, д, е), характеризующие полученные результаты.
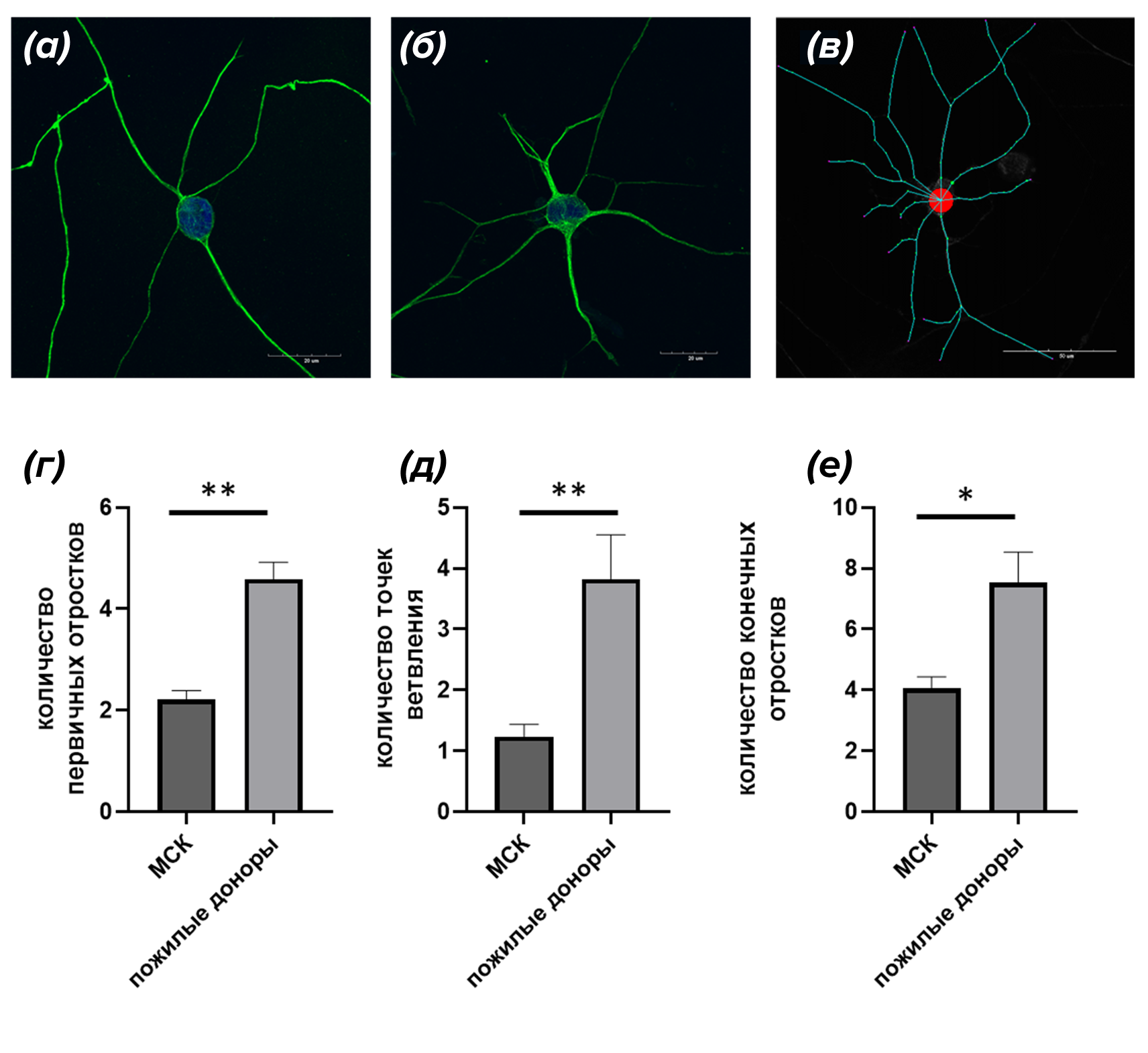
Рисунок 6. Анализ строения нейронов и количественный обсчет параметров. Микрофотографии, иллюстрирующие морфологию «молодых» (а) и «пожилых» нейронов, а также пример построения модели нейрона (в). Для визуализации клеток применялось окрашивание на нейрональный маркер бета-3-тубулин (зеленый). Ядра визуализировались красителем DAPI (синий). На модели нейрона красный круг — тело нейрона, голубой — отростки, желтая точка — точка ветвления, фиолетовая точка — конечный отросток. (г), (д), (е) — гистограммы, иллюстрирующие подсчет количества первичных отростков, количества точек ветвления и количества конечных отростков в «молодых» и «пожилых» нейронах. Данные представлены как среднее значение ±ошибка среднего. p<0,05.
собственные результаты автора
В результате исследования мы показали, что при помощи прямого репрограммирования можно получать популяции нейрональных клеток от доноров разного возраста, в том числе пожилого. Полученные клетки имеют характерное для нейрональных клеток сложное строение и функциональные свойства, специфичные для данного типа клеток. Но самое важное, что нейроны, полученные из фибробластов молодых и пожилых доноров, имеют заметные различия как на молекулярном, так и на структурном уровне. В частности, «пожилые» нейроны показали более выраженное окислительное повреждение ДНК и более сложную структуру дендритного древа, тогда как «молодые» нейроны характеризовались более простым строением. Это объясняется тем, что у «молодых» нейронов более активны системы защиты к различным факторам клеточного стресса, таким как активные формы кислорода. «Пожилые нейроны», наоборот, более чувствительны к окислительному повреждению ДНК, но зато формируют более развитое дендритное древо для лучшего контакта с соседними клетками и эффективного обмена информацией.
Эти два примера отлично подчеркивают, что нейроны, полученные из фибробластов доноров разных возрастных групп, могут существенно отличаться друг от друга различными параметрами, и что прямое репрограммирование позволяет сохранить эти изменения. Полученный результат подчеркивает важность такого подхода для изучения возрастных изменений в нейронах. Это открывает новые горизонты для дальнейшего применения этой методики в создании моделей нейродегенеративных заболеваний и поиске новых терапевтических решений, основанной на сравнении популяции нейронов, полученной от здоровых доноров и пациентов с нейродегенеративным заболеваниями.
От кожи до мозга: какую дорогу выбрать?
Методика прямого репрограммирования представляет собой современный инструмент, позволяющий превращать клетки одного типа, например, кожные фибробласты, непосредственно в функциональные нейроны. Этот подход особенно ценен для изучения возраст-ассоциированных изменений и нейродегенеративных процессов, поскольку он позволяет получать клетки, которые «сохраняют» возрастные особенности донора. Это критически важно для понимания того, как старение и генетические факторы влияют на здоровье нервной системы. Однако у этого метода есть свои ограничения. Одним из ключевых недостатков является то, что процесс репрограммирования предполагает выход клеток из клеточного цикла. Это значит, что после превращения в нейроны они больше не могут делиться, что делает невозможным увеличение их числа. Таким образом, размах эксперимента изначально зависит от стартовой популяции клеток, которая будет ограничена биопсионным материалом пациента. Это создает определенные сложности, особенно при необходимости проведения масштабных исследований или скрининговых исследований потенциальных лекарственных агентов. С другой стороны, технология ИПСК предоставляет ученым более гибкие возможности. Эти клетки можно не только перепрограммировать из взрослых соматических клеток, но и размножать практически неограниченно, сохраняя их плюрипотентность — способность превращаться в любые типы клеток организма, включая нейроны. Это делает такой подход особенно удобным для создания больших популяций клеток, необходимых для масштабных экспериментов и скрининга большого количества потенциальных препаратов.
Несмотря на эти различия, оба метода — прямое репрограммирование и ИПСК— обладают своими уникальными преимуществами и по сути своей являются взаимодополняющими подходами. Прямое репрограммирование обеспечивает более «быстрый» путь к получению клеток с сохранением возрастных характеристик донора, что особенно полезно для изучения заболеваний нейронов, ассоциированных с возрастом, таких как болезнь Альцгеймера или Паркинсона. В то же время ИПСК позволяют ученым глубже исследовать этапы развития нервных клеток, проводить скрининговые исследования и изучать механизмы устойчивости молодых нейронов к нейродегенеративным и стрессовым воздействиям. Совместное использование этих подходов открывает новые горизонты в биомедицинских исследованиях. Оно позволяет создавать пациент-специфичные модели заболеваний, которые могут помочь ученым понять причины их возникновения, выявить новые мишени для терапии и разрабатывать новые эффективные лекарства. В конечном счете, такие исследования приближают нас к персонализированной медицине, где лечение будет максимально адаптировано под особенности конкретного пациента.
Благодарности:
Автор выражает благодарность Михайловой Наталье Аркадьевне, Хотину Михаилу Георгиевичу и Безпрозванному Илье Борисовичу.
Литература
- Kumar A., Pareek V., Faiq M. A., Ghosh S. K., Kumari C. (2019) Adult neurogenesis in humans: A Review of Basic Concepts, History, Current Research, and Clinical Implications. Innov Clin Neurosci. 16, 30–37;
- Peter S. Eriksson, Ekaterina Perfilieva, Thomas Björk-Eriksson, Ann-Marie Alborn, Claes Nordborg, et. al.. (1998). Neurogenesis in the adult human hippocampus. Nat Med. 4, 1313-1317;
- Kirsty L. Spalding, Olaf Bergmann, Kanar Alkass, Samuel Bernard, Mehran Salehpour, et. al.. (2013). Dynamics of Hippocampal Neurogenesis in Adult Humans. Cell. 153, 1219-1227;
- Mercedes F. Paredes, Shawn F. Sorrells, Arantxa Cebrian-Silla, Kadellyn Sandoval, Dashi Qi, et. al.. (2018). Does Adult Neurogenesis Persist in the Human Hippocampus?. Cell Stem Cell. 23, 780-781;
- Kazutoshi Takahashi, Shinya Yamanaka. (2006). Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors. Cell. 126, 663-676;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- Стволовые клетки: эпигенетический бьютиблог;
- Болезнь Паркинсона: что изучать? как изучать?;
- Steve Horvath. (2013). DNA methylation age of human tissues and cell types. Genome Biology. 14, R115;
- Ali Fathi, Sakthikumar Mathivanan, Linghai Kong, Andrew J. Petersen, Cole R. K. Harder, et. al.. (2022). Chemically induced senescence in human stem cell‐derived neurons promotes phenotypic presentation of neurodegeneration. Aging Cell. 21;
- Jerome Mertens, Dylan Reid, Shong Lau, Yongsung Kim, Fred H. Gage. (2018). Aging in a Dish: iPSC-Derived and Directly Induced Neurons for Studying Brain Aging and Age-Related Neurodegenerative Diseases. Annu. Rev. Genet.. 52, 271-293;
- Liang Zhu, Chenxi Sun, Jie Ren, Guangming Wang, Rongjie Ma, et. al.. (2019). Stress-induced precocious aging in PD-patient iPSC-derived NSCs may underlie the pathophysiology of Parkinson’s disease. Cell Death Dis. 10;
- Elsa Vera, Nazario Bosco, Lorenz Studer. (2016). Generating Late-Onset Human iPSC-Based Disease Models by Inducing Neuronal Age-Related Phenotypes through Telomerase Manipulation. Cell Reports. 17, 1184-1192;
- Justine D. Miller, Yosif M. Ganat, Sarah Kishinevsky, Robert L. Bowman, Becky Liu, et. al.. (2013). Human iPSC-Based Modeling of Late-Onset Disease via Progerin-Induced Aging. Cell Stem Cell. 13, 691-705;
- Молодой в старческом обличии;
- Andrew S. Yoo, Alfred X. Sun, Li Li, Aleksandr Shcheglovitov, Thomas Portmann, et. al.. (2011). MicroRNA-mediated conversion of human fibroblasts to neurons. Nature. 476, 228-231;
- Thomas Vierbuchen, Austin Ostermeier, Zhiping P. Pang, Yuko Kokubu, Thomas C. Südhof, Marius Wernig. (2010). Direct conversion of fibroblasts to functional neurons by defined factors. Nature. 463, 1035-1041;
- Yuanchao Xue, Kunfu Ouyang, Jie Huang, Yu Zhou, Hong Ouyang, et. al.. (2013). Direct Conversion of Fibroblasts to Neurons by Reprogramming PTB-Regulated MicroRNA Circuits. Cell. 152, 82-96;
- Christine J Huh, Bo Zhang, Matheus B Victor, Sonika Dahiya, Luis FZ Batista, et. al.. (2016). Maintenance of age in human neurons generated by microRNA-based neuronal conversion of fibroblasts. eLife. 5;
- Yongsung Kim, Xinde Zheng, Zoya Ansari, Mark C. Bunnell, Joseph R. Herdy, et. al.. (2018). Mitochondrial Aging Defects Emerge in Directly Reprogrammed Human Neurons due to Their Metabolic Profile. Cell Reports. 23, 2550-2558;
- Yu Tang, Meng-Lu Liu, Tong Zang, Chun-Li Zhang. (2017). Direct Reprogramming Rather than iPSC-Based Reprogramming Maintains Aging Hallmarks in Human Motor Neurons. Front. Mol. Neurosci.. 10;
- Matheus B. Victor, Michelle Richner, Hannah E. Olsen, Seong Won Lee, Alejandro M. Monteys, et. al.. (2018). Striatal neurons directly converted from Huntington’s disease patient fibroblasts recapitulate age-associated disease phenotypes. Nat Neurosci. 21, 341-352;
- Camila Gudenschwager, Isadora Chavez, Cesar Cardenas, Christian Gonzalez-Billault. (2021). Directly Reprogrammed Human Neurons to Understand Age‐Related Energy Metabolism Impairment and Mitochondrial Dysfunction in Healthy Aging and Neurodegeneration. Oxidative Medicine and Cellular Longevity. 2021;
- Matheus B. Victor, Michelle Richner, Tracey O. Hermanstyne, Joseph L. Ransdell, Courtney Sobieski, et. al.. (2014). Generation of Human Striatal Neurons by MicroRNA-Dependent Direct Conversion of Fibroblasts. Neuron. 84, 311-323;
- Michelle Richner, Matheus B Victor, Yangjian Liu, Daniel Abernathy, Andrew S Yoo. (2015). MicroRNA-based conversion of human fibroblasts into striatal medium spiny neurons. Nat Protoc. 10, 1543-1555;
- Nina Kraskovskaya, Anna Koltsova, Polina Parfenova, Alla Shatrova, Natalya Yartseva, et. al.. (2024). Dermal Fibroblast Cell Line from a Patient with the Huntington’s Disease as a Promising Model for Studying Disease Pathogenesis: Production and Characterization. Biochemistry Moscow. 89, 1239-1250.