Наступает эра стереоизомеров
12 мая 2017
Наступает эра стереоизомеров
- 1845
- 1
- 4
Картина бельгийского сюрреалиста Рене Магритта «Черное Фальшивое зеркало» как бы говорит нам: на каждый хитрый цитокин найдется свой шпигельмер с левой резьбой.
В коллаже использована оригинальная картина Магритта «Фальшивое зеркало» и рисунок из обсуждаемой статьи [1]
-
Автор
-
Редакторы
Недаром зазеркалье манит любителей волшебных историй и ученых. Там скрываются настоящие сокровища — например, зеркальные молекулы, которые можно применять в антицитокиновой терапии, помогающей больным аутоиммунными заболеваниями, но уже на нашей стороне зеркала. Из этой статьи, немного загадочной, вы узнаете о зазеркальных молекулах-шпигельмерах и гомохиральности, а также о роли пущинского кристаллографа в их исследовании.
Как правая и левая рука —
Твоя душа моей душе близка.
Мы смежны, блаженно и тепло,
Как правое и левое крыло.
Но вихрь встает — и бездна пролегла
От правого — до левого крыла!
Марина Цветаева
Эта история для меня началась с того, что мой коллега по Пущинскому научному центру, к.ф.-м.н. Азат Габдулхаков, занимающийся рентгеноструктурным анализом, рассказал об одной своей головоломке. Довелось ему сотрудничать с товарищами из Гамбургского университета для определения пространственной структуры комплекса белка и необычной молекулы РНК [1]. Белок был человеческим цитокином, а РНК создали на основе левой (!) рибозы. Такой комплекс оказался перспективной моделью для получения медицинских препаратов широкого спектра действия.
Меня удивила молекула РНК на основе левой рибозы — это очень эксклюзивная вещь. Какое вообще отношение химические вещества имеют к понятиям лево и право, рассказывает врезка «L- и D-стереоизомеры». К счастью, редко кто из нас задумывается, что природные белки и нуклеиновые кислоты состоят только из левых (L) аминокислот и правых (D) сахаров (см. врезку «Мистическая гомохиральность живого»).
Живые клетки предпочитают употреблять именно такие аминокислоты и сахара, используя их для построения жизненно важных клеточных структур. Белков, построенных только из правых аминокислот, равно как и нуклеиновых кислот, собранных из левых сахаров, в земных организмах не обнаружено. Откуда же взялась левая рибоза? И как такая молекула РНК взаимодействует с человеческим белком? Эти вопросы меня побудили на независимое научное расследование и написание статьи о L- и D-стереоизомерах и прочих интересных вещах.
Дабы не запутаться во всех этих L и D, естественных и искусственных, я буду молекулы с несвойственной природе хиральностью выделять приставкой «ксено-» (от греч. ξενος, «чуждый»). К примеру, ксенонуклеиновые кислоты [3] образованы L-рибозой. А приставкой «био-» снабжу нуклеиновые кислоты и белки, построенные из преобладающих в живых существах мономеров — D-сахаров и L-аминокислот соответственно.
Теперь подробнее о комплексе человеческого белка и ксеноРНК.
Поиск стерео: научный подход
Человеческий цитокин под названием CCL2 служит «тревожным сигналом» для лейкоцитов — белых клеток крови, отвечающих за иммунитет, — и указывает им место, где требуется их вмешательство. В передаче сигнала принимают участие углеводы, называемые гликозаминогликанами. CCL2 воздействует на клетки посредством рецептора CCR2, сопряженного с G-белком, — о таких рецепторах уже немало сказано на «биомолекуле» [8], [9]. При этом цитокин CCL2 передает свой сигнал исключительно рецептору CCR2, но рецептор этот может принимать сигналы и от других цитокинов: CCL8, CCL7 и CCL13 [10]. У здорового человека этот отлаженный механизм обеспечивает активное долголетие: иммунитет работает четко, не доставляя никаких хлопот своему хозяину.
Однако род людской подвержен разным заболеваниям. И сейчас известны такие болезни, в которых повинен чрезмерно активный иммунитет. В частности, интенсивная атака на собственные клетки по непонятным причинам происходит при аутоиммунных заболеваниях, о чем рассказывает статья «Иммунитет: борьба с чужими и... своими» [11]. Сильный иммунитет также мешает при трансплантации органов, заставляя организм отторгать их. В терапии подобных недугов локальный защитник от пагубных нападок иммунитета был бы хорошим помощником. С такими защитниками имеет дело одно из самых современных направлений в медицине — антицитокиновая терапия.
Оказалось, что цитокин CCL2 и рецептор CCR2 играют определенную роль в иммунном ответе. В частности, активация сигнализации по этому пути влияет на течение воспалительных заболеваний, в том числе и аутоиммунных [12]. Поэтому белок CCL2 выбрали в качестве удобной мишени для блокирования этой сигнализации и приступили к поискам блокатора — локального защитника от ненужной активности иммунитета.
Путь поиска блокатора немецкие ученые, коллеги Азата, избрали нестандартный (рис. 2) [13]. Сначала они создали стереоизомер человеческого цитокина CCL2 и подобрали для него специфично связывающийся фрагмент биоРНК, который затем «вывернули наизнанку» — синтезировали его стереоизомер. Итоговый фрагмент ксеноРНК оказался эффективным ингибитором активности биоцитокина CCL2. Не пошла еще голова кругом? У меня — да.
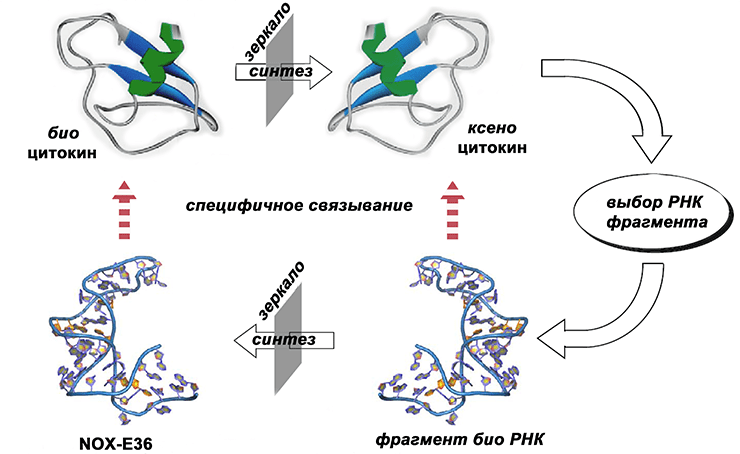
Рисунок 2. Схема эксперимента.
[13], рисунок адаптирован автором
До этого предпринимались попытки найти фрагменты биоРНК или биоДНК, специфически связывающиеся с биоцитокином, и использовать их для блокировки сигнала. Однако нуклеиновые кислоты на основе биосахаров легко распознаются ферментами и, соответственно, склонны к быстрой деградации в организме пациента [14]. Поэтому необычный подход с ксеноРНК дал надежду на успех.
Красивая идея, не правда ли?! Да и неординарность всей работы меня лично восхищает, поэтому далее хочу заострить ваше внимание на наиболее захватывающих моментах научного поиска.
Гомохиральность in cellulo и in vitro
Отмечу, что биосинтез белка возможен только из L-аминокислот, и это один из базовых биохимических процессов [15]. Биотехнологический синтез белка проводят либо непосредственно в клетке (например, в бактерии Escherichia coli), и тогда клеточный аппарат сам синтезирует вам из L-аминокислот столько нужного белка, сколько потребуется, либо в пробирке, для чего составляют специальную биосинтетическую смесь. В ее состав должны входить: 1) матричная РНК, кодирующая аминокислотную последовательность нужного белка; 2) исходный субстрат — левые аминокислоты; 3) энергетики — молекулы АТФ и ГТФ; 4) специально обработанный клеточный экстракт, в котором содержатся рибосомы и вспомогательные молекулы.
Все синтезированные белки будут точной копией друг друга: ошибки в биосинтезе белка — редкое явление. Несомненно, это огромный плюс для исследователей. При некоторой сноровке получение белка таким способом, конечно, занимает определенное время, но сейчас это стандартная задачка, с которой может справиться даже любознательный студент-биолог.
Другое дело — химический синтез белка. Его плюс в том, что в качестве субстрата можно использовать хоть D-, хоть L-аминокислоты, но минус — очень большая трудоемкость при невысокой точности. Поэтому исход процесса зависит от терпения и аккуратности химика-синтетика, то есть человеческий фактор играет значительную роль. Раньше химически синтезировали лишь небольшие пептиды — от двух до десяти аминокислот в цепочке. Сейчас уже можно собрать белок из трехсот и более аминокислот, но до сих пор это нетривиальная задача [16].
В случае с человеческим цитокином CCL2 мишень исследования оказалась в каком-то смысле удачной. Белок состоит всего из 66 аминокислотных остатков, но тем не менее в нём представлены все 20 разных аминокислот. Поэтому для создания ксенобелка исследователям пришлось последовательно, в определенном порядке, химически соединять 20 D-изомеров аминокислот. При этом на каждой стадии контролировать и отделять растущий пептид от молекул, синтезированных с ошибками. Экспериментаторы с этим справились. Далее оставалось лишь надеяться, что ксеноCCL2 сложится в нужную форму.
Сворачивание (фолдинг) белка до сих пор остается фундаментальной научной проблемой [17]. Правда, не буду лукавить, еще в прошлом столетии удалось показать, что, например, химически синтезированная из D-аминокислот ксенопротеаза ВИЧ-1 функционально активна [18]. Отмечу, что именно гомохиральность позволяет молекуле белка создавать функциональную структуру. Поэтому ВИЧ-1-ксенопротеаза специфично расщепляла D-пептиды и имела форму биопротеазы, но зеркально отраженную. Однако природа непредсказуема в своих проявлениях и с одинаковой легкостью рушит или поддерживает теории и хрупкие надежды ученых. С верой в то, что ксеноCCL2 похож на свой биологический стереоизомер, исследователи продолжали экспериментировать, и на следующем этапе использовали метод SELEX (см. врезку «SELEX: создай свой лиганд») для поиска специфично связывающегося фрагмента биоРНК.
В достаточно больших подробностях с представлениями о том, как белковые молекулы обретают свою форму, можно ознакомиться и на «биомолекуле»: «Проблема фолдинга белка» [19]. — Ред.
На работу потратили немало времени и сил, но аптамер из бионуклеотидов нашли. А дальше — стадия трудоемкого химического синтеза ксеноРНК.
Фрагмент биоРНК, с которым связался ксеноCCL2, состоял из 40 нуклеотидов. Конечно, здесь задача была чуть проще. В молекуле рибонуклеиновой кислоты всего четыре разновидности нуклеозидов: аденозин, гуанозин, уридин и цитидин. С помощью твердофазного синтеза ученые создали все четыре L-рибонуклеозида, а затем получили нужный 40-нуклеотидный ксеноРНК фрагмент [23]. В ходе эксперимента сделали необходимые контроли, и наконец наступил момент истины — связывание с человеческим биобелком CCL2. К всеобщей радости, контакт этих молекул оказался высокоспецифичным: КD = 1,05 нМ [14].
Рентген, проницательный и беспощадный
Однако, чтобы детально понять процесс взаимодействия ксеноРНК и биобелка и воочию подтвердить факт их специфичного связывания, комплекс подвергли рентгеноструктурным исследованиям. На данном этапе подключили российского эксперта. Азат поведал следующее: «Коллегам посчастливилось найти специфический фрагмент L-РНК — это была их большая удача. Они получили кристаллы комплекса цитокина с L-РНК, что тоже невероятное везение. Эту L-РНК, кстати, назвали NOX-E36. Мне нужно было определить структуру и показать с помощью рентгеноструктурного анализа, что человеческий белок CCL2 сохраняет свою природную форму и действительно специфично связывается с NOX-E36. После трудоемких вычислений и длительного поиска нам удалось решить пространственную структуру этого необычного комплекса. Установить, что связывание происходит в месте взаимодействия цитокина с рецептором. Благодаря такому связыванию блокируется сигнал CCL2. Оказалось, что фрагмент ксеноРНК — потенциальный ингибитор и других цитокинов: CCL8, CCL11 и CCL13».
Во время рентгеноструктурного анализа были и свои приключения. Исследователи получили кристаллы в надежде, что это комплекс цитокина с NOX-E36. Поставили кристаллы в пучок рентгеновского луча, собрали дифракционные данные. Задачу решали кристаллографы испытанным методом молекулярного замещения, но решения не находили. Скрупулезная обработка полученных данных результатов не дала, и возникли сомнения. В элементарной ячейке кристалла было что-то, но что именно? Может, просто белок закристаллизовался, а может, это фрагмент ксеноРНК сформировал кристалл? Возможно, в кристалле вообще что-то ненужное!
Тогда решили прибегнуть к другому варианту экспериментов по кристаллизации, с использованием тяжелых атомов. И только с их помощью удалось получить детальную карту электронной плотности, которую должен был расшифровать кристаллограф. Здесь исследователей ждала удача: получилось определить, какие вещества составляли кристалл, и наконец-то найти что-то похожее на РНК. После полного вписывания атомов оказалось, что это и есть ксеноРНК. Обнаружили также дополнительные фрагменты электронной плотности и для белка. Так было доказано реальное существование комплекса биобелка CCL2 с ксеноРНК. Полученная карта электронной плотности отличалась высоким разрешением, а значит, описывала почти все детали молекул и их контакта (рис. 3).
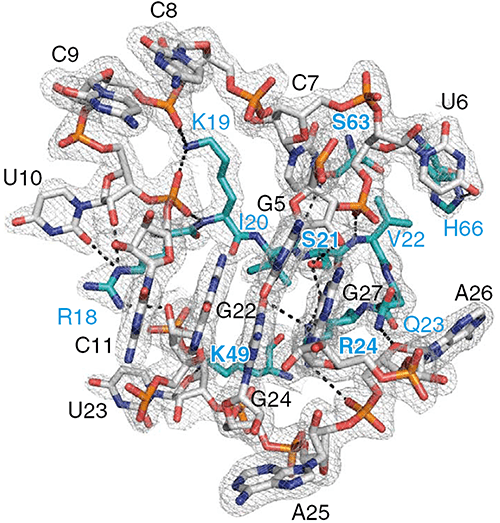
Рисунок 3. Фрагмент карты электронной плотности с аминокислотными остатками и нуклеотидами.
На карте видны нуклеотиды, составляющие NOX-E36, и заметно, что они особенные. Понятно, как аминокислоты формируют α-спирали и β-тяжи в белке. Видны атомы, образующие нуклеотиды и аминокислотные остатки, и ясно, как они взаимодействуют. Однако на этом эксперимент не закончился. Более того, всё самое интересное только начиналось. Теперь на основе полученной структуры проводят анализ — ищут ответы на самые интригующие вопросы: как взаимодействуют ксеноРНК и цитокин, почему блокируется сигнал и как это можно использовать?
КсеноРНК — помощница
Представленная работа — плодотворный союз академической науки и фармацевтической фирмы Noxxon, поэтому параллельно с проверками качества полученного комплекса, ксеноРНК NOX-E36 проходила доклинические испытания на животных, которые оказались успешными. Молекулу сейчас проверяют в схемах иммуносупрессорной терапии, необходимой при трансплантации органов [24], [25]. Уже показана ее эффективность при лечении альбуминурии у людей, больных сахарным диабетом: идет вторая фаза клинических исследований [14], [26].
NOX-E36 — один из представителей шпигельмеров. Так назвали семейство молекул ксеноРНК — от немецкого spiegel, «зеркало» [14]. Разобранная здесь работа — лишь вершина айсберга. В частности, ксеноРНК NOX-A12 испытывают в борьбе с раком: идет вторая фаза клинических исследований, в которых участвуют пациенты с миеломой [27]. Кстати, и ксенопептиды не остаются в стороне. Их синтезируют и тоже тестируют в схемах лечения различных заболеваний [28].
Эра стереоизомеров подкрадывается незаметно. Однако перспективы, которые она открывает, заманчивы. Создание нового класса медицинских препаратов — это только начало. Вероятно, мы не сможем разгадать причину гомохиральности биосферы, но использовать эту особенность природы для нашего глобального прогресса реально уже сегодня.
Литература
- Dominik Oberthür, John Achenbach, Azat Gabdulkhakov, Klaus Buchner, Christian Maasch, et. al.. (2015). Crystal structure of a mirror-image L-RNA aptamer (Spiegelmer) in complex with the natural L-protein target CCL2. Nat Comms. 6, 6923;
- Пастер Л. Избранные труды (т. 1). М.: Изд-во АН СССР, 1960. С. 9–48;
- Элементы: «Искусственные полимеры могут хранить генетическую информацию»;
- D-аминокислоты: не только в Зазеркалье;
- Bradley J. Honas, Urlene M. Glassman, Thomas J. Wiese. (2009). Enzymatic activity of α-L-fucosidase and L-fucokinase across vertebrate animal species. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology. 153, 359-364;
- Твердислов В.А., Яковенко Л.В., Жаворонков А.А. (2007). Хиральность как проблема биохимической физики. Российский химический журнал. 1, 13–22;
- David W. Deamer, Reay Dick, Wolfram Thiemann, Meir Shinitzky. (2007). Intrinsic asymmetries of amino acid enantiomers and their peptides: A possible role in the origin of biochirality. Chirality. 19, 751-763;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Новый рубеж: получена пространственная структура β2-адренорецептора;
- Samantha J. Allen, Susan E. Crown, Tracy M. Handel. (2007). Chemokine:Receptor Structure, Interactions, and Antagonism. Annu. Rev. Immunol.. 25, 787-820;
- Иммунитет: борьба с чужими и… своими;
- Satish L. Deshmane, Sergey Kremlev, Shohreh Amini, Bassel E. Sawaya. (2009). Monocyte Chemoattractant Protein-1 (MCP-1): An Overview. Journal of Interferon & Cytokine Research. 29, 313-326;
- Laure Yatime, Christian Maasch, Kai Hoehlig, Sven Klussmann, Gregers R. Andersen, Axel Vater. (2015). Structural basis for the targeting of complement anaphylatoxin C5a using a mixed L-RNA/L-DNA aptamer. Nat Comms. 6, 6481;
- Axel Vater, Sven Klussmann. (2015). Turning mirror-image oligonucleotides into drugs: the evolution of Spiegelmer® therapeutics. Drug Discovery Today. 20, 147-155;
- Рибосома за работой;
- M. T. Weinstock, M. T. Jacobsen, M. S. Kay. (2014). Synthesis and folding of a mirror-image enzyme reveals ambidextrous chaperone activity. Proceedings of the National Academy of Sciences. 111, 11679-11684;
- Финкельштейн А.В. Введение в физику белка. Курс лекций;
- R. Milton, S. Milton, S. Kent. (1992). Total chemical synthesis of a D-enzyme: the enantiomers of HIV-1 protease show reciprocal chiral substrate specificity [corrected]. Science. 256, 1445-1448;
- Проблема фолдинга белка;
- Мода на ретро. Где встречается обратная транскрипция, и как она эволюционировала;
- Andrew D. Ellington, Jack W. Szostak. (1990). In vitro selection of RNA molecules that bind specific ligands. Nature. 346, 818-822;
- C Tuerk, L Gold. (1990). Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymerase. Science. 249, 505-510;
- Stefanie Hoffmann, Johannes Hoos, Sven Klussmann, Stefan Vonhoff. (2011) RNA Aptamers and Spiegelmers: Synthesis, Purification, and Post-Synthetic PEG Conjugation;
- A. Kalnins, M. N. Thomas, M. Andrassy, S. Müller, A. Wagner, et. al.. (2015). Spiegelmer Inhibition of MCP-1/CCR2 - Potential as an Adjunct Immunosuppressive Therapy in Transplantation. Scand J Immunol. 82, 102-109;
- Mike Notohamiprodjo, Aivars Kalnins, Martin Andrassy, Manuel Kolb, Benjamin Ehle, et. al.. (2016). Multiparametric Functional MRI: A Tool to Uncover Subtle Changes following Allogeneic Renal Transplantation. PLoS ONE. 11, e0165532;
- Menne J., Eulberg D., Beyer D., Baumann M., Saudek F., Valkusz Z. et al. (2017). C-C motif-ligand 2 inhibition with emapticap pegol (NOX-E36) in type 2 diabetic patients with albuminuria. Nephrol. Dial. Transplant. 32, 307–315;
- H Ludwig, K Weisel, M T Petrucci, X Leleu, A M Cafro, et. al.. (2017). Olaptesed pegol, an anti-CXCL12/SDF-1 Spiegelmer, alone and with bortezomib–dexamethasone in relapsed/refractory multiple myeloma: a Phase IIa Study. Leukemia. 31, 997-1000;
- Le Zhao, Wuyuan Lu. (2014). Mirror image proteins. Current Opinion in Chemical Biology. 22, 56-61.