Неожиданная взаимосвязь между воспалением и способностью клетки «перепрограммироваться»
17 ноября 2012
Неожиданная взаимосвязь между воспалением и способностью клетки «перепрограммироваться»
- 1100
- 0
- 5
Неожиданно оказалось, что эффективность перекрограммирования выше в случае стимуляции толл-рецепторов — как, например, во время воспалительной реакции.
-
Автор
-
Редакторы
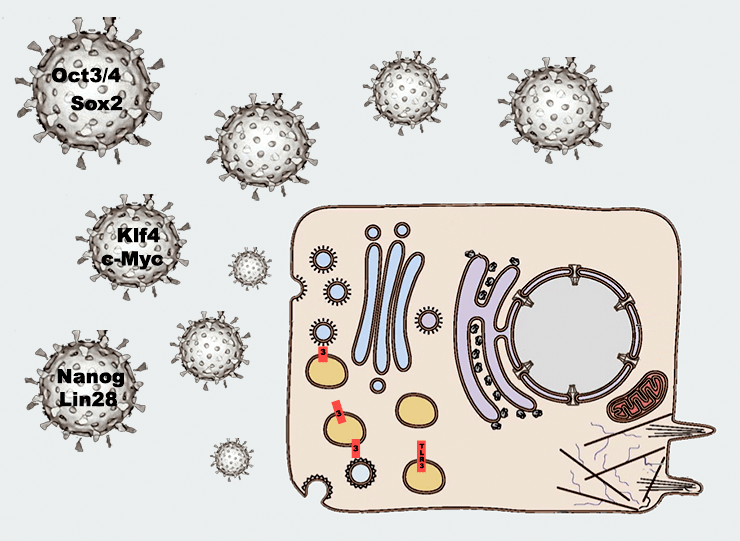
Исследователи из Стэнфордского университета неожиданно открыли действенный способ повышения эффективности перепрограммирования соматических клеток в стволовые. Оказалось, что помимо белков-индукторов, считываемых клеткой с вирусного носителя-вектора, необходимо присутствие самого вируса, который активирует один из рецепторов врожденной иммунной системы.
В работе, заслужившей Нобелевскую премию по физиологии и медицине в 2012 году [1], японский исследователь Шинья Яманака продемонстрировал, что клетки взрослого организма можно вернуть в состояние, аналогичное эмбриональной клетке. Для такого кардинального омоложения клетки требуется гиперактивация всего четырех генов (белков Oct4, Klf4, Sox2 и c-Myc), доставленных в клетку с помощью ретровирусов. Подробно об этом рассказывается в статье «Была клетка простая, стала стволовая» [2].
Казалось бы, найден «родник вечной молодости и здоровья». Да не тут то было. Хотя с помощью этого метода можно омолодить даже клетки столетних [3], клиницисты не спешат использовать это открытие, так как внедрение в геном с помощью вируса инородной ДНК вполне может привести к генетическим нарушениям, вплоть до злокачественной трансформации. Преодолеть этот недостаток, по мнению ряда исследователей, может использование при перепрограммировании не генов, а просто проникающих в ядро белков, которые эти гены кодируют [4–9].
Однако попытки использовать белки вместо генов оказались неудачными. Эффективность перепрограммирования с помощью проникающих в ядро белковых факторов оказалась ничтожно мала. Ученые задались вопросом: «Почему белки действуют на несколько порядков менее эффективно, чем „вирусная“ доставка генов?» Может быть, вирус как-то помогает перепрограммированию? Но как? Ответ был получен в экспериментах, где вместе с перепрограммирующими белками был использован посторонний вирус, не несущий генов необходимых для перепрограммирования. Оказалось, что необходимым условием для перепрограммирования клеток и получения индуцированных плюрипотентных стволовых клеток (ИПСК) является активация врожденной иммунной системы [10].
Дальнейшие исследования показали, что вирус вызывает воспалительную реакцию и инициирует активацию в клетке рецептора-«таможенника» 3 (toll-like receptor 3), сокращенно TLR3 [11]. (Кстати, за открытие и изучение толл-подобных рецепторов тоже вручена Нобелевская премия [12]. А название свое они получили не от английского слова toll — «пошлина», «тариф», — а от немецкого Toll — «сумасбродный», «безумный».)
Действительно, «выключение» гена TLR3 с помощью РНК-интерференции снижает эффективность вирусного метода перепрограммирования, существенно уменьшая количество ИПСК на выходе. Стимуляция же TLR3, вызываемая синтетическим аналогом двухцепочечной РНК вместо вируса, вызывала увеличение эффективности перепрограммирования. Выяснилось, что активация TLR3 приводит к эпигенетическим изменениям определенных участков хроматина [13], делая их доступными для белковых факторов перепрограммирования (Oct4, Klf4, Sox2 и c-Myc), а также для «модификаторов» эпигенома (таких, как, например, β-катенин [14], [15]). Это облегчает индукцию генов, вовлеченных в перепрограммирование, и вызывает образование индуцированных плюрипотентных стволовых клеток.
В целом, это открытие может помочь разработке новых методов получения ИПСК с помощью проникающих в клетку перепрограммирующих белков — методики возможно более безопасной, а потому более приемлемой для использования в клинике.
Написано по материалам оригинальных работ [10], [13].
Литература
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- Была клетка простая, стала стволовая;
- Французским исследователям удалось омолодить клетки столетних людей;
- Hongyan Zhou, Shili Wu, Jin Young Joo, Saiyong Zhu, Dong Wook Han, et. al.. (2009). Generation of Induced Pluripotent Stem Cells Using Recombinant Proteins. Cell Stem Cell. 4, 381-384;
- Dohoon Kim, Chun-Hyung Kim, Jung-Il Moon, Young-Gie Chung, Mi-Yoon Chang, et. al.. (2009). Generation of Human Induced Pluripotent Stem Cells by Direct Delivery of Reprogramming Proteins. Cell Stem Cell. 4, 472-476;
- P. F. Hu, W. J. Guan, X. C. Li, Y. H. Ma. (2012). Construction of recombinant proteins for reprogramming of endangered Luxi cattle fibroblast cells. Mol Biol Rep. 39, 7175-7182;
- David B. Thompson, Roberto Villaseñor, Brent M. Dorr, Marino Zerial, David R. Liu. (2012). Cellular Uptake Mechanisms and Endosomal Trafficking of Supercharged Proteins. Chemistry & Biology. 19, 831-843;
- Christine Voelkel, Melanie Galla, Tobias Maetzig, Eva Warlich, Johannes Kuehle, et. al.. (2010). Protein transduction from retroviral Gag precursors. Proc Natl Acad Sci USA. 107, 7805-7810;
- Candace Bichsel, Dennis K. Neeld, Takashi Hamazaki, Donghai Wu, Lung-Ji Chang, et. al.. (2011). Bacterial Delivery of Nuclear Proteins into Pluripotent and Differentiated Cells. PLoS ONE. 6, e16465;
- Jieun Lee, Nazish Sayed, Arwen Hunter, Kin Fai Au, Wing H. Wong, et. al.. (2012). Activation of Innate Immunity Is Required for Efficient Nuclear Reprogramming. Cell. 151, 547-558;
- K. W. Boehme, T. Compton. (2004). Innate Sensing of Viruses by Toll-Like Receptors. Journal of Virology. 78, 7867-7873;
- Толл-подобные рецепторы: от революционной идеи Чарльза Джейнуэя до Нобелевской премии 2011 года;
- Luke A.J. O’Neill. (2012). “Transflammation”: When Innate Immunity Meets Induced Pluripotency. Cell. 151, 471-473;
- K. Hoffmeyer, A. Raggioli, S. Rudloff, R. Anton, A. Hierholzer, et. al.. (2012). Wnt/ -Catenin Signaling Regulates Telomerase in Stem Cells and Cancer Cells. Science. 336, 1549-1554;
- Важнейшие стрелочники клеток организма: белки Wnt;
- Abdenour Soufi, Greg Donahue, Kenneth S. Zaret. (2012). Facilitators and Impediments of the Pluripotency Reprogramming Factors' Initial Engagement with the Genome. Cell. 151, 994-1004.