
Нобель vs Шнобель, или Механизмы магниторецепции
06 ноября 2014
Нобель vs Шнобель, или Механизмы магниторецепции
- 1910
- 7
- 3
В любом исследовании крайне важен подходящий объект. Поэтому на вершине медалей двух премий 2014 года изображены животные, без которых исследования не состоялись бы!
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Ощущение пространства и определение себя в нём всегда было важным инструментом в познании мира. В настоящее время этот вопрос стал особенно актуальным, ведь 2014 год знаменателен тем, что и Нобелевскую, и Шнобелевскую премию дали именно за изучение ориентации в пространстве. Давайте будем в тренде и попробуем разобраться с нашим внутренним компасом!
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Своя работа».
Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Магниторецепция — наше шестое чувство
Не секрет, что мы живем на планете Земля, ядро которой состоит из расплавленного железа — хорошего проводника. Именно движение проводящего вещества ядра приводит к возникновению магнитного поля [1]. И хотя магнитное поле для нас невидимо, живые существа научились его ощущать. Способность чувствовать магнитное поле называется магниторецепцией.
Какие живые организмы чувствуют магнитное поле?
Насекомые
В нашей семье вопрос о магниторецепции поднял мой младший брат-энтомолог Матвей еще два года назад. Бегая по саду с компасом, он обнаружил, что мухи садятся исключительно по направлению линий магнитного поля (рис. 1) либо север—юг, либо запад—восток!

Рисунок 1. Мухи ориентируются по линиям магнитного поля: либо строго «север—юг», либо «запад—восток»
Более того, около железной калитки мухи садились на северо-запад! Мы с удивлением обнаружили, что стрелка компаса тоже повернулась не на север, а на северо-запад. Так что основная причина положения мухи вовсе не движение «за солнцем», а магнитные поля.
Так Матвей заинтересовал нас всех явлением магнитотропизма. Покопавшись в статьях, я обнаружила, что у мух есть некий белок, который называется криптохром. Именно он позволяет им ориентироваться по магнитному полю в условиях освещения синим или ультрафиолетовым светом [2]. С тех пор мы и собираем интересные факты, связанные с криптохромом.
Растения
Магнитотропизм растений гораздо лучше изучен [3], поэтому мы вместе с братом продолжили опыты на растениях. Для начала мы рассадили свёклу тремя способами: (1) на запад—восток, (2) север—юг и (3) контрольные растения, растущие «кучкой». Когда корнеплоды подросли, мы сделали пометку «ЮГ» желтой краской. После сбора урожая выяснилось, что во всех трех вариантах основная масса боковых корней на свеклах растут в направлении запад—восток (рис. 2)! Более того, грядка (2) дала более крупные экземпляры. Мы думаем, это связано с оптимальной ориентацией корней, когда они не мешают друг другу.

Рисунок 2. Ориентация боковых корней свёклы преимущественно «запад—восток» и не зависит от положения грядки и соседних корнеплодов
Данное свойство было бы здорово использовать в сельском хозяйстве! Убедившись, что все работает, мы приступили к поиску других организмов, у кого может быть магниторецепция. Первыми в голову пришли птицы, и не зря! Ведь перелетным птицам ориентирование по магнитным линиям необходимо, как никому другому.
Птицы
Красивое доказательство магниторецепторной роли криптохромов было получено Хенриком Моритценом с соавт. на птицах , [5]. Исследователи взяли две группы птиц: оседлых вьюрков — зебровых амадин (Taeniopygia guttata) — и ночных мигрирующих садовых славок (Sylvia borin). Птиц содержали в округлых деревянных клетках. Миграционная активность садовой славки была настолько велика, что проявлялась даже в лабораторных условиях! Все перелетные птицы ориентировались и пытались двигаться на юго-восток, причем только ночью, тогда как оседлые птицы хаотично перемещались по клетке (рис. 3а).
Детальное исследование «эффекта компаса» показывает, что это — процесс квантово-механический. Между прочим, это один из немногих примеров в биологии, когда квантовая природа сущего «дает о себе знать»: «Зарождение квантовой биологии» [4]. — Ред.
Анализ экспрессии матричной РНК криптохрома показал, что у обеих групп птиц криптохром экспрессировался в дневное время, что связано с его циркадной функцией [6], но только у ночных мигрирующих птиц — садовой славки — экспрессия криптохрома была особенно высока в ночное время (рис 3б и 3в).
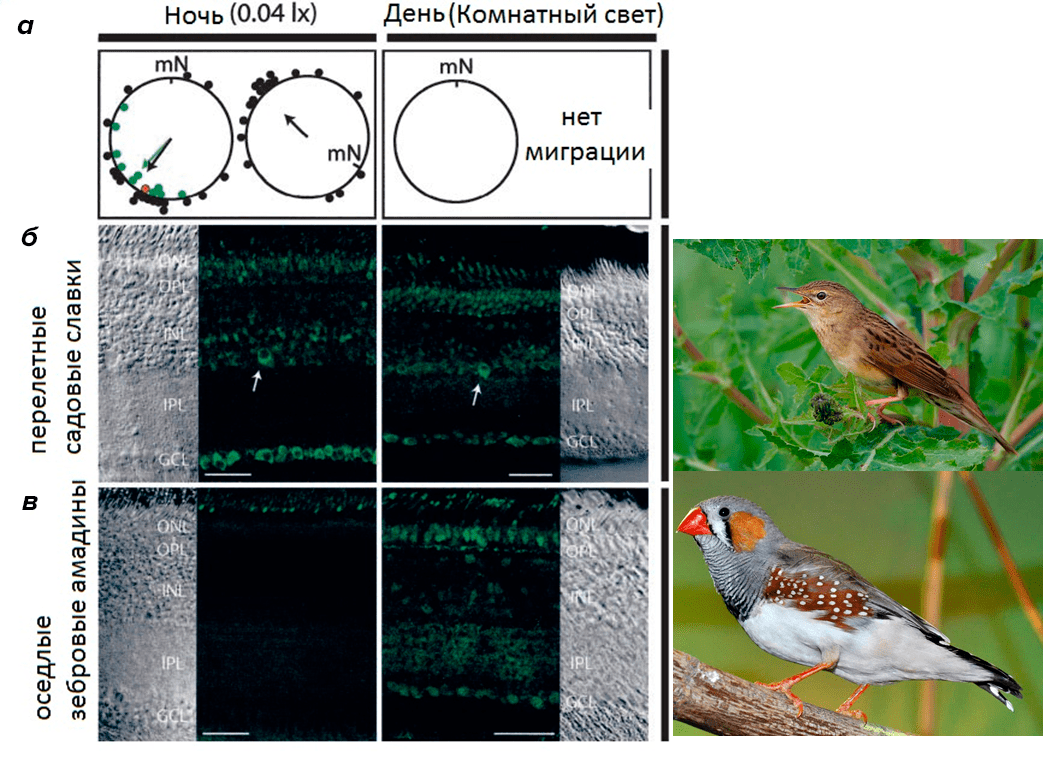
Рисунок 3. Ориентация в клетке и экспрессия криптохрома перелетных и оседлых птиц в разное время суток. а — Ориентация птиц в клетке в ночное и дневное время. Точками показано положение птиц в пространстве. Зелеными точками отмечены экземпляры, у которых была исследована экспрессия мРНК криптохрома. Стрелками обозначено преимущественное направление движения птиц. mN — магнитный север. б — Иммуногистохимический анализ CRY1 в ночное время (слева) и в дневное время (в центре) перелетных птиц — садовых славок. Справа показана фотография представителя садовых славок на воле. в — Аналогичное исследование для оседлых птиц — зебровой амадины. Криптохромы экспрессируются во внутреннем ретинальном эпителии, в слое ганглиозных клеток (GCL), и внутреннем ядерном слое (INL). Они передают сигнал из сетчатки в средний мозг.
[5], рисунок адаптирован
Млекопитающие

Рисунок 4. Ориентация собаки во время дефекации
Нынешний год знаменателен тем, что и Нобелевскую, и Шнобелевскую премию дали за одну и ту же проблему — ориентацию в пространстве. И если нобелевские лауреаты открыли внутреннюю карту [7], то шнобелевских лауреатов больше интересовал внутренний компас [8]! А именно, группа чешских биологов определила, что собаки во время дефекации располагаются в соответствии с линиями земного магнитного поля (рис. 4) [9]! Вполне возможно, что у собак экспрессируется криптохром, обеспечивающий магниторецепцию. Надеюсь, что это удивительное исследование продолжится уже на уровне Нобелевской премии.
А мы?
Могут ли люди ощущать магнитные поля — до сих пор вопрос открытый... Однако сам по себе человеческий криптохром чувствителен к магнитному полю, что было показано на мушках дрозофилах. Дрозофилы с выключенным CRY1 экспрессировали человеческий криптохром, и работал он ничуть не хуже родного [10].
Белок, который открыли биоинформатики
Еще Ч. Дарвин в 1881 году в своих опытах с фототропизмом у канареечной травы (Phalaris) показал, что экран из раствора бихромата калия, не пропускающий синий свет, полностью снимает эффект фототропизма. Со временем было показано, что от синего света (длина волны 400–500 нм) зависят и многие другие процессы. Однако выделить рецептор синего света у растений долгое время не удавалось, поэтому гипотетический фоторецептор был назван криптохром (от греч. cryptos — скрытный) [11].
Впервые завесу тайны криптохрома приоткрыли ученые А.Р. Кашмор и М. Ахмад, выделив его РНК из растения Arabidopsis thaliana [12]. Они отсеквенировали кДНК гена HY4 дикого типа и нескольких мутантов, не обладающих реакцией на синий свет, и сравнили его последовательность с геном, кодирующим белок фотолиазу (рис. 5а). Выбор данного белка был не случайным. Фотолиаза присутствует у многих прокариот и некоторых эукариот, за исключением плацентарных млекопитающих. Он способен исправлять серьезные повреждения ДНК — пиримидиновые димеры и аддукты, возникающие под действием ультрафиолета. Другими словами, фотолиаза — это белок, осуществляющий фотоиндуцированную репарацию ДНК. Но самое главное, что для активации этого фермента необходим синий или фиолетовый свет.
Оказалось, что криптохром и фотолиаза крайне похожи! Создав такой прекрасный белок, обладающий способностью фотоиндуцированной репарации ДНК, эволюция пошла дальше и создала криптохром. От фотолиазы криптохром унаследовал способность улавливать синий свет и связываться с ДНК, что позволяет ему работать в качестве транскрипционного фактора.
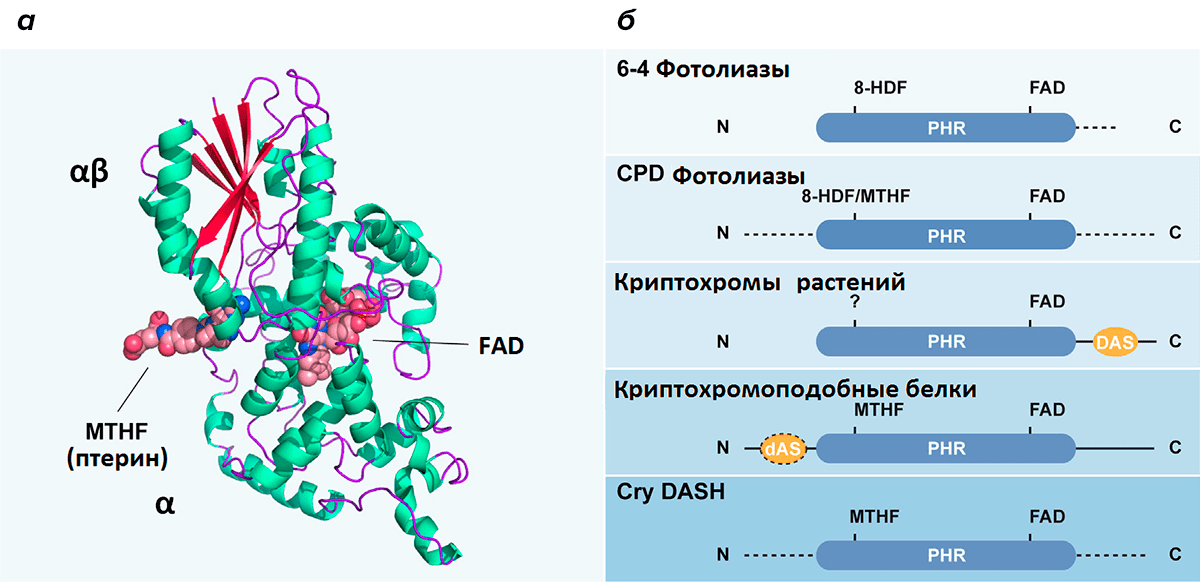
Рисунок 5. а — Строение фотолиазы Escherichia coli. Фотолиаза — это фермент, способный к фотоиндуцированной репарации ДНК. Существует два типа фотолиаз: 1) CPD-фотолиазы способны репарировать циклобутановые пиримидиновые димеры, 2) (6-4) фотолиазы репарируют т.н. пиримидиновые аддукты (6-4 пиримидин-пиримидон). Фотолиазы обоих типов имеют схожее строение: фермент имеет 2 субъединицы. В α-субъединице расположен флавиновый кофактор (FAD), между α и α/β субъединицами — MTHF (птерин) или 8-HDF. α-спирали белка обозначены зеленым, β-структуры — оранжевым, а межспиральные петли — фиолетовым цветом.
б — Схематичное изображение белковых доменов разных представителей криптохром/фотолиазного семейства. Условные обозначения: N — N-конец полипептида; C — C-конец; DAS — консервативный мотив из определенной последовательности аминокислот; dAS — это укороченный DAS-мотив; FAD — Flavin adenine dinucleotide; MTHF — птерин (methyltetrahydrofolate); 8-HDF — одно из производных флавина (hydroxy-5-deazaflavin); PHR — консервативный домен гомологии (photolyase homology region).
[13], рисунок адаптирован
Спустя несколько лет многочисленные биоинформатические исследования обнаружили криптохром и во многих других организмах. В 2003 Бредлер с соавт. открыли криптохром DASH (Drosophila, Arabidopsis, Synechococcus, Homo), доказав тем самым, что появление криптохрома предшествовало разделению на эукариот и прокариот [14]. С тех пор каждый год эволюционное древо видоизменяется и дополняется новыми фактами. Современные филогенетические представления вы можете увидеть на рис. 6, а структурные отличия разных типов криптохромов и фотолиаз на рис. 5б.
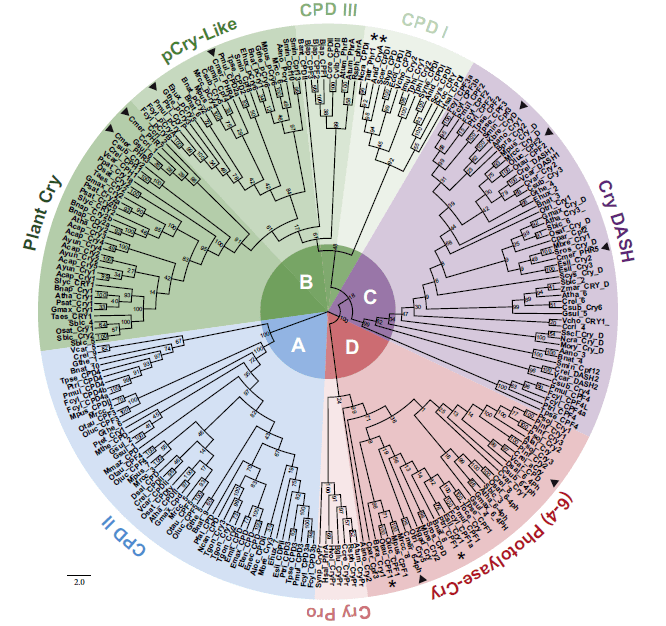
Рисунок 6. Филогенетическое древо семейства криптохромов и фотолиаз. В семействе можно выделить 4 суперкласса: A. CPD фотолиазы II типа. B. Большая группа, включающая криптохромы растений (Plant Crys), криптохромоподобные белки (pCry-likes) и CPD фотолиазы I и III классов (они отличаются только хромофором). C. Криптохром DASH (Drosophila, Arabidopsis, Synechococcus, Homo). D. Суперкласс (6-4) фотолиаз и криптохромы животных и прокариот.
Эволюция семейства. Считается, что все многообразие семейства криптохромов и фотолиаз произошло в результате всего четырех генных дупликаций. Прародителями современных фотолиаз и криптохромов считаются CPD-фотолиазы. В результате первой дупликации они разделились на 2 типа (прототипы I и II группы фотолиаз). Вторая дупликация привела к появлению современных CPD фотолиаз первого типа и группы (6-4) фотолиаз и криптохромов. Третья дупликация выделила криптохромы растений в отдельную группу. В результате последней генной дупликации из оставшейся группы сформировались (6-4) фотолиазы и криптохромы животных [15].
Как работает криптохром?
Криптохром очень похож по строению на фотолиазу (сравн. рис. 7 и 5а). Он также состоит из двух доменов, между которыми располагается птерин. α-Домен имеется полость, в которой расположен кофактор — флавин (FADH). В непосредственной близости от флавина располагается сайт связывания ДНК, в котором имеется множество положительно заряженных аминокислот [16].

Рисунок 7. Строение криптохрома. Фиолетовым цветом показаны α-спирали белка, бледно-желтым — β-структуры. Флавиновый кофактор (FADH) и триада триптофанов (Trp 400, Trp 377 и Trp 324) показаны синим цветом.
Ключевым элементом в строении криптохрома являются три консервативных остатка аминокислоты триптофана вблизи флавина (Trp 400, Trp 377 и Trp 324). Это так называемая триада триптофанов. Под действием синего света осуществляется перераспределение зарядов между триптофанами и флавином, что приводит к образованию устойчивой радикальной пары, чувствительной к магнитному полю! Именно в этом и заключается механизм магниторецепции. Более подробно об этих процессах можно узнать из рисунка 8.
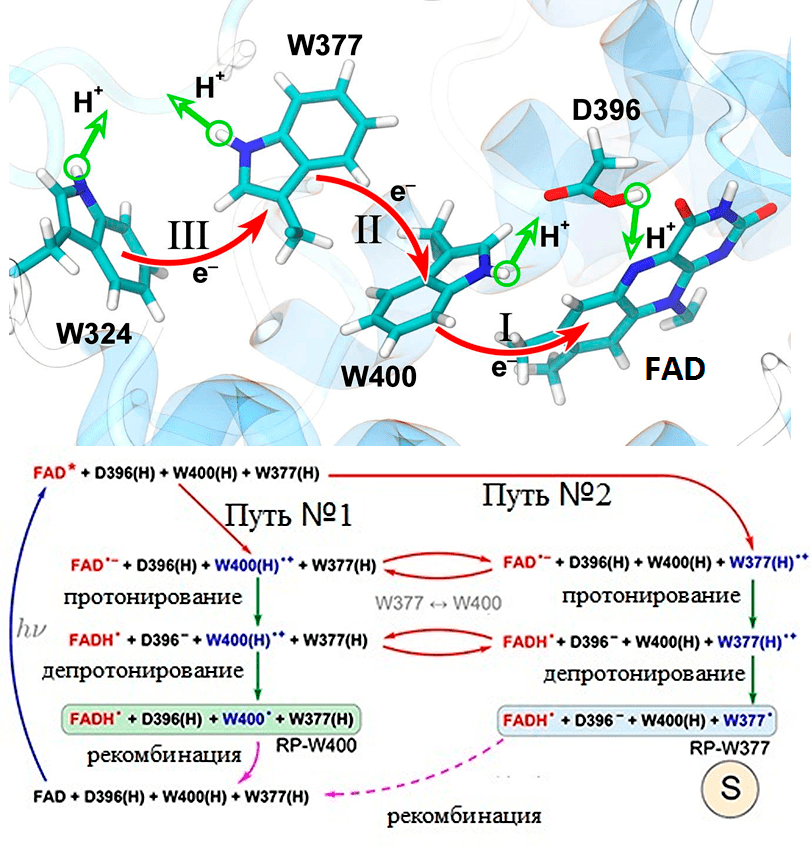
Рисунок 8. Механизм магниторецепции, опосредованный криптохромом. Показан FAD, триада триптофанов (W400, W377, W324) и аспарагиновая кислота (D396). Красным цветом изображен электронный перенос, зеленым — протонный.
1. Поглощение света. Синий свет поглощается птерином (не показан). Птерин передает возбуждение на молекулу FAD посредством резонансного переноса энергии, так как два кофактора располагаются очень близко.
2. Электронный и протонный транспорт в криптохроме. В результате передачи энергии на флавин, он активируется (FAD*). Возбужденный флавин является сильным акцептором электронов. Он может получить электрон от ближайшего триптофана: или W400, или W377. В зависимости от того, какой триптофан передал электрон на FAD*, фотореакция идет по механизму № 1 или № 2 (между двумя путями возможно переключение). Для простоты рассмотрим перенос электрона по пути № 1.
3. Образование радикальной пары. Итак, флавин получил электрон от W400. Таким образом, образовалась первая ионная радикальная пара FAD•− + W400(H)•+. Положительно заряженный W400 приводит в движение следующий остаток — W377, который поворачивается, что облегчает транспорт электронов к W400. Рядом с флавином располагается аспарагиновая кислота (D396). Она донирует свой протон на отрицательно заряженный FAD−, что приводит к образованию устойчивой нейтральной радикальной пары FADH• + W400(H)•.
4. В итоге, радикальная пара может вернуться в исходное состояние. Однако данная радикальная пара очень стабильна, и времени жизни (>10 мс) достаточно, чтобы уловить направление магнитного поля. Это и есть сигнальная форма криптохрома, которая передает сигнал клетке о положении магнитных линий. На схеме использованы стандартные обозначения: hν — квант света; X* — возбужденное состояние молекулы X; X• — радикал молекулы X; X−/X+ — анион/катион; X(H) — протонированная форма.
Такие разные гипотезы
«Если предположить, что все отмеченные эффекты реальны, то возникает мысль, что магнитное чувство живых организмов вовсе не обязательно является эволюционным прорывом. Скорее наоборот, это просто свойство одной молекулы — криптохрома, — которое случайно было выбрано птицами для осуществления магнитной рецепции»
Хенрик Моритцен и Мириям Лидвогель [23].
Магниторецепция изучается уже много лет, однако споры о её природе не заканчиваются. На сегодняшний день существует несколько гипотез механизма магниторецепции разных организмов.
- Наличие кристаллов магнетита (Fe3O4) в различных органах и тканях. Первым организмом, в котором были обнаружены кристаллы магнетита — моллюск (Polyplacophora). Позже был открыт другой любопытный организм, в котором вполне различимы магнитные кристаллы — это магнетобактерии типа Proteobacteria, которые появились на Земле более 1,5 млрд лет назад. У этих бактерий есть специальные органеллы — магнетосомы, в которых образуются ферримагнитные наночастицы из магнетита или грейгита (Fe3S4) [20]. О поисках подобных кристаллов в многоклеточных организмах, а также об их потенциальном предназначении вы можете прочесть в любопытной статье [21].
- Есть версия, что «орган магниторецепции» сокрыт в вестибулярном аппарате [22].
- Наконец, фотохимическая гипотеза, которая свидетельствует в пользу существования белка в сетчатке глаза, способного к фотопревращениям и чувствительного к магнитному полю.
Каждая из этих гипотез имеет свои преимущества и недостатки. На сегодняшний день ни одна из них не дает исчерпывающего ответа на все вопросы, связанные с магниторецепцией. Но, на мой взгляд, высокоорганизованные формы жизни требуют более изящного решения проблемы магниторецепции, нежели механическое давление кристаллов. К тому же, эволюция редко выбрасывает что-то хорошее, и возникший при зарождении жизни белок передавался все более и более высокоорганизованным формам, видоизменяясь и приобретая новые функции.
Независимо от того, какая из гипотез окажется наиболее верной, я надеюсь, что исследования магниторецепции заслужат свою Нобелевскую премию!
Литература
- Магнитное поле Земли. «Энциклопедия Кругосвет»;
- Ориентация в магнитном поле: Молекула криптохром. (2008). «Популярная механика»;
- Крылов А.В. и Тараканова Г.А. (1960). Явление магнитотропизма у растений и его природа. «Физиология растений». 2, 191–197;
- Зарождение квантовой биологии;
- H. Mouritsen, U. Janssen-Bienhold, M. Liedvogel, G. Feenders, J. Stalleicken, et. al.. (2004). Cryptochromes and neuronal-activity markers colocalize in the retina of migratory birds during magnetic orientation. Proceedings of the National Academy of Sciences. 101, 14294-14299;
- Найдена связь между обменом веществ и циркадным ритмом;
- GPS в нашем мозге: Нобелевская премия по физиологии или медицине 2014;
- Vlastimil Hart, Petra Nováková, Erich Malkemper, Sabine Begall, Vladimír Hanzal, et. al.. (2013). Dogs are sensitive to small variations of the Earth’s magnetic field. Front Zool. 10, 80;
- Собаки справляют нужду, ориентируясь на север. (2014). «Шнобелевская премия»;
- Элементы: «Возможно, люди способны ощущать магнитное поле»;
- Суковатая И.Е., Кратасюк В.А., Межевикин В.В. и др. Фотобиофизика: электрон. учеб. пособие. Красноярск: ИПК СФУ, 2008;
- Margaret Ahmad, Anthony R. Cashmore. (1993). HY4 gene of A. thaliana encodes a protein with characteristics of a blue-light photoreceptor. Nature. 366, 162-166;
- Antonio Emidio Fortunato, Rossella Annunziata, Marianne Jaubert, Jean-Pierre Bouly, Angela Falciatore. (2015). Dealing with light: The widespread and multitasking cryptochrome/photolyase family in photosynthetic organisms. Journal of Plant Physiology. 172, 42-54;
- Ronald Brudler, Kenichi Hitomi, Hiromi Daiyasu, Hiroyuki Toh, Ken-ichi Kucho, et. al.. (2003). Identification of a New Cryptochrome Class. Molecular Cell. 11, 59-67;
- Chentao Lin, Takeshi Todo. (2005). The cryptochromes. Genome Biol. 6, 220;
- Y. Huang, R. Baxter, B. S. Smith, C. L. Partch, C. L. Colbert, J. Deisenhofer. (2006). Crystal structure of cryptochrome 3 from Arabidopsis thaliana and its implications for photolyase activity. Proceedings of the National Academy of Sciences. 103, 17701-17706;
- Ilia Solovyov. (2009). Understanding how birds navigate. SPIE Newsroom;
- Ilia A. Solov'yov, Tatiana Domratcheva, Klaus Schulten. (2015). Separation of photo-induced radical pair in cryptochrome to a functionally critical distance. Sci Rep. 4;
- Solov'yov I. and Schulten K. (2014). Cryptochrome and magnetic sensing. University of Illinois;
- Karen Grünberg, Eva-Christina Müller, Albrecht Otto, Regina Reszka, Dietmar Linder, et. al.. (2004). Biochemical and Proteomic Analysis of the Magnetosome Membrane in Magnetospirillum gryphiswaldense. AEM. 70, 1040-1050;
- Роль биогенных нанокристаллов в работе биологической «машины времени»;
- Кишкинёв Д.А. и Чернецов Н.С. (2014). Магниторецепторные системы у птиц: обзор современных исследований. «Журнал общей биологии». 75, 104–123;
- Miriam Liedvogel, Henrik Mouritsen. (2010). Cryptochromes—a potential magnetoreceptor: what do we know and what do we want to know?. J. R. Soc. Interface.. 7.








