
Новый вид ингибирования ферментативной активности
21 июня 2008
Новый вид ингибирования ферментативной активности
- 1108
- 2
- 1
Принципиально новый тип ингибирования ферментативных реакций открывает новые возможности по созданию лекарств
-
Автор
-
Редакторы
Темы
Издавна биохимикам известно два типа ингибирования ферментов — конкурентное (прямое) и аллостерическое. В новом исследовании на примере селективного ингибирования образования β-амилоидного белка открыт новый, доселе не встречавшийся тип ингибирования. Ингибитор, относящийся к семейству модуляторов активности γ-секретазы (белка, «конвертирующего» предшественников β-амилоида в активную форму), связывается не с ферментом, как обычные ингибиторы, а с субстратом реакции — пептидом Aβ42, «спасая» его от расщепления. Это открытие ещё больше расширяет спектр возможных точек приложения фармацевтического воздействия, и вселяет надежду на то, что болезнь Альцгеймера, связанная с β-амилоидным белком, когда-нибудь всё же будет побеждена.
Каждое лекарство имеет свои мишени внутри организма. Чаще всего их — мишеней — несколько, а точней сказать — много прямых и намного больше — непрямых. Это часто не позволяет спрогнозировать побочные эффекты новых лекарственных препаратов. Однако что поделать — наши знания о молекулярной организации организма находятся ещё только на ранней стадии понимания.
Однако часто и прямые мишени, на которые действует то или иное лекарство, не известны — несмотря на то, что применение медикамента на уровне организма устраняет болезнь. Просто известно, что препарат Х снимает определенные симптомы заболевания, а каким образом — остаётся загадкой. Разгадывание подобного ребуса и привело к открытию нового типа действия медикаментов, о чем мировую общественность уведомил последний номер журнала Nature [1].
При изучении ингибиторов одной из протеаз — класса ферментов, обеспечивающего расщепление белков в клетке, — был обнаружен новый вид ингибирования каталитической активности. Как хорошо известно из университетского курса биохимии, существует два типа ингибиторов. Первый тип специфично связывается с активным центром фермента и блокирует дальнейшую его работу. Ко второму типу относятся молекулы, которые специфически связываются с любой другой частью фермента и меняют его конформацию на неактивную. Всё это хорошо известно и описано в тысячах работ.
В статье Томаса Кукара (Thomas Kukar) и соавторов описан третий, абсолютно неожиданный тип ингибирования [2]. Напомним, что каждый фермент реагирует со строго специфической областью субстрата. Так вот, обнаружилось, что в их случае молекула ингибитора связывалась именно с такой областью на субстрате, не давая ферменту произвести гидролиз белка. То есть ингибитор действовал не на фермент — последний оставался активным, — а маскировал от него сам субстрат.
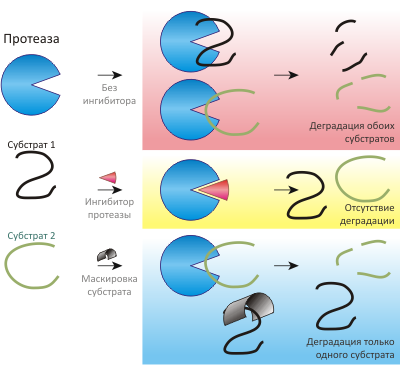
Рисунок 1. Схема нового механизма ингибирования ферментативной реакции. «Обычные» ингибиторы связываются с ферментом — его активным сайтом в случае конкурентных ингибиторов или с любой другой его областью в случае аллостерических ингибиторов. В результате такого связывания фермент — навсегда или временно — теряет свою активность и не может катализировать уже никакие реакции, если, например, он специфичен более чем к одному субстрату. Ингибиторы же нового типа связываются уже не с ферментом, а с субстратом (правда, субстрат протеазы — тоже какой-либо белок). В результате такого «маскирования» ингибируется лишь одна реакция, другие же метаболические превращения, за которые отвечает данный фермент, остаются незатронутыми.
Важность данной работы можно объяснить двумя обстоятельствами. Первое — в исследовании в качестве фермента выступала γ-секретаза, а субстрата — предшественник амилоидного белка (amyloid precursor protein). Именно сбои этой системы приводят к одной из самых печально известных болезней нашего времени — болезни Альцгеймера (см., например, «Альцгеймеровский нейротоксин: ядовиты не только фибриллы» [3]). И возможность предотвратить сбои путём ингибирования расщепления амилоидного белка является одним из перспективных и реальных путей лечения. Второе — если научится применять ингибиторы нового типа, мы получим новое поколение лекарств! Действительно, все существующие на сегодня медикаменты на основе ингибиторов направлены на «выключение» ферментов. Однако ферменты, как правило, катализируют превращения многих субстратов на разных уровнях. И, ингибируя ферменты, мы блокируем не только нежелательные процессы, но и целый ряд других, некоторые из которых могут быть жизненно важными. В результате такого лечения часто развиваются нежелательные эффекты, которые надо дополнительно корректировать. Новый способ уникален тем, что он позволит отключать не сам фермент, а выводить из метаболизма только один из его субстратов. Это дает в руки исследователей и медиков поистине ювелирный инструмент, точность которого ещё будет оценена по достоинству.
Литература
- S Landshamer, M Hoehn, N Barth, S Duvezin-Caubet, G Schwake, et. al.. (2008). Bid-induced release of AIF from mitochondria causes immediate neuronal cell death. Cell Death Differ. 15, 1553-1563;
- Thomas L. Kukar, Thomas B. Ladd, Maralyssa A. Bann, Patrick C. Fraering, Rajeshwar Narlawar, et. al.. (2008). Substrate-targeting γ-secretase modulators. Nature. 453, 925-929;
- Альцгеймеровский нейротоксин: ядовиты не только фибриллы.






