Обуздать воспаление: мезенхимальные стволовые клетки в терапии ожогов и обморожений
18 сентября 2020
Обуздать воспаление: мезенхимальные стволовые клетки в терапии ожогов и обморожений
- 1376
- 3
- 7
коллаж автора статьи
-
Автор
-
Редакторы
Темы
Статья на конкурс «Био/Мол/Текст»: Что такое терапия ожогов и обморожений? Это длительное консервативное лечение, включающее гели, мази, повязки. Это оперативное хирургическое вмешательство, при необходимости. Тут уже в ход идет пересадка донорской кожи или искусственных биотрансплантатов. Мы же предлагаем дополнить лечение мезенхимальными стволовыми клетками. С какой целью? Каким образом клетки могут увеличить эффективность лечения? На все вопросы найдем ответы.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Партнер номинации — Российский научный фонд.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
На нас двоих один фактор: особенности ожогов и обморожений
Наша кожа — наша «броня» от вредных воздействий внешнего мира: ультрафиолета, пыли, микроорганизмов. Но, к сожалению, она не стальная и существует очень много различных воздействий, которые могут нарушить целостность кожных покровов [1]. Наиболее распространенными нарушениями целостности кожи являются ранения. В первую очередь они ассоциируются с механическими травмами, которые сопровождаются рассечением кожного покрова, кровотечением и болью. Помимо этого, существует целый спектр физических и химических факторов, вызывающих наиболее сложные повреждения анатомической целостности кожи. Речь идет об ожогах и обморожениях. Несмотря на то, что оба этих вида повреждений могут быть обусловлены действием температур, они имеют ряд ключевых различий. Давайте разбираться.
Начнем с одного из распространенных в мире травматических поражений — ожогов (рис. 1), которые могут быть обусловлены воздействием высоких температур, некоторых химических веществ (сильных кислот или щелочей), ионизирующими излучениями или электричеством. В тяжелом случае происходят два события: потеря ткани и чрезмерная воспалительная реакция. И тут необходима помощь специалистов, так как собственных сил организма становится недостаточно.
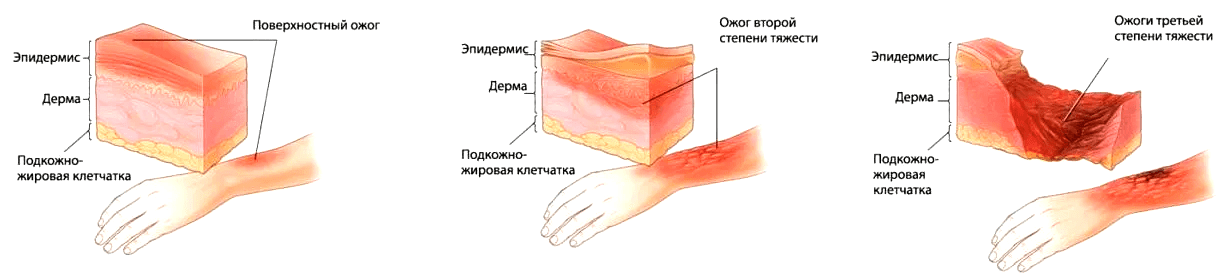
Рисунок 1. Стадии ожога согласно международной классификации
Теперь по порядку. Потеря тканей — это потеря того самого важного барьера, о котором мы говорили в начале. В этом случае используют повязки, донорские участки кожи самого пациента и, как альтернативу, биологически активные имплантаты, активно разрабатываемые сегодня [2]. Но сейчас касаться тканевой инженерии кожи мы не будем, а рассмотрим травму именно с точки зрения второго события — воспалительного процесса, неизменно сопровождающего потерю тканей.
Заживление ран включает в себя координацию многих отдельных физиологических процессов, которые регулируются секрецией различных цитокинов, хемокинов и факторов роста [3]. Все начинается с того, что увеличивается уровень провоспалительных медиаторов и цитокинов (интерлейкинов IL-1β, IL-6, IL-8, фактора некроза опухоли альфа), причем как системно, так и местно [4]. Их секреция необходима на начальных стадиях воспаления, но в случае сохранения их активации в течение всего заболевания возникают патологии, формируется хроническая рана [3]. Способствовать снижению продукции провоспалительных молекул может интерлейкин 10. Он стимулирует пролиферацию и дифференцировку Т-супрессоров, а также синтез интерлейкина 4, другого противовоспалительного цитокина.
Чем же отличается повреждающее действие низких температур? Обморожение сопровождается потерей тканей и иммунным ответом, но при криотравме также имеет место синдром ишемии-реперфузии (рис. 2). Холод является причиной стойкого нейрорефлекторного спазма сосудов, приводящего к замедлению кровотока и ишемии. В свою очередь, ишемия сопровождается уменьшением кровенаполнения органа или ткани и снижением количества протекающей через них крови. Помимо этого, происходит прямое повреждение тканей, связанное с формированием кристаллов льда внутри и вне клеток, что приводит к разрушению клеточных мембран, нарушению внутриклеточного гомеостаза и, как следствие, к некрозу клеток [5]. Результатом ишемии и повреждений является отмирание тканей.
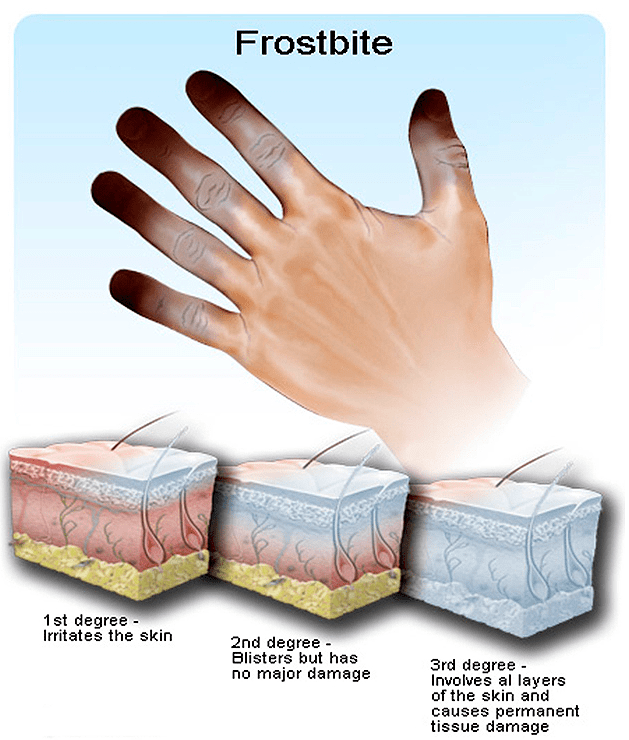
Рисунок 2. Стадии обморожения согласно международной классификации
Что делают при обморожениях? Согревают пораженные участки, чтобы восстановить кровоток и остановить некроз тканей. Но восстановление кровообращения в ишемизированных тканях приводит к реперфузионному синдрому. Как результат, происходят еще более существенные повреждения клеток, тканей и органов на местном и системном уровнях (рис. 3). Причина кроется в биохимии процесса ишемии-реперфузии.
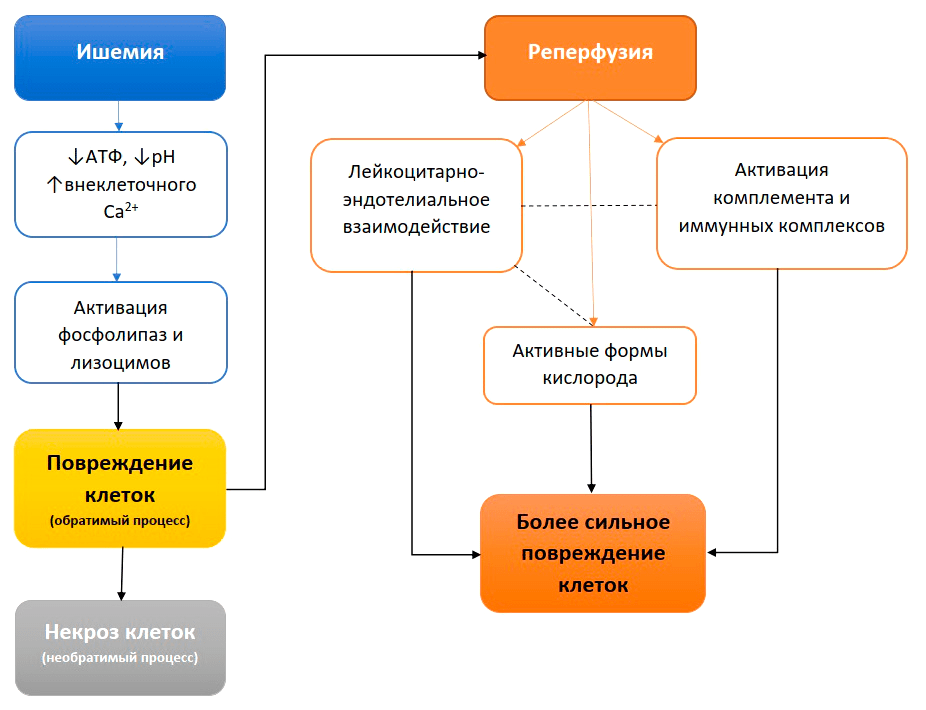
Рисунок 3. Последовательность событий синдрома ишемии-реперфузии
[7], рисунок адаптирован
Сделаем шаг в сторону и вспомним про один универсальный источник энергии всех биохимических процессов, протекающих в живых системах, — аденозинтрифосфат (АТФ). Именно в его химических связях запасается энергия, которая высвобождается в ходе окисления углеводов, липидов и аминокислот. А уже совокупность биохимических реакций, во время которых происходит окисление этих веществ, называется клеточным дыханием. Следовательно, в случае недостатка кислорода снижается активность процессов окисления. Во время ишемии пораженные клетки становятся зависимыми от анаэробного гликолиза, который позволяет вырабатывать АТФ даже без кислорода. В результате в клетке происходит накопление лактата, протонов и NAD+ [6]. Затем активируются фосфолипазы, которые превращают фосфолипиды клеточной мембраны в предшественники медиаторов воспаления, и протеолитические ферменты лизоцимы [7].
Но тут мы решили согреть замороженные ткани и тем самым восстановить кровоток и доставку кислорода к клеткам. Происходит реперфузия — повторное наполнение сосудов кровью. Что происходит дальше? Главным образом, восстановление кровотока приводит к появлению активных форм кислорода (АФК), а они в свою очередь (они же активные) начинают окислять все, что «под молекулу подвернется», в том числе накопленные продукты метаболизма, о которых мы говорили ранее. Стоит отметить, что в клетках в ходе различных окислительно-восстановительных реакций регулярно образуются АФК, играющие значительную роль в регуляции основных функций, в том числе пролиферации и дифференцировки [8]. Только в нормальных условиях концентрация АФК регулируется, в частности, антиоксидантными ферментами митохондрий. В условиях ишемии-реперфузии митохондрии повреждены и плохо справляются с регуляцией концентрации активных форм кислорода, избыток которых способен нанести повреждение.
Но и это еще не все. Ранее было сказано, что фосфолипиды клеточной мембраны превращаются в медиаторы воспаления, которые, в свою очередь, привлекают лейкоциты в зону повреждения, а эндотелиальные клетки сосудов обеспечивают место их закрепления. При этом лейкоциты сами способны генерировать АФК и высвобождать хемотаксические агенты, привлекающие еще большее количество лейкоцитов.
Все это приводит к усилению повреждений клеток. АФК вызывают перекисное окисление липидов клеточной мембраны, и, в частности, способствуют высвобождению лейкоцитарных факторов [7]. В результате, происходит агрегация тромбоцитов и снижение перфузии тканей.
Подведем небольшой итог: в случае ожогов есть внешний агрессивный фактор (например температура), непосредственно приводящий к травме; в случае обморожений — температура является «катализатором» процессов, которые начинаются внутри организма и приводят к повреждениям. В любом случае все это сопровождается воспалением, выбросом различных медиаторов воспаления, цитокинов и факторов роста. Травма вызывает защитную реакцию иммунной системы организма, который рассчитывает только на себя и не знает меры. И в этот момент нужно обуздать воспаление, чтобы предотвратить опасные последствия безмерной самозащиты.
«Менеджеры по воспалению», или перспективы биомедицинского клеточного продукта
Лаборатория специальных клеточных технологий Физтеха, в которой работает автор, предлагает использовать в комплексной терапии ожогов и обморожений биомедицинский клеточный продукт на основе мезенхимальных стволовых клеток (МСК). МСК обладают выраженными иммуномодулирующими, антиапоптотическими, противовоспалительными и регенеративными свойствами [9]. Перспективы применения МСК обусловлены тремя ключевыми факторами.
Во-первых, мезенхимальные клетки в организме способны перемещаться в поврежденные участки. Миграция обусловлена как химическими (в направлении увеличения концентрации факторов роста и хемокинов, в частности, SDF-1), так и механическими (механическая деформация, напряжение сдвига, жесткость матрицы, микрогравитация) факторами [10].
Во-вторых, МСК могут дифференцироваться в локальные клетки. Правда, вклад трансдифференцировки стволовых клеток в специфические при репарации тканей все еще остается спорным, поскольку частота дифференцировки имплантированных МСК в ткани-мишени довольно низка [11].
В-третьих, клетки способны секретировать хемокины, цитокины и факторы роста, способствующие регенерации тканей. И на этом мы остановимся подробнее, так как основным механизмом терапевтического влияния МСК является именно паракринная секреция биоактивных молекул [12]. Широкий спектр секретируемых молекул позволяет МСК взаимодействовать с клетками, принадлежащими к адаптивной иммунной системе, а также с компонентами врожденного иммунного ответа. Это обеспечивает как про-, так и противовоспалительное действие [13].
Стоит перечислить, какие трофические факторы, активно участвующие в заживлении, секретируют мезенхимальные стволовые клетки. В числе этих активных молекул стромальный фактор (SDF-1), фактор роста гепатоцитов (HGF), инсулиноподобный фактор роста (IGF-1), эпидермальный фактор роста (EGF), фактор роста нервов (NGF), трансформирующий фактор роста (TGFα) и фактор роста эндотелия сосудов (VEGF). Помимо этого, МСК продуцируют важный противовоспалительный интерлейкин 10 (IL-10) [14].
Не стоит забывать, что для использования на практике мы рассматриваем потенциальный биомедицинский клеточный продукт (БМКП), к которым сегодня существует множество этических вопросов. Одной из проблем БМКП является доступность клеток для терапии. В этом случае стоит отметить, что МСК могут быть выделены из широкого спектра доступных источников: костного мозга, пуповины, жировой ткани, печени [15]. Другой важной этической проблемой для БМКП является сложность прогнозирования последствий, к которым приведет применение препарата. Необходимо уточнить, что мезенхимальные клетки являются мультипотентными клетками. Они могут дифференцироваться в клетки разных тканей, но многообразие их видов ограничено пределами одного зародышевого листка. В частности, они могут дифференцироваться преимущественно в остеогенном (костная ткань), хондрогенном (хрящевая ткань) и адипогенном (жировая ткань) направлениях. Стоит подчеркнуть, именно «преимущественно», так как из МСК можно получить и другие типы клеток, но в определенных условиях культивирования. Помимо этого, частота дифференцировки низкая, как уже было сказано ранее. Тем не менее, несмотря на сложность предсказания последствий терапии, применение мезенхимальных стволовых клеток преодолевает имеющиеся этические проблемы [16], что, безусловно, является еще одним их преимуществом. Продолжение исследований позволит решить все этические проблемы и сделать терапию с использованием МСК максимально безопасной.
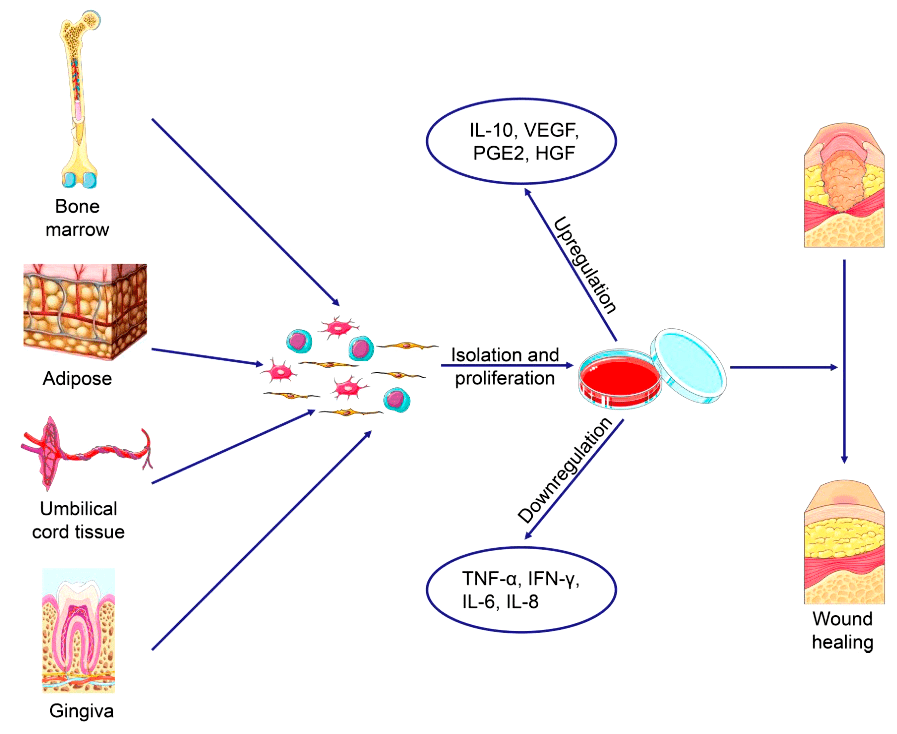
Рисунок 4. Стратегии заживления ран: мезенхимальные стволовые клетки выделяют и идентифицируют, после клетки культивируют в соответствующих условиях. Чтобы осуществить регенерацию кожи, МСК секретируют множество факторов, модулирующих воспаление и индуцирующих ангиогенез.
Все это делает мезенхимальные стволовые клетки перспективными для клеточной терапии, регенеративной медицины и восстановления тканей, но существует одно важное ограничение. Какими универсальными «бойцами» они бы не были, у них есть ахиллесова пята. Местное введение клеток в зону раневого воспаления поврежденных тканей приводит к гибели значительного количества инъецированных МСК. Это связано с тем, что в данной зоне происходит значительный выброс воспалительных медиаторов, сопровождающийся окислительным стрессом [17].
Как можно увеличить жизнеспособность клеток при трансплантации? Какие условия и методики позволят увеличить секрецию биологически активных молекул и, тем самым, повысить эффективность БМКП на основе мезенхимальных стволовых клеток? Другими словами, поговорим о биотехнологической эксплуатации.
Объясняем клеткам, что их ждет, и морально готовим к стрессу
Улучшение регенеративных свойств и пролиферации клеток мы начали с изучения влияния и подбора оптимальных условий культивирования МСК. При культивировании клеток в инкубаторе в стандартных условиях содержание кислорода — 21%, как и в атмосфере. Но в тканях концентрация кислорода значительно ниже. В частности, физиологической гипоксии соответствует содержание кислорода 2–9% [18]. Поэтому культивирование МСК проводили как в условиях нормоксии (21% кислорода в атмосфере, культура «МСК-нормоксия»), так и в условиях гипоксии (5% кислорода, культура «МСК-гипоксия»). Таким образом, мы выделили мезенхимальные клетки из костного мозга и сразу поместили их в разные условия. Оценка пролиферации и секреции факторов роста, в том числе после переноса клеток из одних условий в другие, показали главный результат — культивирование в условиях низкого содержания кислорода в атмосфере позволяет увеличить секрецию факторов роста и пролиферацию МСК.
Результат обусловлен тем, что клетки оказываются в условиях стресса, им приходится выживать, но тут необходимо вспомнить о физиологической гипоксии. Сам факт ее существования свидетельствует о том, что клетки должны быть адаптированы к данным условиям. Они имеют пару ключевых сигнальных путей PI3K-Akt и HIF-1α, которые активируются при недостатке кислорода.
Знакомимся: первый из них — главный регулятор энергетического обмена, выживания и пролиферации Akt (серин/треониновая протеинкиназа), способная повышать содержание АТФ в клетках и стимулировать гликолиз, интенсифицируя анаболические и катаболические процессы [19].
Второй регулятор — HIF-1α — основной транскрипционный фактор, участвующий в регуляции нескольких сотен генов в ответ на гипоксию (рис. 5). Гены кодируют белки, многие из которых способствуют энергетическому обмену, васкуляризации, иммортализации клеток в целом. HIF-1α есть всегда, но при нормальном содержании кислорода он появляется, чтобы быть уничтоженным. Механизм следующий: под действием кислорода происходит гидроксилирование ферментом ряда аминокислотных остатков на поверхности HIF. Это является причиной связывания опухолевого супрессора VHL, который и обеспечивает последующую деградацию фактора HIF-1α в протеасоме. Но как только кислорода становится недостаточно, гидроксилирование не происходит, и HIF вступает в игру, точнее, отправляется в ядро [20]. И тут довольно простая логика: чем меньше кислорода, тем выше активность HIF — сигнального пути. Но не стоит забывать, что кислород нужен клетке для большинства метаболических процессов, и полностью лишить ее жизненно необходимых молекул мы не можем.
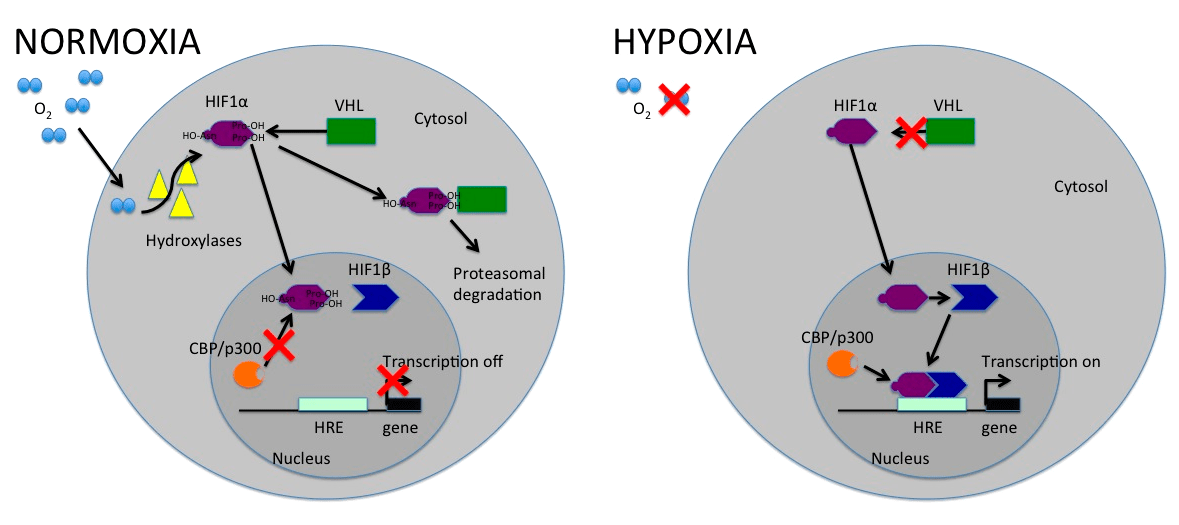
Рисунок 5. Передача сигналов, связанных с HIF-1α в условиях нормоксии и гипоксии
Культивирование в условиях недостатка кислорода способствовало увеличению пролиферации клеток и секреции цитокинов и факторов роста, поэтому мы перешли к следующему этапу — доклиническим испытаниям. Первая часть доклиники была завершена в предыдущем году. В результате мы подтвердили безопасность продукта при аллогенной терапии. Сейчас идет следующий, ключевой этап — оценка эффективности терапии. Ранее разработанные модели обморожения и механической травмы у крыс и химического ожога у мышей позволят сравнить терапию с использованием культуры МСК, культивируемых в условиях гипоксии, с терапией МСК, выращенными в стандартных условиях.
Собираем клетки в сфероиды и пласты
В последние годы в регенеративной медицине активно используются 3D-культуры стволовых клеток [21], поэтому дополнительно мы рассматриваем возможность повышения секреции и пролиферации клеток путем создания 3D-структур.
Во-первых, из клеток можно получить сфероиды — тканеподобные агрегаты клеток сферической формы. Необходимо отметить, что мезенхимальные стволовые клетки — это адгезивная клеточная культура, следовательно, для получения сфероидов клетки должны быть во взвешенном состоянии. Существует множество различных способов получения сфероидов, часть из которых представлена на рисунке 6. Мы использовали специальные агарозные подложки, препятствующих адгезии клеток (рисунок 6б).
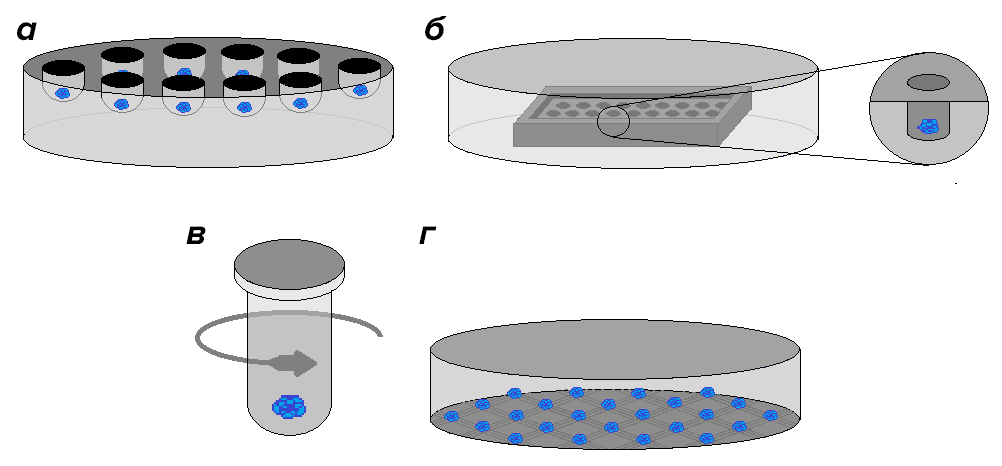
Рисунок 6. Техники получения сфероидов. а — Метод «висячей капли». б — Метод с применением низкоадгезивных субстратов (подложек). в — Метод принудительной агрегации. г — Метод с использованием специальных мембран.
рисунок автора статьи
Во-вторых, из клеток можно получить пласты — структуры, состоящие из нескольких слоев. Причем их можно использовать как для нанесения на поврежденную ткань, так и вводить внутримышечно, как в 2007 году предложил Чен с соавторами (рис. 7) [22]. Обычно МСК никогда не выращивают до плотности в 100%, когда клетки полностью покрывают поверхность подложки. Это связано с тем, что, достигая ее, клетки быстро начинают погибать. Поэтому исследователи идут на хитрость. В нашем случае мы нашли и опробовали относительно простой способ получения — длительное (10–14 суток) культивирование клеток в монослое с добавлением витамина С в питательную среду [23]. Предположительно, формирование пластов под действием аскорбиновой кислоты может быть обусловлено ее основными физиологическими свойствами, среди которых — стимуляция пролиферации [24], подавление апоптоза, ключевая роль в биосинтезе коллагена и других компонентов внеклеточного матрикса [25].
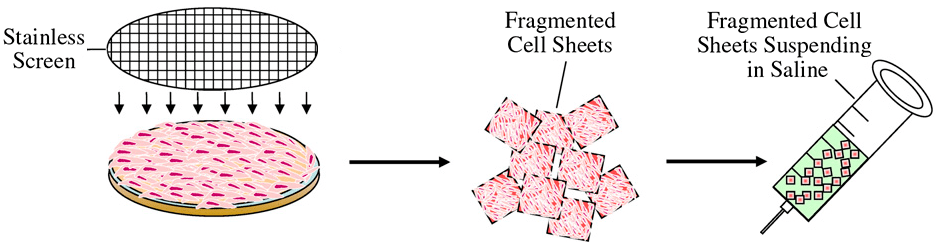
Рисунок 7. Способ получения фрагментированных клеточных пластов
На данный момент проведены исследования, показавшие бóльшую секрецию факторов роста сфероидами и пластами по сравнению с клетками в монослое (с плотностью клеток около 90%).
А теперь давайте разберемся, с чем связана перспективность 3D-культивирования. Чем может быть выгодно применение более сложных структур в терапии вместо суспензии единичных клеток?
Во-первых, это предпочтительно из-за присутствия в сфероидах и пластах очагов гипоксии, то есть условий, которые были описаны выше. Во-вторых, клетки в тесном контакте друг с другом, при наличии некоторого внеклеточного матрикса между ними, более жизнеспособны в пораженных тканях. Вроде бы какая разница, можно ведь просто ввести большее количество обычных культур клеток! Но нет, внеклеточный матрикс также играет значительную роль и не только как механическая поддержка, но и как «концентратор» клеток и секретируемых ими активных биомолекул. Кроме того, при введении агрегатов не нужно использовать протеолитические ферменты, необходимые для снятия клеток перед инъекционным введением.
В заключение стоит отметить, что на сегодняшний день имеются данные о ряде доклинических исследований, показавших ослабление прогрессирования ожоговой раны после местного введения аллогенных МСК. Таким образом, локально введенные клетки могут улучшить динамику заживления ран. Продемонстрированные защитные и трофические эффекты введенных МСК позволяют предположить, что клетки способны улучшить исход острых термических повреждений и снизить потребность в аутотрансплантации кожи в клинических условиях [26]. Что касается обморожений, данных о проведенных исследованиях на животных нет. Но значительное количество публикаций, связанных с применением мезенхимальных клеток в терапии ишемически-реперфузионных травм различных органов [27], [28], позволяет предположить эффективность БМКП на основе МСК и для лечения обморожений.
В этой статье мы целенаправленно рассматриваем несколько биотехнологических подходов улучшения регенеративных свойств клеток неразрывно с дальнейшим применением разрабатываемой клеточной терапии. По неопубликованным данным автора и ее коллег, культивирование в условиях гипоксии и получение клеточных 3D-структур позволяет увеличить секрецию факторов роста, что является ключевой характеристикой регенеративных свойств терапии ожогов и обморожений с использованием МСК. Существуют и другие методики, например, генетическая модификация или включение клеток в полимерные биоматериалы. Об этих перспективных методах в этом материале мы не рассказали, но, возможно, сделаем это в будущем.
Впереди много неразрешенных вопросов, еще больше исследований, но одно мы знаем точно. Терапия ожогов и обморожений оценивается по значительному количеству параметров, начиная с восстановления физиологической активности тканей и заканчивая косметическими результатами. Поэтому использование биомедицинского клеточного продукта на основе мезенхимальных стволовых клеток может стать большим шагом в направлении создания новых подходов к лечению ожогов и обморожений.
Благодарности
Автор благодарит своего научного руководителя, к.б.н. Михаила Олеговича Дурыманова и коллег за помощь в подготовке статьи.
Работа выполняется при финансовой поддержке Министерства науки и высшего образования РФ в рамках соглашения о предоставлении субсидии № 14.575.21.0179 от 28 ноября 2018 г. Уникальный идентификатор проекта: RFMEFI57518Х0179.
Литература
- Alicia Fernández-Colino, Laura Iop, Mónica S. Ventura Ferreira, Petra Mela. (2019). Fibrosis in tissue engineering and regenerative medicine: treat or trigger?. Advanced Drug Delivery Reviews. 146, 17-36;
- Тканевая инженерия: мы живем в матрице;
- Biraja Dash, Zhenzhen Xu, Lawrence Lin, Andrew Koo, Sifon Ndon, et. al.. (2018). Stem Cells and Engineered Scaffolds for Regenerative Wound Healing. Bioengineering. 5, 23;
- Jayme A. Farina, Marina Junqueira Rosique, Rodrigo G. Rosique. (2013). Curbing Inflammation in Burn Patients. International Journal of Inflammation. 2013, 1-9;
- Amalia Cochran, Stephen E. Morris. (2018). Cold-Induced Injury. Total Burn Care. 403-407.e2;
- Theodore Kalogeris, Christopher P. Baines, Maike Krenz, Ronald J. Korthuis. (2012). Cell Biology of Ischemia/Reperfusion Injury. International Review of Cell and Molecular Biology Volume 298. 229-317;
- Alizan A. Khalil, Farah A. Aziz, John C. Hall. (2006). Reperfusion Injury. Plastic and Reconstructive Surgery. 117, 1024-1033;
- Активный кислород: друг или враг, или О пользе и вреде антиоксидантов;
- Fernando E Figueroa, Flavio Carrión, Sandra Villanueva, Maroun Khoury. (2012). Mesenchymal Stem Cell treatment for autoimmune diseases: a critical review. Biol. Res.. 45, 269-277;
- Fu, Liu, Halim, Ju, Luo, Song. (2019). Mesenchymal Stem Cell Migration and Tissue Repair. Cells. 8, 784;
- Yan Peng, Min Xuan, Jiping Zou, Hongwei Liu, Ziyuan Zhuo, et. al.. (2015). Freeze-Dried Rat Bone Marrow Mesenchymal Stem Cell Paracrine Factors: A Simplified Novel Material for Skin Wound Therapy. Tissue Engineering Part A. 21, 1036-1046;
- O. V. Payushina, N. N. Butorina, O. N. Sheveleva, E. I. Domaratskaya. (2018). Effect of Mesenchymal Stromal Cells and Conditioned Media on Healing of Skin Wound. Bull Exp Biol Med. 165, 572-575;
- Maria Ester Bernardo, Willem E. Fibbe. (2015). Mesenchymal stromal cells and hematopoietic stem cell transplantation. Immunology Letters. 168, 215-221;
- Dobroslav Kyurkchiev. (2014). Secretion of immunoregulatory cytokines by mesenchymal stem cells. WJSC. 6, 552;
- Ji Sun Park, Smruthi Suryaprakash, Yeh-Hsing Lao, Kam W. Leong. (2015). Engineering mesenchymal stem cells for regenerative medicine and drug delivery. Methods. 84, 3-16;
- Ana Patricia Ayala-Cuellar, Ji-Houn Kang, Eui-Bae Jeung, Kyung-Chul Choi. (2019). Roles of Mesenchymal Stem Cells in Tissue Regeneration and Immunomodulation. Biomolecules & Therapeutics. 27, 25-33;
- Liangpeng Li, Xiongwen Chen, Wei Eric Wang, Chunyu Zeng. (2016). How to Improve the Survival of Transplanted Mesenchymal Stem Cell in Ischemic Heart?. Stem Cells International. 2016, 1-14;
- Гипоксия, негипоксическая гипоксия и иммунитет;
- Куликов В.А. и Беляева Л.Е. (2014). Сигнальные каскады, онкогены, гены-онкосупрессоры и метаболизм раковой клетки. «Вестник Витебского государственного медицинского университета». 13, 6–15;
- Dum spiro, spero. Нобелевская премия за регуляцию дыхания (2019);
- Zoe Cesarz, Kenichi Tamama. (2016). Spheroid Culture of Mesenchymal Stem Cells. Stem Cells International. 2016, 1-11;
- Chun-Hung Chen, Yen Chang, Chung-Chi Wang, Chih-Hao Huang, Chieh-Cheng Huang, et. al.. (2007). Construction and characterization of fragmented mesenchymal-stem-cell sheets for intramuscular injection. Biomaterials. 28, 4643-4651;
- Peng Guo, Jing-jing Zeng, Nuo Zhou. (2015). A novel experimental study on the fabrication and biological characteristics of canine bone marrow mesenchymal stem cells sheet using vitamin C. Scanning. 37, 42-48;
- Kyung-Min Choi, Young-Kwon Seo, Hee-Hoon Yoon, Kye-Yong Song, Soon-Yong Kwon, et. al.. (2008). Effect of ascorbic acid on bone marrow-derived mesenchymal stem cell proliferation and differentiation. Journal of Bioscience and Bioengineering. 105, 586-594;
- Peng Guo, Jing-jing Zeng, Nuo Zhou. (2015). A novel experimental study on the fabrication and biological characteristics of canine bone marrow mesenchymal stem cells sheet using vitamin C. Scanning. 37, 42-48;
- Filip Rangatchew, Peter Vester-Glowinski, Bo Sonnich Rasmussen, Eva Haastrup, Lea Munthe-Fog, et. al.. (2020). Mesenchymal stem cell therapy of acute thermal burns: A systematic review of the effect on inflammation and wound healing. Burns;
- Pascal Rowart, Pauline Erpicum, Olivier Detry, Laurent Weekers, Céline Grégoire, et. al.. (2015). Mesenchymal Stromal Cell Therapy in Ischemia/Reperfusion Injury. Journal of Immunology Research. 2015, 1-8;
- Mark F. Pittenger, Bradley J. Martin. (2004). Mesenchymal Stem Cells and Their Potential as Cardiac Therapeutics. Circulation Research. 95, 9-20;
- Yu Han, Xuezhou Li, Yanbo Zhang, Yuping Han, Fei Chang, Jianxun Ding. (2019). Mesenchymal Stem Cells for Regenerative Medicine. Cells. 8, 886.