
Тканевая инженерия: мы живем в матрице
02 ноября 2013
Тканевая инженерия: мы живем в матрице
- 2398
- 0
- 4
Сердечный клапан, полученный методами тканевой инженерии
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Тканевая инженерия — активно развивающаяся область науки и медицины, в задачи которой входит создание конструкций для восстановления поврежденных, утраченных и даже отсутствующих с рождения тканей/органов человека. В данной статье в популярной форме (в виде отсылки к научно-фантастическому произведению) описано, как создается биологически активный имплантат, составляющий основу тканевой инженерии.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Регенерация
Разрезанный пополам дождевой червь продолжает существовать и дальше в двух экземплярах (хотя и есть сведения, что полноценная особь получится только из передней половины); для тритона не представляет сложности отрастить новую лапу или даже глаз, не говоря уж о хвосте; ящерице приходится ограничиваться хвостом, в то время как регенеративный потенциал млекопитающих, включая человека, исчезающе мал. На нашу долю осталась регенерация кожи (но при обширных повреждениях остаются рубцы), срастание костей и восстановление тканей печени; однако два последних случая требуют специального лечения, как, впрочем, зачастую и в случае обширного повреждения кожи, — например, при ожоге.
Существует множество экспериментальных работ и обзорных статей по теме восстановления поврежденных и утраченных тканей и даже органов. Возможно даже устранить врожденные дефекты. Или сделать человека красивее.
Так полагали фантасты
В начале прошлого века фантасты (С. Лем, А. Беляев) много писали как о возможности почти полностью восстановить организм человека, так и придать ему новые функции, — например, способность жить под водой или видеть электрические токи. Увы, описанная в романе «Человек-амфибия» операция по ксенотрансплантологии (пересадка органов и тканей от других биологических видов) оказалась невозможна не по причине несовершенной хирургической техники, а из-за антигенной несовместимости, преодолеть которую возможно только с помощью сильных иммуносупрессантов.
А вообще говоря, зачем искать пути преодоления отторжения чужеродных тканей, когда можно создать свои собственные? Именно этим и занимается тканевая инженерия.
Биологически активный имплантат
Типичный биоактивный имплантат, лежащий в основе тканевой инженерии, состоит из клеток (часто стволовых), полимерной матрицы, поддерживающей их пролиферацию и дифференциацию, а также формирующую в целом очертания восстанавливаемой ткани (органа), и различных составляющих, например, белков и пептидов, которые способствуют созданию максимально благоприятной среды для клеток восстанавливаемой ткани (рис. 1) [1].

Рисунок 1. Состав биологически активного имплантата
Как получают такой имплантат? Поставим себя на место доктора Сальватора (А. Беляев, «Человек-амфибия»). От сложных ксенотрансплантатов придется отказаться, потому что поддержание их деятельности в организме требует постоянного приема дорогостоящих лекарств, которые его не слишком обеспеченным пациентам недоступны. Применение донорских тканей связано с рядом этических проблем и той же антигенной несовместимостью, хотя и в меньшей степени.
А не взять ли собственные ткани пациента? Известно, что в организме человека имеется пул стволовых клеток, — например, в костном мозге или жировой ткани. С возрастом их количество падает, но в крайнем случае можно использовать донорские. Следует помнить, что в организме взрослого человека нет тотипотентных стволовых клеток (тотипотентность у высших позвоночных — прерогатива зиготы и клеток раннего эмбриона), которые могут дифференцироваться в любом направлении и даже сформировать целый организм [1–3]. Поэтому придется выбирать те, которые могут «превратиться» в клетки искомой ткани. Например, мезенхимальные стволовые клетки дают начало гладкомышечной, соединительной ткани или тканям сосудов [4].
Бесклеточная матрица
Предположим, для каждой ткани уже разработан свой набор соединений, в том числе ростовых факторов, которые позволят стволовым клеткам дифференцироваться в нужном направлении. Но как быть с формой вводимой в организм конструкции? Наивно полагать, что клетки сами поймут, куда им становиться и в каком направлении дифференцироваться. Придется посадить их на матрицу. Для этой цели все же можно использовать межклеточную матрицу какого-нибудь органа животного, — например, свиньи. Однако в этом случае нужно будет тщательно удалить из этого органа все собственные клетки, чтобы осталась только бесклеточная матрица, — иначе иммунная система опознает конструкцию как чужую и «благополучно» ее отторгнет [6]. Затем нужно «заселить» матрицу стволовыми клетками, поместить в питательную среду и ждать, когда вырастет, например, сердце* (рис. 2). Готово! Можно приступать к операции по пересадке.
Если с пересадкой «инженерного» сердца до сих пор могут быть различные непредсказуемые ситуации, «выращивание» и использование в хирургии искусственных кровеносных сосудов постепенно становится рутиной: «Кровеносные сосуды XXI века» [5]. — Ред.
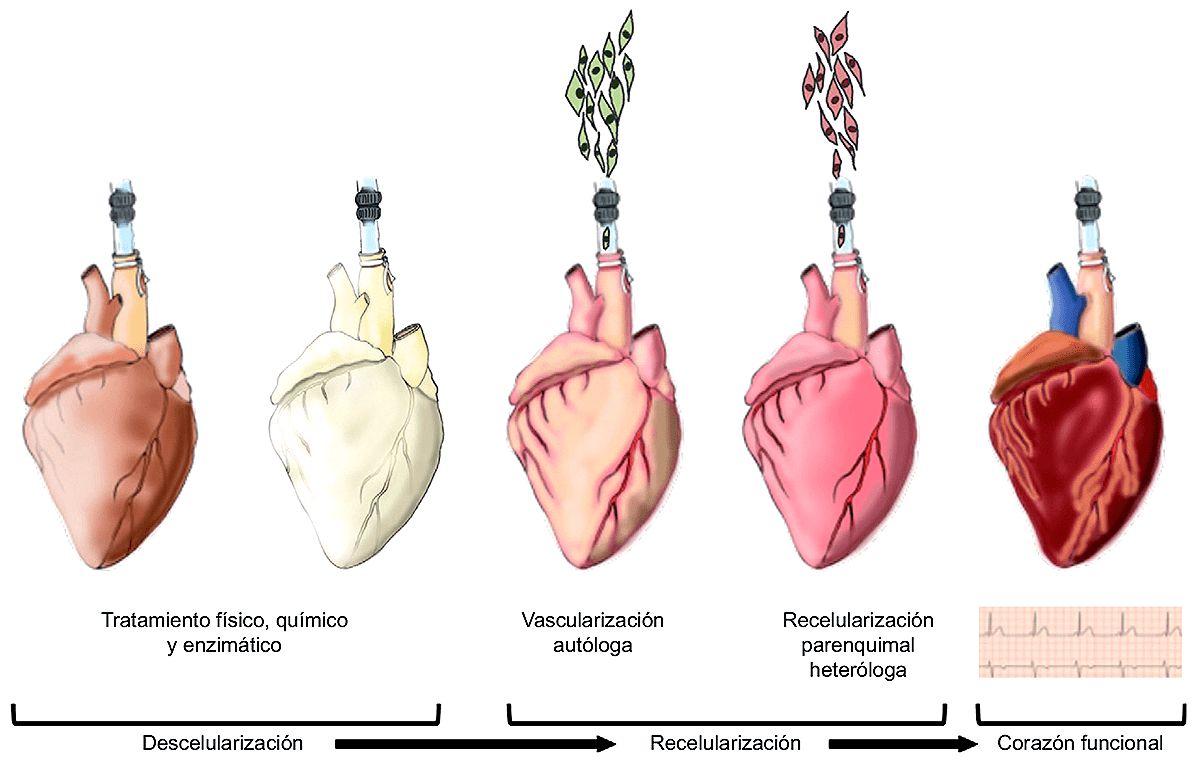
Рисунок 2. Формирование сердца de novo на основе бесклеточной матрицы
В коллаборации с коллегами
Подбираем матрицу
Посмотрим, что имеется в лаборатории у коллег-химиков. Например, здесь занимаются металлами. Авторы некоторых фантастических произведений наделяют своих героев металлическим скелетом, причем не обязательно наружным. Кто-то из фантастов предложил делать кости более прочными с помощью металлических нитей. Лучше бы предложил способ ускоренной регенерации! Металлический или металлизированный скелет приведет к существенному возрастанию веса тела за счет веса костей. Кроме того, металл не должен вступать в химические реакции с окружающими тканями (быть химически инертным). Можно попробовать титановые сплавы, однако они плотнее и тяжелее кости, из-за чего контактирующая с ними костная ткань начинает разрушаться. (Поэтому металлические имплантаты используют главным образом как скобы или штифты в зубах.)
Идеальный вариант — это постепенное замещение имплантата собственными тканями пациента. Попробуем взять производные гидроксиапатитов [8], — например, сополимер наногидроксиапатита, коллагена и поли-L-лактата, керамические материалы и т.д. [9]. Из них получают заготовку по форме кости. Главное, чтобы отсутствовали иммунные реакции и поддерживался рост клеток. Для восстановления мягких тканей (например, кожи) возьмем что-то эластичное, но прочное. Можно взять, например, полимеры на основе поливинилового спирта (что-то подобное продают в отделе канцелярских товаров) в качестве прочной механической основы — шелк, хирургические нитки из кетгута [10]. Конечно, поливиниловый спирт не идеален. В зависимости от состава его сополимеров он может либо вовсе не распадаться в организме, либо выделять в окружающую микросреду чужеродные соединения.
А вот в колбе густая мутноватая субстанция, напоминающая клей. Это коллаген — белок межклеточного матрикса (собственно, по-гречески это и означает «клей»). Кажется, эта партия выделена из сухожилий хвостов крыс. Однако этот белок высококонсервативен и почти не отличается от такового у человека. Предположим, что крысы выращивались в стерильных условиях и не контактировали с вирусами и прочими болезнетворными микроорганизмами. Со временем коллаген имплантата заместится собственным коллагеном пациента.
Врачебная этика требует говорить пациенту правду, поэтому есть вероятность, что одно только упоминание о крысах вызовет брезгливую гримасу и отказ от лечения. Но это не единственная сложность: коллаген может «развалиться» до того, как будет замещен на собственный. Значит, его нужно стабилизировать. На столе у гистолога стоят емкости с глутаровым альдегидом и карбодиимидом. Они образуют поперечные сшивки между отдельными молекулами коллагена и тем самым замедляют разрушение конструкции коллагеназами. Да вот незадача: оба эти соединения очень ядовиты и при расщеплении коллагеновых фибрилл коллагеназами неизбежно попадут в кровь. Можно одолжить у коллеги-ботаника немного природных полифенолов — например, кверцетина и дигидрокверцетина. Эти соединения выделяют из различных частей растений, вплоть до древесины; они менее токсичны и тоже образуют поперечные сшивки молекул белка, а кроме того, являются антиоксидантами, противостоящими окислительному стрессу, повреждающему клеточную мембрану, митохондрии, белки и ДНК. Ведь если клетка не справятся с окислительным стрессом — это верная гибель!
Впрочем, лучшее — враг хорошего. Итак, мы выбрали материалы. Теперь подумаем о форме и внутренней структуре. Это может быть пленка, если речь идет о коже, но лучше остановиться на пористой матрице, которую можно заселить клетками, собрав трехмерную конструкцию [1].
А вот клетки заселяться не хотят. Может быть, поверхность слишком гладкая? Или их не устраивает заряд или соотношение гидрофильных и гидрофобных групп на поверхности? Варьируем состав компонентов, затем отправляемся к коллеге-физику из лаборатории материалов и просим сделать несколько вариантов поверхности с разной шероховатостью.
Включаем в матрицу все необходимое
Ура! К некоторым матрицам клетки успешно приклеились (адгезировали). Но как-то вяло и почти не делятся — видимо, им чего-то не хватает. А не хватает им, например, пептида RGD, который опознается рецепторами клеток как сигнал к прикреплению. На всякий случай вводим в матрицу другие белки и пептиды, — например, фибриноген. Каким образом? Их можно включить непосредственно в толщу матрицы на стадии ее получения, а можно прикрепить к поверхности. Белок может самопроизвольно связаться с матрицей, адсорбируясь на ней из раствора, в том числе за счет электростатических взаимодействий, но иногда (в особенности для коротких пептидов) лучше использовать ковалентное «пришивание» (рис. 3). Самое главное, чтобы белок минимально изменил свою структуру, а функциональный конец пептида не оказался пришитым.
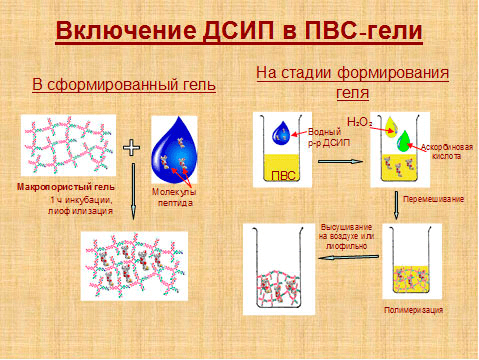
Рисунок 3. Включение пептидов (на примере дельта-сон-индуцирующего пептида, ДСИП) в матрицу на основе поливинилового спирта (ПВС)
Итак, клетки благополучно адгезировали к матрице и делятся. А что, если немного ускорить их деление? Инъекция ростовых факторов? Где гарантия, что все они попадут по назначению и не приведут к избыточному росту других тканей? Может быть, включить их непосредственно в матрицу?
Любая ткань состоит из нескольких типов клеток. Распределяем ростовые факторы по матрице и получаем нужное расположение клеток в ткани. Вот здесь эпителиальные, здесь мышечные, здесь пройдут кровеносные сосуды и нервы. Добавим немного нейропротекторов, потому что иннервация имплантата — очень важная задача.
Впрочем, что мелочиться? Мы ввели в матрицы компоненты, нужные для формирования имплантата. Может быть, использовать этот объем еще и как депо лекарственных препаратов? Добавим аскорбиновую кислоту в качестве антиоксиданта (ох уж этот окислительный стресс!), антибиотики (сколько веков хирургия стояла на месте из-за зловредности микроорганизмов!), и пусть они свободно диффундируют из толщи матрицы или с ее поверхности, формируя максимально благоприятные условия для роста клеток (рис. 4).

Рисунок 4. Выход биологически активных веществ из матриц (в данном случае, сферических частиц)
Главное, чтобы скорость их выделения в организм была именно той, какая необходима. Таким образом, препарат действует именно по месту назначения, не нанося вреда другим системам (прежде всего, печени и почкам). Однако материал матрицы может не поддерживать такой функции как контролируемая скорость выхода молекул, быть чересчур гидрофильным или гидрофобным, слишком рыхлым или плотным. Не страшно. Что мешает нам включить лекарственные препараты в микро- и наночастицы, отвечающие нужным требованиям? Чаще всего для этой цели используется сополимер гликолевой и молочной кислот (PLGA — Plylactide-Co-Glycolide), при распаде которого образуются вполне усваиваемые организмом компоненты [11]. Конечно, есть сведения, что вокруг вышеупомянутых частиц отмечается небольшое подкисление тканевой жидкости, но это «терпимо», да и для чего мы добавляли аскорбиновую кислоту? Включаем эти частицы в матрицу, сеем клетки, помещаем в питательную среду и ждем.
Со временем, уже в организме пациента, матрица частично или полностью заместится его собственными тканями. Увы, придать сверхспособности пока не получается. Неземную красоту можно, но за этим — к другому специалисту.
От автора
Разумеется, в реальной жизни не все так просто. В статье опущены этапы экспериментов на лабораторных животных и добровольцах, вопросы безопасности использования стволовых клеток, склонных к неуправляемой, в том числе онкогенной, дифференциации. Вместе с этим остаются многочисленные этические проблемы, в том числе проблема «черной трансплантологии», и, что бывает чаще, смерти пациентов в очереди за донорскими органами. Остается надеяться, что научно-технический прогресс... Впрочем, каждый закончит эту фразу по-своему.
Литература
- Тканевая инженерия — окно в современную медицину;
- Была клетка простая, стала стволовая;
- Murnaghan I. (2019). Totipotent stem cells. Explore Stem Cells;
- Лозовская Е. (2005). Стволовые клетки про запас. «Наука и жизнь». 2;
- Кровеносные сосуды XXI века;
- R L Knight, H E Wilcox, S A Korossis, J Fisher, E Ingham. (2008). The use of acellular matrices for the tissue engineering of cardiac valves. Proc Inst Mech Eng H. 222, 129-143;
- Carolina Gálvez-Montón, Cristina Prat-Vidal, Santiago Roura, Carolina Soler-Botija, Antoni Bayes-Genis. (2013). Ingeniería tisular cardiaca y corazón bioartificial. Revista Española de Cardiología. 66, 391-399;
- Гидроксилапатит — самый главный из фосфатов кальция;
- Jingfeng Li, Jijun Hong, Qixin Zheng, Xiaodong Guo, Shenghui Lan, et. al.. (2011). Repair of rat cranial bone defects with nHAC/PLLA and BMP-2-related peptide or rhBMP-2. J. Orthop. Res.. 29, 1745-1752;
- J.Y. Tan, C.K. Chua, K.F. Leong, K.S. Chian, W.S. Leong, L.P. Tan. (2012). Esophageal tissue engineering: An in-depth review on scaffold design. Biotechnol. Bioeng.. 109, 1-15;
- J. Liu, S. M. Zhang, P. P. Chen, L. Cheng, W. Zhou, et. al.. (2007). Controlled release of insulin from PLGA nanoparticles embedded within PVA hydrogels. J Mater Sci: Mater Med. 18, 2205-2210.






