
Dum spiro, spero. Нобелевская премия за регуляцию дыхания (2019)
08 октября 2019
Dum spiro, spero. Нобелевская премия за регуляцию дыхания (2019)
- 2254
- 0
- 7
-
Автор
-
Редакторы
Утром 7 октября были объявлены лауреаты Нобелевской премии по физиологии или медицине 2019 года. Ими оказались Уильям Келин, Питер Рэтклифф и Грэгг Семенза, награжденные за «открытие того, как клетки ощущают кислород и адаптируются к изменению его доступности».
Жизнь — очень энергозатратный процесс. Особенно когда организму приходится поддерживать не только свою сложную организацию, но и постоянную температуру, а иногда и способность к активному движению и — представьте себе — разумному поведению. Наши познания в эволюции жизни показывают, что вся эта фантастически энергозатратная деятельность, обеспечивающая существование многоклеточных животных с высоким уровнем активности, возможна только за счет высокоэффективного метаболизма, связанного с полным окислением органических веществ с помощью кислорода. Поэтому нехватка O2 (гипоксия) становится серьезным вызовом, требующим значительных изменений обмена веществ и целого каскада реакций как на уровне клетки, так и на уровне всего организма и его отдельных систем. Подобную нехватку переживают клетки мышц человека при физической нагрузке, раковые клетки опухоли во время ее безудержного роста или весь организм — при подъеме в высокогорье или во время внутриутробного развития. Не удивительно, что каскады, обеспечивающие адаптацию к гипоксии, оказались встроены в число самых фундаментальных и базовых регуляторных путей клетки. Именно поэтому их открытие оказалось в центре внимания Нобелевского комитета и нашего обсуждения. Но — обо всем по порядку.
Вообще, нобелевская история изучения процессов дыхания и их регуляции довольно насыщенна. В 1931 году премию по физиологии или медицине присудили Отто Варбургу за открытие цитохромоксидазы — одного из центральных звеньев дыхательной цепи мембраны митохондрий. Спустя всего семь лет, в 1938 году, лауреатом премии стал бельгийский физиолог Корней Хейманс, открывший роль каротидных тел в регуляции дыхания.
В адаптации нашего организма к гипоксии принимают участие множество механизмов. Самый верхний из них — физиологическая реакция увеличения интенсивности дыхательных движений при гипоксии. За этот быстрый, рефлекторный ответ на гипоксию отвечают хеморецепторы, локализованные в уже упомянутых каротидных телах и в среднем мозге. При длительном воздействии гипоксии, например, при долгих физических тренировках у бегунов-марафонцев или при акклиматизации у альпинистов в условиях высокогорья, происходит увеличение содержания эритроцитов в крови. Делением и дифференцировкой предшественников-эритробластов в зрелые эритроциты управляет белковый гормон эритропоэтин. Ген этого центрального физиологического регулятора эритропоэза был клонирован и охарактеризован в 1985 году [1]. Сегодня рекомбинантный эритропоэтин используется для лечения самых разных анемий, однако истинную славу ему принесла роль одного из самых распространенных и универсальных допинг-препаратов.
То есть интенсивностью эритропоэза управляет эритропоэтин, но что определяет интенсивность его экспрессии? Тут мы и подбираемся к первому виновнику свеженькой Нобелевской премии — профессору Школы медицины при Университете Джонса Хопкинса Грэггу Семензе. Работая с клетками печени и почек, ему удалось показать, что в условиях гипоксии экспрессия эритропоэтина в них индуцируется благодаря одному и тому же транскрипционному фактору, связывающемуся с энхансером гена эритропоэтина (рис. 1) [2]. Вскоре структура этого фактора была установлена, а сам он был назван HIF-1α (сокр. от hypoxia-inducible factor 1). Строго говоря, активатором оказался гетеродимер из целых двух транскрипционных факторов: HIF-1α (или просто HIF-1) и HIF-1β (более известного как ARNT). Именно в виде двойного комплекса HIF-1α/ARNT способен к переносу в ядро и связыванию c ДНК-последовательностью-энхансером [3].
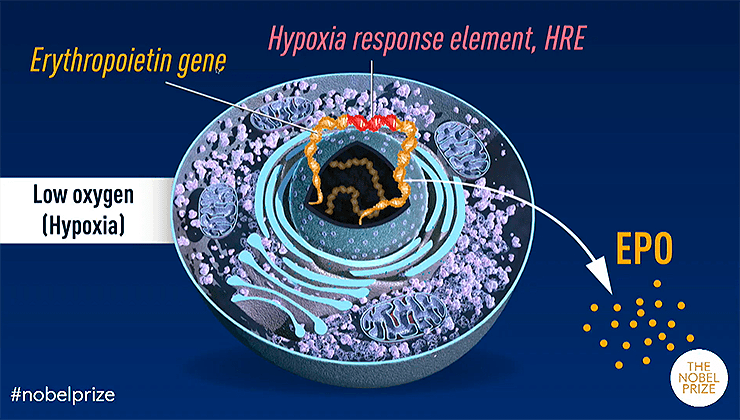
Рисунок 1. Экспрессия гена эритропоэтина (EPO) регулируется фактором HIF-1α, который связывается с энхансером (HRE)
Одновременно регуляцией активности гена эритропоэтина занимался [4] и другой герой сегодняшнего рассказа — нынешний профессор Оксфорда, англичанин Питер Рэтклифф. К середине 1990-х работы научных групп, возглавляемых обоими нашими героями, показали, что HIF-1α является не просто активатором экспрессии эритропоэтина в отдельных клетках почек, а одним из важнейших транскрипционных факторов, управляющим множеством метаболических процессов во всех клетках тела [5], [6]. Более того, на рубеже 2000-х были опубликованы работы, продемонстрировавшие вовлечение HIF-1α в регуляцию пролиферации раковых клеток [7], ангиогенез, апоптоз и еще ряд других клинически значимых процессов [8]. Стало очевидно, что открытый не так давно белок уверенно входит в компанию пары дюжин ключевых для жизнедеятельности клетки транскрипционных факторов.
И тут, наконец, мы подходим к третьему герою нашего сегодняшнего рассказа — профессору Гарвардского университета Уильяму Келину. На рубеже веков основным направлением работы Келина было изучение болезни Гиппеля—Линдау. Это довольно редкое наследственное аутосомно-доминантное заболевание проявляется в предрасположенности пациента к целому набору различных сильно васкуляризированных опухолей, вырабатывающих большое количества фактора роста эндотелия сосудов. К тому моменту уже был идентифицирован белок [9], мутация в котором приводит к болезни Гиппеля—Линдау. Сегодня он известен как опухолевый супрессор VHL, или pVHL (сокр. от von Hippel—Lindau disease). Индуцировав синтез нормального pVHL в клетках карциномы почки, несущих мутантный ген VHL, исследователям из группы Келина еще в середине 90-х удалось добиться снижения производства целого ряда белков гипоксического ответа — VEGF, глюкозного транспортера GLUT1 и тромбоцитарного фактора роста PDGFβ [10]. Спустя несколько лет, уже знакомая нам оксфордская группа Рэтклиффа показала, что белок pVHL каким-то образом дестабилизирует транскрипционный фактор HIF-1, отправляя его на протеасомную деградацию [11]. Однако сам характер взаимодействия двух белков всё еще оставался неуловим. Удалось выяснить лишь то, что это взаимодействие каким-то образом зависит от присутствия достаточных количеств кислорода.
Кажется, что все элементы мозаики регуляторного каскада уже легли на стол перед учеными. Оставалось только собрать их в нужном порядке. Эту задачу выполнила опубликованная в 2001 году в Science работа гарвардской группы Уильяма Келина и его соавторов [12]. Оказалось, что pVHL является частью комплекса убиквитинлигазы E3, навешивающей на белки убиквитин и отправляющей их в клеточную машину разрушения — протеасому [13–15]. При этом сам pVHL выполняет роль своеобразного умного адаптера, заставляя убиквитинлигазу садится на HIF-1 и приговаривать его к смерти, но только тогда, когда на его поверхности появляется подходящая «посадочная площадка». А появляется эта посадочная площадка только под действием кислорода благодаря ферменту пролилгидроксилазе (а точнее — Fe(II)-/2-оксоглутаратзависимой HIF-пролилгидроксилазе [16]), гидроксилирующей ряд аминокислотных остатков на поверхности HIF-1 под действием кислорода. Этот фермент и является кислородным сенсором, отправляющим HIF-1 на деградацию в оксигенных условиях и прекращающим свое действие (и сохраняющим тем самым HIF-1) в условиях гипоксии (рис. 2). (Подробнее о гипоксии и кислород-чувствительных системах эукариот вы можете прочитать в обзоре «Гипоксия, негипоксическая гипоксия и иммунитет» [17].)
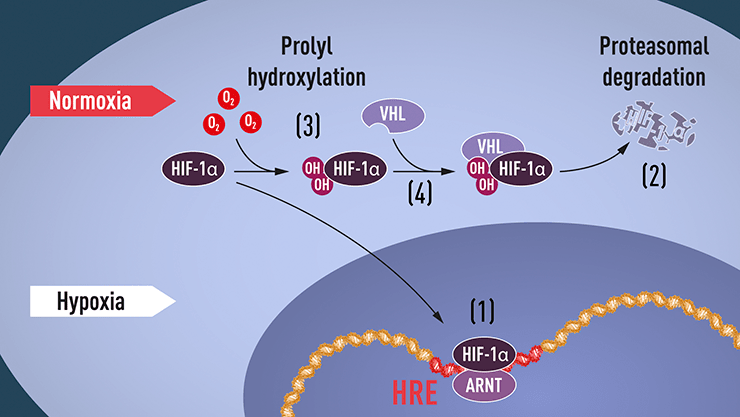
Рисунок 2. При низком уровне кислорода транскрипционный фактор HIF-1α защищен от деградации и накапливается в ядре, где он в составе гетеродимера с ARNT связывается с энхансерной последовательностью HRE, активируя ряд генов (в том числе ген эритропоэтина) (1). При нормальном уровне кислорода HIF-1α быстро разрушается в протеасоме (2). Этот процесс обусловлен тем, что в присутствии кислорода HIF-1α гидроксилируется пролилгидроксилазой (3), что позволяет белку VHL связаться с ним, обеспечив его убиквитинирование убиквитинлигазой E3 и последующее расщепление в протеасоме (4).
Позднейшие исследования показали, что открытый героями нашего рассказа механизм кислородной рецепции является довольно древним эволюционным приобретением; он консервативен для всех многоклеточных животных [18]. По-видимому, именно эта эволюционная древность сделала HIF-1 важным компонентов сразу нескольких регуляторных каскадов, поставив его буквально на перекресток гипоксии, воспаления и онкогенеза [19]. По современным данным, транскрипционный фактор HIF-1 управляет экспрессией более чем 300 различных генов (рис. 3). Сейчас HIF-1 рассматривается в качестве перспективной мишени противораковых препаратов [20]. По-видимому, именно это одновременно фундаментальное и потенциально прикладное значение открытия заставило Нобелевский комитет сделать свой выбор в пользу трио Келина, Рэтклиффа и Семензы.
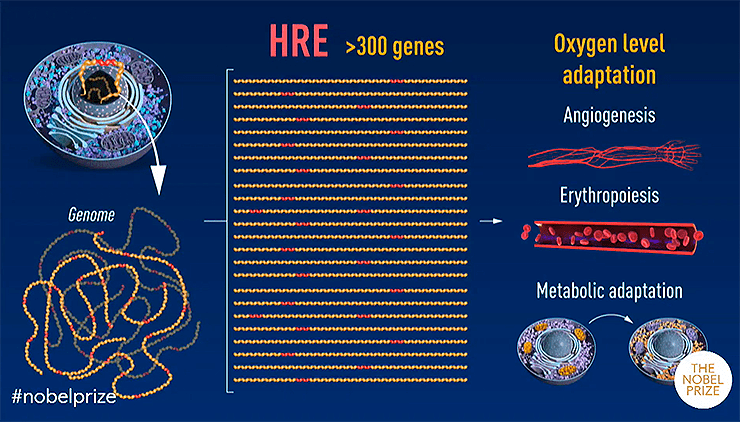
Рисунок 3. Транскрипционный фактор HIF-1 управляет экспрессией более чем 300 различных генов
Чтобы лучше разобраться в значении работ, удостоившихся столь высокой оценки, мы попросили прокомментировать этот вопрос Всеволода Белоусова — заведующего Отделом метаболизма и редокс-биологии ИБХ РАН. Всеволод дал «Биомолекуле» развернутый комментарий:
Значение регуляции HIF в биологии трудно переоценить. Во-первых, кислород является центральным условием существования аэробной жизни, а значит, от его доступности зависят практически все процессы в аэробных живых системах. Клетке очень важно чувствовать малейшие отклонения в уровне кислорода и быстро реагировать на них. Во-вторых, это открытие, несомненно, важно для медицины, поскольку ингибиторы HIF — потенциальные противораковые препараты, и в настоящее время ведется интенсивный поиск таких соединений. Нет практически ни одного аспекта онкогенеза, который не регулировался бы каскадом HIF, нет только хороших ингибиторов. В-третьих, HIF — это красивый пример того, как природа решила проблему быстрого ответа на гипоксию. Если бы ответ на гипоксию реализовывался “традиционным” образом, были бы белки-сенсоры на кислород, они бы при гипоксии связывались с промотором HIF, запускали бы экспрессию этого гена, уровень HIF постепенно возрастал бы, что приводило бы к активации таргетных HIF-зависимых генов. Просто, но долго. Но клетке важно очень быстро реагировать на гипоксию. Поэтому она постоянно синтезирует HIF, который тут же гидроксилируется и деградирует в протеасоме. При гипоксии его экспрессию не нужно активировать, она и так активна, HIF просто перестает гидроксилироваться и деградировать, мгновенно накапливается, идет в ядро и запускает свои таргетные гены.
Возможно, выбор Нобелевского комитета оставил кого-то в удивлении. Ведь пока не удостоились премии ни создатели нашумевшей системы CRISPR-Cas9 [21], ни отцы современных NGS-технологий [22] и прочих методов, изменивших лицо современных наук о жизни. Действительно, открытия наших сегодняшних героев не привели к революции в методах исследования и пока что не совершили переворот в медицине, как это было с лауреатами прошлого года [23]. Однако нет ни малейшего сомнения, что их фундаментальная работа сделала прорыв в понимании регуляторных механизмов клетки, дав мощный толчок множеству дальнейших, в том числе и прикладных, исследований, плоды которых нам еще предстоит увидеть.
Литература
- F. K. Lin, S. Suggs, C. H. Lin, J. K. Browne, R. Smalling, et. al.. (1985). Cloning and expression of the human erythropoietin gene.. Proceedings of the National Academy of Sciences. 82, 7580-7584;
- G. L. Semenza, M. K. Nejfelt, S. M. Chi, S. E. Antonarakis. (1991). Hypoxia-inducible nuclear factors bind to an enhancer element located 3' to the human erythropoietin gene.. Proceedings of the National Academy of Sciences. 88, 5680-5684;
- G. L. Wang, B. H. Jiang, E. A. Rue, G. L. Semenza. (1995). Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension.. Proceedings of the National Academy of Sciences. 92, 5510-5514;
- Patrick H. Maxwell, Mark K. Osmond, Christopher W. Pugh, Andrew Heryet, Lynn G. Nicholls, et. al.. (1993). Identification of the renal erythropoietin-producing cells using transgenic mice. Kidney International. 44, 1149-1162;
- John D. Firth, Benjamin L. Ebert, Peter J. Ratcliffe. (1995). Hypoxic Regulation of Lactate Dehydrogenase A. J. Biol. Chem.. 270, 21021-21027;
- Charles M. Wiener, Greg Booth, Gregg L. Semenza. (1996). In VivoExpression of mRNAs Encoding Hypoxia-Inducible Factor 1. Biochemical and Biophysical Research Communications. 225, 485-488;
- Zhong H., De Marzo A.M., Laughner E., Lim M., Hilton D.A., Zagzag D. et al. (1999). Overexpression of hypoxia-inducible factor 1alpha in common human cancers and their metastases. Cancer Res. 59, 5830–5835;
- Semenza G.L. (2000). HIF-1 and human disease: one highly involved factor. Genes Dev. 14, 1983–1991;
- F Latif, K Tory, J Gnarra, M Yao, F. Duh, et. al.. (1993). Identification of the von Hippel-Lindau disease tumor suppressor gene. Science. 260, 1317-1320;
- O. Iliopoulos, A. P. Levy, C. Jiang, W. G. Kaelin, M. A. Goldberg. (1996). Negative regulation of hypoxia-inducible genes by the von Hippel-Lindau protein.. Proceedings of the National Academy of Sciences. 93, 10595-10599;
- Patrick H. Maxwell, Michael S. Wiesener, Gin-Wen Chang, Steven C. Clifford, Emma C. Vaux, et. al.. (1999). The tumour suppressor protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis. Nature. 399, 271-275;
- M. Ivan, K. Kondo, H. Yang, W. Kim, J. Valiando, et. al.. (2001). HIFalpha Targeted for VHL-Mediated Destruction by Proline Hydroxylation: Implications for O2 Sensing. Science. 292, 464-468;
- Вездесущий убиквитин;
- «Вездесущий убиквитин» возвращается;
- Как клетка убирает мусор;
- John S. Scotti, Ivanhoe K. H. Leung, Wei Ge, Michael A. Bentley, Jordi Paps, et. al.. (2014). Human oxygen sensing may have origins in prokaryotic elongation factor Tu prolyl-hydroxylation. Proc Natl Acad Sci USA. 111, 13331-13336;
- Гипоксия, негипоксическая гипоксия и иммунитет;
- William G. Kaelin, Peter J. Ratcliffe. (2008). Oxygen Sensing by Metazoans: The Central Role of the HIF Hydroxylase Pathway. Molecular Cell. 30, 393-402;
- Kuppusamy Balamurugan. (2016). HIF-1 at the crossroads of hypoxia, inflammation, and cancer. Int. J. Cancer. 138, 1058-1066;
- Georgina N. Masoud, Wei Li. (2015). HIF-1α pathway: role, regulation and intervention for cancer therapy. Acta Pharmaceutica Sinica B. 5, 378-389;
- Как CRISPR/Cas работает не по специальности;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- Иммунитет без тормозов: Нобелевская премия за антитела против рака (2018).






