От двигательных расстройств до шизофрении: тесная связь дофаминовых рецепторов и фосфодиэстераз
10 января 2024
От двигательных расстройств до шизофрении: тесная связь дофаминовых рецепторов и фосфодиэстераз
- 2016
- 0
- 15
Рисунок в полном размере.
иллюстрация сделана с помощью сайта fusionbrain.ai
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Дофамин играет большую роль в функциях центральной нервной системы: мы двигаемся, испытываем эмоции, познаем мир и делаем многое другое благодаря этому нейромедиатору. Нарушения дофаминовой нейропередачи — важный элемент патогенеза многих нейропсихических расстройств: болезни Паркинсона (БП), болезни Гентингтона (БГ), шизофрении, синдрома дефицита внимания с гиперактивностью, болезни лекарственной зависимости, обсессивно-компульсивного расстройства и других. Традиционные подходы к лечению этих нейропсихических нарушений предполагают прямое или непрямое воздействие на рецепторы к дофамину и другим нейромедиаторам, однако в настоящее время в психофармакологии активно развивается новое направление, в рамках которого лекарства оказывают влияние не на рецепторы, а на их внутриклеточные посредники передачи информации. В этой статье мы расскажем про поиск терапевтических мишеней на внутриклеточном уровне и о том, как воздействие на эти мишени способно помочь в лечении целого ряда нейропсихических расстройств.
Конкурс «Био/Мол/Текст»-2023/2024
 Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2023/2024 и заслужила спецприз «Огненный дебют».
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2023/2024 и заслужила спецприз «Огненный дебют».

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.
Партнер номинации — компания «Хеликон».

«Книжный» спонсор конкурса — «Альпина нон-фикшн».
От намерения к движению: два пути через базальные ганглии
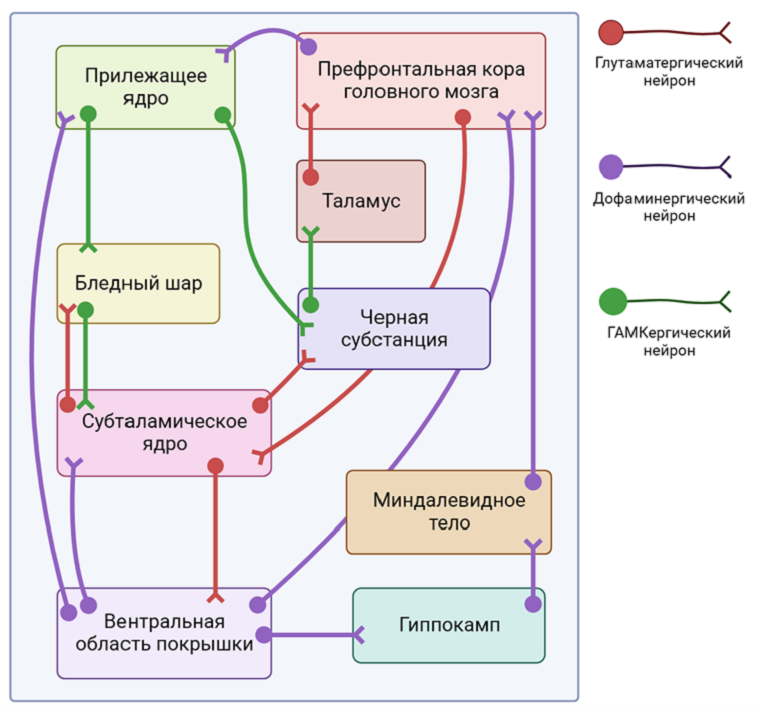
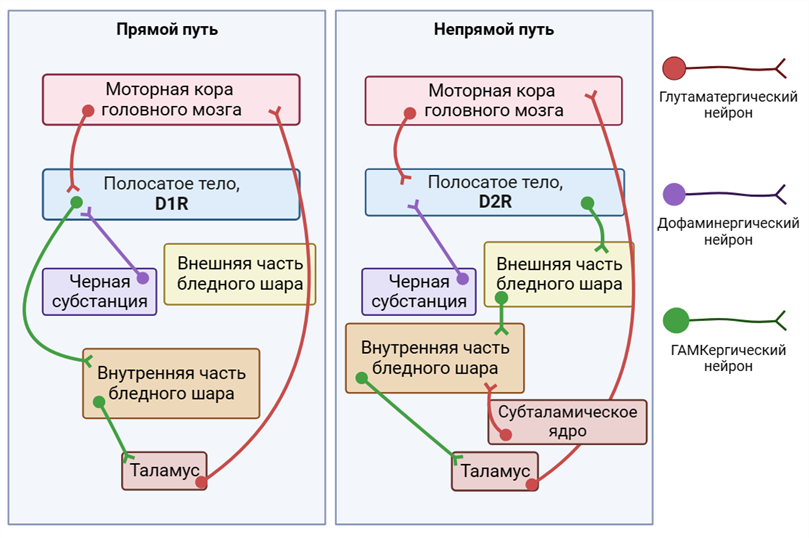
В основе механизмов высшей нервной деятельности (ВНД) лежит чрезвычайно сложное и не до конца изученное взаимодействие между структурами коры больших полушарий, базальными ядрами (полосатое тело, миндалевидное тело, ограда, черная субстанция, субталамическое ядро, ножкомостовое ядро покрышки) и таламуса [1]. Одной из самых важных структур внутри этой системы является полосатое тело (стриатум): здесь, как и в коре, происходит пересечение глутамат- и дофаминергической нейропередач. Основные клетки стриатума — ГАМК-ергические среднеразмерные шипиковые нейроны (MSNs), которые составляют более 95% популяции нейронов этой структуры и получают сигналы как от глутаматергических нейронов коры, так и от дофаминергических нейронов нижележащих отделов мозга. Дофаминергическая нейропередача представлена мезолимбическим (рис. 1А) и нигростриарным (рис. 1Б) путями. Тела нейронов мезолимбического пути находятся в вентральной области покрышки, а их дофаминовые окончания — в прилежащем ядре перегородки вентральной части полосатого тела [2]; в случае же нигростриарного пути тела нейронов локализуются в черном веществе, а выделяющие дофамин окончания — в хвостатом ядре дорсальной части полосатого тела. Воздействие дофамина на MSNs различно в зависимости от типа дофаминовых рецепторов, поэтому данные нейроны делят на две популяции: одни экспрессируют D1-подобные (D1R) активирующие рецепторы, чье взаимодействие с дофамином приводит к активации аденилатциклазного сигнального пути, а другие — D2-подобные (D2R) — ингибирующие, взаимодействие которых с нейромедиатором, в свою очередь, сопровождается снижением активности того же самого внутриклеточного сигнального пути. Таким образом, в случае одних MSNs дофамин играет роль возбуждающего медиатора, а в случае других — ингибирующего.
В классическом представлении через D1R-MSNs проходит так называемый «прямой» путь. ГАМК-ергические окончания этих клеток ингибируют еще одну популяцию ГАМК-ергических нейронов, расположенных в бледном шаре и иннервирующих те или иные ядра таламуса. Через вторую популяцию MSNs проходит «непрямой» путь; его основное отличие от «прямого» в том, что, прежде чем попасть в таламус, он проходит не только через бледный шар, но и через другие структуры. Описанные выше пути значительно различаются и по своим функциям. Разницу в функциях «прямого» и «непрямого» пути удобнее всего проиллюстрировать на примере контроля движений, осуществляемого с вовлечением дорсального полосатого тела. Если максимально упростить, то «прямой» путь работает как педаль газа, соответственно, активация D1R-MSNs приводит к стимуляции движения. В то же время «непрямой» путь служит своеобразным ручным тормозом, предотвращающим нежелательные движения. Соответственно для того, чтобы совершить движение, нам нужно ослабить активность «непрямого» пути, что и происходит при воздействии дофамина на D2R. Между «прямым» и «непрямым» путями существует очень сложное динамическое взаимодействие. Например, считается, что оба пути должны работать слаженно для инициации движения. Нарушение баланса между «прямым» и «непрямым» путями является частью патогенеза двигательных расстройств. Так, при БП снижается выделение дофамина в дорсальном полосатом теле, т.е. снижается его действие как на «прямой», так и на «непрямой» путь, и из-за этого у пациентов появляются сложности в инициации движений и развивается характерный тремор в покое [3]. При этом, когда таких пациентов начинают лечить с помощью препаратов, повышающих уровень дофамина в полосатом теле, у них могут развиваться дискинезии, характерные непроизвольные движения, возникновение которых связано с неоптимальным функционированием «непрямого» пути. Интересно, что симптомы БП также могут возникнуть при применении препаратов, которые блокируют действие дофамина на D2R. Нежелательные явления такого рода довольно часто отмечаются при медикаментозном лечении шизофрении. Другим примером состояния, при котором вышеописанные пути работают несбалансированно, является БГ. При этом заболевании наблюдается гибель MSNs в полосатом теле, и у пациентов развивается хорея, которая характеризуется беспорядочными, отрывистыми, нерегулярными движениями [4]. Ранее в «Биомолекуле» были опубликованы статьи о БП [5], [6] и БГ [7].
Ветки «прямого» и «непрямого» пути, проходящие через вентральное полосатое тело, имеют не менее важное значение для процессов ВНД [8]. Это хорошо иллюстрируют заболевания, связанные с нарушениями функции этой части полосатого тела. Предполагают, что характерные психотические симптомы (бред, галлюцинации) возникают при повышении выброса дофамина в мезолимбическом пути. Это может быть связано с какой-то внутренней причиной; так происходит, например, у пациентов с шизофренией или манией, а может возникать из-за действия некоторых лекарств, увеличивающих уровень дофамина, например, используемых при лечении БП. Также с нарушением функции путей, проходящих через вентральное полосатое тело, связывают механизмы формирования такой трудно поддающейся лечению группы психических расстройств, как зависимости от употребления алкоголя, опиоидов, никотина и других психоактивных соединений. И тут снова можно вспомнить нежелательные эффекты, связанные с использованием противопаркинсонических препаратов: у некоторых пациентов может появиться синдром дофаминовой дизрегуляции, при котором развивается психическая зависимость от леводопы или других средств, повышающих уровень дофамина в центральной нервной системе (ЦНС). Дополнительно погрузиться в информацию о дофамине поможет статья, ранее опубликованая на «Биомолекуле» [9].
Внимательный читатель, наверное, уже заметил, что препараты для лечения психозов вызывают симптомы БП, и наоборот, прием противопаркинсонических лекарств может приводить к развитию психозов. Так возможен ли выход из этого тупика? Мы предполагаем, что да. Для этого нужно отойти от препаратов, которые влияют на уровень или действие дофамина на его рецепторы, и взглянуть вглубь: на процессы, происходящие внутри клеток.
Наш фаворит среди фосфодиэстераз: фосфодиэстераза 10А (PDE10A)
Уровень активности клеток зависит от многочисленных внутренних факторов, но одним из самых важных является уровень циклических нуклеотидов аденозинмонофосфата (cAMP) и гуанозинмонофосфата (cGMP), которые действуют как внутриклеточные вторичные мессенджеры. Есть большое семейство ферментов, непосредственно влияющих на уровень cAMP и cGMP и способных инактивировать циклические нуклеотиды путем гидролиза. Они называются фосфодиэстеразы (PDE) (рис. 2). В клетках млекопитающих насчитывается более 20 вариантов этих ферментов. Данные ферменты — очень перспективная мишень для лекарств, потому что разные типы клеток содержат разные варианты PDE. Поэтому можно, подобрав ингибитор, воздействующий строго на определенный вариант PDE, селективно воздействовать на конкретный орган или нужную группу клеток. В настоящее время в клиническую практику уже введено три группы ингибиторов PDE, к одной из которых принадлежит «маленькая голубая таблетка, изменившая мир» — силденафил (широко известная как Виагра®), ингибитор PDE5. Другие используемые в медицине ингибиторы блокируют PDE3 и PDE4, их применяют для лечения инфаркта миокарда и хронической обструктивной болезни легких, соответственно.
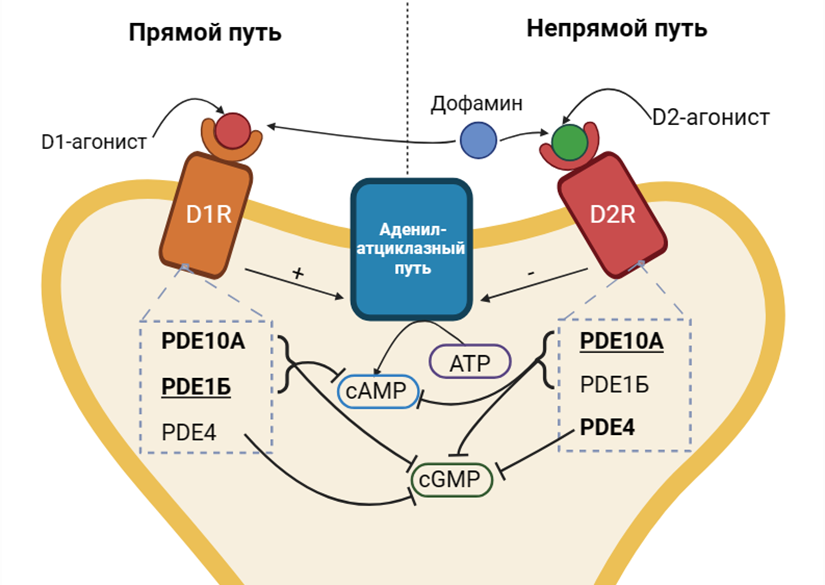
Рисунок 2. Схема аденилатциклазного пути в нейронах стриатума при участии D1R и D2R.
авторский рисунок; сделано с помощью сайта BioRender.com
В MSNs активно экспрессируется PDE10А [10]. Эта изоформа PDE гидролизует как cAMP, так и cGMP. В последнее время она притягивает к себе внимание многих фармацевтических компаний. Это неудивительно, ведь в ранее упомянутых MSNs PDE10А играет совершенно разные роли в зависимости от типа рецепторов, которые находятся на их мембране. В нейронах с «возбуждающими» D1R работа PDE10А приводит к снижению сигнала, вызванного их активацией. А в случае MSNs с «ингибирующими» D2R — наоборот, к усилению сигнала, вызванного их активацией. Таким образом, ингибиторы PDE10А обладают уникальным паттерном активности, действуя одновременно как активаторы (функциональные агонисты) D1R и блокаторы (функциональные антагонисты) D2R. То есть данная группа веществ может обладать одновременно и антипсихотическим, и противопаркинсоническим действием.
Такая особенность работы ингибиторов PDE10А открывает большие перспективы использования их в качестве фармакологических мишеней для лечения различных заболеваний. Независимые группы ученых исследуют антипсихотическое действие ингибиторов PDE10А для лечения таких симптомов шизофрении, как бред, галлюцинации, психомоторное возбуждение, кататония, в то время как другие исследования затрагивают только изучение противопаркинсонического действия. Например, в работах по изучению БП проводили совместное введение ингибиторов PDE10А и леводопа (лекарство для лечения БП), что способствовало снижению проявлений дискинезии, характерных при использовании леводопа, без снижения противопаркинсонических эффектов [11]. В других исследованиях применение ингибиторов PDE10А на животных моделях БГ демонстрировало обратное влияние — снижение проявлений двигательного дефицита [12]. Таким образом, ингибиторы PDE10A могут приводить в норму как повышенную, так и пониженную двигательную активность.
Наш вклад в изучение ингибитора фосфодиэстеразы 10А
Когда мы приступили к собственному исследованию ингибиторов PDE10A, то сразу поставили перед собой две основные задачи. Во-первых, нам надо было подтвердить, что ингибиторы PDE10А действительно обладают свойствами агонистов D1R и способны усиливать двигательную активность животных, что ранее было продемонстрировано лишь в одной работе [13]. Во-вторых, мы решили проверить, изменится ли данный эффект в случае многократного введения исследуемых веществ в течение нескольких дней, то есть будет ли развиваться толерантность к их эффектам.
Поскольку в обычных условиях влияние выключения PDE10А на D1R-MSNs продемонстрировать невозможно из-за преобладающего действия на D2-экспрессирующие клетки (в связи с более высокой аффинностью дофамина к D2R), мы использовали две модели гиподофаминергии. Первая основана на введении генетически модифицированным крысам без дофаминового транспортёра вещества — альфа-метилпаратирозина, ингибитора фермента тирозингидроксилазы, без которого синтез дофамина в организме невозможен. Под его воздействием уровень дофамина в синапсах экспериментальных животных снижался практически до нуля. Вторая модель — обычные крысы линии Wistar, которым предварительно вводили препарат тетрабеназин (в клинической практике его используют для лечения болезни Гентингтона). Это вещество блокирует везикулярный транспортёр моноаминов 2-го типа (VMAT2), который расположен только в нейронах ЦНС. Под его действием дофамин перестает поступать из цитозоля клеток в везикулы, что в конечном счете также приводит к снижению синаптического уровня дофамина. В обоих случаях модельные животные демонстрируют выраженные моторные нарушения: снижение или даже полное отсутствие двигательной активности (гипо- или акинезия), а также в случае первой модели — сохранение неестественной позы (каталепсия).
Для оценки действия выключения PDE10A на моделях гиподофаминергии мы проверили эффекты двух ингибиторов PDE10А, MP-10 и RO (RO5545965, теперь известный как NOE-105), на двигательную активность крыс с помощью экспериментальной установки «Актометр» (рис. 3) и на каталепсию в тесте «поддержания неестественной позы» (рис. 4).
Как проводили тесты? Первый тест проходил так: экспериментальное животное помещали в индивидуальную камеру установки «Актометр», которая была оборудована инфракрасными датчиками для измерения двигательной активности животного. Все передвижения животного фиксировались компьютерной программой.
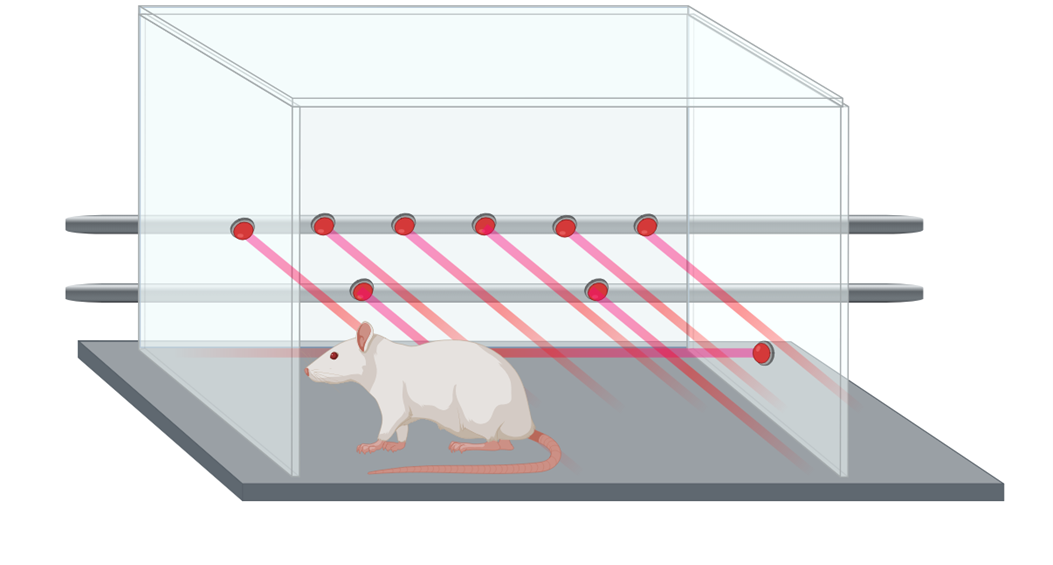
Рисунок 3. Крыса в камере установки «Актометр».
авторский рисунок; сделано с помощью сайта BioRender.com
Второй тест «поддержания неестественной позы» проводили на горизонтальной деревянной перекладине, где располагали передние лапы экспериментального животного и в течение трех минут фиксировали время его нахождения в вынужденной «позе лектора» (рис. 4) [14].
Рисунок 4. Тест «поддержание вынужденной позы»: крыса в «позе лектора».
авторский рисунок; сделано с помощью сайта BioRender.com
Мы обнаружили, что введение обоих ингибиторов PDE10A сопровождалось восстановлением двигательной активности модельных животных. То, что обнаруженное стимулирующее действие связано именно с действием фармакологических агентов, подчеркивал его дозозависимый характер, то есть чем больше вещества получала экспериментальная крыса, тем выраженнее было восстановление двигательной активности [15], [16]. Насколько было удивительно для нас наблюдать тот факт, что два вещества, которые по отдельности должны угнетать двигательную активность, при их совместном введении приводили к стимулирующему действию, будто крысе дали кокаин?! Это было просто чудо!
К сожалению, у применения ингибиторов PDE10A, по всей видимости, есть значительные ограничения. В фармакологии частой проблемой является развитие толерантности к терапевтическому действию препаратов: пациент несколько раз подряд принимает лекарство, и с каждым новым приемом действие препарата снижается. Именно поэтому мы решили провести второй этап экспериментов, где проверяли появление толерантности к ингибиторам PDE10А при 5- и 10-дневном введении. Чтобы это сделать, мы разделили экспериментальных животных на шесть групп: 1) две группы животных, которым в течение 4 или 9 дней до теста вводили растворитель (плацебо) и в день самого теста тоже вводили растворитель; 2) две группы животных, которым в течение 4 и 9 дней до теста вводили растворитель, а в день теста вводили исследуемые ингибиторы PDE10А; 3) две группы животных, которым в течение 4 или 9 дней до теста вводили ингибиторы PDE10А и в день теста тоже вводили ингибиторы PDE10А. При повторном тестировании животных даже после пяти дней введения ингибиторов фосфодиэстеразы 10А разным группам крыс были получены данные об уменьшении стимулирующего действия. У нас есть предположение, что обнаруженная толерантность развивалась к эффектам, связанным с активацией аденилатциклазной системы внутриклеточных вторичных посредников в D1-, но не в D2-экспрессирующих MSNs. Это подтверждают данные другого нашего эксперимента, где мы не наблюдали изменений в угнетающем (D2-антагонист-подобном) действии ингибиторов PDE10А на оперантное поведение у крыс: в этой методике мы оценивали влияние ингибиторов PDE10A на импульсивный выбор у животных. Крыс обучали выбирать между двумя педалями: нажатие на первую приводило к немедленному получению маленького пищевого подкрепления (1 кусочка корма), а на вторую — к получению большого пищевого подкрепления (4 кусочка корма), но спустя некоторое время. Под действием обоих веществ крысы переставали нажимать на педали — это неспецифическое угнетающее действие, в основе которого, по-видимому, лежит действие ингибиторов на MSNs «непрямого» пути.
На сегодняшний день молекулярные механизмы обнаруженной нами толерантности неизвестны, но мы можем предположить, что они связаны с тем, что в полосатом теле есть и другие варианты PDE.
Другие важные фосфодиэстеразы полосатого тела
PDE10А — не единственный вариант PDE, который обнаружен в полосатом теле. Как минимум, там обнаружены еще PDE1, PDE2 и PDE4 [17]. Следует оговориться, что изучение профилей экспрессии белков в полосатом теле — нетривиальная и очень сложная задача, так как очень тяжело разобраться, где же на самом деле находится конкретный вариант PDE: в MSNs, гигантских безшипиковых нейронах, выделяющих ацетилхолин, вставочных ГАМК-ергических нейронах, дофаминовых окончаниях нейронов черного вещества и вентральной тегментальной области, или клетках глии. Вот что сейчас известно об этих PDE.
PDE1 — единственные PDE, которые ассоциированы с Ca2+-связывающим белком кальмодулином. В ЦНС экспрессия PDE1 показана в первую очередь в областях с выраженной дофаминергической иннервацией, таких как зубчатая извилина, полосатое тело и префронтальная кора. Предполагают, что в основном этот вариант PDE экспрессируется в нейронах с D1R, а значит, в первую очередь отвечает за уменьшение cAMP-сигналинга, вызванного активацией данных рецепторов [18]. На сегодняшний день существует несколько веществ, селективно ингибирующих PDE1, например, ITI-214 и DNS-0056. Из них особенный интерес представляет ITI-214, этот препарат под названием «ленрисподун» разрабатывает американская фармацевтическая компания Internal Therapeutics, Inc. именно как новое средство для лечения БП.
Существуют три варианта PDE2 — 2А, 2B и 2C. Но и это деление не окончательное, потому что молекула 2А подвергается альтернативному сплайсингу, который приводит к образованию вариантов 2А1, 2А2 и 2А3. Определенная разница в структуре между ними может объяснить их различную субклеточную локализацию: PDE2А1 находится преимущественно в цитозоле, PDE2А3 — около плазматической мембраны, а PDE2А2 локализуется в митохондриальном матриксе, где регулирует выработку ATP [19], [20]. PDE2А рассматривают как возможную терапевтическую мишень для разработки новых фармакологических агентов для лечения депрессии [21], болезни Альцгеймера [22] и шизофрении [23].
Локализация PDE4 изучена не до конца. Существует мнение, что этот вариант фермента может экспрессироваться и в аксонах дофаминовых нейронов, и в MSNs. Также нам известно, что PDE4, в отличие от PDE10А, гидролизует только cAMP. Существуют исследования, демонстрирующие на животных моделях, что селективные ингибиторы PDE4 снижают потребление аддиктивных препаратов, то есть имеют влияние на мезолимбическую дофаминовую систему. Например, селективный ингибитор PDE4, ролипрам, значительно снижает вызванное кокаином повышение двигательной активности и развитие зависимости от стимулятора [24]. Таким образом, PDE4 является потенциальной фармакологической мишенью для разработки препаратов для лечения болезней лекарственной зависимости [25]. Есть отдельные работы о том, что активность различных вариантов PDE может зависеть от уровня cAMP (и cGMP), например, PDE10А работает в условиях низких концентраций циклических нуклеотидов, а PDE2А и PDE4 начинают работать, когда количество cAMP повышается выше определенного уровня [26].
Наша гипотеза и направления будущих исследований
Мы предполагаем, что выявленная нами толерантность связана с тем, что когда мы длительное время ингибируем один вариант PDE в D1R-MSNs, это приводит к повышению экспрессии других ее вариантов. Работ с PDE10А, подтверждающих наше предположение, на данный момент нет, однако есть некоторые работы, которые косвенно связаны с нашей гипотезой: в одном исследовании было показано, что увеличение экспрессии PDE10А присутствует у генетически модифицированных мышей, нокаутных по гену, кодирующему PDE1B [27]. Таким образом, можно предположить, что проблему толерантности можно решить, если одновременно ингибировать несколько вариантов PDE в полосатом теле. Сейчас мы пытаемся экспериментально подтвердить или опровергнуть нашу гипотезу. Мы надеемся, что в будущем результаты нашей работы помогут людям, которые страдают от болезни Паркинсона.
Работа поддерживалась грантом РНФ 23-25-00158 и выполнялась под руководством Артёма Романовича Доротенко.
Литература
- Roberto Erro, Niccoló E. Mencacci, Kailash P. Bhatia. (2021). The Emerging Role of Phosphodiesterases in Movement Disorders. Movement Disorders. 36, 2225-2243;
- Claire Haegelen, Tiphaine Rouaud, Pierre Darnault, Xavier Morandi. (2009). The subthalamic nucleus is a key-structure of limbic basal ganglia functions. Medical Hypotheses. 72, 421-426;
- A.M. Garcia, M. Redondo, A. Martinez, C. Gil. (2014). Phosphodiesterase 10 Inhibitors: New Disease Modifying Drugs for Parkinson’s Disease?. CMC. 21, 1171-1187;
- Francesca R. Fusco, Emanuela Paldino. (2017). Role of Phosphodiesterases in Huntington’s Disease. Advances in Neurobiology. 285-304;
- Болезнь Паркинсона: что изучать? как изучать?;
- Болезнь Паркинсона и астроциты: новый взгляд на лечение нейродегенеративных заболеваний;
- Болезнь Хантингтона;
- Robert A. McCutcheon, Anissa Abi-Dargham, Oliver D. Howes. (2019). Schizophrenia, Dopamine and the Striatum: From Biology to Symptoms. Trends in Neurosciences. 42, 205-220;
- Дофаминовые болезни;
- Ryan Bonate, Gabriela Kurek, Michael Hrabak, Santanna Patterson, Fernando Padovan-Neto, et. al.. (2022). Phosphodiesterase 10A (PDE10A): Regulator of Dopamine Agonist-Induced Gene Expression in the Striatum. Cells. 11, 2214;
- Goichi Beck, Shunsuke Maehara, Phat Ly Chang, Stella M. Papa. (2018). A Selective Phosphodiesterase 10A Inhibitor Reduces
L ‐Dopa‐Induced Dyskinesias in Parkinsonian Monkeys. Movement Disorders. 33, 805-814; - Akina Harada, Kazunori Suzuki, Haruhide Kimura. (2017). TAK-063, a Novel Phosphodiesterase 10A Inhibitor, Protects from Striatal Neurodegeneration and Ameliorates Behavioral Deficits in the R6/2 Mouse Model of Huntington’s Disease. J Pharmacol Exp Ther. 360, 75-83;
- Anton A. H. P. Megens, Herman M. R. Hendrickx, Michel M. A. Mahieu, Annemie L. Y. Wellens, Peter de Boer, Greet Vanhoof. (2014).
PDE 10A inhibitors stimulate or suppress motor behavior dependent on the relative activation state of the direct and indirect striatal output pathways. Pharmacology Res & Perspec. 2; - Tomek J. Banasikowski, Richard J. Beninger. (2012). Haloperidol conditioned catalepsy in rats: a possible role for D1-like receptors. Int. J. Neuropsychopharm.. 15, 1525-1534;
- Ilya Sukhanov, Artem Dorotenko, Zoia Fesenko, Artem Savchenko, Evgeniya V. Efimova, et. al.. (2022). Inhibition of PDE10A in a New Rat Model of Severe Dopamine Depletion Suggests New Approach to Non-Dopamine Parkinson’s Disease Therapy. Biomolecules. 13, 9;
- Ilya Sukhanov, Artem Dorotenko, Artem Savchenko, Olga Dravolina Tolerance to a paradoxical increase in motor activity induced by PDE10A inhibition under hypodopaminergic conditions — Authorea, Inc.;
- Ying Xu, Han-Ting Zhang, James M. O’Donnell. (2011). Phosphodiesterases in the Central Nervous System: Implications in Mood and Cognitive Disorders. Phosphodiesterases as Drug Targets. 447-485;
- Susan McQuown, Shouzhen Xia, Karsten Baumgärtel, Richard Barido, Gary Anderson, et. al.. (2019). Phosphodiesterase 1b (PDE1B) Regulates Spatial and Contextual Memory in Hippocampus. Front. Mol. Neurosci.. 12;
- Stefania Monterisi, Miguel J Lobo, Craig Livie, John C Castle, Michael Weinberger, et. al.. (2017). PDE2A2 regulates mitochondria morphology and apoptotic cell death via local modulation of cAMP/PKA signalling. eLife. 6;
- Corina Russwurm, Georg Zoidl, Doris Koesling, Michael Russwurm. (2009). Dual Acylation of PDE2A Splice Variant 3. Journal of Biological Chemistry. 284, 25782-25790;
- Lianshu Ding, Chong Zhang, Anbrin Masood, Jianxin Li, Jiao Sun, et. al.. (2014). Protective effects of phosphodiesterase 2 inhibitor on depression- and anxiety-like behaviors: Involvement of antioxidant and anti-apoptotic mechanisms. Behavioural Brain Research. 268, 150-158;
- Lina Ruan, Kai Du, Mengjia Tao, Chunyan Shan, Ruixuan Ye, et. al.. (2019). Phosphodiesterase-2 Inhibitor Bay 60-7550 Ameliorates Aβ-Induced Cognitive and Memory Impairment via Regulation of the HPA Axis. Front. Cell. Neurosci.. 13;
- Reagan Farmer, Steven D. Burbano, Neema S. Patel, Angelo Sarmiento, Abigail J. Smith, Michy P. Kelly. (2020). Phosphodiesterases PDE2A and PDE10A both change mRNA expression in the human brain with age, but only PDE2A changes in a region-specific manner with psychiatric disease. Cellular Signalling. 70, 109592;
- Erin MacDonald, Heidi Van der Lee, David Pocock, Christy Cole, Nagheme Thomas, et. al.. (2007). A Novel Phosphodiesterase Type 4 Inhibitor, HT-0712, Enhances Rehabilitation-Dependent Motor Recovery and Cortical Reorganization After Focal Cortical Ischemia. Neurorehabil Neural Repair. 21, 486-496;
- Xiaojie Liu, Peng Zhong, Casey Vickstrom, Yan Li, Qing-Song Liu. (2017). PDE4 Inhibition Restores the Balance Between Excitation and Inhibition in VTA Dopamine Neurons Disrupted by Repeated In Vivo Cocaine Exposure. Neuropsychopharmacol. 42, 1991-1999;
- Élia Mota, Ségolène Bompierre, Dahdjim Betolngar, Liliana R. V. Castro, Pierre Vincent. (2021). Pivotal role of phosphodiesterase 10A in the integration of dopamine signals in mice striatal D1 and D2 medium‐sized spiny neurones. British J Pharmacology. 178, 4873-4890;
- Jillian R. Hufgard, Michael T. Williams, Matthew R. Skelton, Olivera Grubisha, Filipa M. Ferreira, et. al.. (2017). Phosphodiesterase-1b (Pde1b) knockout mice are resistant to forced swim and tail suspension induced immobility and show upregulation of Pde10a. Psychopharmacology. 234, 1803-1813.