Оземпик: больше, чем средство для похудения
19 декабря 2023
Оземпик: больше, чем средство для похудения
- 9501
- 1
- 14
«Оземпик» — препарат, выпущенный компанией Novo Nordisk для лечения сахарного диабета II типа, также офф-лейбл применялся для снижения веса. Находясь между этими двумя показаниями, «чудо-укол» уже способен изменить жизни миллионов людей, но его потенциал этим не ограничивается.
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Один из самых популярных препаратов последних лет — «Оземпик» (он же — Семаглутид) и его аналоги, созданные датской компанией Novo Nordisk. Компания относительно молодая: ей всего сто лет (а разве для фармгиганта это возраст?); началась ее история с производства инсулина для лечения сахарного диабета II типа в небольшой лаборатории в подвале. А в 2023 году она стала самой дорогой в Европе, увеличив свою прибыль более чем на 30% благодаря упомянутым «блокбастерам». «Оземпик» применяется в качестве антидиабетического препарата; его продажи выросли на 49%. А продажи «Вегови», зарегистрированного для лечения ожирения, выросли аж на 174%. Как компании удалось достичь такого ошеломительного успеха, неужели они нашли «волшебную пилюлю»? Разбираемся вместе с «Биомолекулой» в этой статье.
Конкурс «Био/Мол/Текст»-2023/2024
 Эта работа заняла первое место в спецноминации «Академия и бизнес» конкурса «Био/Мол/Текст»-2023/2024.
Эта работа заняла первое место в спецноминации «Академия и бизнес» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
В Средние века продолжительность жизни людей составляла около 30 лет, а основными причинами смерти были инфекционные болезни. После изобретения правил гигиены и вакцинации [1] люди стали доживать до следующего «рубежа»: сейчас основными причинами смерти ВОЗ называет сердечно-сосудистые и метаболические заболевания, такие как сахарный диабет II типа (СД-II). Пока мы учимся их лечить и предотвращать, на горизонте маячит новая угроза — нейродегенерация, которая, по разным оценкам, к 2050 году будет поражать более 135 миллионов человек [2]. Помимо генетических причин, большое значение имеют и факторы риска, такие как ожирение, курение и сидячий образ жизни, которые сами по себе могут и не приводить к смерти пациента, но становятся катализатором для других заболеваний. Ожирение, в частности, приводит к развитию сердечно-сосудистых заболеваний, СД-II, проблем с дыханием, артриту и разным типам онкологии. Круто было бы вылечить их все сразу одной таблеткой! В 2017 году ожирение стали сравнивать с эпидемией, а ВОЗ начала активно бить тревогу, потому что 4 миллиона человек ежегодно умирают от ожирения. Человечество оказалось просто не готово к широкому распространению сахара в виде пирожных, тортиков и булочек. Лечить ожирение пытались всегда, но настоящие успехи появились с открытием инкретинов.
Инкретины — это гормоны, высвобождающиеся после еды и стимулирующие глюкозозависимую секрецию инсулина. При этом снижается и концентрация глюкозы в крови. К инкретинам относят глюкагон-подобный пептид 1 (GLP-1) и глюкозозависимый инсулиноподобный пептид (GIP). В качестве терапии используют миметики инкретинов, которые можно разделить на два класса веществ: «глутиды» (агонисты к рецептору GLP-1) и глиптины (ингибиторы фермента DPP-4, о котором будет сказано ниже). В данной статье под миметиками инкретина подразумеваются именно агонисты рецептора GLP-1 (GLP-1R).
В 2023 году компания Novo Nordisk вышла на британский рынок и вырвалась в лидеры в ЕС: стоимость компании составила более $440B, обогнав «роскошную» Moët Hennessy Louis Vuitton. А акции компании за последние пять лет выросли в 4,4 раза. Препараты, поднявшие Novo Nordisk на недосягаемую высоту, являются агонистами рецептора небольшого нейрогормона GLP-1 — «Оземпик», «Вегови» и их таблетированный аналог «Ребелсас». Самым первым препаратом этого класса был эксенатид, одобренный еще в 2005 году для лечения СД-II.
Вслед за ним были одобрены еще ряд препаратов не только для лечения СД-II, но и ожирения (Таблица 1). Однако интерес к созданию новых агонистов рецептора GLP-1R сохраняется до сих пор. Это трансмембранные белки, относящиеся к классу рецепторов, сопряженных с G-белком (GPCR) B класса. О самом первом GPCR-белке семейства А можно прочитать в другом материале «Биомолекулы» [3]. GLP-1R экспрессируется в организме повсеместно, что делает его интересным для изучения самых различных заболеваний: популяции GLP-1R в ЖКТ изучают для лечения диабета и ожирения, в сердце — кардиопатологий, а в мозге — нейродегенерации.
А кроме этого, интерес публики к агонистам GLP-1R вырос из-за их офф-лейбл использования для косметического снижения веса. Практически все препараты вводятся подкожно, исключением является «Ребелсас», выпускающийся в таблетках. С точки зрения побочных эффектов агонисты GLP-1R кажутся чудом. Обычно в инструкции к препарату можно увидеть крайне «страшные» побочные эффекты, пусть их частота может быть и небольшой. А вот в инструкции к семаглутиду, помимо реакций в месте подкожной инъекции или аллергических реакций, самыми «страшными» являются гипогликемия и реакции со стороны ЖКТ: тошнота, диарея или констипация, гастрит, метеоризм. Более серьезные нежелательные явления не подтверждены компанией.
| МНН (торговое название) | Компания | Показание | Одобрение | Время полувыведения | Способ введения |
|---|---|---|---|---|---|
| Эксенатид (Byetta, Bydureon) | AstraZeneca | сахарный диабет II типа | 2005 | 2,4 часа | подкожная инъекция |
| Лираглутид (Victoza, Saxenda) | Novo Nordisk | сахарный диабет II типа, ожирение | 2010 | 13 часов | подкожная инъекция |
| Албиглутид (Tanzeum, Eperzan) | GSK | сахарный диабет II типа | 2014 | 5 дней | подкожная инъекция |
| Дулаглутид (Trulicity) | Eli Lilly | сахарный диабет II типа, в частности, для предупреждения серьезных сердечно-сосудистых явлений | 2014 | 5 дней | подкожная инъекция |
| Ликсисенатид (Lyxumia, Adlyxin) | Sanofi | сахарный диабет II типа | 2016 | 3–4 часа | подкожная инъекция |
| Семаглутид (Ozempic, Wegovy и Rybelsus) | Novo Nordisk | сахарный диабет II типа | 2017 | 7 дней | подкожная инъекция, таблетки |
| ожирение | 2021 | ||||
| Тирзепатид (Mounjaro, Zepbound) | Eli Lilly | сахарный диабет II типа, ожирение | 2022 | 5 дней | подкожная инъекция |
Где и как работают агонисты GLP-1 рецепторов
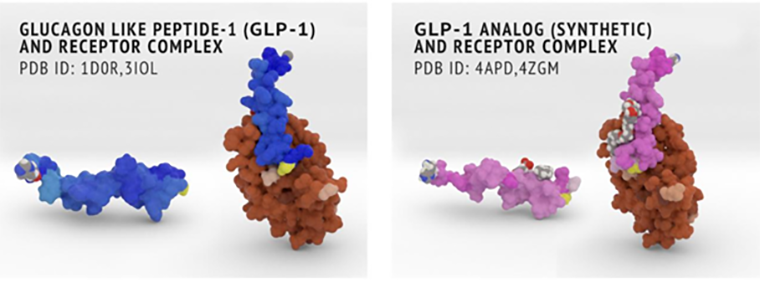
GPCR-рецепторы класса В имеют большой внеклеточный домен, и поэтому долгое время их структуру целиком установить не удавалось — первым расшифровали строение как раз внеклеточной части, распознающей нейрогормон в растворе (рис. 1). Следствием «поимки» пептида становится активация трансмембранного домена, инициирующая распад G-белка на отдельные субъединицы, запускающие внутриклеточные каскады реакций и в итоге повышающие уровень кальция в клетках [4]. Это приводит в разных тканях к разному результату.
GLP-1R экспрессируются в ацинарных клетках и в β-клетках островков Лангерганса поджелудочной железы, а также в синоатриальном узле, эндотелии, гладкомышечных клетках сосудов, гипоталамусе, железах кишечника, почках и даже в нейронах [5]. Эндогенный лиганд этого рецептора состоит всего из 30 аминокислот и высвобождается в кишечнике в течение 15 минут после приема пищи при расщеплении глюкагона [6]. Взаимодействие GLP-1 со своим рецептором в поджелудочной железе приводит к снижению секреции глюкагона и увеличению глюкозозависимой секреции инсулина (рис. 2). Глюконеогенез (образование новой глюкозы) в печени также подавляется. В результате уровень глюкозы в крови снижается. Единственный минус эндогенного GLP-1 — это его быстрое, в течение пары минут, расщепление дипептидилпептидазой-4 (DPP-4) в самом подвижном месте белка и выведение почками.
Есть данные о том, что снижается апоптоз β-клеток поджелудочной железы [7], однако органопротективный эффект агонистов GLP-1R в клинических исследованиях пока не был доказан [8]. Возможно, что с возрастом снижается способность β-клеток к пролиферации [9]. Также GLP-1 замедляет перистальтику желудка, за счет чего замедляется и его опорожнение. GLP-1 проходит через гематоэнцефалический барьер, и в ЦНС снижает аппетит и способствует более быстрому возникновению чувства насыщения [10]. В результате последних двух механизмов человек долго чувствует себя сытым, а пациенты, получающие терапию агонистами GLP-1R, утверждают, что у них не возникает и мысли о еде. Однако вместе со снижением аппетита, агонисты GLP-1 рецептора приводят и к снижению чувства жажды [11]. Пациентам, принимающим такие препараты, нужно обязательно следить за своим водным балансом, причем чуть ли не по часам, чтобы избежать обезвоживания.
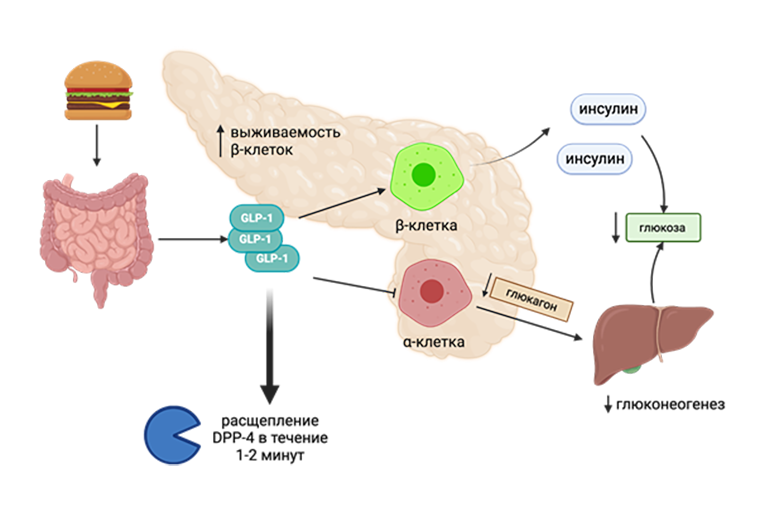
Рисунок 2. Гипогликемические эффекты GLP-1 в ЖКТ. После приема пищи в кишечнике высвобождается GLP-1, который стимулирует выработку инсулина ꞵ-клетками поджелудочной железы, ингибирует выработку глюкагона и подавляет глюконеогенез, в результате чего снижается глюкоза в плазме крови, а это и есть главная цель антидиабетических препаратов.
адаптировано автором из [46] с помощью программы Biorender
В клинических исследованиях результаты семаглутида поражают. У пациентов с СД-II, принимающих семаглутид, обнаружили снижение гликированного гемоглобина — основного показателя наличия глюкозы в крови в течение последних 3 месяцев [12]. Обычно этот тест позволяет понять, насколько эффективно антидиабетическое лечение. Также отмечалось снижение риска возникновения сердечно-сосудистых заболеваний, сопутствующих СД-II [13]. Но самое интересное, конечно, касается снижения веса: семаглутид снижал массу тела в среднем аж на 15%, в то время как у контрольной группы — только на 2,4% примерно за полтора года [14]. Тут стоит отметить, что обе группы также соблюдали низкокалорийную диету и занимались спортом — как минимум, ходьбой два часа в неделю.
GLP-1R — очень важный белок для ЖКТ и метаболизма; казалось бы, зачем он нужен в других тканях? Экспрессия GLP-1R в сердце, например, оказалась самой настоящей «фичей», так как пациенты, страдающие от СД-II, в два раза чаще заболевают сердечно-сосудистыми заболеваниями. А самый главный «убийца» — это не рак, а ишемическая болезнь сердца.
Интересно, что агонизм рецепторов GLP-1 видоспецифичен. У грызунов GLP-1 увеличивает частоту сердечных сокращений (ЧСС) и артериальное давление [24], в то время как на людях GLP-1 демонстрирует слабое действие на ЧСС и снижает давление, но только у людей с артериальной гипертензией [20]. Механизмы снижения давления не до конца изучены. Предполагается, что агонисты GLP-1R вызывают вазодилатацию [25], а также усиливают выведение натрия почками [26]. В случае длительного приема препарата агонисты GLP-1R могут снижать давление не напрямую, а за счет снижения веса, так как ожирение является одним из факторов риска сосудистых патологий [27].
Влияние агонистов GLP-1R на сердце изучено, помимо ЖКТ, лучше всего. Компания Eli Lilly тоже утверждает, что препарат дулаглутида снижает риск возникновения сердечно-сосудистых заболевнаний, а также инфаркта миокарда, сопутствующих СД-II.
GLP-1R изучают и в костях. Интересно, что мыши с нокаутом гена GLP-1R обладают высокой активностью остеокластов и сниженной массой губчатых костей [28]. Остеокласты — это огромные многоядерные макрофаги, которые разрушают костную ткань. Вместе с остеобластами, которые, наоборот, ее создают, они контролируют количество костной ткани. Агонисты GLP-1R увеличивают прочность костей, а также созревание коллагена у мышей [29]. На людях с ожирением введение лираглутида приводило к улучшению формирования костей и снижало темп их разрушения [30]. Однако данные исследований с участием пациентов с СД-II более противоречивы: в некоторых из них протективного эффекта на кости обнаружено не было [31], тогда как в других снижалась вероятность возникновения трещин в костях [32].
Помимо перечисленного, агонисты GLP-1R могут обладать и нейропротекторным действием [33]. Рецепторы экспрессируются в гиппокампе и улучшают память и способность к обучению [34]. Благодаря тому, что GLP-1R были обнаружены в мозге, их миметики стали активно изучать на моделях нейродегенеративных заболеваний, сопровождающихся образованием белковых агрегатов в мозге: белок Хантингтин играет ключевую роль в болезни Хантингтона, синуклеин — в болезни Паркинсона, а β-амилоид — в болезни Альцгеймера. В результате накопления этих белков в различных регионах разрушаются нейроны, это может приводить к деменции, нарушениям двигательной или речевой функции и другим. Угрозу нейродегенерации в глобальном смысле нельзя недооценивать. На данный момент нет лечения этих заболеваний; всё что мы можем — лечить симптомы, причем пациент получает терапию после постановки диагноза до конца жизни, но болезнь всё равно прогрессирует и со временем лишает человека дееспособности. Результаты изучения агонистов GLP-1R от нейродегенераций пока скромные, но многообещающие и очень интересные. Вероятно, вылечить нейродегенеративное заболевание раз и навсегда агонисты GLP-1R не смогут, но даже улучшить состояние пациентов с помощью новой симптом-модифицирующей терапии — уже значительный успех.
Диабет давно связывают с нейродегенерацией, в том числе поэтому ученые обратили внимание на агонисты GLP-1R. Было замечено, что люди с болезнью Хантингтона чаще страдают от СД-II из-за высокой инсулинорезистентности тканей [35], а, по крайней мере на клеточных моделях, выживание клеток и чувствительность к инсулину увеличивались после обработки их лираглутидом [36].
Поведенческие исследования на мышах показали значительное улучшение памяти и способности к обучению при моделировании болезни Альцгеймера после введения животным лираглутида [37]. На людях данных меньше, но вот еще один факт в копилку знаний: болезнь Альцгеймера сопровождается снижением транспорта глюкозы через гематоэнцефалический барьер (то есть в мозг), а введение лираглутида в течение 6 месяцев его увеличивало [38]. Авторы статьи подозревают, что снижение глюкозного транспорта может способствовать массовому разрушению нейронов.
Наконец, для болезни Паркинсона был показано, что есть некоторый нейропротективный эффект на дофаминергические нейроны после введения агонистов GLP-1R на токсичных моделях грызунов [39]. Именно из-за разрушения дофаминергических нейронов пациенты с болезнью Паркинсона испытывают двигательные и когнитивные нарушения. Несколько клинических исследований также подтвердили благоприятное воздействие эксенатида для улучшения когнитивной и двигательной функции при болезни Паркинсона даже спустя год после терапии [40–42].
Изучают агонисты GLP-1R и от зависимостей и маний. В 2023 году было опубликовано исследование, в результате которого алкогольная зависимость пациентов снижалась на фоне курса лечения семаглутидом. Механизм работы здесь до конца не выяснен, но в эксперименте на грызунах было показано, что агонисты GLP-1R снижают избыточный выброс «гормона счастья», дофамина, спровоцированный алкоголем [43]. Дофамин играет важную роль в системе вознаграждения, подробнее о которой можно почитать в другой статье «Биомолекулы» [44].
Все упомянутые «новые эффекты» агонистов GLP-1R требуют больших клинических исследований. Многое в этой области еще неизвестно, но ученые и врачи уже подозревают, что агонисты GLP-1R можно будет применять не только для лечения ожирения и СД II типа.
Потенциал этих препаратов огромный (рис. 3) [45], а для любой компании намного выгоднее запустить исследование препарата, который уже есть в портфолио, для нового показания, чем разрабатывать абсолютно новую молекулу с нуля, включая все доклинические и клинические исследования и вопросы патентования. Для регистрирования нового показания с использованием уже существующей формы препарата достаточно провести новое клиническое исследование. Подробнее обо всех этих аспектах можно прочитать в спецпроектах «Биомолекулы» о доклинических и клинических исследованиях.
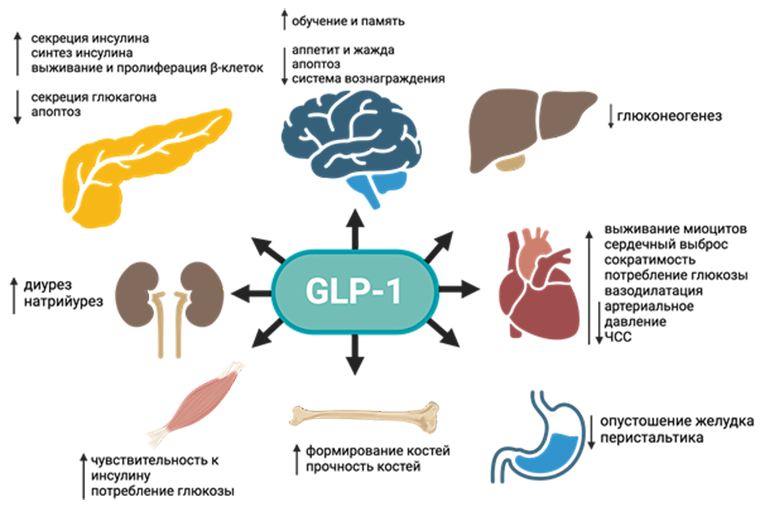
Рисунок 3. Потенциальные эффекты, которые оказывает GLP-1 на организм. Схема включает в себя прямые и непрямые эффекты.
адаптировано автором из [45] с помощью программы Biorender
Рецепт агонистов GLP-1R
В основном «глутиды» вводятся с помощью подкожной инъекции (табл. 1). Первые препараты, такие как лираглутид, необходимо вводить ежедневно, поэтому их называют препаратами короткого действия. Конечно, ежедневная подкожная инъекция влияет на качество жизни пациентов — однако у многих пациентов с СД-II просто нет выбора, и они вынуждены колоть себе инсулин ежедневно. Поэтому фармацевтические компании соревновались в создании агониста GLP-1R с бóльшим периодом полувыведения, который можно было бы колоть подкожно лишь раз в неделю, а не каждый день. Другой задачей было создание пероральной формы лекарства, а не раствора для инъекции. Победила в этой гонке именно компания Novo Nordisk, которая выпустила семаглутид с периодом полувыведения 7 дней — и в таблетках, и в виде раствора. Еженедельное введение не только более комфортно для пациента и значительно уменьшает побочные реакции в месте введения инъекции, но и позволяет снизить стоимость терапии.
Эндогенный GLP-1 в течение 1–2 минут расщепляется DPP-4 или выводится почками [46]. Поэтому основная стратегия создания агонистов GLP-1R — продление действия вещества, увеличение его периода полувыведения [47]. В основном, агонисты GLP-1R похожи по своей структуре на эндогенный пептид (рис. 4); обычно происходит замена лишь тех аминокислот, что необходимы для разрезания цепочки пептидазой. Также часто добавляют длинный гидрофобный хвост с карбоксильной группой на конце — для связывания с альбумином, что существенно продлевает нахождение препарата в крови. Другой способ, как в случае албиглутида, это соединить две копии GLP-1 с модифицированными аминокислотами в месте разрезания DPP-4 с последовательностью человеческого альбумина [47]. Соответственно, албиглутид намного больше «весит», не проходит через гематоэнцефалический барьер и не может влиять на аппетит и чувство сытости, поэтому его влияние на снижение веса было ниже, и в 2018 году фармацевтическая компания решила отозвать препарат по экономическим причинам. А в случае дулаглутида последовательность фрагмента GLP-1 соединили с Fc-фрагментом человеческого иммуноглобулина G, что замедлило выведение препарата почками [47].
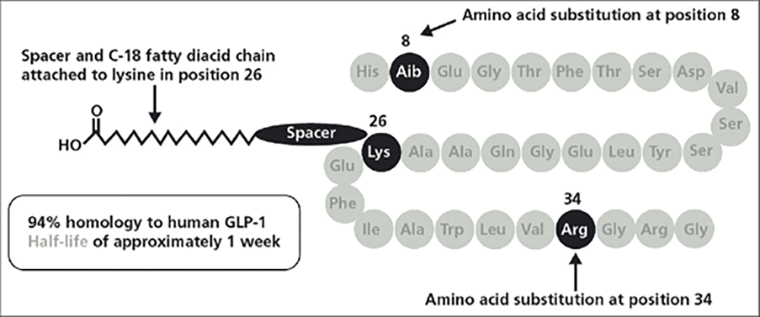
Рисунок 4. Структура агонистов GLP-1R на примере семаглутида. Cемаглутид на 94% идентичен эндогенному GLP-1, за исключением некоторых изменений. К лизину в 26 положении добавляется жирная углеродная цепочка для связывания с альбумином; одновременно Лиз-34 меняют на аргинин, чтобы хвост не встраивался туда. Всё это снижает выведение препарата почками. Также заменяется аминокислота в позиции 8 для предотвращения разрезания DPP-4, что увеличивает стабильность семаглутида и способствует его длительному нахождению в организме [48].
В 2022 году у семаглутида появился достойный соперник — тирзепатид, разработанный компанией Eli Lilly. Тирзепатид является препаратом первого класса (first-in-class medication), обладающим новым и уникальным механизмом действия. Первым first-in-class среди агонистов GLP-1R был эксенатид, разработанный также при поддержке Eli Lilly. Тирзепатид, помимо связывания с GLP-1R, взаимодействует с рецептором другого инкретина — глюкозозависимого инсулинотропного пептида (GIP). Его дуальный механизм действия повышает эффективность препарата: так, вес пациентов снижался на 22,5% за полтора года на фоне диеты и занятий спортом, что сопоставимо с результатами бариатрической операции [49].
В чем же подвох?
Исходя из механизмов действия, агонисты GLP-1R действительно выглядят волшебной таблеткой от многих заболеваний. Для снижения побочных эффектов со стороны ЖКТ компании придумали постепенное повышение дозы миметиков GLP-1R. Так, например, первый месяц семаглутид вводят в дозе 0,25 мг, которая не является терапевтической, — для оценки побочных эффектов и постепенного привыкания организма. После этого дозу повышают до 0,5 мг. С коммерческой точки зрения агонисты GLP-1R — идеальные препараты для фармацевтической компании , ведь это лечение длится всю жизнь, так как при отмене препарата эффект проходит. В случае ожирения постепенно вес вернется... А вот для пациента терапия агонистами GLP-1R недешевая. Они, конечно, не стоят как самые дорогие лекарства (более $3M на одно использование), но месячный курс семаглутида варьирует от $1000 в США до $83 во Франции. Нужно отметить, что из-за повышения дозировки в последующие месяцы, когда пациент «дойдет» до терапевтической дозы, стоимость месячного курса лечения вырастает.
Соотношение пользы и цены лекарства изучает фармакоэкономика [50].
Настораживают данные о возникновении рака щитовидной железы у животных на фоне приема лираглутида [51], [52]. Постмаркетинговые исследования, однако, не доказали взаимосвязь между раком щитовидной железы и длительным применением глутидов [53]. При этом в инструкции к «Оземпику» наличие в анамнезе медуллярного рака щитовидной железы является противопоказанием к назначению препарата. Врач должен информировать пациента о риске возникновения медуллярного рака щитовидной железы, первых симптомах и периодически обследовать пациента.
Также агонисты GLP-1R могут приводить к развитию острого панкреатита: компания рекомендует применять «Оземпик» с осторожностью пациентам, имеющим его в анамнезе. А в случае развития панкреатита прием препарата останавливают и не возобновляют.
Несмотря на все эти риски, «глутиды» являются одними из самых продаваемых препаратов. В 3 квартале 2023 года «Оземпик» находился на третьем месте, немного отставая от «Хумиры», которая в 2016 году (до регистрации «Оземпика») лидировала. В одном исследовании показано, что за пять лет (с 2018 по 2023 годы) упоминание в интернете торговых названий семаглутида выросло экспоненциально [54]. Авторы статьи намекают, что это связано с использованием препарата офф-лейбл, то есть для незарегистрированных показаний и не отраженных в инструкции к препарату. Фармацевтические компании отслеживают такое использование и часто регистрируют новые показания и вносят их в инструкцию после проведения клинических исследований. В случае «глутидов» основной офф-лейбл — это использование препаратов, в частности семаглутида, для косметической коррекции веса. Популярность «Оземпика» настолько разрослась, что Джимми Киммел, ведущий Оскара-2023, на фоне слухов о знаменитостях, худеющих на «Оземпике», шутил:
Все выглядят так великолепно. Когда я оглядываю эту комнату, я не могу не задаться вопросом: „Подходит ли мне Ozempic?“
Сама компания также активно поддерживает пиар «Оземпика»: его реклама мгновенно завирусилась благодаря песенке Oh! Oh! Oh! Ozempic. В интернете можно найти множество мемов, посвященных «Оземпику» и другим препаратам агонистов GLP-1R, некоторые из которых ироничные, а другие — осуждающие (рис. 5).
На самом деле, многие знаменитости, например, Илон Маск, и не скрывают, что принимают «глутиды» для похудения. Немаленькая стоимость и такая популярность превратили агонисты GLP-1R в элитарное лекарство для похудения. Что и привело к глобальному «глутидному кризису», который начался в 2023 году и, видимо, продлится еще несколько лет, ведь изначально препараты были рассчитаны преимущественно на пациентов с СД-II, которым не помогают другие лекарства. Хотя семаглутид внесен в список жизненно-необходимых и важнейших лекарственных средств в России, в 2023 году препарат исчез из аптек. Позже компания «Герофарм» сообщила о регистрации аналога под названием «Семавик». Кризис привел к тому, что уже появились случаи фальсификации: за 2023 год только в Великобритании сообщили о 369 таких случаях.
Novo Nordisk, производящая «Оземпик», сообщила о том, что поставки препарата в 2024 году будут ниже, но к 2026–28 годам компания планирует расширяться и увеличивать обороты. Локальные органы здравоохранения тоже отреагировали по всему миру от Англии до Австралии: одобрили закупку зарубежных аналогов «глутидов», рекомендуют перераспределять существующие запасы препарата и выпустили рекомендации для врачей. Так, не рекомендуется выписывать агонисты GLP-1R новым пациентам; следует, по возможности, переводить на другую терапию тех пациентов, кто уже получает курс лечения этими препаратами. Исключение можно сделать только для тех пациентов, у кого не осталось других опций для лечения СД-II типа.
Конечно, не для всех «глутидов» применение для снижения веса является офф-лейблом. У лираглутида, который отпускается по рецепту, — это официальное показание. Но, во-первых, он должен вводиться ежедневно, а, как мы уже обсуждали, это не так удобно. Поэтому так популярен именно «Оземпик» в странах, где не зарегистрированы его аналоги для снижения веса. Во-вторых, согласно инструкции к лираглутиду, препарат выписывается людям с диагнозом «ожирение» (индекс ИМТ выше 30), которые уже внедрили в свою жизнь низкокалорийную диету и физическую активность. То есть нельзя просто по своему желанию попросить врача выписать лираглутид для похудения — перед этим врач должен удостовериться, что человек адекватно питается и занимается спортом.
Миметики инкретина уже повлияли как на образ жизни людей, так и на фармацевтический рынок. Еще раз подчеркнем, что агонисты GLP-1R не являются панацеей для снижения веса, а служат лишь дополнением к комплексному лечению: без налаженного питания и физической активности снижение веса за счет «глутидов» надолго не задержится. А в это же время есть пациенты, страдающие от СД-II, которым эти лекарства крайне необходимы. Агонисты GLP-1R показали высокую эффективность и безопасность в клинических исследованиях и потенциально обладают широким диапазоном применения, что делает их привлекательными для дальнейшего изучения и лечения самых разных заболеваний.
Литература
- Мир до и после изобретения вакцин;
- Katharine Gammon. (2014). Neurodegenerative disease: Brain windfall. Nature. 515, 299-300;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Fan Wu, Linlin Yang, Kaini Hang, Mette Laursen, Lijie Wu, et. al.. (2020). Full-length human GLP-1 receptor structure without orthosteric ligands. Nat Commun. 11;
- Kelly E. Mayo, Laurence J. Miller, Dominique Bataille, Stéphane Dalle, Burkhard Göke, et. al.. (2003). International Union of Pharmacology. XXXV. The Glucagon Receptor Family. Pharmacol Rev. 55, 167-194;
- Eleanor Spreckley. (2015). The L-cell in nutritional sensing and the regulation of appetite. Front. Nutr.. 2;
- Jonathan E. Campbell, Daniel J. Drucker. (2013). Pharmacology, Physiology, and Mechanisms of Incretin Hormone Action. Cell Metabolism. 17, 819-837;
- Ravi Retnakaran, Caroline K. Kramer, Haysook Choi, Balakumar Swaminathan, Bernard Zinman. (2014). Liraglutide and the Preservation of Pancreatic Beta-Cell Function in Early Type 2 Diabetes: The LIBRA Trial. Canadian Journal of Diabetes. 38, S4-S5;
- Chunhua Dai, Yan Hang, Alena Shostak, Greg Poffenberger, Nathaniel Hart, et. al.. (2017). Age-dependent human β cell proliferation induced by glucagon-like peptide 1 and calcineurin signaling. Journal of Clinical Investigation. 127, 3835-3844;
- Daniel J. Drucker. (2018). Mechanisms of Action and Therapeutic Application of Glucagon-like Peptide-1. Cell Metabolism. 27, 740-756;
- Jean-Pierre Gutzwiller, Petr Hruz, Andreas R. Huber, Christian Hamel, Carlos Zehnder, et. al.. (2006). Glucagon-Like Peptide-1 Is Involved in Sodium and Water Homeostasis in Humans. Digestion. 73, 142-150;
- Kaitlin E. Miles, Jessica L. Kerr. (2018). Semaglutide for the Treatment of Type 2 Diabetes Mellitus. Journal of Pharmacy Technology. 34, 281-289;
- Steven P. Marso, Stephen C. Bain, Agostino Consoli, Freddy G. Eliaschewitz, Esteban Jódar, et. al.. (2016). Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med. 375, 1834-1844;
- John P.H. Wilding, Rachel L. Batterham, Salvatore Calanna, Melanie Davies, Luc F. Van Gaal, et. al.. (2021). Once-Weekly Semaglutide in Adults with Overweight or Obesity. N Engl J Med. 384, 989-1002;
- B P Bullock, R S Heller, J F Habener. (1996). Tissue distribution of messenger ribonucleic acid encoding the rat glucagon-like peptide-1 receptor.. Endocrinology. 137, 2968-2978;
- Y. WEI, S. MOJSOV. (1996). Distribution of GLP‐1 and PACAP receptors in human tissues. Acta Physiologica Scandinavica. 157, 355-357;
- Yang Wei, Svetlana Mojsov. (1995). Tissue‐specific expression of the human receptor for glucagon‐like peptide‐I: brain, heart and pancreatic forms have the same deduced amino acid sequences. FEBS Letters. 358, 219-224;
- Charles Pyke, R. Scott Heller, Rikke K. Kirk, Cathrine Ørskov, Steffen Reedtz-Runge, et. al.. (2014). GLP-1 Receptor Localization in Monkey and Human Tissue: Novel Distribution Revealed With Extensively Validated Monoclonal Antibody. Endocrinology. 155, 1280-1290;
- Antonio Ceriello, Katherine Esposito, Roberto Testa, Anna Rita Bonfigli, Maurizio Marra, Dario Giugliano. (2011). The Possible Protective Role of Glucagon-Like Peptide 1 on Endothelium During the Meal and Evidence for an “Endothelial Resistance” to Glucagon-Like Peptide 1 in Diabetes. Diabetes Care. 34, 697-702;
- Feng Sun, Shanshan Wu, Shuxia Guo, Kai Yu, Zhirong Yang, et. al.. (2015). Impact of GLP-1 receptor agonists on blood pressure, heart rate and hypertension among patients with type 2 diabetes: A systematic review and network meta-analysis. Diabetes Research and Clinical Practice. 110, 26-37;
- Lazaros A. Nikolaidis, Dariush Elahi, Teresa Hentosz, Aaron Doverspike, Rhonda Huerbin, et. al.. (2004). Recombinant Glucagon-Like Peptide-1 Increases Myocardial Glucose Uptake and Improves Left Ventricular Performance in Conscious Dogs With Pacing-Induced Dilated Cardiomyopathy. Circulation. 110, 955-961;
- Tingcun Zhao, Pratik Parikh, Siva Bhashyam, Hakki Bolukoglu, Indu Poornima, et. al.. (2006). Direct Effects of Glucagon-Like Peptide-1 on Myocardial Contractility and Glucose Uptake in Normal and Postischemic Isolated Rat Hearts. J Pharmacol Exp Ther. 317, 1106-1113;
- Lazaros A. Nikolaidis, Sunil Mankad, George G. Sokos, Glen Miske, Ankur Shah, et. al.. (2004). Effects of Glucagon-Like Peptide-1 in Patients With Acute Myocardial Infarction and Left Ventricular Dysfunction After Successful Reperfusion. Circulation. 109, 962-965;
- J. M. Barragan, R. E. Rodriguez, E. Blazquez. (1994). Changes in arterial blood pressure and heart rate induced by glucagon-like peptide-1-(7-36) amide in rats. American Journal of Physiology-Endocrinology and Metabolism. 266, E459-E466;
- Minsuk Kim, Mathew J Platt, Tadao Shibasaki, Susan E Quaggin, Peter H Backx, et. al.. (2013). GLP-1 receptor activation and Epac2 link atrial natriuretic peptide secretion to control of blood pressure. Nat Med. 19, 567-575;
- Ali Asmar, Per K Cramon, Lene Simonsen, Meena Asmar, Charlotte M Sorensen, et. al.. (2019). Extracellular Fluid Volume Expansion Uncovers a Natriuretic Action of GLP-1: A Functional GLP-1–Renal Axis in Man. The Journal of Clinical Endocrinology & Metabolism. 104, 2509-2519;
- James R Sowers. (2003). Obesity as a cardiovascular risk factor. The American Journal of Medicine. 115, 37-41;
- Chizumi Yamada, Yuichiro Yamada, Katsushi Tsukiyama, Kotaro Yamada, Nobuyuki Udagawa, et. al.. (2008). The Murine Glucagon-Like Peptide-1 Receptor Is Essential for Control of Bone Resorption. Endocrinology. 149, 574-579;
- Sity Aishah Mansur, Aleksandra Mieczkowska, Peter R. Flatt, Daniel Chappard, Nigel Irwin, Guillaume Mabilleau. (2019). The GLP-1 Receptor Agonist Exenatide Ameliorates Bone Composition and Tissue Material Properties in High Fat Fed Diabetic Mice. Front. Endocrinol.. 10;
- Eva W. Iepsen, Julie R. Lundgren, Bolette Hartmann, Oluf Pedersen, Torben Hansen, et. al.. (2015). GLP-1 Receptor Agonist Treatment Increases Bone Formation and Prevents Bone Loss in Weight-Reduced Obese Women. The Journal of Clinical Endocrinology & Metabolism. 100, 2909-2917;
- Guillaume Mabilleau, Aleksandra Mieczkowska, Daniel Chappard. (2014). Use of glucagon‐like peptide‐1 receptor agonists and bone fractures: A meta‐analysis of randomized clinical trials (胰高血糖素样肽‐1受体激动剂的使用与骨折的关系:一项对随机临床试验的meta分析). Journal of Diabetes. 6, 260-266;
- Liang Cheng, Yun Hu, Yun‐Yun Li, Xin Cao, Ning Bai, et. al.. (2019). Glucagon‐like peptide‐1 receptor agonists and risk of bone fracture in patients with type 2 diabetes: A meta‐analysis of randomized controlled trials. Diabetes Metabolism Res. 35;
- TracyAnn Perry, Norman J. Haughey, Mark P. Mattson, Josephine M. Egan, Nigel H. Greig. (2002). Protection and Reversal of Excitotoxic Neuronal Damage by Glucagon-Like Peptide-1 and Exendin-4. J Pharmacol Exp Ther. 302, 881-888;
- Matthew J During, Lei Cao, David S Zuzga, Jeremy S Francis, Helen L Fitzsimons, et. al.. (2003). Glucagon-like peptide-1 receptor is involved in learning and neuroprotection. Nat Med. 9, 1173-1179;
- Nebojša M. Lalić, Jelena Marić, Marina Svetel, Aleksandra Jotić, Elka Stefanova, et. al.. (2008). Glucose Homeostasis in Huntington Disease. Arch Neurol. 65, 476;
- Ching-Chi Chang, Tzu-Chin Lin, Hsiao-Li Ho, Chien-Yin Kuo, Hsin-Hua Li, et. al.. (2018). GLP-1 Analogue Liraglutide Attenuates Mutant Huntingtin-Induced Neurotoxicity by Restoration of Neuronal Insulin Signaling. IJMS. 19, 2505;
- Liqin Qi, Linfang Ke, Xiaohong Liu, Lianming Liao, Sujie Ke, et. al.. (2016). Subcutaneous administration of liraglutide ameliorates learning and memory impairment by modulating tau hyperphosphorylation via the glycogen synthase kinase-3β pathway in an amyloid β protein induced alzheimer disease mouse model. European Journal of Pharmacology. 783, 23-32;
- Michael Gejl, Birgitte Brock, Lærke Egefjord, Kim Vang, Jørgen Rungby, Albert Gjedde. (2017). Blood-Brain Glucose Transfer in Alzheimer’s disease: Effect of GLP-1 Analog Treatment. Sci Rep. 7;
- Yazhou Li, TracyAnn Perry, Mark S. Kindy, Brandon K. Harvey, David Tweedie, et. al.. (2009). GLP-1 receptor stimulation preserves primary cortical and dopaminergic neurons in cellular and rodent models of stroke and Parkinsonism. Proc. Natl. Acad. Sci. U.S.A.. 106, 1285-1290;
- Iciar Aviles-Olmos, John Dickson, Zinovia Kefalopoulou, Atbin Djamshidian, Joshua Kahan, et. al.. (2014). Motor and Cognitive Advantages Persist 12 Months After Exenatide Exposure in Parkinson’s Disease. JPD. 4, 337-344;
- Thomas Foltynie, Iciar Aviles-Olmos. (2014). Exenatide as a potential treatment for patients with Parkinson's disease: First steps into the clinic. Alzheimer's & Dementia. 10;
- Dilan Athauda, Kate Maclagan, Simon S Skene, Martha Bajwa-Joseph, Dawn Letchford, et. al.. (2017). Exenatide once weekly versus placebo in Parkinson's disease: a randomised, double-blind, placebo-controlled trial. The Lancet. 390, 1664-1675;
- Daniel Vallöf, Jesper Vestlund, Elisabet Jerlhag. (2019). Glucagon-like peptide-1 receptors within the nucleus of the solitary tract regulate alcohol-mediated behaviors in rodents. Neuropharmacology. 149, 124-132;
- Дофаминовые болезни;
- T.D. Müller, B. Finan, S.R. Bloom, D. D'Alessio, D.J. Drucker, et. al.. (2019). Glucagon-like peptide 1 (GLP-1). Molecular Metabolism. 30, 72-130;
- Dilip Sharma, Suril Verma, Shivani Vaidya, Kiran Kalia, Vinod Tiwari. (2018). Recent updates on GLP-1 agonists: Current advancements & challenges. Biomedicine & Pharmacotherapy. 108, 952-962;
- Daniel B. Maselli, Michael Camilleri. (2020). Effects of GLP-1 and Its Analogs on Gastric Physiology in Diabetes Mellitus and Obesity. Advances in Experimental Medicine and Biology. 171-192;
- AbdulH Zargar, Sanjay Kalra, Sambit Das. (2022). A review of oral semaglutide available evidence: A new era of management of diabetes with peptide in a pill form. Indian J Endocr Metab. 26, 98;
- Ania M. Jastreboff, Louis J. Aronne, Nadia N. Ahmad, Sean Wharton, Lisa Connery, et. al.. (2022). Tirzepatide Once Weekly for the Treatment of Obesity. N Engl J Med. 387, 205-216;
- Фармакоэкономика: лечить или экономить?;
- Lotte Bjerre Knudsen, Lars Wichmann Madsen, Søren Andersen, Kasper Almholt, Anne S. de Boer, et. al.. (2010). Glucagon-Like Peptide-1 Receptor Agonists Activate Rodent Thyroid C-Cells Causing Calcitonin Release and C-Cell Proliferation. Endocrinology. 151, 1473-1486;
- Lars Wichmann Madsen, Jeffrey A. Knauf, Carsten Gotfredsen, Andrew Pilling, Ingrid Sjögren, et. al.. (2012). GLP-1 Receptor Agonists and the Thyroid: C-Cell Effects in Mice Are Mediated via the GLP-1 Receptor and not Associated with RET Activation. Endocrinology. 153, 1538-1547;
- Donnie Funch, Kathleen Mortimer, Najat J Ziyadeh, John D Seeger, Li Zhou, et. al.. (2021). Risk of Thyroid Cancer Associated with Use of Liraglutide and Other Antidiabetic Drugs in a US Commercially Insured Population. DMSO. Volume 14, 2619-2629;
- Sabrina H Han, Rachel Safeek, Kyle Ockerman, Nhan Trieu, Patricia Mars, et. al.. (2023). Public Interest in the Off-Label Use of Glucagon-like Peptide 1 Agonists (Ozempic) for Cosmetic Weight Loss: A Google Trends Analysis. Aesthetic Surgery Journal.