
Путь к спасению: клеточная и генная терапии в борьбе с заболеваниями периферических артерий
06 марта 2024
Путь к спасению: клеточная и генная терапии в борьбе с заболеваниями периферических артерий
- 614
- 0
- 2
Схематическое изображение закупорки сосудов.
Рисунок в полном размере.
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Сердечно-сосудистые заболевания являются одной из главнейших проблем медицины XXI века. Всем известно об ишемии и ее влиянии на сердечную мышцу, но не только сердце страдает от данной патологии. В нашей работе мы рассмотрим проблему ишемии задних конечностей и новые методы лечения с помощью клеточных и генных технологий. Кроме того, мы подробнее расскажем, что представляют собой процессы ангиогенеза и артериогенеза.
Конкурс «Био/Мол/Текст»-2023/2024
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
К чему может привести хромота и вредные привычки?
Заболевание периферических артерий (ЗПА) — группа патологий периферических артерий, характеризующихся поражением артериальных сосудов периферических тканей, которое может приводить к недостатку кислорода и питательных веществ в органах и тканях. Одной из наиболее частых причин возникновения данной патологии является атеросклероз, но не менее важным остается проблема повреждения и сдавливания сосудов, нарушение микроциркуляции и другие причины. В данном исследовании мы рассматривали именно нижние конечности или же, в случае с животными моделями, задние. Сам по себе атеросклероз носит остросоциальный характер, но в связи с малой информированностью немногие люди задумываются о проблеме. Только по последним оценкам от данной болезни страдают более 200 млн человек во всем мире [1]. Проблема раннего лечения ЗПА заключается в трудном диагностировании данной патологии. В самом частом случае на начальном этапе наблюдается небольшая хромота, которую тяжело диагностировать как ЗПА. Человек не придает ей большого значения, что в итоге может привести к прогрессированию заболевания. Все это может спровоцировать острое течение заболевания и необходимость хирургического вмешательства [2]. Основным клиническим методом диагностики является лодыжечно-плечевой индекс, который представляет собой показатель состояния кровеносных сосудов в нижних конечностях. Данный индекс рассчитывается как отношение систолического артериального давления на ногах к уровню давления на руках, референсные значения находятся в диапазоне от 0,9 до 1,3 [3], [4]. В этой связи необходимо углублять знания в методах диагностики на ранних стадиях заболевания и разработки фармацевтических препаратов для лечения острой и хронической формы ЗПА, которая приведет к уменьшению хирургических инвазивных процедур и к большой доступности курса лечения [5–7]. В настоящее время основным способом лечения считается хирургическая реконструкция сосудов, а именно, сшивание дополнительного сосуда в обход поврежденного, шунтирование поврежденного сосуда [8–11]. К проблемам хирургического лечения относятся противопоказания хирургического вмешательства у некоторых пациентов. Также одной из важнейших проблем служит послеоперационных уход и подбор медикаментозного лечения, который тоже может быть отвергнут определенной группой пациентов [12]. В связи с этим в последние годы активно ведется разработка клеточной и генной терапии, действующих как модуляторы терапевтического ангиогенеза или же способствующие привлечению стволовых клеток в зону патологии. Такие методы являются более универсальными, не требующими инвазивного вмешательства, и послеоперационного восстановления, и будут подходить пациентам с сопутствующими хроническими заболеваниями [13–15].
Особо высоким риском появления ЗПА могут выступать не только хронические заболевания, но и вредные привычки, такие обыденные, как курение и алкоголь [16]. Среди хронических заболеваний, на фоне которых может развиваться ЗПА, выделяются сахарный диабет, дислипидемии и гипертонии [17–19]. На первых занятиях по изучению сахарного диабета на кафедрах патофизиологии студенты узнают, что у людей с данной патологией особо сильно страдают периферические сосуды, что приводит, например, к синдрому диабетической стопы, которая характеризуется инфекцией или язвой в области стоп, связанной с нарушением кровотока в нижние конечности [20]. В случае с вредными привычками ситуация, в результате которой повышается риск возникновения ЗПА, донельзя стандартная: повышается уровень липопротеинов низкой плотности (ЛПНП), следовательно, повышается уровень холестерина, что приводит к закупорке сосудов и дальнейшему прогрессированию заболевания. Здесь мы объяснили механизм возникновения атеросклеротической бляшки очень скудно, но, думаем, в других статьях вы можете куда более точно изучить механизмы атеросклероза сосудов. Наша же задача — изучить уже возникшие патологии, появившиеся в результате ранее описанных факторов или же в результате какой-либо травмы, и, что еще интереснее, рассмотреть способы лечения с помощью современных технологий и достижений генной и клеточной инженерии [21], [22].
Артериогенез и ангиогенез: строители сосудов в организме
Для начала нам нужно разобраться, что представляет из себя острая и хроническая форма ЗПА, а также узнать отличия артериогенеза от ангиогенеза. Начнем наше путешествие с определения форм заболевания. В привычном понимании острая форма — это внезапно возникшее клиническое яркое проявление заболевания. Хроническая же форма может возникать постепенно и не проявляться клинически, имея накопительный эффект. Так вот, если говорить о внезапно возникшем ЗПА, то мы имеем дело с прекращением артериального кровотока в конечности, которое может возникнуть в результате закупорки или сжатия сосуда. В данном случае требуется неотложная помощь, так как при нарушении артериального кровотока возникает угроза целостности конечности. Хроническая же форма ЗПА, в большинстве случаев, возникает в результате уменьшения просвета сосуда, вследствие чего ткани дистальных конечностей начинают получать меньше кислорода и питательных веществ. В данном случае возможно медикаментозное лечение. И чем раньше начнется это лечение, тем больше шансов на успех [23–25].
Теперь же разберемся с артериогенезом и ангиогенезом. Ангиогенез представляет собой процесс восстановления, при котором новые сосуды образуются из уже существующих сосудов. Данный процесс происходит во многих физиологических процессах в нашем организме, будь то заживление ран или менструация. В этих процессах ангиогенез жестко контролируется нашим организмом с помощью проангиогенных и антиангиогенных факторов, таких как VEGF (фактор роста эндотелия сосудов), FGF (фактор роста фибробластов), IGF (инсулиноподобный фактор роста). Нарушение баланса этих факторов приводит к неконтролируемому росту сосудов. Артериогенез, в свою очередь, возникает при сосудистых поражениях и представляет собой анатомическую трансформацию существующих коллатеральных артерий. Коллатерали — это боковые ветви кровеносных сосудов, которые идут в обход основному сосуду. Они не участвуют в образовании новых сосудов, а обеспечивают ткани кровотоком при различных нарушениях, например, сдавливании сосуда или при тромбозе, когда функция основного сосуда невозможна или затруднена. При артериогенезе происходит увеличение площади просвета и толщины стенки сосуда. Также при артериогенезе возникает местная воспалительная реакция, которая вызывает апоптоз в соседних эндотелиальных клетках [26].
В качестве главного стимула ангиогенеза выступает гипоксия, вследствие которой происходит активация метаболических путей. Это приводит к началу работы таких сигнальных белков, как HIF (индуцируемый гипоксией фактор), VEGF, FGF и ряда других. При гипоксии происходит разрыв базальных мембран и внеклеточного матрикса, в результате этих изменений осуществляется миграция эндотелиальных клеток во внесосудистое пространство, где они начинают пролиферировать и дифференцироваться. Этот процесс завершается образованием трубочек с просветом, что, в свою очередь, приводит к образованию новой капиллярной сети (рис. 1). В случае с артериогенезом главным стимулом выступает нарушение давления и напряжения стенки сосуда, в результате чего происходит рекрутирование гладкомышечных клеток для нормализации работы сосуда между артериями. После этого сосуд уплотняется и становится нормальным сосудом. С точки зрения биохимических факторов, при артериогенезе происходит активация цитокинов и рецепторов клеточной адгезии, например, увеличение напряжения сосуда вызывает повышение уровня экспрессии таких белков, как MCP-1 (моноцитарный хемотаксический белок 1), TNF-α (фактор некроза опухоли α), FGF и MMP (матриксные металлопротеиназы) [26].
В настоящее время существуют различные направления по исследованию новых клеточных и генных препаратов и определению наиболее оптимального механизма репарации периферических сосудов. Но проблема состоит в моделировании этих патологий, а конкретно, нахождении мишеней для данных терапий и их репрезентативности для человека. Например, уже обнаружено, что активация сигнального пути VEGF-VEGFR2, который играет ключевую роль в регуляции ангиогенеза, при переходе к клиническим испытаниям у людей не приводила к желаемому успеху [27]. По этой причине в настоящий момент доклинические исследования служат особо ценным инструментом в поиске необходимых биологических мишеней, а также объектом для изучения потенциальной эффективности терапевтических препаратов.
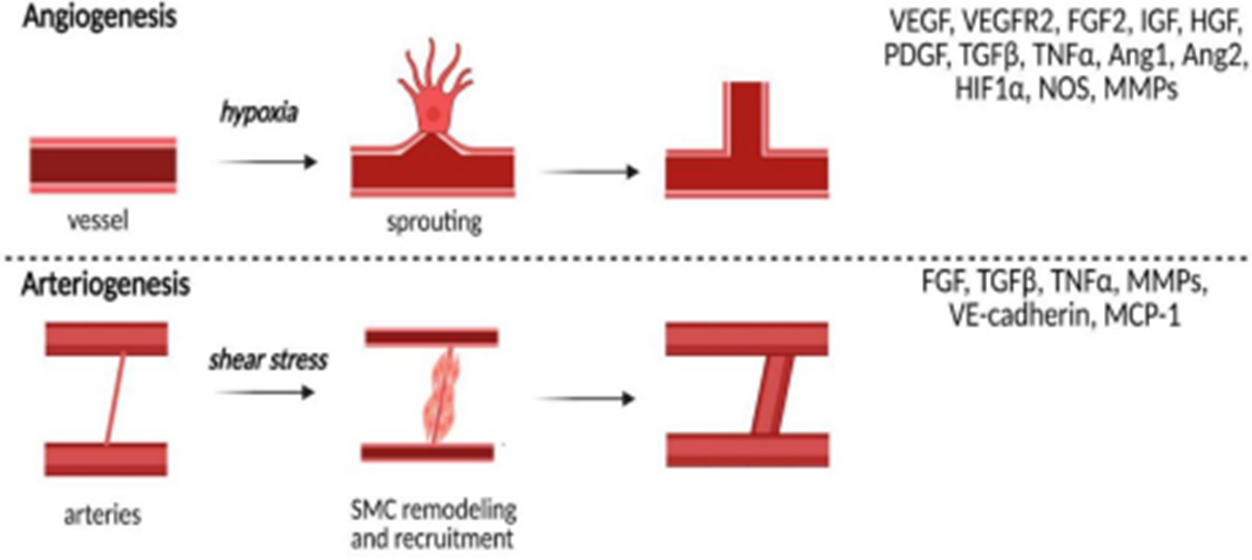
Рисунок 1. Механизмы артериогенеза и ангиогенеза, а также факторы, которые в них задействованы.
Как же нам изучать кандидатов для помощи нашему организму?
Теперь же мы приступим к изучению существующих моделей, узнаем их плюсы и минусы. Сразу же надо сказать, что изучение ЗПА большинством исследователей ведется на нижних конечностях животных. Самым часто используемым модельным объектом при изучении ЗПА являются мыши, немного реже используются крысы. Основным методом моделирования является хирургическое вмешательство, которое используется, чтобы остановить кровоток в сосудах. Основными мишенями для лигирования и/или иссечения становятся внутренняя и внешняя подвздошные артерии. Также важным обстоятельством является место лигирования или иссечения сосуда, так как различные положения места лигирования запускают разные пути восстановления сосуда, то есть в одном случае запустится артериогенез, в другом — ангиогенез. Сами же подходы моделирования могут отличаться от нужд исследователя, временного промежутка и от того, какой механизм репарации необходимо исследовать. Так, используются подходы от одиночной перевязки бедренной артерии до полного иссечения бедренной артерии и ее боковых ветвей. В зависимости от этого будет отличаться длительность реперфузии и степень поврежденности окружающих мышц, на которых будет изучена ишемия. Основным преимуществом мышей как модельных объектов является воспроизводимость и имитация специфических особенностей ЗПА у человека. Минусами же являются размеры животного, из-за которых возникают ограничения по манипуляциям с животным. Также в большинстве случаев модель ишемии у мышей имеет острый характер, а для изучения генных и клеточных препаратов предпочтителен результат с хроническим исходом. У крыс же в этом плане больше преимуществ, так как возможно не просто моделирование хронического состояния ЗПА, но и ЗПА на фоне сахарного диабета или атеросклероза, что более интересно для исследователей. В опубликованной нами работе вы можете найти интересующие вас подробности моделирования данной патологии, нюансах и более детального описания методологии [28].
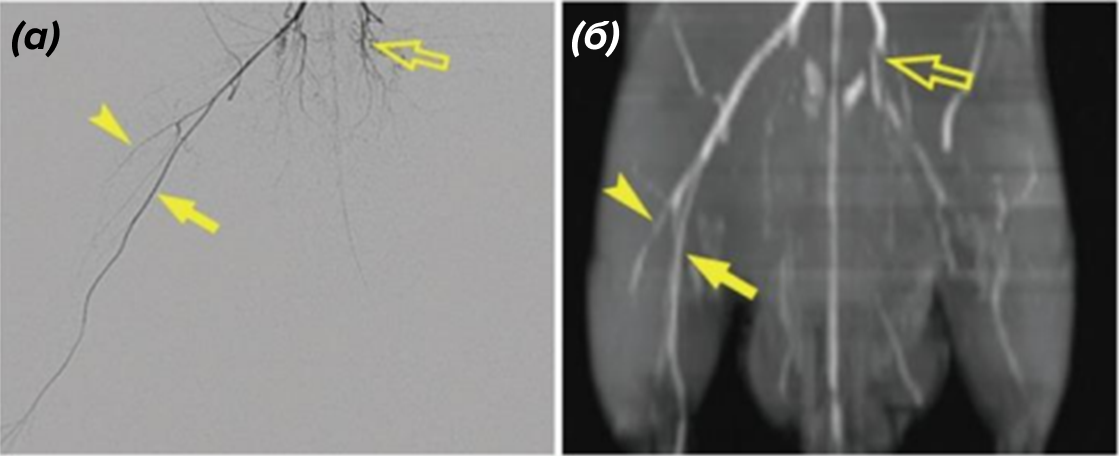
Рисунок 2. Ангиограмма (а) и TOF-MRA (б) у крыс Sprague-Dawley на 14-й день ишемии задней конечности. Закрашенными стрелками показаны сосуды в норме, пустыми стрелками сосуды после ишемии. TOF-MRA — времяпролетная магнитно-резонансная ангиография (метод получения детального изображения кровеносных сосудов при помощи МРТ).
Choose your fighter
В нашем приключении в поиске «волшебного способа регенерации» мы обратимся к современным методам терапии, а конкретно — к генной и клеточной. Вначале разберемся с генной терапией — это введение генетического материала в организм человека. В большинстве случаев генетический материал доставляется в виде векторов (носителей для доставки генов). В качестве доставки используются вирусные и невирусные векторы. Подробнее узнать о генной терапии, векторах и методах, которые используются в данной области, вы можете из статей, опубликованных на «Биомолекуле» [30–35].
Основными мишенями для лечения ЗПА с использованием генных препаратов являются: VEGF, HGF (фактор роста гепатоцитов), FGF, HIF-1α, Del-1 (белок эндотелиального локуса развития-1) [36].
В большинстве исследований в качестве мишени обычно выбирается VEGF, так как он рассматривается как первичный рецептор, активация которого запускает зависимый от гипоксии ангиогенез. Вторым по популярности у исследователей оказался фактор роста гепатоцитов, который улучшает перфузию, то есть прохождение крови через ткани организма у пациентов с критической ишемией конечности. Это дает надежду на лечение ЗПА даже при поздних стадиях заболевания без ампутации конечности. Остальные мишени терапии находятся на стадии изучения эффективности и определения дозы эффективности, но, в целом, в некоторых исследованиях 1 фазы клинических испытаний была показана их безопасность [37].
Теперь разберемся с клеточной терапией. Клеточная терапия основана на трансплантации клеток пациенту для восстановления функции клеток его собственного организма. У данного метода терапии выделяют два механизма действия [38–40]:
- Замена поврежденной ткани в результате дифференцировки мультипотентных или унипотентных клеток в клетки определенного вида и замена поврежденных. Такие клетки встраиваются в место повреждения и заменяют патологические клетки.
- Высвобождение растворимых факторов, таких как цитокины, хемокины, факторы роста и тд. При данном механизме действия терапевтические клетки действуют эндокринным или паракринным образом, вызывая индукцию собственных клеток организма и их миграцию в поврежденную область.
В исследованиях по терапии ЗПА можно обнаружить использование обоих механизмов, поэтому разберемся немного конкретнее с препаратами, которые используют в испытаниях.
Первыми на очереди клетками, имеющими потенциал к лечению, являются эндотелиальные клетки-предшественники. В норме данные клетки происходят из костного мозга и могут участвовать в ангиогенезе [41], [42]. Для терапии эндотелиальные клетки получают из фибробластов, которые под действием таких факторов, как Oct3/4 (октамер-связывающий транскрипционный фактор), Sox2 (SRY(Пол-определяющая область)-box 2), KLF4 (крюпелеподобный фактор 4) и c-Myc (клеточный миелоцитоматоз), превращаются в индуцированные плюрипотентные стволовые клетки. Затем они дифференцируются в необходимую линию эндотелиальных клеток в результате действия факторов VEGF и PDGF (фактор роста тромбоцитов). Полученные эндотелиальные клетки проявляют все необходимые характеристики и функции, экспрессируя на своей поверхности маркеры клеток эндотелия. Они способны выделять оксид азота и ангиогенные цитокины, такие как VEGF-A, VEGF-C, PDGF-AA, Ang-1 (ангиопоэтин-1) и FGF. При данном подходе получения эндотелиальных клеток и при введении в ишемизированную область наблюдалось увеличение перфузии [43], [44].
Следующим кандидатом на лечение ЗПА являются мезенхимальные стволовые клетки. Эти клетки представляют собой мультипотентные стромальные клетки; они могут дифференцироваться в различные типы клеток, их получают из костного мозга [45], [46]. В ряде исследований было показано, что введение мезенхимальных стволовых клеток способствовало образованию сосудов и ангиогенезу в результате секретирования паракринных сигналов, которые влияют на эндотелиальные клетки и гладкомышечные клетки сосудов. Кроме того, мезенхимальные стволовые клетки способствовали восстановлению и регенерации скелетных мышц в ишемизированной ткани [40], [47–50].
Нельзя оставить без внимания и мононуклеарные клетки костного мозга и периферической крови. Сами по себе мононуклеарные клетки представляют собой смесь моноцитов, лимфоцитов, гранулоцитов, негемопоэтических стволовых клеток и эндотелиальных клеток-предшественников, которые получают либо из костного мозга, либо из периферической крови. Исследования с использованием данных клеток в качестве терапевтического средства показывают, что внутримышечная инъекция мононуклеарных клеток костного мозга улучшала лодыжечно-плечевой индекс и перфузию крови. Использование мононуклеарных клеток периферической крови также положительно сказывалось на лодыжечно-плечевом индексе, перфузии крови и выживаемости на мышиных моделях ЗПА [26], [51].
Сама по себе клеточная терапия является очень перспективным методом лечения многих заболеваний, но во многих крупных плацебо-контролируемых исследованиях не наблюдались некоторые эффекты, встречаемые в более мелких исследованиях по эффективности клеточных препаратов. Причин, которые приводят к таким результатам, можно назвать несколько [51]. Во-первых, это недостаток адекватных экспериментальных моделей, которые воспроизводят острое или хроническое состояние заболевание с теми же молекулярными и клеточными мишенями, что характерны для человека. В результате этого клеточные и генные препараты не показывают такую же эффективность, как в исследованиях на животных. Во-вторых, нехватка данных о выживаемости и времени активности клеток и оценки клинических результатов между исследователями. И, наконец, отсутствие стандартных протоколов для характеристики клеток и оценки клинических результатов между исследователями.
Заключение
В настоящее время подходы для лечения ЗПА, основанные на использовании генной и клеточной терапий, являются одними из самых перспективных для использования в терапии заболевания. Изучены и изучаются отдельные ангиогенные факторы, такие как VEGF, HGF и HIF-1α, на которые могут быть нацелены новые лекарственные препараты. Одной из главной проблем использования данных подходов для терапии ЗПА является разрыв результатов между доклиническими исследованиями и клиническими исследованиями. Есть проблемные области для данных препаратов, которые еще предстоит решить, но уже на данном этапе есть сведения о многообещающих терапевтических эффектах при использовании клеточной и генной терапии в доклинических и клинических испытаниях. Таким образом, мы имеем реальную возможность получить важную потенциальную стратегию лечения ЗПА в обход хирургических вмешательств, длительного восстановления и непредсказуемых эффектов от этих процедур.
Литература
- Victor Aboyans, Jean-Baptiste Ricco, Marie-Louise E L Bartelink, Martin Björck, Marianne Brodmann, et. al.. (2018). 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS). European Heart Journal. 39, 763-816;
- Firnhaber J.M., Powell C.S. (2019). Lower Extremity Peripheral Artery Disease: Diagnosis and Treatment. American family physician. 99, 362–369;
- Fay Crawford, Karen Welch, Alina Andras, Francesca M Chappell. (2016). Ankle brachial index for the diagnosis of lower limb peripheral arterial disease. Cochrane Database of Systematic Reviews. 2016;
- N Bhasin, D J A Scott. (2007). Ankle Brachial Pressure Index: identifying cardiovascular risk and improving diagnostic accuracy. J R Soc Med. 100, 4-5;
- Thomas F.X. O'Donnell, Sarah E. Deery, Marc L. Schermerhorn, Jeffrey J. Siracuse, Daniel J. Bertges, et. al.. (2018). The Impact of Perioperative Ankle-Brachial Index and Clinical Status on Outcomes following Lower Extremity Bypass. Annals of Vascular Surgery. 53, 139-147;
- Devraj Sukul, Scott F. Grey, Peter K. Henke, Hitinder S. Gurm, P. Michael Grossman. (2017). Heterogeneity of Ankle-Brachial Indices in Patients Undergoing Revascularization for Critical Limb Ischemia. JACC: Cardiovascular Interventions. 10, 2307-2316;
- Fay Crawford, Karen Welch, Alina Andras, Francesca M Chappell. (2016). Ankle brachial index for the diagnosis of lower limb peripheral arterial disease. Cochrane Database of Systematic Reviews. 2016;
- George A Antoniou, George S Georgiadis, Stavros A Antoniou, Ragai R Makar, Jonathan D Smout, Francesco Torella. (2017). Bypass surgery for chronic lower limb ischaemia. Cochrane Database of Systematic Reviews;
- M. Lepäntalo, K. Laurila, W.-D. Roth, P. Rossi, J. Lavonen, et. al.. (2009). PTFE Bypass or Thrupass for Superficial Femoral Artery Occlusion? A Randomised Controlled Trial. European Journal of Vascular and Endovascular Surgery. 37, 578-584;
- Suzanne S. Gisbertz, Rudolf P. Tutein Nolthenius, Gert Jan de Borst, Lyckle van der Laan, Tim Th. C. Overtoom, et. al.. (2010). Remote Endarterectomy Versus Supragenicular Bypass Surgery for Long Occlusions of the Superficial Femoral Artery: Medium-Term Results of a Randomized Controlled Trial (The REVAS Trial). Annals of Vascular Surgery. 24, 1015-1023;
- Swedish Council on Health Technology Assessment. (2008). Peripheral Arterial Disease – Diagnosis and Treatment: A Systematic Review. SBU Yellow Report. 187;
- Jihee Kang, Ji Hyun An, Hong Jin Jeon, Yang Jin Park. (2021). Association between ankle brachial index and development of postoperative intensive care unit delirium in patients with peripheral arterial disease. Sci Rep. 11;
- Robert J Lederman, Farrell O Mendelsohn, R David Anderson, Jorge F Saucedo, Alan N Tenaglia, et. al.. (2002). Therapeutic angiogenesis with recombinant fibroblast growth factor-2 for intermittent claudication (the TRAFFIC study): a randomised trial. The Lancet. 359, 2053-2058;
- Sanjay Rajagopalan, Emile R. Mohler, Robert J. Lederman, Farrell O. Mendelsohn, Jorge F. Saucedo, et. al.. (2003). Regional Angiogenesis With Vascular Endothelial Growth Factor in Peripheral Arterial Disease. Circulation. 108, 1933-1938;
- T A Khan, F W Sellke, R J Laham. (2003). Gene therapy progress and prospects: therapeutic angiogenesis for limb and myocardial ischemia. Gene Ther. 10, 285-291;
- Ramin Shadman, Michael H. Criqui, Warner P. Bundens, Arnost Fronek, Julie O. Denenberg, et. al.. (2004). Subclavian Artery Stenosis: Prevalence, Risk Factors, and Association With Cardiovascular Diseases. Journal of the American College of Cardiology. 44, 618-623;
- Michael H. Criqui, Victor Aboyans. (2015). Epidemiology of Peripheral Artery Disease. Circ Res. 116, 1509-1526;
- Michel M. Joosten, Jennifer K. Pai, Monica L. Bertoia, Eric B. Rimm, Donna Spiegelman, et. al.. (2012). Associations Between Conventional Cardiovascular Risk Factors and Risk of Peripheral Artery Disease in Men. JAMA. 308, 1660;
- Wouter T. Meijer, Diederick E. Grobbee, M. G. Myriam Hunink, Albert Hofman, Arno W. Hoes. (2000). Determinants of Peripheral Arterial Disease in the Elderly. Arch Intern Med. 160, 2934;
- Maren Volmer-Thole, Ralf Lobmann. (2016). Neuropathy and Diabetic Foot Syndrome. IJMS. 17, 917;
- Наночастицами — по «плохому» холестерину!;
- Хороший, плохой, злой холестерин;
- L. Norgren, W.R. Hiatt, J.A. Dormandy, M.R. Nehler, K.A. Harris, F.G.R. Fowkes. (2007). Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II). Journal of Vascular Surgery. 45, S5-S67;
- Robert B. Rutherford, J.Dennis Baker, Calvin Ernst, K.Wayne Johnston, John M. Porter, et. al.. (1997). Recommended standards for reports dealing with lower extremity ischemia: Revised version. Journal of Vascular Surgery. 26, 517-538;
- Bernat Soria, Natalia Escacena, Aitor Gonzaga, Barbara Soria-Juan, Etelvina Andreu, et. al.. (2023). Cell Therapy of Vascular and Neuropathic Complications of Diabetes: Can We Avoid Limb Amputation?. IJMS. 24, 17512;
- Mohamed Sabra, Catherine Karbasiafshar, Ahmed Aboulgheit, Sidharth Raj, M. Ruhul Abid, Frank W. Sellke. (2021). Clinical Application of Novel Therapies for Coronary Angiogenesis: Overview, Challenges, and Prospects. IJMS. 22, 3722;
- Brian H. Annex, John P. Cooke. (2021). New Directions in Therapeutic Angiogenesis and Arteriogenesis in Peripheral Arterial Disease. Circ Res. 128, 1944-1957;
- V. M. Pavlov, Branch of Institute of Bioorganic Chemistry, Russian Academy of Sciences, Pushchino, Moscow region, Russia, A. Yu. Fedotova, M. V. Shinelev, V. A. Palikov, et. al.. (2024). Pathological changes in the gastrocnemius muscle throughout hind limb ischemia modeling in rats. BEBM. 177, 31-35;
- Cheong-Il Shin, Hyo-Cheol Kim, Yong Sub Song, Hye Rim Cho, Kyoung-Bun Lee, et. al.. (2013). Rat Model of Hindlimb Ischemia Induced via Embolization with Polyvinyl Alcohol and N-Butyl Cyanoacrylate. Korean J Radiol. 14, 923;
- Молекулярное клонирование, или как засунуть в клетку чужеродный генетический материал;
- Великий рекомбинатор;
- Генная терапия: познакомьтесь с лекарствами будущего;
- Биотехнология. Генная инженерия;
- 12 методов в картинках: генная инженерия. Часть I, историческая;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники;
- Jingxuan Han, Lailiu Luo, Olivia Marcelina, Vivi Kasim, Shourong Wu. (2022). Therapeutic angiogenesis-based strategy for peripheral artery disease. Theranostics. 12, 5015-5033;
- Rachel Forster, Aaron Liew, Vish Bhattacharya, James Shaw, Gerard Stansby. (2018). Gene therapy for peripheral arterial disease. Cochrane Database of Systematic Reviews. 2018;
- Abed El-Hakim El-Kadiry, Moutih Rafei, Riam Shammaa. (2021). Cell Therapy: Types, Regulation, and Clinical Benefits. Front. Med.. 8;
- Vasileios Karantalis, Ivonne Hernandez Schulman, Wayne Balkan, Joshua M. Hare. (2015). Allogeneic Cell Therapy. Circulation Research. 116, 12-15;
- Eriko Tateishi-Yuyama, Hiroaki Matsubara, Toyoaki Murohara, Uichi Ikeda, Satoshi Shintani, et. al.. (2002). Therapeutic angiogenesis for patients with limb ischaemia by autologous transplantation of bone-marrow cells: a pilot study and a randomised controlled trial. The Lancet. 360, 427-435;
- Oren M. Tepper, Robert D. Galiano, Jennifer M. Capla, Christoph Kalka, Paul J. Gagne, et. al.. (2002). Human Endothelial Progenitor Cells From Type II Diabetics Exhibit Impaired Proliferation, Adhesion, and Incorporation Into Vascular Structures. Circulation. 106, 2781-2786;
- G. P. Fadini, A. Avogaro. (2010). Potential manipulation of endothelial progenitor cells in diabetes and its complications. Diabetes Obesity Metabolism. 12, 570-583;
- Abdul Jalil Rufaihah, Ngan F. Huang, Sina Jamé, Jerry C. Lee, Ha N. Nguyen, et. al.. (2011). Endothelial Cells Derived From Human iPSCS Increase Capillary Density and Improve Perfusion in a Mouse Model of Peripheral Arterial Disease. ATVB. 31;
- Ngan F. Huang, Hiroshi Niiyama, Christoph Peter, Abhijit De, Yasodha Natkunam, et. al.. (2010). Embryonic Stem Cell–Derived Endothelial Cells Engraft Into the Ischemic Hindlimb and Restore Perfusion. ATVB. 30, 984-991;
- Debin Lu, Bing Chen, Ziwen Liang, Wuquan Deng, Youzhao Jiang, et. al.. (2011). Comparison of bone marrow mesenchymal stem cells with bone marrow-derived mononuclear cells for treatment of diabetic critical limb ischemia and foot ulcer: A double-blind, randomized, controlled trial. Diabetes Research and Clinical Practice. 92, 26-36;
- B M Abdallah, M Kassem. (2008). Human mesenchymal stem cells: from basic biology to clinical applications. Gene Ther. 15, 109-116;
- Taiga Shibata, Keiko Naruse, Hideki Kamiya, Mika Kozakae, Masaki Kondo, et. al.. (2008). Transplantation of Bone Marrow–Derived Mesenchymal Stem Cells Improves Diabetic Polyneuropathy in Rats. Diabetes. 57, 3099-3107;
- David S Kwon, Xiaohua Gao, Yong Bo Liu, Deborah S Dulchavsky, Andrew L Danyluk, et. al.. (2008). Treatment with bone marrow‐derived stromal cells accelerates wound healing in diabetic rats. International Wound Journal. 5, 453-463;
- Gabriel P. Lasala, Jose A. Silva, Philip A. Gardner, Jose J. Minguell. (2010). Combination Stem Cell Therapy for the Treatment of Severe Limb Ischemia: Safety and Efficacy Analysis. Angiology. 61, 551-556;
- Yaojiong Wu, Liwen Chen, Paul G. Scott, Edward E. Tredget. (2007). Mesenchymal Stem Cells Enhance Wound Healing Through Differentiation and Angiogenesis. Stem Cells. 25, 2648-2659;
- Nikolaos G Frangogiannis. (2018). Cell therapy for peripheral artery disease. Current Opinion in Pharmacology. 39, 27-34.






