
Работа над ошибками адаптивного иммунитета: новый подход к лечению болезни Бехтерева
08 января 2024
Работа над ошибками адаптивного иммунитета: новый подход к лечению болезни Бехтерева
- 2670
- 0
- 7
Новый подход к лечению болезни Бехтерева основан на применении цитотоксического антитела, таргетно убивающего аутоиммунные Т-клетки, но не приводящего к подавлению какой-либо ветви иммунитета. На иллюстрации ученая целится из рогатки, символизирующей антитело, в бешенных псов, олицетворяющих аутоиммунные Т-клетки. Рядом с ней в безопасности сидят хорошие мальчики и девочки (в виде розовых собачек) — прочие Т-клетки.
Рисунок в полном размере.
иллюстрация Lena Podobed
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: При болезни Бехтерева собственный иммунитет разрушает суставы, медленно приводя к их окостенению. Пациентам приходится справляться с постоянными болями и ежедневно бороться за сохранение активного образа жизни. Болезнь считалась неизлечимой. В этой статье мы расскажем о своей работе, в результате которой была разработана новая терапия, направленная на первопричину (а не симптомы!) заболевания, о первом получившем ее пациенте и о возможностях применения этого подхода для лечения других заболеваний. Научная публикация по работе вышла в журнале Nature Medicine.
Конкурс «Био/Мол/Текст»-2023/2024
 Эта работа заняла первое место в номинации «Своя работа» конкурса «Био/Мол/Текст»-2023/2024.
Эта работа заняла первое место в номинации «Своя работа» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.
Партнер номинации — компания «Хеликон».

«Книжный» спонсор конкурса — «Альпина нон-фикшн».
При аутоиммунных патологиях [1] собственные иммунные клетки ошибочно атакуют здоровые ткани организма. Одна из таких патологий — Болезнь Бехтерева или анкилозирующий спондилоартрит — поражает суставы. Воспаление чаще всего начинается с крестцово-подвздошных сочленений и распространяется вверх по позвоночнику. Болезнь развивается медленно, но неумолимо: хроническое воспаление вызывает не только постоянные боли, но и приводит к постепенному сращиванию суставов (анкилозу), что значительно ухудшает их подвижность и качество жизни пациентов. До недавнего времени лечение анкилозирующего спондилоартрита было лишь симптоматическим, направленным на снижение воспалительных процессов.
Наша научная группа уже более 15 лет занимается изучением адаптивного иммунитета и лидирует в области анализа Т- и В-клеточных репертуаров. Многолетний труд в данном направлении дал свои плоды и в медицинской практике. Работа, выполненная под руководством Дмитрия Чудакова и Сергея Лукьянова и опубликованная в Nature Medicine [2], рассказывает об инновационном подходе к лечению болезни Бехтерева, бьющем по первопричине заболевания. Предложенный метод не только дает надежду пациентам с анкилозирующим спондилоартритом, но и открывает новую эру в лечении аутоиммунных патологий. В этой статье рассмотрим содержание работы и разберемся: почему иммунитет может обратиться против хозяина и как исправить его ошибки.
Открытия, предшествующие разработке нового лечения
Главные герои работы — Т-клетки — верные псы, стоящие на страже безопасности организма. Т-клетки разделяются на две основные популяции: Т-хелперы (CD4+) и цитотоксические Т-лимфоциты (CD8+). Первые управляют иммунным ответом и, как сторожевые псы, поднимают шум, если заметят непрошенного гостя. Вторые, как древние боевые собаки, бросаются на врага и уничтожают зараженные или раковые клетки. В контексте болезни Бехтерева основную роль играют именно цитотоксические CD8+ Т-лимфоциты.
Т-клетки как бы обнюхивают своими чуткими носиками — Т-клеточными рецепторами (ТКР) — поверхности клеток на предмет спрятанных внутри опасностей. Ключевой процесс, позволяющий иммунной системе следить за происходящим внутри клетки, — презентация антигена. Каждая клетка разрезает на мелкие части все белки, что есть у нее внутри, и выставляет в специальных витринах — комплексах гистосовместимости (MHC — major histocompatibility complex; у человека их принято называть HLA — human leukocyte antigen). Если внутрь клетки забрался вирус или другой внутриклеточный патоген, его частичка также будет выставлена наружу в комплексе с MHC. Цитотоксический Т-лимфоцит обнаружит MHC с частичкой вируса на поверхности клетки при помощи Т-клеточного рецептора и убьет зараженную клетку.
Чтобы защититься от невообразимого множества патогенов, которое постоянно меняется и эволюционирует, в человеческом организме присутствует около 1011 Т-клеток, несущих 109 различных Т-клеточных рецепторов [4]. От ТКР зависит, будет ли Т-клетка бороться с вирусом герпеса или с новым штаммом SARS-CoV-2. Для кодирования столь огромного множества рецепторов в человеческом геноме попросту не хватило бы места, поэтому природа решила эту задачу другим элегантным способом. Каждый Т-клеточный рецептор собирается случайно в процессе созревания Т-лимфоцита из фрагментов, закодированных в геноме. Так, каждый пес натренирован на выслеживание только одного врага, и какого именно — определяет случай.
Если вам интересно подробней узнать о Т-клеточных рецепторах и анализе их совокупностей, рекомендуем статью Дмитрия Чудакова [3]. Мы же остановимся лишь на тех подробностях, которые необходимы для понимания принципа действия новой терапии. Если вы открыли статью в Nature Medicine [2], то уже в названии увидели, что она основана на удалении TRBV9+ Т-клеток из организма. Что же это значит?
ТКР состоит из двух субъединиц: ɑ- и β-цепей. Каждая цепь собирается, как мозаика, из нескольких генных сегментов. В случае β-цепи человека в начало помещается один из 52 V (variable) сегментов, в середину — один из двух D (diversity) сегментов, а в конец — J (joining) сегмент, выбранный из 13 вариантов. На месте стыков сегментов могут произойти случайные удаления нуклеотидов (делеции) или добавления новых (инсерции). TRBV9 — ген, кодирующий один из возможных V-сегментов β-цепи.
Но что, если в ходе случайной генерации получится ТКР, узнающий собственные пептиды организма? Как организм контролирует своих сторожевых псов, не давая набрасываться на хозяев? Во-первых, каждая Т-клетка при созревании тестируется на агрессивность к собственным тканям: если ТКР связывается с MHC и пептидом, полученным из своих же тканей, клетка с этим ТКР удаляется из репертуара. Во-вторых, если аутореактивная Т-клетка всё же проскочила через первый этап проверки, на периферии ее ждут регуляторные Т-клетки, подавляющие активность Т-лимфоцитов, нападающих на окружающих. В-третьих, собственные пептиды зачастую представлены на поверхности клеток в количестве, недостаточном для активации иммунного ответа. То есть потенциально опасные Т-лимфоциты могут присутствовать в организме, но в «спящем», неактивированном состоянии.
Таким образом, толерантность Т-клеток к собственным тканям контролируется тремя уровнями защиты. Однако при определенном стечении обстоятельств защита может быть прорвана. Давно существующая теория артритогенного пептида описывает один из возможных сценариев. Представим, что потенциально опасная Т-клетка — дикий волк — проскочила через проверку на «агрессивность» при созревании. После, будучи милым щенком, вела себя тихо и не привлекала внимания Т-регуляторных клеток. Но случилось чрезвычайное происшествие — бактериальная инфекция. Среди множества иммунных клеток, борющихся с инвазией, волчонок проявил себя, и опыт множества битв сделал его настоящим волком. Когда опасность миновала, он уже не смог остановиться и начал нападать на другие клетки, которые показались ему похожими на встреченные ранее бактерии. Таким образом, аутореактивные Т-клетки, активированные схожим с собственным бактериальным пептидом, впоследствии реагируют даже на небольшое содержание собственного пептида на поверхности клеток [5].
Также, как мы помним, ТКР взаимодействует не только с пептидами, но и с MHC, которые их представляют, поэтому Т-клетка не обязательно будет активироваться даже очень схожими пептидами в равной степени. Для этого похожие пептиды должны быть представлены Т-клеточному рецептору в составе одного и того же MHC. Рассмотрим, как MHC-контекст влияет на развитие болезни Бехтерева (рис. 1) [2].
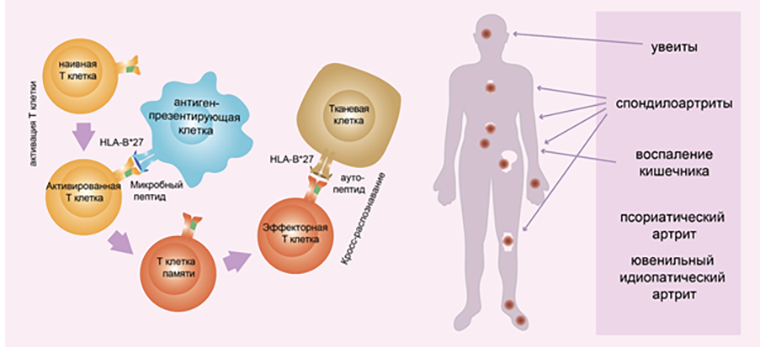
Рисунок 1. Предполагаемый механизм возникновения болезни Бехтерева и других HLA-B27 ассоциированных аутоиммунных заболеваний. Каждая клетка организма показывает Т-клеткам, что у нее внутри, нарезая на маленькие кусочки внутриклеточные белки и выставляя в специальных витринах — HLA. В норме на поверхности находятся только собственные пептиды, то есть последовательности, полученные из собственных белков организма. При бактериальной инфекции на поверхности антигенпрезентирующих клеток выставляется микробный пептид в комплексе с HLA-B27. Т-клетка специфично узнает комплекс пептид—HLA-B27 при помощи TRBV9+ Т-клеточного рецептора. В результате TRBV9+ Т-клетки активируются, то есть начинают делиться и продуцируют провоспалительные факторы, чтобы обеспечить контроль над инфекцией. Часть активированных Т-клеток становится эффекторными Т-клетками памяти. Далее, из-за схожести микробного пептида и собственного, эффекторные TRBV9+ Т-клетки атакуют здоровые такни. Таким образом формируется популяция аутоиммунных TRBV9+ Т-клеток.
В начале 70-х годов прошлого века группа ученых под руководством британского ревматолога и исследователя Джозефа Брювертона (Joseph B. Brewerton) выяснила, что большинство пациентов с болезнью Бехтерева являются носителями определенного гена, кодирующего один из MHC — HLA-B27. В изучаемой группе 96% пациентов с классическим анкилозирующим спондилоартритом имели аллель HLA-B27, тогда как в контрольной группе носителей этого гена было всего 4% [6]. Это никак не могло быть случайностью, так как гены HLA имеют самое большое количество аллельных вариантов среди всех человеческих генов. У вас и вашего лучшего друга, скорее всего, абсолютно разный набор генов HLA. В свою очередь, белки HLA, презентующие пептиды Т-клеткам, тоже немного отличаются, и в них по-разному «сидят» одни и те же пептиды.
В дальнейшем была показана связь HLA-B27 с другими аутоиммунными заболеваниями: псориатическим артритом [7], антериорным увеитом [8], ювенильным идиопатическим артритом и болезнью Крона [9], [10].
Но не стоит пугаться, если вы носитель HLA-B27 (а узнать это можно только по последовательности вашего генома). В абсолютном большинстве случаев это никак не влияет на жизнь и не ведет к аутоиммунным заболеваниям. Только у 5–6% носителей HLA-B27 обнаруживаются симптомы болезни Бехтерева. Оба автора данной статьи на «Биомолекуле» — носители HLA-B27, и у нас нет аутоиммунных заболеваний. Репертуар Т-клеточных рецепторов формируется путем стохастических перестроек участков генома, а дальнейшая судьба Т-клеток определяется случайными событиями вашей жизни: болезнями, путешествиями, рукопожатиями и поцелуями. Таким образом, наличие HLA-B27 увеличивает вероятность возникновения аутоиммунных заболеваний, но не говорит о непременном их развитии.
Болезнь Бехтерева была особенно интересна научному сообществу из-за наличия ассоциации с HLA-B27. Во-первых, так как HLA показывает внутриклеточную жизнь Т-клеткам, можно было предположить, что именно Т-клетки играют ключевую роль в аутоиммунном воспалении. Во-вторых, у разных людей атаковать собственные ткани или бороться с одним и тем же вирусом могут Т-клетки, несущие разные ТКР. Это связано со случайным формированием репертуара ТКР у каждого человека и с аллельными вариантами HLA. Если у двух людей разные варианты HLA, они будут по-разному подставлять один и тот же пептид под носики Т-клеток. Один и тот же аллельный вариант HLA-B27 у пациентов с анкилозирующим спондилоартритом указывал ученым на возможность существования общего для них варианта ТКР, узнающего собственные пептиды, и давал надежду на появление таргетного лечения.
И эти надежды оправдались. В 2017–18 годах независимые группы исследователей обнаружили общий мотив ꞵ-цепи T-клеточного рецептора, связанного с заболеванием [11], [12]. Мотив включал девятый сегмент вариабельного домена ТКР (TRBV9), что подтолкнуло нас уже на этой стадии начать разработку цитотоксического антитела против патогенных Т-клеток для лечения болезни Бехтерева. Если бы не существовало ассоциации между болезнью Бехтерева и HLA-B27, скорее всего, не удалось бы найти нечто общее среди Т-клеток многих пациентов.
Однако для понимания механизма заболевания нужна была полная структура ТКР. Пазл сложился, когда научная группа профессора Гарсия из Стэнфордского университета вместе с российскими учеными (Иван Звягин) расшифровали с помощью анализа транскриптома единичных клеток полную структуру патогенного ТКР. Теперь была известна не только β-цепь, но и вторая половинка ТКР — α-цепь. Было показано, что Т-клетки с данным ТКР активируются в ответ и на микробные, и на собственные пептиды, представленные в контексте HLA-B27. Наши волки-людоеды попали в фотоловушку, и мы увидели их морды крупными планом.
Следующим шагом стало определение артритогенного пептида, который пробуждает спящих волчат. Был проведен сравнительный анализ и найдена пара микробного и собственного пептида со схожей аминокислотной структурой. Таким образом, сложилась полная картина, какой именно бактериальный пептид провоцирует хронический аутоиммунный процесс и какие Т-клетки в него вовлечены [9].
От теории к практике
Для лечения болезни Бехтерева было решено прицельно ударить по найденным аутоиммунным Т-клеточным клонам. Так как была известна последовательность ТКР, отличающая их от других Т-клеток, мишенью стала одна из частей β-цепи Т-клеточного рецептора — TRBV9.
Усилиями ученых компании BIOCAD [13] и РНИМУ им. Пирогова был разработан препарат на основе цитотоксического антитела — BCD-180 [14]. Антитело связывается с Т-клеточным рецептором, а точнее, с TRBV9 доменом аутоиммунного Т-клеточного клона. Дальнейшее цитотоксическое действие антитела, то есть способность убивать клетки, к поверхности которых оно прилипло, связано с особенностью структуры константного домена. Антитело внешне похоже на рогатку, усики которой связываются с ТКР, а основание рогатки — константный домен — в свою очередь распознает либо натуральные киллеры и макрофаги, либо белки системы комплемента (рис. 2) [2]. У каждого из них свои способы уничтожить клетку, помеченную антителом: макрофаги поглощают и переваривают «чужеродную» клетку; натуральные киллеры запускают в ней процесс запрограммированной клеточной смерти; а белки системы комплемента разрушают мембрану. В результате этих процессов клетки, несущие TRBV9, погибают.
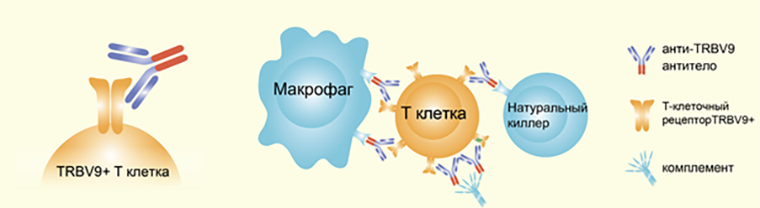
Рисунок 2. Механизм действия цитотоксического антитела. Анти-TRBV9 антитело взаимодействует с Т-клеточным рецептором и «помечает» Т-клетки, несущие вариабельный домен TRBV9. Константный домен такого антитела определяет его цитотоксические свойства или способность «убивать» другие клетки. Ликвидация меченых антителом TRBV9+ T клеток происходит двумя способами: через привлечение других иммунных клеток (макрофаги и натуральные киллеры), которые убивают TRBV9+ Т-клетки, или посредством системы комплемента.
Конечно, не только аутоиммунные Т-клетки несут TRBV9. Удаляются из репертуара также и клетки, не вовлеченные в аутоиммунный процесс (рис. 3). Однако TRBV9+ клетки составляют лишь 4% репертуара, и их гибель не приводит к общему подавлению иммунитета. Даже если из репертуара будет выбита Т-клетка с полезной специфичностью — например, против вируса гриппа, — среди огромного множества Т-лимфоцитов найдется другая с аналогичной функцией. Таким образом, применение анти-TRBV9 антитела у пациентов с болезнью Бехтерева должно выкосить всех диких волков, пожирающих организм, но не задеть большую часть полезных защитников.
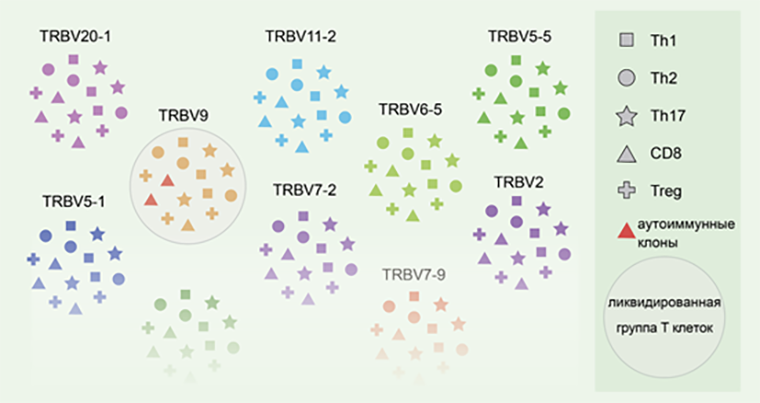
Рисунок 3. Разнообразие Т-клеток. β-цепь Т-клеточного рецептора может содержать разные вариабельные домены (TRBV20-1, TRBV9, TRBV5-1 и т. д.). Все Т-клетки можно разделить на группы по наличию того или иного вариабельного сегмента в составе ТКР. Удаление TRBV9+ Т-клеток не влияет на разнообразие репертуара ТКР и не подавляет какой-либо тип иммунного ответа (Th1, Th2, Th17 и т. д.).
Каждый препарат на основе моноклональных антител должен пройти несколько этапов проверок. Врачи и производители должны быть уверены в том, что препарат справляется с болезнью и не вредит пациентам. Для проверки безопасности и эффективности препарата (то есть способности антитела удалять TRBV9+ Т-клетки и не затрагивать другие) были проведены доклинические испытания на макаках. Испытания препарата на животных перед тем, как лекарство попадает к людям, — рутинная практика и обязательное требование для дальнейших исследований [15].
Во время испытаний обезьянки жили в комфортных условиях в Сочи и хорошо питались. Инъекция антитела не вызвала никаких серьезных побочных эффектов, и животные продолжили жить свою лучшую обезьянью жизнь. В нашей статье представлено слежение за Т-клеточным репертуаром обезьян до и после инъекции препарата. Мы увидели снижение TRBV9+ Т-клеток после инъекции вплоть до нулевых значений и сохранение их низкого содержания на большом временном промежутке. Иммунные клетки, несущие другие вариабельные сегменты, не пострадали. На самом деле, нам очень повезло, что полученное антитело против ТКР человека сработало на макаках! Ведь ген макак, кодирующий TRBV9, немного отличается от человеческого. Но BCD-180, как оказалось, может связываться и с человеческим, и обезьяньим вариантом ТКР.
Итак, на животных была показана эффективность препарата в таргетном удалении TRBV9+ Т-клеток и безопасность этой процедуры.
Первый пациент
Первым пациентом, получившим инъекцию анти-TRBV9, стал ученый, который не только подходил по всем критериям для тестирования препарата, но и был главным вдохновителем исследования! Также он является, наверное, самым изученным донором в области Т-клеточных репертуаров. На наших серверах хранится множество данных о его репертуарах ТКР, а в холодильниках лаборатории — замороженные образцы клеток крови более чем за 15 лет, что позволило проследить судьбу его иммунного репертуара на большом промежутке времени. Рассмотрим его долгую и непростую клиническую историю.
Назовем пациента L. Первые симптомы болезни Бехтерева у него появились еще в 20 лет. Постепенно состояние ухудшалось — в 36 лет уже наблюдались не только общая скованность, но и ограниченность движений в тазобедренных суставах и первые признаки сращения крестцово-подвздошных сочленений.
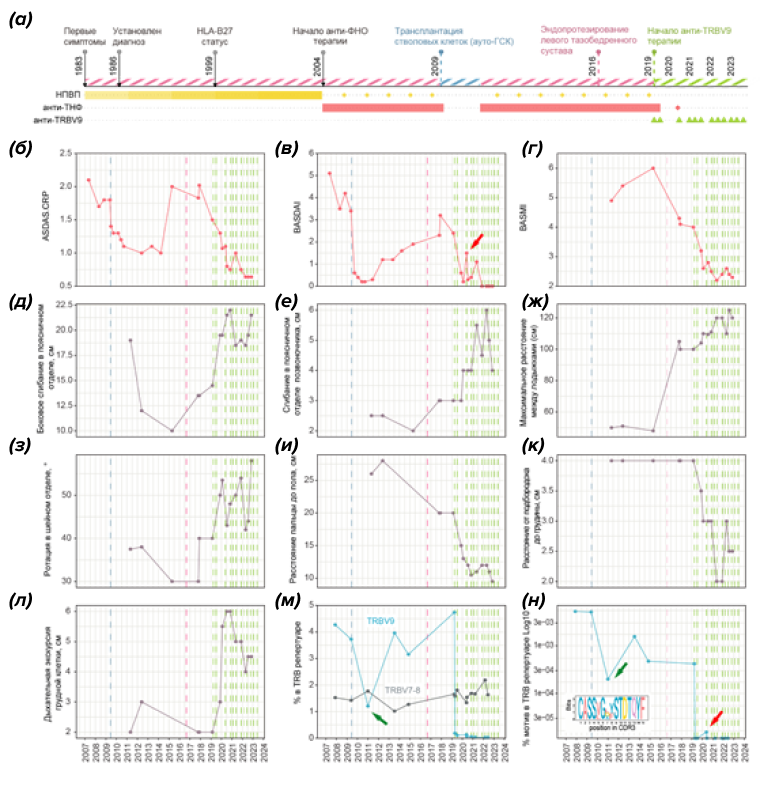
Рисунок 4. Клиническая история пациента L.
(а) — розовым цветом обозначены периоды активности заболевания, а синим и зеленым — ремиссии. Инъекции антител против TRBV9 обозначены зелеными треугольниками. Остальные препараты показаны прямоугольниками. Желтый прямоугольник с градиентом отражает увеличение дозы индометацина. Единичные приемы лекарств показаны ромбами.
(б–н) — синие пунктирные вертикальные линии показывают аутологичную трансплантацию, розовые — замену тазобедренного сустава, зеленые — введение анти-TRBV9;
(б) — ASDAS-CRP;
(в) — BASDAI;
(г) — BASMI;
(д–л) — показатели подвижности позвоночника;
(м) — доля клонотипов TRBV9 и TRBV7-8 в периферической крови согласно общему репертуару β-ТКР;
(н) — доля мотива, связанного с анкилозирующим спондилитом (мотив показан на вставке), в β-ТКР репертуаре, предварительно обогащенном на содержание TRBV9.
При построении графика учитывалась доля клонотипов TRBV9 в общем репертуаре. Зеленые стрелки указывают на истощение и мотива, связанного с анкилозирующим спондилитом, после аутологичной трансплантации. Красные стрелки указывают на ухудшение самочувствия, которое сопровождалось увеличением доли мотива, связанного с болезнью Бехтерева.
Медикаментозная терапия была типична (рис. 4а): сначала L принимал нестероидные противовоспалительные препараты, такие как индометацин. Приходилось постепенно увеличивать дозировку, но боли всё равно усиливались, и воспаление поразило весь позвоночник.
Позднее пациент перешел на биологические блокаторы медиатора воспаления — фактора некроза опухоли (ФНО). Эти препараты на основе моноклональных антител [16] — инфликсимаб (Remicade) и адалимумаб (Humira), которые связываются либо с самим ФНО, либо с его клеточным рецептором, — стали настоящим спасением для многих пациентов. Благодаря анти-ФНО терапии у L уменьшились боли и скованность в спине. Однако исследования показывают, что блокаторы ФНО способны снять симптомы, но не замедлить прогрессию заболевания [17]. К сожалению, по истечении пяти лет эффект применения биологических блокаторов практически сошел на нет.
В 2009 году L решился на трансплантацию собственных гемопоэтических стволовых клеток (ауто-ГСК, рис. 4а). Отметим, что это было экспериментальное лечение. Из-за высокого риска тяжелых осложнений оно редко применяется для аутоиммунных заболеваний. К счастью, для L трансплантация прошла благополучно: у него наблюдалась устойчивая ремиссия на протяжении двух лет. До и после трансплантации собирались образцы крови L для дальнейшего анализа репертуара ТКР (впрочем, на тот момент мы не знали ни мотива, ни семейства патогенного ТКР). Основной результат исследования на тот момент — обновление множества Т-клеток, подтвержденное секвенированием репертуаров ТКР. Подробности этого исследования описаны в другой нашей статье [18].
Спустя годы мы разморозили клетки крови L того периода и получили из них иммунные репертуары. В результате слежения за ними мы установили, что в тот момент времени существенно снизилась как доля всех TRBV9+ Т-клеток, так и содержание аутоиммунного мотива (рис. 4и—н). Так, ретроспективно, нашлось объяснение улучшению состояния пациента L в результате ауто-ГСК.
После двух лет ремиссии, достигнутой благодаря трансплантации, в 2013 состояние L обострилось. Это можно объяснить тем, что иммунные клетки обновляются на протяжении всей жизни. Есть вероятность, что родятся новые дикие звери — даже после столь радикальной процедуры как трансплантация гемопоэтических стволовых клеток, что мы и наблюдали у L.
Он возобновил анти-ФНО терапию. Чередовались разные моноклональные антитела, такие как инфликсимаб, адалимумаб, цертолизумаб и голимумаб. При этом каждый препарат был эффективен только 6–12 месяцев, и далее приходилось его менять. Интересно, что после 1–2 лет альтернативной анти-ФНО терапии изначальное антитело вновь обретало способность эффективно справляться с симптомами болезни. Возможным объяснением этого эффекта может быть следующее. Так как препарат по своей сути — инородный белок, к нему у пациента вырабатываются собственные нейтрализующие антитела. Они связываются с препаратом и подавляют его активность. Через некоторое время после отмены препарата снижается концентрация и выработка нейтрализующих антител, и препарат снова может быть эффективен при повторном приеме. Скорее всего, описанный механизм и позволял L снова возвращаться к потерявшей ранее эффективность терапии.
Мы почти добрались до ключевой для нас точки клинической истории. Чтобы в полной мере оценить произошедшие изменения, разберемся со специфическими ревматологическими понятиями.
Для мониторинга состояния пациента с болезнью Бехтерева ревматологи используют специализированные метрики (рис. 4б–л). Врачи измеряют, насколько близки кончики пальцев пациента к полу при наклоне, как далеко отводится каждая нога и другое. Усреднение нескольких таких измерений — BASMI — используется для оценки подвижности позвоночника пациента. В норме значение BASMI около нуля; у L оно доходило до 6 (рис. 4г). Другой индекс — BASDAI — используется для оценки активности заболевания и рассчитывается по результатам ответов пациента на специальные вопросы. Чем больше индекс, тем выше активность болезни Бехтерева. ASDAS-CRP также получается на основе результатов опроса пациента, но также учитывается уровень C-реактивного белка (CRP) в крови, который повышается при воспалении.
В результате большой совместной работы с клиницистами были собраны и проанализированы данные о десятке специализированных метрик для пациента L за последние 12–15 лет (рис. 4б–л). Посмотрев на рис. 4, вы может оценить их динамику. Бросаются в глаза две точки еще до лечения анти-TRBV9: 2009 и 2016 годы. Первое улучшение объясняется аутологичной трансплантацией клеток крови в 2009 году (рис. 4б–в; момент трансплантации отмечен синим пунктиром), а увеличение показателей подвижности в 2016 — результат замены тазобедренного сустава (рис. 4и, л; операция отмечена красным пунктиром). Однако самые интересные изменения были еще впереди.
В марте 2019 пациент первым в мире получил первую дозу анти-TRBV9 антитела. Всех охватывало нешуточное беспокойство. Только L был в радостном волнении — кажется, возбужденном в большей степени научным интересом. Ко всеобщему облегчению, всё прошло благополучно, без тяжелых побочных эффектов. Уже через 10 дней мы наблюдали снижение TRBV9+ Т-клеток по анализу репертуаров ТКР. В течение следующих трех месяцев самочувствие пациента постепенно становилось лучше. Исчезли утренняя скованность, боли в спине и бедре. У L появилась возможность вести более активный образ жизни, который был невозможен до этого из-за постоянных болей. Это стало возможно даже без приема анти-ФНО терапии.
С тех пор L принимает анти-TRBV9 периодически, так как нельзя гарантировать, что не останется малой фракции аутореактивных Т-клеток, которые вновь оскалят клыки после затишья. Также репертуар постоянно обновляется. Есть вероятность возникновения новых аутоиммунных клонов. Так, в марте 2020 года к нашему пациенту ненадолго вернулись симптомы болезни. Он описывал их как боль и чувство скованности в груди, тяжесть в ногах после непродолжительного нахождения в стоячем положении. Ухудшение состояния подтверждалось индексом BASDAI. Любопытно, что, несмотря на практически нулевое содержание TRBV9+ Т-клеток, нам удалось в это же время заметить увеличение содержания аутоиммунного мотива при тагретном секвенировании TRBV9+ репертуара (ТКР с другими вариабельными сегментами не секвенировались). Дело в том, что направленное секвенирование репертуара обладает высокой чувствительностью и позволяет отследить небольшую по численности популяцию Т-клеток.
Самый неожиданный результат — влияние препарата на уже произошедшие изменения костной ткани. Мы увидели улучшение состояния позвоночника и тазобедренного сустава, подтвержденное рентгенологическими исследованиями, после начала приема анти-TRBV9. За годы болезни у L увеличивался костный нарост на краю тазобедренного сустава — остеофит. Но после начала приема анти-TRBV9 врачи заметили его постепенное уменьшение, а по метрикам ASDAS-CRP, BASDAI и BASMI видно снижение активности заболевания, улучшение самочувствия и подвижности.
На время написания статьи у первого в мире пациента с болезнью Бехтерева, получившего анти-TRBV9, идет уже четвертый год ремиссии. Новая терапия не только остановила прогресс болезни, но и в некоторой степени повлияла на изменения, казавшиеся необратимыми. Лечение улучшило качество жизни L, избавив его от постоянных болей, и позволило быть более активным и счастливым. В настоящее время идет вторая фаза клинических испытаний BCD-180 и одобрено проведение третьей фазы. После завершения всех стадий исследования можно будет судить об эффективности терапии для широкого круга пациентов.
В будущем анти-TRBV9 терапия может быть использована для лечения других HLA-B27 связанных заболеваний: псориатического артрита, острого увеита, ювенильного идиопатического артрита и болезни Крона, так как высока вероятность, что в патогенез данных заболеваний вовлечены TRBV9+ Т-клетки. А сам принцип лечения, заключающийся в удалении аутоиммунных клонов при помощи цитотоксического антитела, специфичного к определенному сегменту, может быть использован для подбора индивидуального лечения других аутоиммунных заболеваний.
Литература
- Иммунитет: борьба с чужими и… своими;
- Olga V. Britanova, Kseniia R. Lupyr, Dmitry B. Staroverov, Irina A. Shagina, Alexey A. Aleksandrov, et. al.. (2023). Targeted depletion of TRBV9+ T cells as immunotherapy in a patient with ankylosing spondylitis. Nat Med. 29, 2731-2736;
- Анализ индивидуальных репертуаров Т-клеточных рецепторов;
- Thierry Mora, Aleksandra M. Walczak. (2019). How many different clonotypes do immune repertoires contain?. Current Opinion in Systems Biology. 18, 104-110;
- Richard Benjamin, Peter Parham. (1990). Guilt by association: HLA-B27 and ankylosing spondylitis. Immunology Today. 11, 137-142;
- D.A. Brewerton, F.D. Hart, Anne Nicholls, Maeve Caffrey, D.C.O. James, R.D. Sturrock. (1973). ANKYLOSING SPONDYLITIS AND HL-A 27. The Lancet. 301, 904-907;
- Ekaterina A. Komech, Anastasia D. Koltakova, Anna A. Barinova, Anastasia A. Minervina, Maria A. Salnikova, et. al.. (2022). TCR repertoire profiling revealed antigen-driven CD8+ T cell clonal groups shared in synovial fluid of patients with spondyloarthritis. Front. Immunol.. 13;
- Xinbo Yang, Lee I. Garner, Ivan V. Zvyagin, Michael A. Paley, Ekaterina A. Komech, et. al.. (2022). Autoimmunity-associated T cell receptors recognize HLA-B*27-bound peptides. Nature. 612, 771-777;
- Jose Garrido-Mesa, Matthew A. Brown. (2022). T cell Repertoire Profiling and the Mechanism by which HLA-B27 Causes Ankylosing Spondylitis. Curr Rheumatol Rep. 24, 398-410;
- Paul Bowness. (2015). HLA-B27. Annu. Rev. Immunol.. 33, 29-48;
- Malek Faham, Victoria Carlton, Martin Moorhead, Jianbiao Zheng, Mark Klinger, et. al.. (2017). Discovery of T Cell Receptor β Motifs Specific to HLA–B27–Positive Ankylosing Spondylitis by Deep Repertoire Sequence Analysis. Arthritis & Rheumatology. 69, 774-784;
- Ekaterina A Komech, Mikhail V Pogorelyy, Evgeniy S Egorov, Olga V Britanova, Denis V Rebrikov, et. al.. (2018). CD8+ T cells with characteristic T cell receptor beta motif are detected in blood and expanded in synovial fluid of ankylosing spondylitis patients. Rheumatology. 57, 1097-1104;
- BIOCAD: взгляд изнутри;
- Терапевтические моноклональные антитела;
- Проблемы, тренды и точки роста доклинических исследований;
- Краткая история открытия и применения антител;
- Nigil Haroon, Robert D. Inman, Thomas J. Learch, Michael H. Weisman, MinJae Lee, et. al.. (2013). The Impact of Tumor Necrosis Factor α Inhibitors on Radiographic Progression in Ankylosing Spondylitis. Arthritis & Rheumatism. 65, 2645-2654;
- Ilgar Z. Mamedov, Olga V. Britanova, Dmitriy A. Bolotin, Anna V. Chkalina, Dmitriy B. Staroverov, et. al.. (2011). Quantitative tracking of T cell clones after haematopoietic stem cell transplantation. EMBO Mol Med. 3, 201-207.






