Проблемы, тренды и точки роста доклинических исследований
11 марта 2022
Проблемы, тренды и точки роста доклинических исследований
- 1443
- 0
- 4
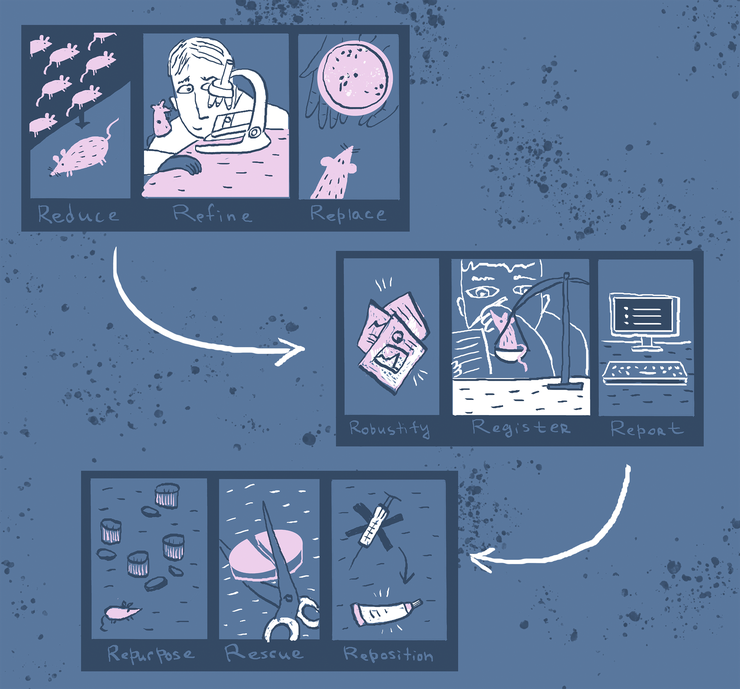
Доклинические исследования in vivo уже много лет базируются на принципах 3R: уменьшения, усовершенствования и замены использования лабораторных животных. Однако улучшения (пока?) не так заметны, как хотелось бы. Пытаясь сдвинуть ситуацию, исследователи формулируют новые «R»: повышая стандарты работы в доКИ (принципы надежности данных, отчетности и регистрации) и снижая финансовые затраты и ресурсы (подходы перепрофилирования, репозиционирования и возобновления). Рисунок в полном размере.
иллюстрация Карины Илиопуло
-
Автор
-
Редакторы
-
Рецензент
-
Иллюстратор
Подходит к завершению спецпроект о доклинических исследованиях. доКИ — это трудоемкий бизнес, с одной стороны которого академические открытия, а по другую сторону — клинические испытания и здоровье людей. В этот раз мы заострим внимание на трендах, определяющих ближайшие изменения в этой области; расскажем, как неправильные доКИ тормозят появление новых лекарств; и какие проблемы нужно искоренять в первую очередь, чтобы технологии завтрашнего дня стали доступны сегодня.
Будущее доклинических исследований
Ни для кого не секрет, что биологические исследования и разработка лекарств — сложный и ответственный процесс. При этом в ходе отбора лучших молекул-кандидатов ученые должны заботиться не только о действенности, но и о безопасности новых препаратов. Так до того, как созданное лекарство получит человек, его изучают в других моделях: от компьютерных программ и клеточных культур до разных видов животных.
Спецпроект о доклинических исследованиях (доКИ) стал своеобразным приквелом к циклу статей о клинических испытаниях (КИ): что нужно сделать и изучить перед тем, как проводить клинические исследования с участием людей? Можно ли обойтись без экспериментов на животных? Почему правильные доКИ не менее значимы для разработки лекарства, чем КИ? Мы постараемся в доступной форме осветить сложные вопросы планирования и регулирования доклинических исследований; принципы этичности работы с лабораторными животными; узнаем, когда и чем можно их заменить; и заглянем в ближайшее будущее биомедицинской отрасли.
Партнер спецпроекта — российские аффилированные лица компании «Филип Моррис Интернэшнл», ФМИ (PMI Affiliates in Russia), которая активно ведет исследования в области биомедицины, системной биологии и биотехнологий.
В предыдущих статьях цикла «Будущее доклинических исследований» мы изложили назначение и философию доклинических исследований (доКИ) [1] и подробно описали применяемые экспериментальные системы: клеточные линии и лабораторных животных [2], компьютерные алгоритмы [3], а также продукт слияния усилий инженеров и биологов — органы-на-чипе [4]. Все эти технологии развиваются и используются параллельно, чтобы не только надежно проверять безопасность и эффективность новых потенциальных лекарств, но и делать это максимально дешево, быстро и этично. Однако революция в доклинических исследованиях пока еще только происходит — зато прямо у нас на глазах, и результаты ее еще предстоит оценить.
Ну а на текущий момент — 80% испытаний, прошедших успешно на животных, увы, проваливаются в клинике (рис. 1). Над снижением этого печального числа сообща работают академическая наука, индустрия и регистрирующие ведомства. Но, к сожалению, мнения экспертов совпадают — о глобальных усовершенствованиях в доклинических испытаниях говорить пока рано. Универсальных решений нет, и к каждой проблеме нужно искать отдельный подход.
Под «клиникой» мы тут имеем в виду клинические исследования лекарств, о роли которых в фармацевтической разработке на «Биомолекуле» также выходил одноименный спецпроект.
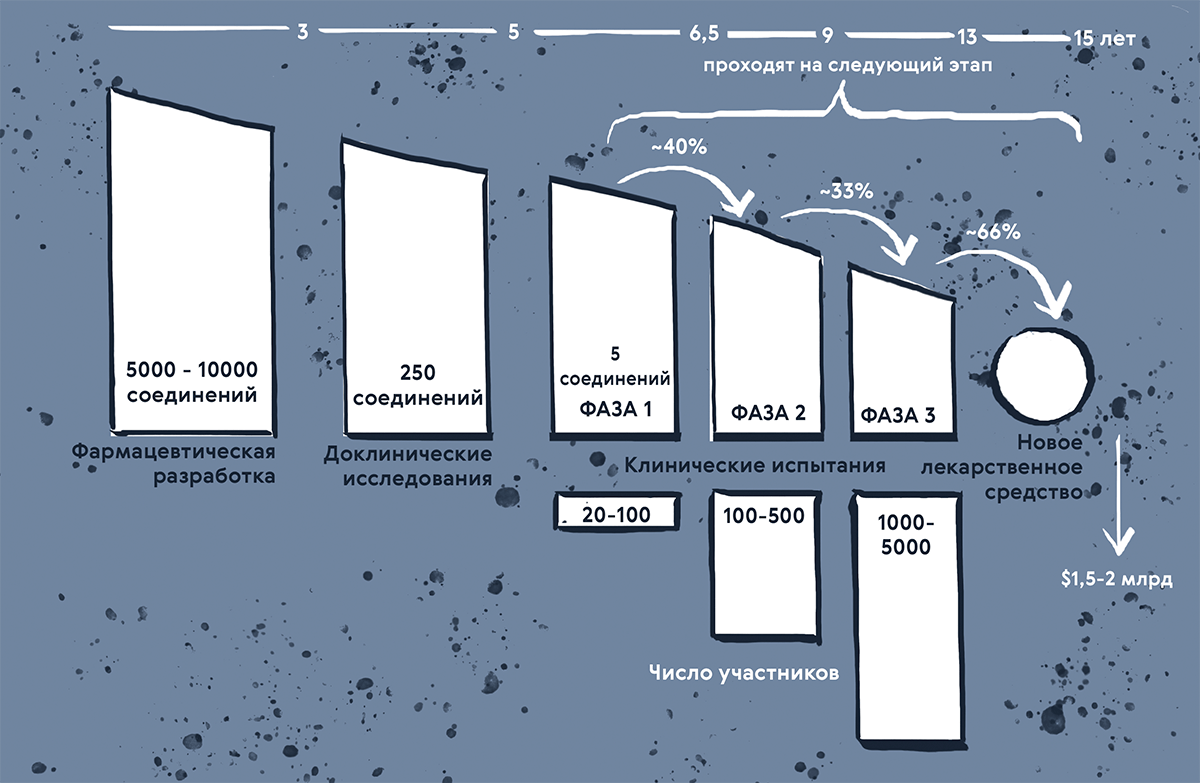
Рисунок 1. Какой путь проходит потенциальная лекарственная молекула, прежде чем лечь на аптечную полку? Перед тем, как на рынке появится новый лекарственный препарат, пройдет до 15 лет и будет потрачено до 1,5–2 миллиардов долларов. Половина — это затраты на клинические исследования, а около 30% уходят на доклинические тесты. По статистике, из пяти соединений, которые войдут в первую фазу клинических исследований, только одно будет одобрено.
иллюстрация Карины Илиопуло по [49]
В этой статье мы обозначим насущные проблемы, с которыми сталкиваются в доклинических исследованиях, и расскажем о современных трендах, предлагающих перспективные решения по реформированию всей сферы доКИ:
- Чтобы извлекать из доКИ действительно важные для человека прогнозы, нужно постоянно держать в уме вопрос: насколько адекватна используемая модель? Эту проблему можно обозначить как механистическую — попросту, исследования надо проводить на более адекватных моделях. Уже более 50 лет назад был озвучен принцип этичной работы с животными — это три большие R: Refinement, Reduction, Replacement (совершенствование, сокращение, замещение) — впервые мы описали этот подход в статье «От живого к неживому. Доклинические исследования сегодня и завтра» [1].
Следуя принципу 3R, исследователи стараются свести к минимуму страдания животных и улучшить условия их жизни. К сожалению, «замещение» (когда вместо животных как объекта экспериментов выбирают что-то, не обладающее развитым сознанием) часто обходят стороной. Но как найти адекватную альтернативу? В этой статье мы приведем показательные случаи, когда выбор альтернативных моделей стал первостепенной задачей исследователей. И это не только вопрос этики: иногда принципиально невозможно адекватно воспроизвести заболевание на классических моделях или животных, но можно — на специализированных моделях. - Второй тренд адресует методологическую проблему: нужно менять подход к проведению доКИ. Эти требования лаконично сформулировали в виде еще одной триады R-принципов: Robustness, Reporting, Registration (надежность, отчетность, регистрация). Осталось только добиться соответствия им проводимых исследований, руководствуясь обратной связью в форме уже проваленных клинических исследований. Регуляторы и консорциумы начинают предлагать простые методы самопроверки качества проведенных доКИ, чтобы не повторять ошибок.
- Третий тренд стоит несколько особняком и связан скорее с формой доклинических исследований, чем с их содержанием. Дело в том, что наряду с нежелательными эффектами лекарства иногда внезапно показывают побочную эффективность. Обобщив эти наблюдения, специалисты предложили еще три «R»: drug Repurposing, Repositioning, Rescue (перепрофилирование, репозиционирование, возобновление), которые обещают подарить вторую жизнь уже изученным лекарствам, снижая затраты и сроки разработки, а также привлекая внимание к борьбе с редкими заболеваниями.
Тренд первый. На пути к адекватным моделям заболеваний
Если прикинуть, что из 5000 соединений, вошедших в доКИ, лишь пять добираются до первой фазы клинических исследований (рис. 1), мы получим конверсию в мизерную 0,1%. Оптимистичная интерпретация — было отсеяно множество потенциально неэффективных и опасных соединений. Но сколько было пропущено потенциально активных средств (то есть с ложноотрицательным результатом)? Есть вероятность, что с развитием новых методов в ретроспективе мы сможем ответить на этот вопрос.
А вот обратную оценку — сколько препаратов окажутся токсичными или неэффективными — нам и так дают клинические исследования. Недостаточные эффективность и безопасность — это две главные причины провала КИ (рис. 2). В большинстве случаев препараты, успешно прошедшие доклинические испытания на плохо подобранных моделях, просто оказываются неэффективными на людях. Предсказывать безопасность, к счастью, получается лучше, чем эффективность. Но бывают и почти трагичные случаи.
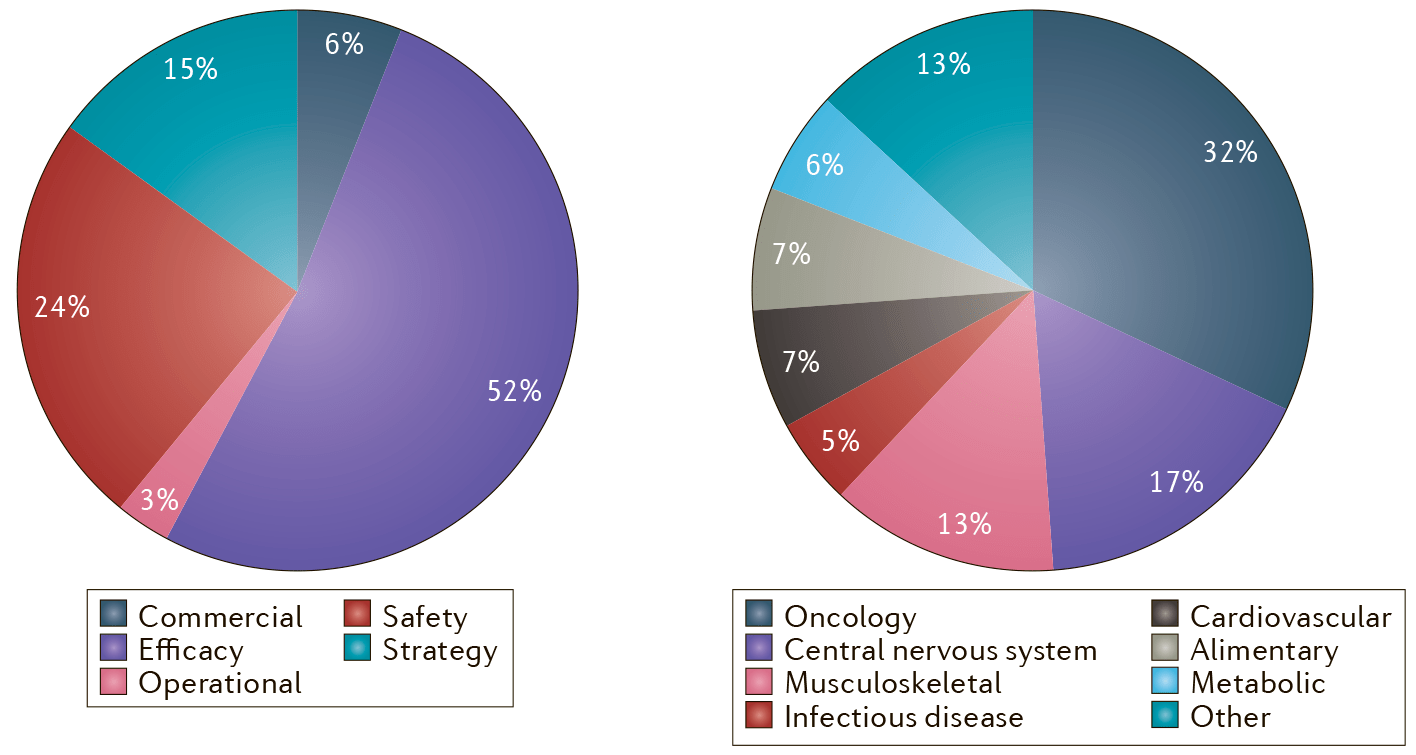
Рисунок 2. Причины провала клинических исследований. Слева — сами причины, среди которых лидируют проблемы в безопасности и эффективности лекарств; а справа — терапевтические области, в которых это чаще всего происходит: онкология и заболевания ЦНС.
Поучительная история произошла с разорившейся компанией TeGenero [5]. Гуманизированное моноклональное антитело TGN1412 (терализумаб) — суперагонист рецептора CD28, активирующего регуляторные T-клетки, — показало отличные результаты в доклинических тестах. Но вот дальше вместо долгожданного средства против аутоиммунных заболеваний, разработчики поставили под угрозу жизни добровольцев, участвовавших в первой фазе клинических испытаний. Оказалось, что небольшое отличие терапевтической мишени привело к драматической разнице безопасной дозы у людей и макак. Через час после приема лекарства у добровольцев развился настолько мощный цитокиновый шторм, что начали отказывать органы и наступила кома. К счастью, всех удалось спасти. Интересно, что через несколько лет российская компания попыталась сделать из этой молекулы успешный препарат, снизив дозу на несколько порядков до безопасного уровня. Спустя полмиллиарда рублей в инвестициях проект закрыли, упомянув, что если были бы новые вложения, то стоило бы проверить препарат в онкологии [6].
Это близкое к катастрофе событие укрепило понимание, что животные могут быть только примерным прототипом человека. В контексте громких неудач с «большими молекулами» (иначе биологическими, или биофармацевтическими препаратами, англ. biologics), такими как TGN1412, становится понятно, почему разработка органов-на-чипе [4] так стремительно набирает обороты. Например, клинические испытания другого моноклонального антитела — Hu5c8, ингибирующего аутоиммунный ответ, — прекратили из-за развития у добровольцев тромбоза. Постфактум оказалось, что эта побочная реакция, которую было не предвидеть по экспериментам на животных, вполне себе воспроизводится в модели сосудов-на-чипе [7]. И если бы в доклинике использовали эту модель — глядишь, в клинические испытания прошел бы рабочий вариант антитела.
Получается, что не всегда нужно обвинять неработающие соединения, а хотя бы иногда — нерелевантные модели. В контексте принципа 3R, самые сложные модели — это давно уже ставшие классикой доКИ грызуны и приматы. За истекшие десятилетия экспериментов на животных проведено бесчисленное множество, но их целесообразность всё чаще оказывается под вопросом. Пришло время проводить доклинические исследования более гибко, зачастую отказываясь от удобных, но неработающих моделей.
Эти случаи подчеркивают: необходимо регулярно пересматривать подход к принципу 3R. С появлением новых данных о том, когда нецелесообразно привлекать не только грызунов, но и нечеловекообразных приматов, должны разрабатываться стандарты, по которым можно оценить, насколько добросовестно подбирали альтернативный метод. Валидация новых методов займет определенное время, но их потенциал нельзя игнорировать. Например, вышеупомянутый тромботический эффект, который исследователи смогли воспроизвести в альтернативной системе — сосуде-на-чипе [7].
А как насчет эффективности? Среди антилидеров по выходу на рынок — разработки в области заболеваний центральной нервной системы и онкологии (рис. 2): они ответственны за половину всех проваленных КИ! Сложная природа этих болезней сильно ограничивает предсказательную силу доКИ на животных — различия между людьми и другими млекопитающими оказываются слишком велики. Что привело к такой плачевной ситуации, и на какие альтернативные модели заболеваний для доКИ нужно обратить пристальное внимание?
Модели опухолей: взаймы у пациентов?
Так уж устроены онкологические заболевания, что традиционная для доКИ стратегия «один-размер-подходит-всем» не работает, и спрос на надежные предсказательные модели здесь рекордно высок. Дело в том, что для опухолей характерна крайне сложная микроструктура, отличающаяся генетической, функциональной и физиологической гетерогенностью клеток . Большим достижением был переход от скрининга на клеточных линиях в чашке Петри к многокомпонентным 3D-моделям. Но по-прежнему нужен качественный скачок — даже опухоли одинакового происхождения развиваются различными путями у разных пациентов, и это разнообразие не учесть в примитивных лабораторных моделях.
Опухоли создают «под себя» микроокружение из множества сигнальных, разнообразных стромальных и иммунных клеток, опухолевых антигенов и т.д. Это микроокружение пронизано разрастающимися кровеносными сосудами и окружено сложным внеклеточным матриксом. Опухоли находятся в состоянии гипоксии, а местастазирующие клетки переживают постоянные превращения. Всё это дает опухолям массу возможностей, чтобы ускользнуть от иммунологического контроля и лечения. Подробнее об этих явлениях читайте в статье «Опухолевые разговоры, или Роль микроокружения в развитии рака» [8].
Лучшие доступные решения основаны на использовании реальных опухолей: например, в виде получаемых непосредственно от онкологических пациентов ксенографтов (patient-derived xenografts, PDX) [9] или эксплантов ex vivo. О них и расскажем подробнее.
Ксенотрансплантация: «вырезать/вставить»
В целом, сейчас накоплен внушительный арсенал онкологических моделей (рис. 3). Ксенографты относятся к перевиваемым, или имплантируемым, опухолям.
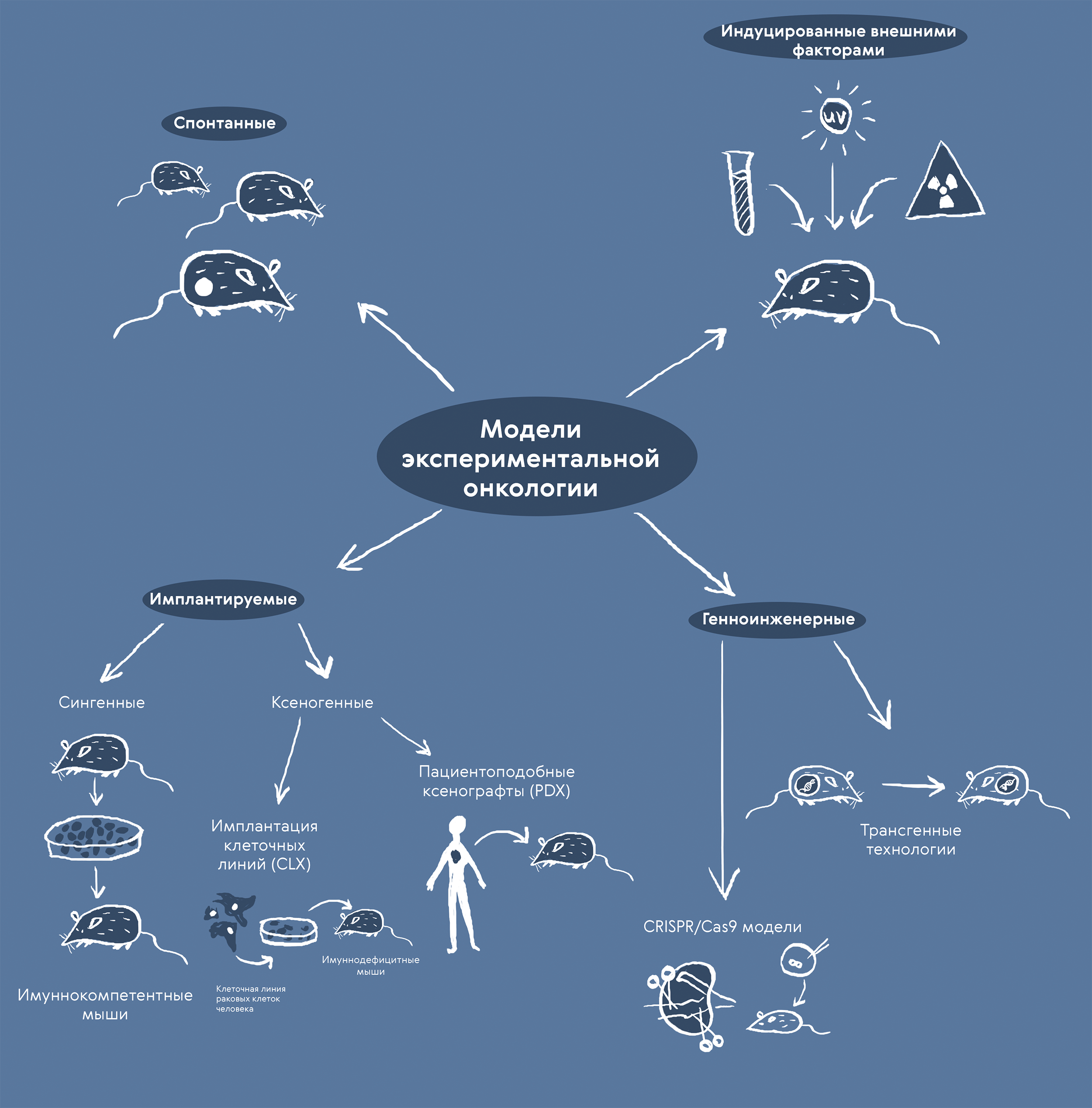
Рисунок 3. Модели экспериментальной онкологии. В лаборатории научились воспроизводить онкологические заболевания разными способами (индукцией внешними факторами, имплантацией опухолевых клеток и образований или методами генной инженерии [10]) и работать с опухолями, возникающими спонтанно. Недостатки и ограничения каждого метода часто компенсируют их совместным применением.
иллюстрация Карины Илиопуло
Ксенотрансплантация («ксено» — «чужой») позволяет сохранить сложный молекулярный профиль и фенотип рака, а чем больше схожесть с исходной опухолью, тем больше вероятность найти эффективный в клинике лекарственный препарат. Фрагменты опухоли пересаживают иммунодефицитным мышам под кожу или, в идеале, в тот же орган, из которого взят образец. Наблюдать за такими ксеноплантами прямо in vivo можно через имплантируемые микродевайсы (рис. 4), одновременно контролируя дозировку нескольких препаратов и собирая многомерные данные о взаимодействии тестируемых лекарств и опухолевой ткани в реальном времени.
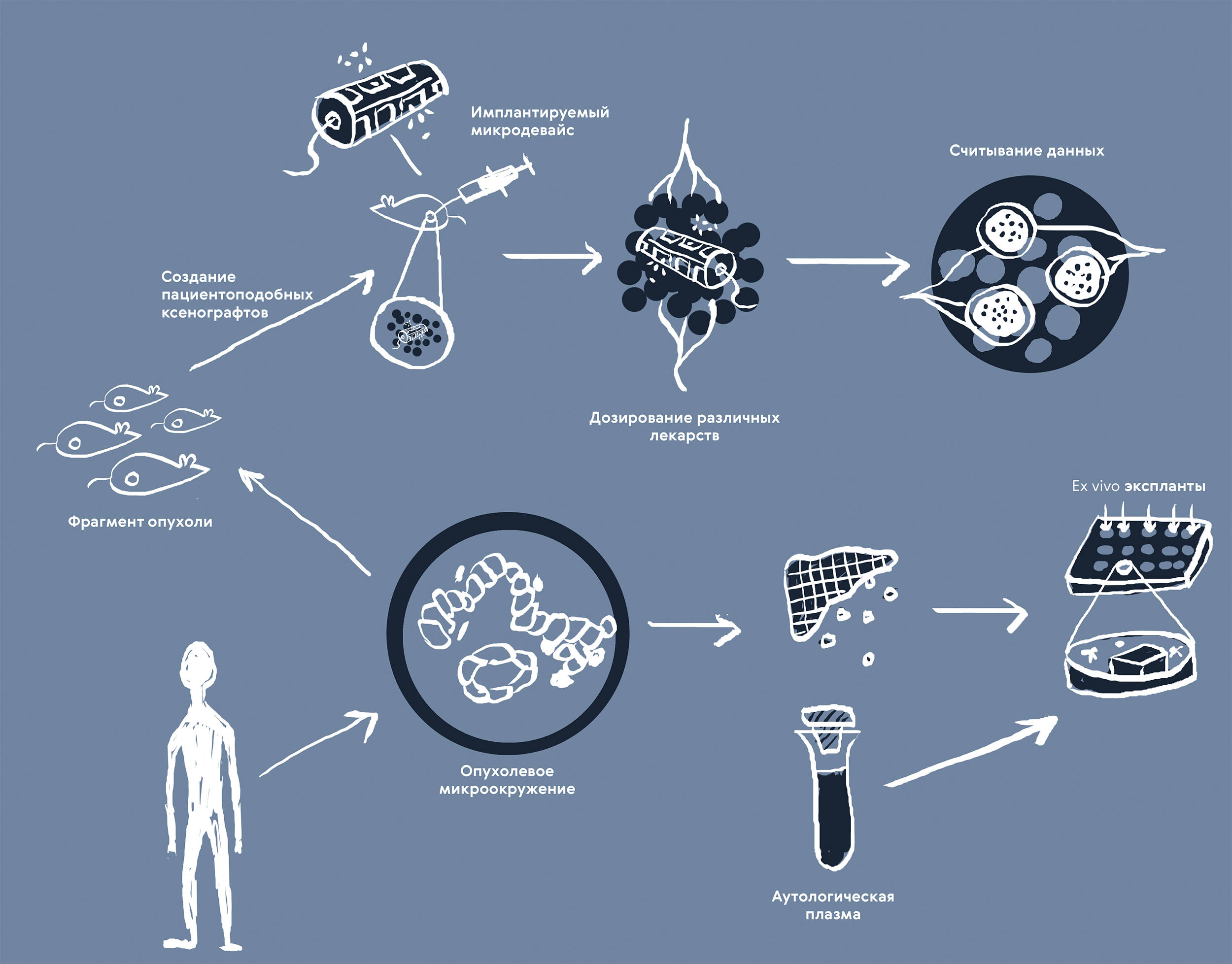
Рисунок 4. Как воспроизвести гетерогенность и сложное микроокружение опухоли? Лучший доступный сейчас способ — это работать непосредственно с реальными образцами опухоли, полученными биопсией у пациентов. Для этого разрабатывают подходы и in vivo, и ex vivo. Пациентопободные ксенографты — это фрагменты опухоли, пересаживаемые мышам в попытке увидеть, как меняется опухоль в ответ на терапию, какие клетки со временем занимают доминирующее положение и как развиваются метастазы. Благодаря дополнительным гаджетам (например, имплантируемым девайсам) можно собирать данные по соотношению доза-ответ в реальном времени. А активное внедрение МРТ помогает отследить развитие опухоли в долгосрочной перспективе. Экспланты ex vivo решают задачу подбора максимально эффективного лечения в индивидуальных случаях. Кусочки опухоли размещают в лунках планшета в коктейле из плазмы, клеток крови и белков матрикса пациента. Метод позволяет собирать многомерные данные о кинетике ответа, морфологических изменениях клеток, анализировать уровень экспрессии генов для многих комбинаций из лекарственных соединений и дозировок.
иллюстрация Карины Илиопуло по [51], [52]
До ксенографтов в первую очередь научились «переносить» мышам клетки, выращенные в искусственной среде: в организме они собираются в опухолевые массы, создавая трехмерную in vivo модель. За пределами организма лучше всего выживают самые агрессивные клеточные линии, поэтому сохранять их многообразие и гетерогенность сложно. А вот при переносе фрагмента опухоли целиком это возможно. Серьезный недостаток при имплантации — иммунная реакция на чужеродные клетки, из-за чего и используют иммунодефицитных мышей; однако это тоже не очень хорошо, ведь иммунная система играет в развитии онкологического заболевания очень важную роль. Со временем из понимания этих взаимодействий даже выросла новая область лечения — онкоиммунология.
В настоящее время нашли способ восполнить недостаток иммунной системы, гуманизируя мышей. Кроме трансплантации фрагментов опухоли, мышам переносят кусочки тимуса, печени человека и CD34+ клетки, включая иммунные элементы для эффективного отбора противоопухолевых препаратов. Другой вариант сохранить функциональную иммунную систему — использовать сингенные опухоли, где донор и реципиент генетически сходны. Сингенную трансплантацию можно комбинировать со спонтанными опухолями.
Спонтанные модели — удобный объект для изучения канцерогенных факторов и новых мутаций. Отследить их можно по фенотипическим признакам, а возникают они всё же довольно редко. Если пересаживать спонтанные опухоли другим животным, то можно располагать достаточным материалом в конкретный момент времени, но это не самая подходящая для доКИ модель.
Если ксенографты позволяют воспроизвести клеточную гетерогенность опухоли, то с манипуляцией с генетическими предпосылками онкологических болезней справляются индуцированные модели. У генно-инженерных мышей можно отключать онкологические гены-супрессоры или, наоборот, активировать онкогены. Опухоли в такой модели развиваются de novo, повторяя фенотипические и физиологические аспекты, связанные с конкретными мутациями, а также давая метастазы, которые часто и определяют выбор эффективного препарата. А благодаря CRISPR/Cas9 стало технически возможно отключать сразу несколько генов, повторяя сложный генетический фон онкологических заболеваний.
Потенциал трансгенных моделей и пациентоподобных ксенографтов запустил развитие коклинических испытаний: параллельный доклинический и клинический скрининг [55]. Мышиные «аватары» опухолей позволяют стратифицировать пациентов, чтобы подобрать наиболее мощную терапию, параллельно с лечением изучать биологию конкретной онкологической болезни с целью определения биомаркеров и проверять потенциальные новые препараты.
Экспланты: повторяем вовне
Ксенографты — это хорошо, но для работы с ними всё-таки нужен виварий и мыши. Другой вариант воспроизвести гетерогенность опухолей — это работать с образцами ex vivo. Опухолевые экспланты [12] научились выращивать на желатиновых гелях и в жидкой среде еще в 1980-х, но почему-то с развитием органоидов, ксенографтов и клеточных культур этот подход ушел на второй план. Экспланты вернула к «жизни» компания Farcast Biosciences, разработав платформу TiME — Tumor immune MicroEnvironment (сначала ее назвали CANscript [13]). Опухолевый срез культивируют в сыворотке пациента, создавая максимально близкое к естественному микроокружение. Платформа позволяет параллельно оценивать цитокиновый ответ, активность иммунных клеток, морфологические изменения, пролиферацию клеток и другие параметры. Предсказательный потенциал такой модели очень высок и позволяет многое изучить in vitro.
Заболевания ЦНС: есть ли путь назад из «долины смерти»?
Второе место по числу проваленных доКИ принадлежит нарушениям центральной нервной системы (ЦНС): нейродегенеративным и заболеваниям развития, а также психическим расстройствам. Это направление с очень высоким спросом, но его пока не получается удовлетворить: начиная с 2011 года R&D-отделы крупнейших компаний систематически сворачивают исследования — даже в таких безусловно коммерчески перспективных направлениях, как болезнь Альцгеймера [14], [15]. Штука в том, что понимание механизмов растет (хоть часто лишь экстенсивно), а вот разработка лекарств только дорожает и теряет в результативности. Разрыв между растущим объемом фундаментальных знаний и результативностью в фармацевтике столь вопиющий, что даже получил название «долина смерти» трансляционных исследований (рис. 5).
Согласно мнению экспертов [16], преодоление долины смерти требует серьезных концептуальных изменений во взаимодействии науки и индустрии. Многие отмечают, что доклинические исследования не успевают за фундаментальными разработками. Важные концепты не интегрируют в доКИ, и они так и остаются достоянием научных публикаций. Мы остановимся на прикладном аспекте выхода из долины смерти — предсказывать эффективность и безопасность лекарств для ЦНС можно лучше с помощью уже существующих альтернативных моделей. Только их нужно грамотно подбирать.
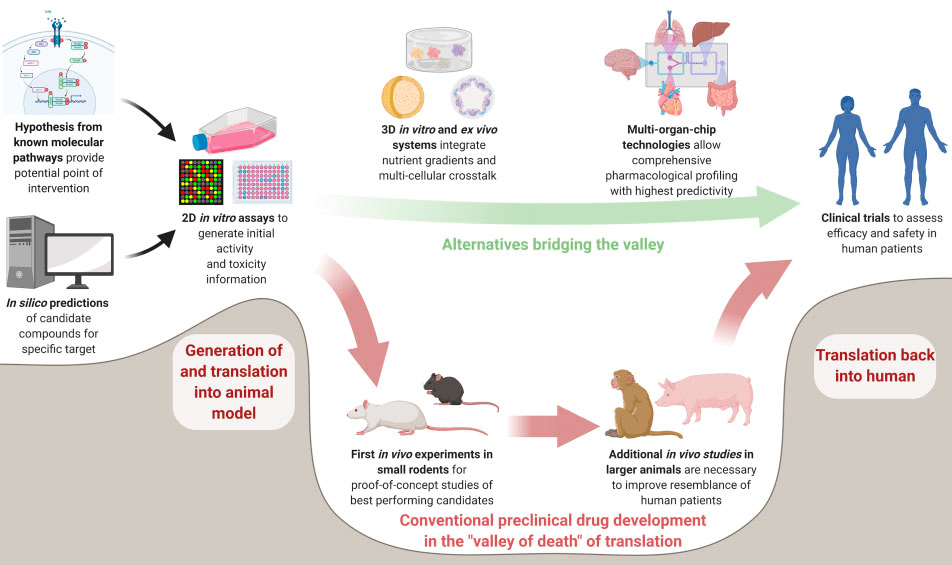
Рисунок 5. Долина смерти фармацевтических исследований. Несмотря на растущее число публикаций по механизмам заболеваний и многочисленные технологические прорывы, скорость появления новых лекарств не увеличивается, а стоимость их разработки лишь растет. Явление плохой «транслируемости» базовых наук в индустрию назвали долиной смерти. Современные разработки в области микрофлюидных технологий и больших данных дают надежду на скорое возведение моста между фундаментальными и клиническими исследованиями.
Долина смерти охватывает все трансляционные области и не ограничена ЦНС. Но почему именно эта область идеальна как пример? Заболевания нервной системы чрезвычайно мультифакторные: влияет как наследственность, так и окружающая среда (концепт, известный как GxE). Нарушения работы ЦНС различаются и по степени проявления, и по симптоматике — отсюда и «спектр» в названиях расстройств аутистического/шизофренического спектра [17], [18]. Даже заболевания с известной генетической природой, такие как болезнь Хантингтона [19], могут сопровождаться либо эмоциональными, либо моторными нарушениями. Но если о многих генетических вариациях и сопутствующих факторах среды известно, почему же до сих пор недоступно полноценное лечение?
Во-первых, доклинические испытания и не стремятся воспроизвести это разнообразие :-(. Для многих патологий (например, инсульта) возраст — главный фактор риска. Почему же тогда во многих исследованиях in vitro клетки получают из эмбриональных или молодых тканей, которые задокументировано отличаются от зрелых? В работах in vivo — аналогично — типичное описание методов: «здоровые самцы породы мышей Y возраста Z». Проверяя эффективность противоинсультных препаратов на такой выборке, исследователи не учитывают ни сопутствующие заболевания, ни вредные привычки, ни средний возраст конечных потребителей. Добавляя к возрасту биологическую разницу между видами, мы получаем модель, еще более оторванную от реальности. Однообразие группы дает статистически значимые результаты, которые в результате невозможно обобщить. Конечная цель доКИ — найти безопасное и эффективное для людей средство. Реальные пациенты между собой очень различаются, и это нужно учитывать в доклинических испытаниях.
Во-вторых, богатый поведенческий репертуар человека, на который ориентируются в «Диагностическом и статистическом руководстве по психическим расстройствам», сокращают до количественных измерений элементарных реакций у животных, например: замираний и пробежек или времени, проведенного у стен и центра клетки. Понятно, что животные модели психических расстройств строятся на трехэтажных допущения о том, что у человека и других животных всё это устроено одинаково.
Однако многое из того, что мы называем моделями, скорее предсказательные фармацевтические тесты (predictive drug screen), и в последнее время обозначается тенденция разделять эти два понятия. Допустим, проблема терминологии решаема, но как это связано с результативностью доклинических испытаний? Рассмотрим на примере стандартного теста принудительного плавания Порсолта .
Подробнее про этот тест и другие методы изучения психических расстройств на животных читайте в статье «Трансляционная психиатрия» [20].
Грызуна опускают в цилиндр с водой и измеряют, насколько активно тот барахтается, стараясь освободиться (являя тем самым жизненную силу и стойкость). Антидепрессанты значимо снижают время бездействия животного, как бы показывая возрастание жизненной силы и энергичности [21]. Вот только валидной моделью депрессии это назвать категорически нельзя. Это проблема антропоморфизма — ошибки интерператации, прочно укрепившейся в изучении заболеваний ЦНС на животных. Объективные основания считать неподвижность животного аналогом безысходности при депрессии не были установлены [22]. Кроме того, тест сложно стандартизировать — данные сильно отличаются в зависимости от того, кто ставил эксперимент.
Подойти к решению проблемы можно с разных сторон. Благодаря машинному обучению в доклинических исследованиях появляется поведенческое фенотипирование. В основе метода — автоматизированный анализ видеозаписей свободно передвигающихся животных. Программы выявляют паттерны в поведении животного, основываясь на типичных движениях и жестах (это могут быть положение на арене, скорость, время, поза). Один из таких алгоритмов — MoSeq (Motion Sequencing) — опробовали на тестировании нейро- и психоактивных препаратов [23]. Из нескольких сотен 20-минутных видео алгоритм научили определять фармакологический класс и дозу введенного животному препарата. Из распознанных поведенческих закономерностей составили карты действия различных лекарств, которые позволили обнаружить неизвестные ранее различия и сходства в их действии и побочные эффекты. Чувствительность метода поразительна — воздействие на разные рецепторы трех антипсихотических лекарств (галоперидол, рисперидон и клозапин) смогли разделить по результатам анализа поведения!
Число программ, основанных на компьютерном зрении и машинном обучении, активно растет, и в ближайшем будущем можно будет отказаться от искусственных упрощений: будут созданы эффективные модели для оценки взаимодействия животных с друг другом и их моторных реакций в естественных условиях. Сейчас важное для регистрации поведение определяется предвзято (т.е. исследователем «на глаз»). Появление более объективных поведенческих методик и протоколов, надеемся, повысит качество доКИ.
Что еще могут предложить альтернативные модели? Если системно заболевания ЦНС нельзя воспроизвести на животных, тесты как минимум можно сделать точнее и этичнее. Кроме эффективности, большая проблема — побочные эффекты. Например, среди потенциальных антидепрессантов из группы психопластогенов [24] есть соединения, связывающиеся с серотониновыми рецепторами. Всё бы хорошо, вот только лиганды этих рецепторов часто оказываются сильнейшими галлюциногенами. До прошлого года галлюцинации с неоднозначной точностью оценивали с помощью другого количественного теста — по увеличению частоты «подергиваний головы» у грызунов: проблема в том, что нельзя просто так взять и спросить животное, не глючно ли ему. Но недавно появился удивительный способ оценивать галлюциногенный эффект in vitro [25]. Диссоциированные нейроны в культуре «запрограммировали» синтезировать биосенсор psychLight — генно-инженерный аналог серотонинового рецептора. Если соединение галлюциногенно, профиль флуоресценции рецептора изменится, что позволило разделить уже известные соединения на галлюциногенные и нет [26].
В дополнение к уже озвученным проблемам, лечить заболевания ЦНС сложно, потому что фармакокинетика и фармакодинамика изучены для мозга существенно хуже, чем для других органов. Между содержанием препарата в крови и в мозге существует лишь косвенная связь, из-за чего сложно подобрать рабочие дозировку и интервалы приема. Из-за строгого пропускного контроля со стороны гематоэнцефалического барьера и дополнительной — глимфатической — системы метаболизма мозга очень сложно оценивать, как соединение поведет себя у нас в голове.
Фармакокинетические и фармакодинамические доклинические тесты изучают, как организм влияет на лекарство и как лекарство влияет на организм. Оценка кинетических закономерностей складывается их четырех главных параметров — абсорбции, биораспределения, метаболизма и выведения [27]. Подробно мы рассматривали всё это в статье «От живого к неживому. Доклинические исследования сегодня и завтра» [1].
Открытая в 2012 году глимфатическая система — это совокупность периваскулярных пространств вокруг кровеносных сосудов, а именно астроцитов, покрывающих кровеносные сосуды. На «Биомолекуле» есть замечательная статья, рассказывающая обо всём подробно: «Промывка мозгов: как работает глимфатическая система» [28].
В исследованиях ЦНС много деталей, которые сложно не упустить из внимания. Например, кто ожидает, что микробиом мышей в двух ведущих исследовательских центрах может противоположно влиять на развитие бокового амиотрофического склероза? Совершенно случайно обнаружили, что качество содержания животных в виварии и, как следствие, различный бактериальный состав кишечника могут глобально изменять симптомы этого неизлечимого нынче заболевания. Или возвращаясь к тесту принудительного плавания: можно ли сопоставлять терапевтический эффект антидепрессантов, наступающий через несколько недель у людей, с ожидаемым в течение часа эффектом у животных? Валидация (т.е. проверка соответствия) доклинических моделей, особенно в ЦНС, не получает должного внимания. Для альтернативных тестов разработаны строгие принципы валидации, где ключевое значение имеют межлабораторные испытания моделей и сравнение с «золотым стандартом» — результатами на животных. Но как их валидировать? Намеренное многократное повторение тестов нельзя признать этичным, и даже концептуальная схожесть не всегда удовлетворяет задачам доклинических исследований — предсказать эффект у человека с максимальной точностью.
Существует несколько способов обозначить, валидна ли модель. Кроме предсказательной, выделяют внешнюю и содержательную валидности: насколько похожа симптоматика заболевания, на каком уровне (молекулярном, клеточном, системном) модель воспроизводит заболевание?
Среди ближайших предложений — использовать генетически разнообразных животных, разрабатывать гуманизированные модели, а главным образом — проводить ретроспективный анализ уже собранных данных, параллельно прописывая критерии валидности, которые будут достаточным основанием для доклинического сообщества отказываться от неработающих моделей.
Для ретроспективного анализа валидности необходимо, чтобы к надежности поставленного исследования не было вопросов. Необходимо грамотно продумывать дизайн экспериментов. А еще тщательно их документировать и корректно анализировать. На этих правилах и базируется вторая триада 3R.
Тренд второй. 3R-гарантии качества, или как вернуть воспроизводимость в исследования?
То ли удивительно, то ли, напротив, закономерно, но за многомиллионными потерями часто стоят вовсе не биологические различия организмов. Эксперты не скрывают — многие доклинические испытания невоспроизводимы (рис. 6) [29]. И причина не в несостоятельности моделей, а в методологической беспечности! Никто не будет оспаривать, что исследования должны быть не только этичны, но и достоверны. Гарантировать достоверность можно, следуя минимальным требованиям:
- в доклинических исследованиях нужно использовать ослепление;
- нужны продуманные отрицательные и, особенно, положительные контроли;
- выборки должны быть репрезентативными и достаточной статистической мощности.
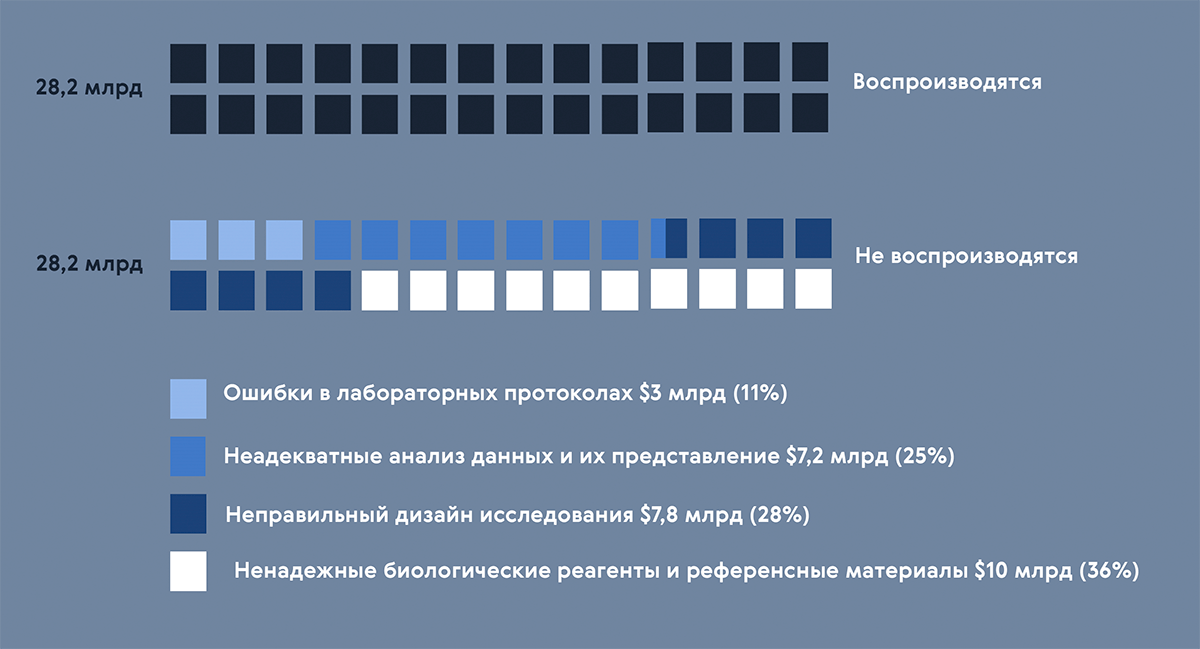
Рисунок 6. В какую цену обходится невоспроизводимость? Половина финансируемых в США исследований на деле невоспроизводимы — это около 30 миллиардов долларов в год. Ответственного отношения требуют содержание лабораторных протоколов, анализ и описание результатов, дизайн исследований, реагентов ненадлежащего качества.
иллюстрация Карины Илиопуло по Reproducibility with Biological Buffers
Регуляторы повторяют, что религиозного следования правилу «p < 0,05» недостаточно, и методику доКИ нужно приблизить к клиническим испытаниям [30]. Обратившись к методу систематических обзоров и метаанализов, эксперты выделили основные методологические недостатки [16], [31], исторически пустившие корни на поле доКИ. Необходимые (и срочные) изменения они отобразили в концепции 3R второго поколения (Robustness, Reporting, Registration) — надежность, отчетность, регистрация.
Систематические обзоры — важный аналитический метод в доКИ. Понимая это, в университете Эдинбурга еще в 2004 году основали исследовательскую группу CAMARADES — Collaborative Approach To Meta Analysis and Review of Animal Experimental Studies. Совместными усилиями исследователей, национальных центров и грантовых агентств они разрабатывают инструменты для максимально информативных доКИ. Среди реализованных проектов — онлайн-платформа Systematic Review Facility (SyRF), на которой исследователям помогают собрать данные для обзора. Анализы подобного рода не только выявляют систематические недочеты, но и помогают ответить на конкретные вопросы: какую модель выбрать для планируемого эксперимента, как надежно провести расчет выборки, какие экспериментальные процедуры и тесты будут оптимальными? Обзорные работы часто инициируются представителями посвященных отдельным заболеваниям обществ или консорциумов European Quality in Preclinical Data.
Только на первый взгляд кажется, что о мы говорим не о трендах, а о трюизмах. Оценить масштаб проблемы можно на свежем примере — по результатам проекта «Воспроизводимость в биологии рака». По инициативе некоммерческого Центра Открытой Науки на ретроспективную проверку отправили 53 высокоцитируемые онкологические работы. Оказалось, что в 29 статьях были описаны эксперименты, которые изначально невозможно воспроизвести — авторы проигнорировали или отказались предоставлять детали исследований, протоколы были расплывчатые или требовали недоступных реагентов. В итоге, полностью воспроизвести удалось только пять (!) опубликованных результатов, а суммарное число полностью задокументированных протоколов — ноль.
Этот масштабный проект был основан еще в 2013 году, когда уже активно говорили о кризисе воспроизводимости в науке. Схожие — неудовлетворительные — результаты уже наблюдали в психологии, социальных науках и экономике. Но доклинические исследования-то существуют вроде как в иной реальности! Они заканчиваются не очередной опубликованной статьей или признанием коллег; их конечный результат — колоссальные финансовые ресурсы и этические обязательства. доКИ должны производить не просто предположения, а статистически надежные и однозначные результаты…
От неграмотного планирования экспериментов страдает их надежность. Например, выборки недостаточной статистической мощности часто дают ошибочные результаты. Животные страдают и отдают жизни, по сути, ни за что. Другая проблема — попытки «подогнать» данные, если регистрируются качественные или субъективные параметры, как часто происходит при поведенческих экспериментах. Со «слепыми контролями» (и с предварительной регистрацией) это сделать сложнее.
В Национальном центре по замене, оптимизации и сокращению животных в исследованиях разработали руководство «Исследования на животных: Отчетность по экспериментам in vivo», которое будет полезно всем желающим придерживаться принципа отчетности. Там опубликован чеклист из 21 пункта, советующих, что включить в публикуемые данные доКИ (и каждый пункт сопровождается реальным опубликованным примером). Среди них есть инструкции и по статистическому анализу, и по дизайну экспериментов, а также напоминание четко указывать критерии включения/исключения.
Под регистрацией понимают, что хорошо бы регистрировать все доКИ, как это сделано для клинических испытаний, либо на платформах, либо в специализированных журналах [32], [33]. И делать это лучше до начала исследования! Среди уже запущенных проектов — академические и государственные [34] инициативы; правда, в эти реестры за три года добавили только 80 работ — еще нужно думать, как мотивировать исследователей.
Тренд третий. За пределами 6R, или Как сэкономить миллиарды?
В рамках спецпроекта мы, в основном, рассказывали, как изучают новые лекарственные средства. Объективно, пройти весь путь разработки и вывести активную молекулу на рынок (рис. 7) пока невозможно без вовлечения животных. Чтобы результатов «так уж вышло» стало как можно меньше, следует строже придерживаться правил «3R + 3R», которые мы описали в двух первых частях этой публикации. Однако со временем оформилась альтернативная стратегия из «еще трех R»: drug Repurposing, Repositioning и Rescue — перепрофилирование, репозиционирование и возобновление [43]. Стоит отметить, что между этими тремя терминами нет четких границ, и чаще всего «перепрофилирование» используют в качестве обобщающего термина. В основе стратегии — поиск у одобренных или проходящих клинические испытания препаратов альтернативного использования, не заявленного при первичных разработках. То есть поиск новых способностей у «старых молекул». Например, многочисленные инфоповоды о препаратах, потенциально активных против коронавируса, — пример экстремального случая «перепрофилирования».
Перепрофилирование выросло из случайных открытий побочных эффективностей: например, у миноксидила, который в прошлом веке проверяли против язвы желудка, а обнаружили антигипертензивное действие. Другой классический пример — способность антидепрессанта бупропиона помогать с никотиновой зависимостью. В основе такого подхода — наблюдения, сделанные в процессе лечения.
С развитием больших данных и методов in silico (рис. 7) перепрофилирование приобрело системный характер [44]. По результатам анализа мультиомиксных данных, карт сигнальных путей и других данных системной биологии исследователи рекомендуют препараты к перепрофилированию.
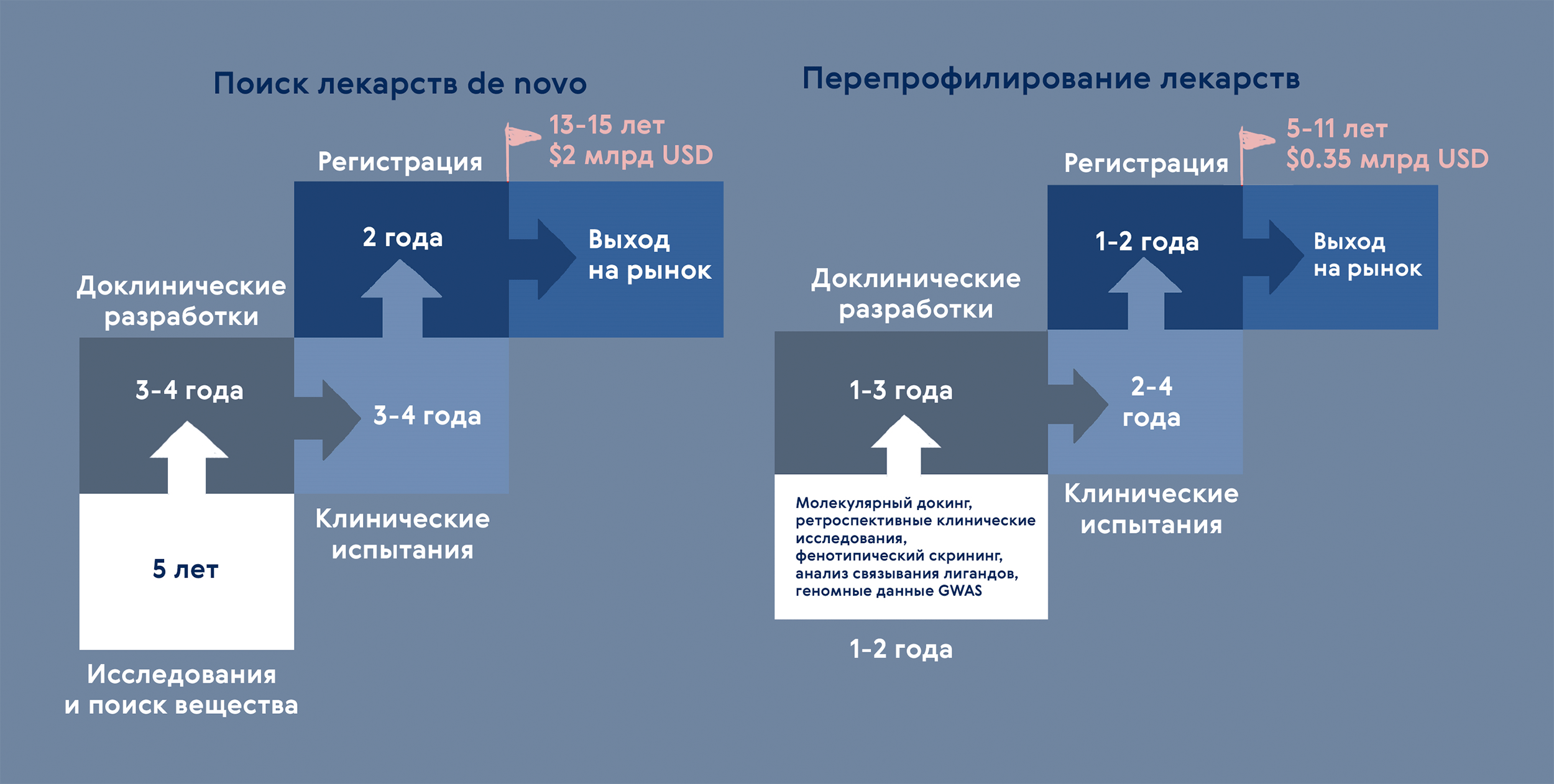
Рисунок 7. Разработка лекарств: создание de novo или перепрофилирование? Перепрофилирование позволяет сократить время разработки более чем вдвое! Основанием для поиска дополнительных свойств у лекарства служат био- и хемоинформатические методы и данные со всех этапов разработок de novo: задокументированные наблюдения клинических испытаний, мультиомискные технологии и данные о взаимодействии лекарств с компонентами клетки и т.д.
иллюстрация Карины Илиопуло по [54]
За последние десять лет треть из одобренных FDA препаратов перепрофилирована [45]. Чем же это так привлекательно? Главным образом, можно значительно снизить затраты и время на доклиническом этапе. Для перепрофилированных препаратов уже доказана безопасность: известны фармакокинетический профиль ADME (абсорбция, распределение, метаболизм и выведение), токсичность и переносимость препарата. Дополнительно в большинстве случаев есть данные по клиническим испытаниям. Интерес к перепрофилированию активно поддерживают благотворительные организации и группы защиты интересов пациентов — часто это единственная надежда на лечение «нерентабельных» редких [46] или обойденных вниманием тропических заболеваний.
Помимо поиска новых задач и лекарственных мишеней, в широком смысле к переформулированию относятся разработки по изменению лекарственной формы или способу доставки лекарств (например, ингаляционно, когда лекарство вдыхают вместо того, чтобы делать укол). Второй шанс могут получить потенциально активные соединения с неадекватной фармакокинетикой, низкой растворимостью, повышенной токсичностью. Перспективы подхода особенно очевидны для легочных заболеваний, когда переключение на ингаляционной путь введения может значительно повысить биодоступность вещества [47]. Очень кстати в таких случаях оказываются модели органов-на-чипе (например, легкого или кожи) [48].
Над поиском и усилением слабых мест в доклинических исследованиях и предложением/регламентацией возможных решений работают и другие заинтересованные лица — например, Международный совет по гармонизации технических требований к лекарственным средствам для человека (ICH). Регуляторы и основные производители со всего мира (Россию представляет Росздравнадзор в качестве наблюдателя) прилагают совместные усилия для создания взаимно признаваемых требований к доКИ. Хочется надеяться, что доступ к международному рынку — достаточная мотивация придерживаться самых строгих стандартов. Большое преимущество в том, что благодаря таким соглашениям компаниям не нужно повторять доКИ при работе в других странах.
Следуя в правильном направлении
С постоянно растущим спросом на новые и более эффективные лекарства потребность в доклинических исследованиях никуда не уйдет. За последние десятилетия было сделано многое, чтобы страдания и дискомфорт животных, участвующих в доКИ, были сведены к минимуму. Прежде чем пожинать плоды новейших технологий, нужно убедиться, что проведена работа над ошибками. В приоритете — избавиться от систематических недочетов в проведении и разработке доклинических исследований. И тогда совместные усилия по внедрению альтернативных методов и отказу от малоэффективных стратегий помогут сократить финансовые затраты по выводу новых лекарств на рынок.
Литература
- От живого к неживому. Доклинические исследования сегодня и завтра;
- Лекарство в пробирке: доклинические исследования in vitro;
- Залог успеха — большие данные в умелых руках;
- Органы-на-чипе: когда технология сплетается с жизнью;
- H. Attarwala. (2010). TGN1412: From Discovery to Disaster. Journal of Young Pharmacists. 2, 332-336;
- TheraMAB starts oncology clinical program with its mAb targeting an immune checkpoint. (2017). Nature;
- Riccardo Barrile, Andries D. van der Meer, Hyoungshin Park, Jacob P. Fraser, Damir Simic, et. al.. (2018). Organ-on-Chip Recapitulates Thrombosis Induced by an anti-CD154 Monoclonal Antibody: Translational Potential of Advanced Microengineered Systems. Clin. Pharmacol. Ther.. 104, 1240-1248;
- Опухолевые разговоры, или Роль микроокружения в развитии рака;
- Bryan E. Welm, Christos Vaklavas, Alana L. Welm. (2021). Toward improved models of human cancer. APL Bioengineering. 5, 010901;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники;
- Mak I.W., Evaniew N., Ghert M. (2014). Lost in translation: animal models and clinical trials in cancer treatment. American journal of translational research. 6, 114–118;
- Ian R. Powley, Meeta Patel, Gareth Miles, Howard Pringle, Lynne Howells, et. al.. (2020). Patient-derived explants (PDEs) as a powerful preclinical platform for anti-cancer drug and biomarker discovery. Br J Cancer. 122, 735-744;
- CANscript: clinically validated oncology drug efficacy platform. (2018). Nature;
- На руинах памяти: настоящее и будущее болезни Альцгеймера;
- Смерть после жизни, болезнь Альцгеймера и почему мы хотим перемен;
- Attila A. Seyhan. (2019). Lost in translation: the valley of death across preclinical and clinical divide – identification of problems and overcoming obstacles. transl med commun. 4;
- Диагностика РАС и генетика;
- Болезнь потерянных связей;
- Как спасти Тринадцатую? (Перспективы лечения болезни Хантингтона);
- Трансляционная психиатрия — как моделировать психические расстройства на животных?;
- Краткая история антидепрессантов;
- S. Clare Stanford. (2020). Some Reasons Why Preclinical Studies of Psychiatric Disorders Fail to Translate: What Can Be Rescued from the Misunderstanding and Misuse of Animal ‘Models’?. Altern Lab Anim. 48, 106-115;
- Alexander B. Wiltschko, Tatsuya Tsukahara, Ayman Zeine, Rockwell Anyoha, Winthrop F. Gillis, et. al.. (2020). Revealing the structure of pharmacobehavioral space through motion sequencing. Nat Neurosci. 23, 1433-1443;
- David E Olson. (2018). Psychoplastogens: A Promising Class of Plasticity-Promoting Neurotherapeutics. J Exp Neurosci. 12, 117906951880050;
- Фармакофоры нейропластичности;
- Chunyang Dong, Calvin Ly, Lee E. Dunlap, Maxemiliano V. Vargas, Junqing Sun, et. al.. (2021). Psychedelic-inspired drug discovery using an engineered biosensor. Cell. 184, 2779-2792.e18;
- Mike Dragunow. (2020). Human Brain Neuropharmacology: A Platform for Translational Neuroscience. Trends in Pharmacological Sciences. 41, 777-792;
- Промывка мозгов: как работает глимфатическая система;
- Timothy M Errington, Maya Mathur, Courtney K Soderberg, Alexandria Denis, Nicole Perfito, et. al.. (2021). Investigating the replicability of preclinical cancer biology. eLife. 10;
- С миру по нитке: как соединились компоненты клинического исследования;
- David W. Howells, Emily S. Sena, Malcolm R. Macleod. (2014). Bringing rigour to translational medicine. Nat Rev Neurol. 10, 37-43;
- Daniel Strech, Ulrich Dirnagl. (2019). 3Rs missing: animal research without scientific value is unethical. BMJ Open Science. 3, bmjos-2018-000048;
- Christopher D. Chambers, Loukia Tzavella. (2022). The past, present and future of Registered Reports. Nat Hum Behav. 6, 29-42;
- Francis S. Collins, Lawrence A. Tabak. (2014). Policy: NIH plans to enhance reproducibility. Nature. 505, 612-613;
- Allan Peter Davis, Cynthia J Grondin, Robin J Johnson, Daniela Sciaky, Jolene Wiegers, et. al.. (2021). Comparative Toxicogenomics Database (CTD): update 2021. Nucleic Acids Research. 49, D1138-D1143;
- D. Pelletier, T. C. Wiegers, A. Enayetallah, C. Kibbey, M. Gosink, et. al.. (2016). ToxEvaluator: an integrated computational platform to aid the interpretation of toxicology study-related findings. Database. 2016;
- Mark Gosink. (2016). ToxReporter: viewing the genome through the eyes of a toxicologist. Database. 2016;
- Andreas Natsch. (2020). Predictivity of the kinetic direct peptide reactivity assay (kDPRA) for sensitizer potency assessment and subclassification. ALTEX;
- Gan, D., Norman, K., Barnes, N., Raabe, H.A., Gómez, C., & Harbell, J.W. (2013). Application of the KeratinoSens Assay for Prediction of Dermal Sensitization Hazard for Botanical Cosmetic Ingredients;
- Takao Ashikaga, Hitoshi Sakaguchi, Sakiko Sono, Nanae Kosaka, Makie Ishikawa, et. al.. (2010). A Comparative Evaluation of In Vitro Skin Sensitisation Tests: The Human Cell-line Activation Test (h-CLAT) versus the Local Lymph Node Assay (LLNA). Altern Lab Anim. 38, 275-284;
- D. P. K. Lankveld, H. Loveren, K. A. Baken, R. J. Vandebriel. (2010). In Vitro Testing for Direct Immunotoxicity: State of the Art. Methods in Molecular Biology. 401-423;
- Rong Li, Chao Guo, Xiao Lin, Ting Fung Chan, Keng Po Lai, Jian Chen. (2020). Integrative omics analyses uncover the mechanism underlying the immunotoxicity of perfluorooctanesulfonate in human lymphocytes. Chemosphere. 256, 127062;
- Jean-Pierre Jourdan, Ronan Bureau, Christophe Rochais, Patrick Dallemagne. (2020). Drug repositioning: a brief overview. Journal of Pharmacy and Pharmacology. 72, 1145-1151;
- Sudeep Pushpakom, Francesco Iorio, Patrick A. Eyers, K. Jane Escott, Shirley Hopper, et. al.. (2019). Drug repurposing: progress, challenges and recommendations. Nat Rev Drug Discov. 18, 41-58;
- Michelle Alvares Sarcinelli, Thalita Martins da Silva, Andressa Daniele Artico Silva, Beatriz Ferreira de Carvalho Patricio, Flávia Costa Mendes de Paiva, et. al.. (2021). The pulmonary route as a way to drug repositioning in COVID-19 therapy. Journal of Drug Delivery Science and Technology. 63, 102430;
- Редко, но метко: орфанные заболевания как вызов современной медицине;
- David C. Cipolla, Igor Gonda. (2011). Formulation technology to repurpose drugs for inhalation delivery. Drug Discovery Today: Therapeutic Strategies. 8, 123-130;
- Longlong Si, Haiqing Bai, Melissa Rodas, Wuji Cao, Crystal Yuri Oh, et. al.. (2021). A human-airway-on-a-chip for the rapid identification of candidate antiviral therapeutics and prophylactics. Nat Biomed Eng. 5, 815-829;
- Stefan Harrer, Pratik Shah, Bhavna Antony, Jianying Hu. (2019). Artificial Intelligence for Clinical Trial Design. Trends in Pharmacological Sciences. 40, 577-591;
- Richard K. Harrison. (2016). Phase II and phase III failures: 2013–2015. Nat Rev Drug Discov. 15, 817-818;
- Yuzhuo Wang, Dong Lin, Peter W. Gout Patient-Derived Xenograft Models of Human Cancer — Springer International Publishing, 2017;
- Aaron Goldman. (2018). Profiling an Active Tumor Immune Microenvironment, Ex Vivo. Genetic Engineering & Biotechnology News. 38, 12-13;
- Fabian Philipp Kreutzer, Anna Meinecke, Kevin Schmidt, Jan Fiedler, Thomas Thum. (2022). Alternative strategies in cardiac preclinical research and new clinical trial formats. Cardiovascular Research. 118, 746-762;
- Andrés Pizzorno, Blandine Padey, Olivier Terrier, Manuel Rosa-Calatrava. (2019). Drug Repurposing Approaches for the Treatment of Influenza Viral Infection: Reviving Old Drugs to Fight Against a Long-Lived Enemy. Front. Immunol.. 10;
- Kelly Kersten, Karin E Visser, Martine H Miltenburg, Jos Jonkers. (2017). Genetically engineered mouse models in oncology research and cancer medicine. EMBO Mol Med. 9, 137-153.