BIOCAD: взгляд изнутри
30 сентября 2019
BIOCAD: взгляд изнутри
- 5382
- 3
- 19
Офис компании BIOCAD в особой экономической зоне Нойдорф (Санкт-Петербург)
рисунок Елены Беловой
-
Автор
-
Редакторы
-
Иллюстратор
Сегодня BIOCAD — одна из крупнейших российских фармацевтических компаний, специализирующаяся в том числе на разработке терапевтических моноклональных антител. Департамент вычислительной биологии (ДВБ) занимается биоинформатическим моделированием этих молекул, тем самым оптимизируя их разработку. Тому, как устроена компания в целом и ДВБ в частности, посвящена заключительная статья спецпроекта о терапевтических антителах.
Терапевтические антитела

Спецпроект об антителах, истории их изучения, методах работы с ними, а также о применении антител в современной медицине и биотехнологии.
Партнер спецпроекта — Департамент вычислительной биологии одной из крупнейших российских биотехнологических компаний — BIOCAD. BIOCAD заслужил серьезные позиции на мировом фармацевтическом рынке благодаря выпуску лекарственных препаратов на основе антител.
Эта статья закрывает наш цикл публикаций, посвященных моноклональным антителам. Партнер спецпроекта — департамент вычислительной биологии (ДВБ) компании BIOCAD, являющейся пионером в разработке терапевтических препаратов на основе моноклональных антител в России. В этом материале мы расскажем о деятельности компании в целом и ДВБ в частности.
История BIOCAD
BIOCAD, одна из крупнейших российских биотехнологических компаний, появилась почти 20 лет назад, в 2001 году, открыв производство лекарственных средств в поселке Ильинское (Московская область). R&D-центр компании открылся лишь в следующем (2002) году на базе Института инженерной иммунологии в Москве. В нем начались работы по разработке, апробации и продвижению новых продуктов компании на фармацевтический рынок.
R&D — исследования и разработки (от англ. Research & Development). Русский аналог — НИОКР (научно-исследовательские и опытно-конструкторские работы). — Ред.
За первые два года существования компании удалось вывести на рынок препарат «Генферон®» , который используется при лечении вирусных инфекций. Его основное действующее вещество интерферон альфа-2b — белок, вырабатываемый иммунными клетками и обладающий противовирусным эффектом. Еще через два года (в 2006) был зарегистрирован первый в портфеле компании препарат для лечения онкологических заболеваний — «Лейкостим®». Это рекомбинантный гранулоцитарный колониестимулирующий фактор человека [1], который способствует активной дифференцировке нейтрофилов и, соответственно, используется тогда, когда этих клеток в организме не хватает (например, при СПИДе или после химиотерапии).
Лекарства, производящиеся BIOCAD, мы выделили в тексте зеленым шрифтом. — Ред.
Чтобы начать уверенно развиваться, разрабатывать и производить оригинальные препараты, BIOCAD сделал ставку на оптимизацию рутинных процессов путем внедрения роботов и автоматизации различных процедур. С одной стороны, такой подход позволил «разгрузить» исследователей, существенно ускорив разработку препаратов. С другой — автоматизация породила получение больших объемов данных, которые стало необходимо быстро и грамотно анализировать. В том числе этим и занимается Департамент вычислительной биологии, о котором мы подробнее расскажем чуть позже.
Рост компании продолжался, и в 2011 году был основан второй R&D-центр в особой экономической зоне Нойдорф под Санкт-Петербургом. Это позволило компании расширить область исследований, и теперь основной фокус интересов сместился в сторону разработки моноклональных антител .
Моноклональные антитела — визитная карточка BIOCAD, благодаря чему компания и стала партнером спецпроекта о терапевтических антителах, заключительный материал которого вы читаете в данный момент. Что собой представляют и зачем нужны моноклональные антитела, вы можете прочесть в других статьях спецпроекта: «Краткая история открытия и применения антител» [2], «Антитело: лучший способ распознать чужого» [3], «Биотехнология антител» [4] и «Терапевтические моноклональные антитела» [5]. — Ред.
Три года работы — и в 2014 году BIOCAD зарегистрировал «Ацеллбию®» — первый препарат на основе моноклональных антител. Это биоаналог знаменитого ритуксимаба — терапевтического антитела против белка CD20 на поверхности В-лимфоцитов, предназначенного для лечения В-клеточных лимфом [4].
Годом позже компания выпустила сразу два препарата на основе моноклональных антител — «Авегру®» и «Гертикад®» (биоаналоги бевацизумаба и трастузумаба, соответственно). Бевацизумаб — антитело к эндотелиальному фактору роста А (VEGF-A), блокирующее ангиогенез (рост сосудов) в опухоли; трастузумаб — антитело к молекуле Her2/neu, избыточное накопление которой в клетках ведет к развитию рака молочной железы [2].
Итак, расширив производство и обзаведясь двумя R&D-центрами, BIOCAD постепенно смещает фокус разработок с биоаналогов и дженериков на производство оригинальных препаратов по трем направлениям:
- MabNext — на основе моноклональных антител;
- ChemNext — на основе малых молекул;
- GeneNext — генотерапевтических препаратов, CAR-T-терапии и инструментов для генодиагностики.
На фармацевтическом рынке в условиях жесткой конкуренции BIOCAD стремится к расширению продуктовой линейки, и сейчас выпускает около 60 препаратов, основные действующие вещества которых — моноклональные антитела, рекомбинантные колониестимулирующие факторы, антиметаболиты и алкалоиды, а также производные платины, таксаны (рис. 1). На стадии разработки находятся, в том числе, лекарства против наследственных заболеваний, например, гемофилии (см. врезку). BIOCAD планирует также пополнить портфель препаратами для лечения сердечно-сосудистых, офтальмологических заболеваний и анемии.
Продукты BIOCAD в первую очередь реализуются в России, что чрезвычайно важно в условиях импортозамещения. В 2018 году компания заняла первое место в рейтинге российских быстрорастущих высокотехнологичных компаний. Однако BIOCAD активен и на международных рынках, что редкость для российских фармацевтических компаний. Сейчас у компании открыты представительства в восьми странах, а продукция экспортируется в более чем 20 стран. В 2018 году выручка компании составила 21,7 миллиардов рублей. Интересно, что почти 80% выручки компании приносят противоопухолевые препараты, такие как «Гертикад®», «Ацеллбия®» и «Авегра®» (рис. 1).
Обеспечивают такие масштабы оборота четыре производственные площадки, находящиеся в Стрельне (Санкт-Петербург), пос. Любучаны (Московская область) и селе Петрово-Дальнее (Московская область). В ближайшие годы ожидается появление еще четырех новых производств.
Расширение производства влечет за собой и увеличение кадрового состава компании (рис. 3): сегодня это более 2000 человек (из которых около 40% — ученые и исследователи), и тенденция к росту сохраняется.
BIOCAD — компания полного цикла: здесь происходит и разработка, и производство лекарств. За каждый этап работы отвечает свой департамент. Так, разработка лекарства начинается в Департаменте вычислительной биологии; in vivo влияние препарата на организм исследуется в Департаменте доклинических испытаний; а Департамент клинических исследований проводит все их стадии как силами самой компании, так и с привлечением CRO (contract research organization, контрактная исследовательская организация ).
Подробнее о том, как устроены клинические исследования, можно прочитать в статьях одноименного спецпроекта. В частности, в статье «Клинические испытания в России — истории успеха» [7] рассказано о наиболее ярких представителях отечественных CRO. — Ред.
Социальные инициативы BIOCAD
Успешный в долгосрочной перспективе бизнес зависит не только от уровня продаж, но и от ценностей, которые он транслирует обществу. В случае BIOCAD это увеличение продолжительности и улучшение качества жизни. Популяризация науки и инвестиции в образование — основные направления социальной активности компании.
Привлечение и подготовка молодых ученых — одно из долгосрочных стратегических направлений развития научной и технологической базы BIOCAD. В 2017 году компания открыла факультет молекулярной и клеточной биологии в Пущинском государственном естественнонаучном институте (ПущГЕНИ). Годом позже на базе Московского физико-технического института (МФТИ) BIOCAD создал лабораторию вычислительной биологии, в которой ведутся научные проекты под руководством опытных менторов из Вычислительного центра РАН, Института вычислительной математики, Института системного анализа и других профильных учреждений. Для обеспечения успешного роста кадрового состава BIOCAD также проводит стажировки внутри компании для студентов старших курсов, по результатам которых предлагает дальнейшее трудоустройство. Кроме того, сотрудники компании читают лекции в ведущих вузах страны, таких как МГУ имени М.В. Ломоносова, КФУ, РНИМУ имени Н.И. Пирогова и других.
BIOCAD планирует участвовать и в школьном образовании. В 2018 году в Парке науки и искусств образовательного центра «Сириус» компания открыла лабораторию генно-инженерных технологий, на базе которой проводит образовательные программы по молекулярной биологии.
Налаживание контактов между представителями науки и бизнеса — еще одна стратегическая цель BIOCAD. Для этого с 2017 года компания организует конференцию BiotechClub, где обсуждаются вопросы медицины, биоинформатики и биотехнологий (см. врезку и рис. 3).
Помимо вовлеченности компании в образовательную деятельность, на базе BIOCAD проходят программы для пациентов и практикующих врачей, основной фокус которых — ранняя диагностика онкологических заболеваний и современные методы их лечения.
Департамент вычислительной биологии — не только биоинформатика
Несомненно, каждый департамент в компании важен и незаменим. Однако, как и в любом деле, начальные этапы являются зачастую ключевыми для успеха всей дальнейшей работы. В Департаменте вычислительной биологии (ДВБ) осуществляют дизайн молекулы, моделирование ее взаимодействия с мишенью, а также последующие этапы компьютерной доработки молекул, которые составляют основу будущего лекарственного препарата (рис. 5).
Изначально биоинформатикой в BIOCAD занималось лишь несколько человек, перед которыми ставили задачи по компьютерному моделированию конкретной молекулы и ее взаимодействию с клетками организма. Однако с расширением продуктовой линейки и добавлением в нее моноклональных антител появилась необходимость в увеличении вклада биоинформатиков в деятельность компании, что и привело к появлению ДВБ как отдельного подразделения. Молекулярная генетика, системная биология [8] и биомоделирование — основные фокусы деятельности ДВБ. Помимо этого, департамент помогает разрабатывать программное обеспечение для роботизации производства лекарственных препаратов.
Методы вычислительной биологии, использующиеся в ДВБ BIOCAD
ДВБ использует множество вычислительных методов, позволяющих не только улучшать уже существующие препараты, но и конструировать новые, а также совмещать прикладную и фундаментальную науки, внося вклад в понимание структурных особенностей антител и ферментов (рис. 6). Эта глава расскажет о «внутренней кухне» ДВБ — тех методах и подходах, которые ему удается эффективно использовать в работе.
Гуманизация антител
Самым первым способом получения моноклональных антител стал метод гибридом — слияние мышиных специфичных В-лимфоцитов и клеток миеломы (о нем мы подробно рассказывали в первой статье спецпроекта [12], а также в публикации «Моноклональные антитела» [9] и комиксе «Открытие моноклональных антител» [10]). Одна из основных проблем антител, полученных таким образом, — их иммуногенность: фрагменты антител животных распознаются иммунной системой человека как чужеродные антигены, а развивающийся против них иммунный ответ может повредить собственные органы и ткани пациента.
Чрезвычайно важно минимизировать иммуногенность терапевтических антител, не ослабив при этом их способность распознавать антиген. Это можно сделать за счет изменения аминокислотных последовательностей антител животного на другие, не распознающиеся иммунной системой человека, без потери целевых качеств. Соответственно, долгое время при создании терапевтических антител ученые постепенно заменяли части молекулы на человеческие (рис. 7). Так появились типы антител, различающиеся по степени их «очеловечивания» [4]:
- животные — антитела животных без каких-либо модификаций;
- химерные — мышиными остаются вариабельные домены, константные же домены заменяются на человеческие;
- гуманизированные — аминокислотная последовательность почти полностью идентична человеческой, от животного остаются лишь гипервариабельные участки внутри вариабельных доменов, отвечающие за связывание с антигеном;
- полностью человеческие — вся аминокислотная последовательность человеческая.
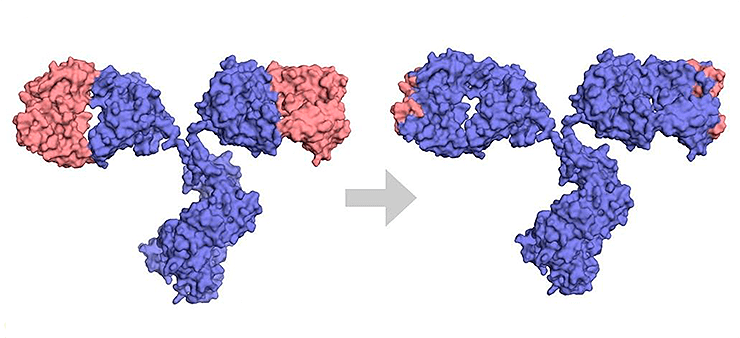
Рисунок 7. Разница между химерными и гуманизированными антителами. Синим показаны человеческие последовательности, оранжевым — мышиные.
Ранее считалось, что безопасность антител возрастает в ряду животные → химерные → гуманизированные → полностью человеческие. Однако в ходе анализа результатов клинических исследований препаратов на основе моноклональных антител было показано, что такая прямая связь существует далеко не всегда. Полученные результаты BIOCAD представил на конференции ВОЗ в 2017 году [11], что заставило организацию пересмотреть свою позицию касательно данной темы.
Один из перспективных подходов к снижению иммуногенности терапевтических антител — их направленная гуманизация: внесение некоторого количества мутаций, которые не влияют на работоспособность, но делают молекулы «невидимыми» для иммунной системы пациента. Для решения этой задачи в ДВБ был создан и постоянно совершенствуется вычислительный алгоритм, подбирающий мутации в ходе дизайна каждого конкретного терапевтического антитела.
В ДВБ разработали протокол для предсказания структуры вариабельных фрагментов антител. Применение знаний о принципах их трехмерной укладки и внутримолекулярных взаимодействий привело к достижению гораздо более высокой точности моделирования, чем при использовании стандартного докинга для произвольных белков. Именно поэтому в департаменте ведут работы по предсказанию трехмерной структуры антитела даже без использования рентгеноструктурного анализа! Добавив к этому разнообразные подходы для предсказания посттрансляционных модификаций белков и моделирования их агрегации, можно получить максимально приближенную к реальности модель терапевтического антитела, существенно сократив и удешевив этим его производство и дальнейший анализ.
Направленный дизайн антител
Одной из сложнейших задач современной биологии является проблема фолдинга (образования третичной структуры) белка [12]. Укладка аминокислотной цепочки определяет основные функции молекулы и, значит, критически важна для предсказания ее свойств. Хотя в общем случае проблема фолдинга до сих пор не решена, для определенных групп белков (например антител) можно найти частные решения. Поскольку получение моноклональных терапевтических антител является для компании BIOCAD одной из важнейших задач, в ДВБ разрабатывают и постоянно улучшают вычислительные алгоритмы, позволяющие по аминокислотной последовательности антитела предсказывать его 3D-структуру и судить о потенциальных мишенях и силе связывания с ними.
Виртуальное моделирование каркаса молекулы позволяет не только анализировать уже готовую аминокислотную цепочку антитела, но и добавлять к ней функциональные группы (например, фосфатные, ацильные или гликозидные), обеспечивающие требуемые свойства. Предсказание же сайтов посттрансляционных модификаций и уровня их активности помогает понять, как замена той или иной аминокислоты в одном белке влияет на его связывание с другими белками, что критически важно для антитела.
Метод белок-белкового докинга позволяет моделировать взаимодействие белковых молекул для поиска и изучения сайтов, в которых оно происходит [13]. Ноу-хау ДВБ является метод гибкого белок-белкового докинга. Он отличается от стандартного подхода тем, что здесь белки представляют собой не жесткие каркасы, а гибкие модели. В этой технологии применяются графические процессоры (GPU), что позволяет существенно ускорить вычисления.
Сотрудники ДВБ разработали собственную методику эпитопного картирования, которая состоит из одновременного конструирования моноклонального антитела и прогнозирования его взаимодействия с белком-мишенью. Это чрезвычайно удобно, поскольку от того, в каком именно месте моноклональное антитело распознает молекулу-мишень, зависит его терапевтический эффект (например, блокировка или активация рецептора, фактора роста, цитокина или иной мишени), а также возможные побочные реакции.
Для анализа взаимодействия антитела с мишенью в ДВБ также используют метод вычисления изменения свободной энергии связывания, который, как правило, применяют при работе с малыми молекулами. Поскольку такой подход уникален, зачастую существующее программное обеспечение не подходит для решения поставленных задач, и ДВБ разрабатывает собственные биоинформатические решения как для молекулярного моделирования, так и для составления протоколов мутаций, влияющих на изменение свободной энергии.
Применив совокупность методов по биоинформатическому моделированию антител, ДВБ буквально собрал из частей других антител препарат BCD132, который будет использоваться для лечения рассеянного склероза и уже прошел первую фазу клинических испытаний.
Синтез полинуклеотидов
Первый этап получения белкового терапевтического препарата — это выделение или синтез соответствующего ему гена и встраивание его в плазмиду (экспрессионный вектор). Как правило, гены — это достаточно длинные цепочки нуклеотидов, которые могут содержать трудные для химического синтеза фрагменты (например, «шпильки», АТ-богатые регионы или длинные области гомологии). Соответственно, такой ген проще синтезировать по частям, уже после собирая из них полноразмерную последовательность. Еще одна трудность при сборке экспрессионного вектора — различие количества каждой тРНК в различных клетках-продуцентах, из-за чего нуклеотидную последовательность необходимо оптимизировать с учетом кодонного предпочтения конкретной системы экспрессии для максимального выхода белка.
Для учета всех этих параметров на стадии конструирования потенциального терапевтического препарата в ДВБ был создан специальный вычислительный алгоритм, подбирающий оптимальные кодоны к заданной последовательности белка, а затем находящий лучший способ разделения последовательности на олигонуклеотиды для их дальнейшего синтеза.
Разработка малых молекул
Малые небелковые молекулы, которые могут эффективно связываться с белком-мишенью, также используются в качестве терапевтических агентов. Разработка лекарственных препаратов такого типа начинается с in silico скрининга миллионов соединений с дальнейшим синтезом кандидатов и экспериментальной проверкой параметров их взаимодействия с мишенями [14].
У такой методики есть значительный недостаток. Процесс можно сравнить с поиском единственной нужной песчинки в бескрайней пустыне из малых молекул. Для увеличения полезного выхода в ДВБ постоянно ведут разработки для скрининга молекул in silico (то есть не в лаборатории, а на компьютере). Взаимодействие тех или иных молекул с клеточными мишенями моделируют на компьютере, и далее отбирают наиболее успешные варианты, что сильно сужает круг поиска. Результаты in silico экспериментов используют для создания новых виртуальных библиотек, отбора лучших молекул и их дальнейшего синтеза, что в конечном итоге увеличивает полезный выход.
Одна из важнейших технологий в области малых молекул — предсказание течения химических реакций. Однако если молекулу удалось предсказать, это еще не значит, что она может быть получена. «Нарисовать на компьютере мы можем любую произвольную молекулу, однако создать ее значительно сложнее. Химики шутят, что для этого необходим атомный взрыв, не меньше», — говорит Павел Яковлев, руководитель ДВБ. Для предсказания хода химической реакции используются методы машинного обучения, в ходе которых рассчитываются параметры процесса и определяется, может ли такая цепочка химического синтеза быть проведена.
Команда департамента вычислительной биологии
Проблемы, которые решают в департаменте, зачастую находятся на стыке различных дисциплин и требуют привлечения специалистов из смежных областей. Поэтому крайне важно сформировать команду, которая могла бы быстро решать неординарные задачи.
В основном набираются люди из IT-области или физических и химических специальностей: им влиться несколько легче, чем людям, пришедшим из области академической биологии. Однако у них могут возникать сложности с биологической составляющей проектов. В качестве вступительных испытаний кандидату предлагается решить какую-то небольшую задачу, связанную с тематикой группы. Например — ввести мутации в последовательность белка, повышающие сродство с другим белком, или же предсказать показатели растворимости для молекулы, исходя из информации о другой схожей с ней молекуле. Конечно же, при проверке оценивают не только итоговый результат, но и ход решения. Чем он интереснее и многограннее — тем больше шансов попасть в команду ДВБ.
Для «удержания» новых сотрудников и облегчения их интеграции в коллектив есть ряд мероприятий, нацеленных на ускоренное их вовлечение в работу команды. За 3–4 первых месяца работы с новоиспеченным сотрудником проводят несколько встреч, на которых проверяется его понимание и вовлеченность в проект. Далее человек пускается в свободное плавание, которое, тем не менее, предполагает постоянное обучение у коллег.
Характерная черта ДВБ — командное деление департамента: у каждой команды своя область задач. Поэтому с приходом нового человека более опытные члены группы вводят его в курс дела. Регулярные встречи сотрудников для совместного разбора новых публикаций или проектов не только позволяют «влиться» в коллектив, но и способствуют общению между проектными группами.
Для обмена знаниями внутри департамента придумано несколько форматов мероприятий. Так, внутри ДВБ издается «Дайджест ДВБ» — информационный листок, регулярно рассылаемый всем работникам департамента. Еженедельно проводится общее собрание департамента, на котором все проектные команды презентуют свою работу за неделю. Раз в квартал проходит более масштабное мероприятие — однодневная конференция, на которой представляются уже не локальные результаты, а стратегические планы департамента.
С момента образования ДВБ его штат вырос примерно в шесть раз. Вначале в нем было лишь шесть человек, сейчас же в ДВБ работает около 35 сотрудников. Темпы увеличения состава ДВБ высоки: в 2018 году департамент принял на работу около двадцати человек, за счет чего увеличился более чем в два раза.
Сотрудники ДВБ активно участвуют в конференциях. Так, в 2019 году каждый второй сотрудник департамента уже был на международных конференциях или планирует их посетить. Это связано как с бурным ростом ДВБ и необходимостью обучения, так и с желанием презентовать собственные материалы на крупных международных научных мероприятиях. В перечень конференций, посещаемых сотрудниками департамента, входят Protein Engineering Summit (PEGS), профильные конференции по антителам и малым молекулам (например Antibody Engineering & Therapeutics), а также конференции по высокопроизводительным вычислениям (такие как NVIDIA’s GPU Technology Conference и ICFP).
Департамент вычислительной биологии BIOCAD, как, впрочем, и компания в целом, стремится показать, что наиболее перспективные и эффективные фармацевтические решения лежат на стыке прикладной и фундаментальной наук. Именно поэтому такое большое внимание уделяется не просто решению частных задач моделирования и синтеза определенных молекул, а поиску новых методов анализа данных, оптимизации существующих подходов и актуализации текущей научной повестки. Пожалуй, именно это можно назвать основной «изюминкой» ДВБ, которая, надеемся, принесет свои плоды.
Литература
- Козлов В.А. (2004). Гранулоцитарный колониестимулирующий фактор: физиологическая активность, патофизиологические и терапевтические проблемы. «Цитокины и воспаление». 2;
- Краткая история открытия и применения антител;
- Антитело: лучший способ распознать чужого;
- Биотехнология антител;
- Терапевтические моноклональные антитела;
- Сводка с генотерапевтических фронтов. Новая стратегия нейтрализации гемофилии;
- Клинические исследования в России — истории успеха;
- Синтетическая биология: от программирования компьютеров к программированию клеток;
- Моноклональные антитела;
- Открытие моноклональных антител;
- Paul W. H. I. Parren, Paul J. Carter, Andreas Plückthun. (2017). Changes to International Nonproprietary Names for antibody therapeutics 2017 and beyond: of mice, men and more. mAbs. 9, 898-906;
- Проблема фолдинга белка;
- Виртуальные тропы реальных лекарств;
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Как работает свертывание крови?;
- Peter T. Jones, Paul H. Dear, Jefferson Foote, Michael S. Neuberger, Greg Winter. (1986). Replacing the complementarity-determining regions in a human antibody with those from a mouse. Nature. 321, 522-525.