
Разработка биспецифических антител для применения в клинике
26 октября 2018
Разработка биспецифических антител для применения в клинике
- 2247
- 0
- 7
Биспецифические антитела могут открывать новые возможности в лечении различных болезней
иллюстрация Дарьи Боголюбовой-Кузнецовой
-
Автор
-
Редакторы
В первой статье этого цикла мы рассказывали о том, что такое биспецифичность в случае антител, и какие она может дать преимущества для лечения заболеваний. В этой публикации речь пойдет о биотехнологии биспецифических антител: мы рассмотрим варианты «связок» между модулями, различные биотехнологические конструкции для правильной сборки молекулы, критерии выбора таких конструкций и примеры их использования.
Биспецифические антитела

Спецпроект о биспецифических антителах, особенностях их строения, свойств, получения и применения в современной медицине.
Партнер спецпроекта — компания Cytiva, занимающаяся оснащением научно-исследовательских лабораторий, фармацевтических и биотехнологических производств приборами, расходными материалами и реактивами.
Биотехнология биспецифических антител еще более разнообразна и сложна, чем в случае «обычных» моноклональных антител. Первая статья спецпроекта о биспецифических антителах [1] в основном рассказывает о том, что такое биспецифические антитела и зачем они нужны, а в этой — второй — публикации мы поговорим о том, как формируется разнообразие биспецифических антител и в каких случаях использовать те или иные подходы.
Если у обычных антител наиболее часто используемый тип один — IgG, — то многообразие типов, или форматов, биспецифических антител (или, как их для краткости называют, биспецификов) огромно: исследователи даже говорят о «зоопарке» форматов. Первая глава посвящена классификации и особенностям наиболее важных представителей этого зоопарка.
Форматы антител
Существует более 60 различных форматов биспецификов, но все их можно разделить на пять категорий:
- биспецифические IgG;
- IgG с присоединением дополнительной антигенсвязывающей группы;
- биспецифические фрагменты;
- биспецифические фьюжн-белки;
- биспецифические конъюгаты.
Рассмотрим каждый из форматов подробнее.
Биспецифические IgG
Биспецифические IgG аналогичны по структуре обычному антителу формата IgG , только вместо двух одинаковых антигенсвязывающих участков у такого биспецифика эти участки разные.
О том, как устроено антитело, можно узнать из статей «12 методов в картинках: иммунологические технологии» [2], «Антитело: лучший способ распознать чужого» [3], а также из первой статьи этого спецпроекта [1]. — Ред.
Различные форматы биспецифических IgG отличаются друг о друга тем, используются ли одинаковые или разные легкие и тяжелые цепи для их создания, и как именно они соединены между собой. Разнообразие возникает во многом из-за попыток решить основную проблему при производстве IgG-биспецификов — проблему гомодимеризации. Обычные антитела состоят из двух симметричных половин, поэтому если без специальных ухищрений экспрессировать для получения биспецифика две половинки от разных антител, то преимущественно будут образовываться не биспецифики, а обычные антитела со специфичностью , соответствующей каждой из половин.
В общем случае под специфичностью антитела или антигенсвязывающего домена понимается его способность связывать антиген с достаточным сродством. Однако для краткости специфичностью биспецифического антитела называют сам антигенсвязывающий домен. — Ред.
О том, какие используются подходы для решения этой проблемы, будет рассказано в разделе «Проблема ошибочного спаривания». Здесь упомянем, что избежать гомодимеризации можно, если попытаться создать антитело обычного формата, у которого каждый вариабельный домен будет узнавать сразу два антигена. Преимуществом является то, что такую молекулу можно производить, как обычные антитела — в одной клеточной линии, подготовленной с помощью одного вектора, как рассказано в статье «Биотехнология антител» [4]. Это существенно упрощает не только разработку клона-продуцента, но и стадии выделения и очистки белка. Недостатком такого метода является то, что при разработке требуются дополнительные усилия по скринингу с использованием дисплейных технологий .
Эти технологии более подробно описаны в статье «Биотехнология антител» [4]. Вкратце, генетические последовательности, кодирующие различные варианты антител, помещают в вирус, который на своей поверхности выставляет эти антитела, а затем отбирают те вирусы, которые несут на поверхности антитела с нужными параметрами связывания. Через несколько раундов мутаций и отбора вирусы будут содержать гены нужных антител. Если проводить скрининг по связыванию сразу с двумя антигенами, то в некоторых случаях удается получить биспецифические антитела, однако результат не гарантирован [5].
К классу биспецифических IgG антител относится один из двух вышедших на фармацевтический рынок продуктов — антитело катумаксомаб против CD3 и EpCAM , о котором рассказывалось в первой статье цикла — «Биспецифические антитела, их мишени и перспективы применения в современной медицине» [1].
CD3 — рецептор на поверхности Т-клеток, играющий одну из главных ролей в их функционировании. EpCAM — белок на поверхности эпителиальных и раковых клеток (раками специалисты называют злокачественные опухоли именно эпителиального происхождения).
IgG с присоединением дополнительной антигенсвязывающей группы
Вторая группа биспецификов получается путем присоединения дополнительного антигенсвязывающего домена к антителу IgG. Внутри этого класса существует несколько разных форматов. Между собой они отличаются тем, что антигенсвязывающий домен может присоединяться к N- или С-концу как легкой, так и тяжелой цепи. Также присоединяться может не домен целиком, а только вариабельный фрагмент тяжелой (VH) или легкой (VL) цепи. Есть варианты и с присоединением одноцепочечного вариабельного фрагмента scFv (рис. 1).
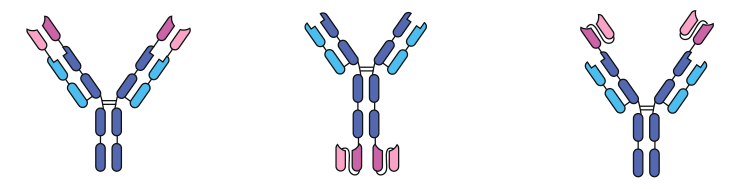
Рисунок 1. Три примера из всего многообразия форматов IgG с присоединением дополнительной антигенсвязывающей группы. Слева — присоединение дополнительных вариабельных доменов (розовый цвет). В центре — присоединение двух scFv с Fc-конца. Справа — присоединение двух scFV к VH.
Один из форматов — DVD-Ig (dual variable domain Ig) — состоит, как и обычное антитело IgG, из двух тяжелых и двух легких цепей, но к N-концам VH и VL с помощью линкерной последовательности присоединяется дополнительный вариабельный домен (рис. 2).
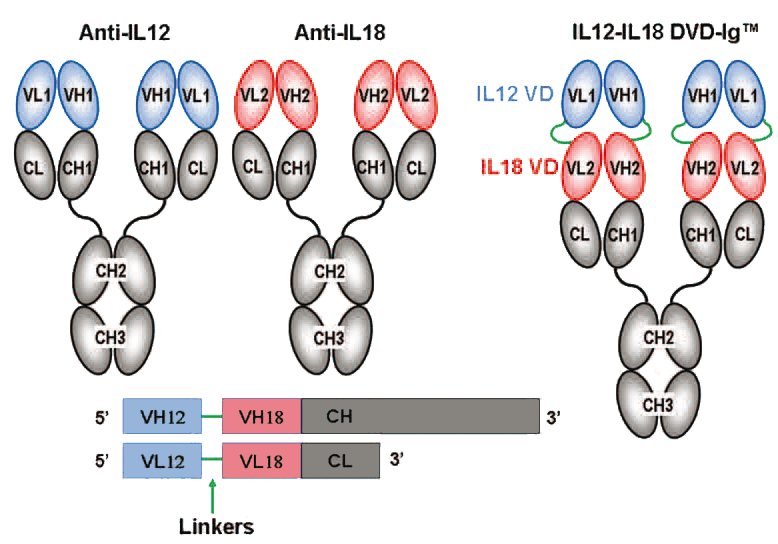
Рисунок 2. DVD-Ig сконструирован из двух обычных антител путем присоединения вариабельных доменов первого антитела к N-концам вариабельных доменов второго с помощью линкеров. IL-12 и IL-18 — интерлейкины 12 и 18, воспалительные цитокины, в норме играющие роль в клеточном ответе на бактериальные инфекции.
Преимуществом такого формата является наличие четырех антигенсвязывающих участков, с которыми антигены могут связываться одновременно, что полезно в случае мишеней с низкой концентрацией, например, цитокинов. На основе подобной конструкции можно создать и тетравалентное антитело, где все специфичности будут разными.
Биспецифические фрагменты
Разнообразие фрагментных биспецификов, наверное, наиболее велико. У таких молекул может вообще не быть константных доменов или они могут присутствовать не полностью. Во многих случаях тяжелые и легкие цепи соединены короткими пептидными линкерами. Тогда белок состоит из одной пептидной цепи, а не из двух, и такой продукт проще получать и выделять.
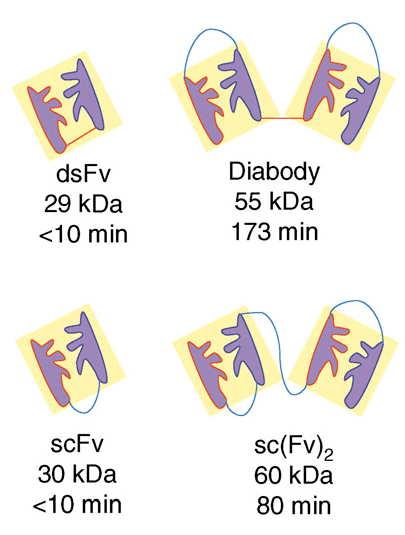
Рисунок 3. Некоторые примеры фрагментных биспецификов. Красным обозначена дисульфидная связь, синим — пептидный линкер. В подписи приведены название, масса и период полувыведения.
Самым распространенным фрагментом для построения таких биспецификов является scFv (single-chain variable fragment — вариабельные фрагменты антитела, соединенные в одну цепь). От того, как между собой объединяются scFv, зависит формат получающегося биспецифика (рис. 3). Например, они могут соединяться нековалентными связями, как в формате diabody, дисульфидной связью, как в dsFv, либо с помощью ковалентного линкера, как в случае single-chain diabody [6]. В структуру diabody возможно введение дисульфидной связи, увеличивающей стабильность конструкции [7]. Такой формат называется DART (dual affinity retargeting; рис. 9б). Ряд биспецификов формата DART сейчас находятся в клинических исследованиях в области онкологии и других заболеваний [8].
Другой способ создания фрагментных биспецификов — соединение двух пар доменов VL и VH в одну полипептидную цепь с созданием биспецифического антитела, бивалентного к обоим антигенам — TandAb (tandem diabody) (рис. 9в). К похожему типу относится и одно из двух вышедших на рынок антител — блинатумомаб, — созданный по технологии BiTE (bispecific T-cell engager) (рис. 9а). У BiTE одна из специфичностей связывает CD3, а другая — мишень на опухолевой клетке, в случае блинатумомаба — белок CD19 на поверхности клеток лимфом и лейкемий [9].
C целью дальнейшей минимизации конструкции были созданы «нанотела» (nanobodies), полученные из фрагментов антител лам и верблюдов [10], которые состоят только из тяжелой цепи. Малый размер таких биспецификов дает им преимущество перед IgG-конструкциями — меньшие молекулы легче проникают в целевые ткани.
Поскольку молекулы небольшого размера достаточно быстро выводятся почками, у фрагментных биспецификов по сравнению с молекулами на основе IgG более короткое время полувыведения. Это приводит либо к необходимости более частого дозирования, либо к введению изменений в структуру для увеличения этого времени [11].
Биспецифические фьюжн-белки
Фьюжн-белками называют искусственные белковые молекулы, полученные слиянием двух белков или белковых фрагментов. Как правило, такое слияние осуществляют ковалентно с помощью пептидного линкера.
Фрагменты антител могут присоединяться к другим белкам для получения дополнительной функциональности. Например, конструкции ImmTAC состоят из анти-CD3 scFv, связанного с Т-клеточными рецепторами, которые узнают пептиды на поверхности белков главного комплекса гистосовместимости (у человека этот комплекс называется HLA) (рис. 4).
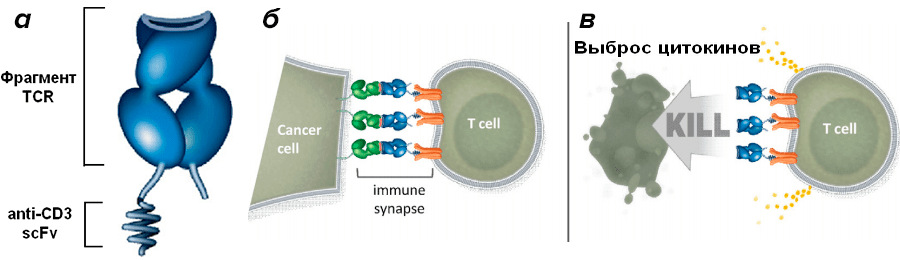
Рисунок 4. Принцип работы биспецифического антитела типа ImmTAC. а — Конструкция биспецифика ImmTAC. б — Образование иммунного синапса между раковой клеткой и Т-клеткой. На поверхности раковой клетки находятся комплексы пептидов с HLA (показан зеленым), которые узнает TCR. в — Уничтожение раковой клетки Т-клеткой после узнавания.
Это дает возможность направлять Т-клетки не только против поверхностных мишеней, но и против клеток, синтезирующих определенные белки внутри. Все клетки организма выставляют на поверхности фрагменты внутриклеточных белков в комплексе с HLA. Поскольку раковые клетки производят необычные для большинства клеток белки, есть возможность создать ImmTAC, нацеленные именно на них.
Биспецифик связывается со всеми Т-клетками в организме, так как они все имеют на поверхности белок CD3, а вторая специфичность биспецифика обеспечивает сближение Т-клетки с теми клетками, у которых на поверхности имеются фрагменты внутриклеточных белков, связанные с HLA. За счет связывания с CD3 Т-клетка активируется и, сблизившись с другой клеткой, обеспечивает ее уничтожение.
Еще один остроумный метод, основанный на природном взаимодействии доменов двух белков, позволил получить гексавалентные биспецифические антитела против антигенов CD20 и CD22 на клетках лимфом. Это белки, которые выставляются на поверхности лимфомных клеток, поэтому антитело против одного из них — CD20 — давно и успешно применяется для лечения В-клеточных лимфом. Однако некоторые клетки лимфом несут не оба белка, а только один из них, поэтому применение биспецифика позволило бы повысить эффективность уничтожения лимфомных клеток. Для получения биспецифической конструкции ученые присоединили к константным доменым исходных антител пептиды, которые нековалентно связываются друг с другом, как показано на рисунке 5. После связывания пептиды соединяются между собой дисульфидными связями, что обеспечивает жесткость конструкции и устойчивость ее к расщеплению, поэтому метод называется dock-and-lock, то есть «связать и закрепить» (рис. 5) [12].

Рисунок 5. Получение гексавалентных антител методом dock-and-lock. а — Дизайн модуля CH1-DDD2-Fab. б — Дизайн модуля CH3-AD2-IgG. в — Структура димера CH1-DDD2-Fab. г — Структура димера CH3-AD2-IgG. д — Структура биспецифического гексавалентного антитела. е — Взаимодействие пептидов DDD2 и AD2. В верхней части — SS-связи, которые скрепляют структуру.
Такой конструкт более эффективно уничтожал клетки лимфомы по сравнению с анти-CD20 антителом, и продлевал жизнь мышам, которым были подсажены клетки лимфомы, по сравнению с мышами, леченными анти-CD20 антителом. Это стало хорошим доказательством концепции применения биспецификов для одновременного воздействия на две мишени.
Биспецифические конъюгаты
Химическая конъюгация антител и их фрагментов широко использовалась до повсеместного внедрения рекомбинантных методов, когда белки стали получать, внося кодирующие их последовательности ДНК в клетки культуры бактерий или животных. Таким способом по остаткам цистеина с помощью образования дисульфидных мостиков осуществляли соединение двух Fab-фрагментов антител для получения биспецификов.
Более современный пример использования химической конъюгации — получение CovX-body. Исследователи взяли два коротких пептида, один специфичный к VEGF, другой — к Ang2 , и соединили их ковалентным линкером. Затем всю конструкцию присоединили к антителу (рис. 6). Такая молекула, по замыслу ученых, должна сочетать длительный период полувыведения, характерный для IgG, с легкостью оптимизации фармакологических характеристик специфичных пептидов [13]. Первая конструкция CovX-body, дошедшая до клинических исследований, правда, не показала достаточных характеристик для продолжения разработки, но, возможно, на этой платформе когда-то удастся сделать работающее лекарство — ведь на ее основе можно использовать пептиды любой специфичности.
VEGF и Ang2 — белки, отвечающие за образование новых сосудов. Одно из антител, применяемых для лечения ряда видов рака, бевацизумаб, связывается с VEGF и не дает ему активировать рецептор. Таким образом, в опухоли снижается рост сосудов, и раковые клетки начинают погибать от недостатка питания.
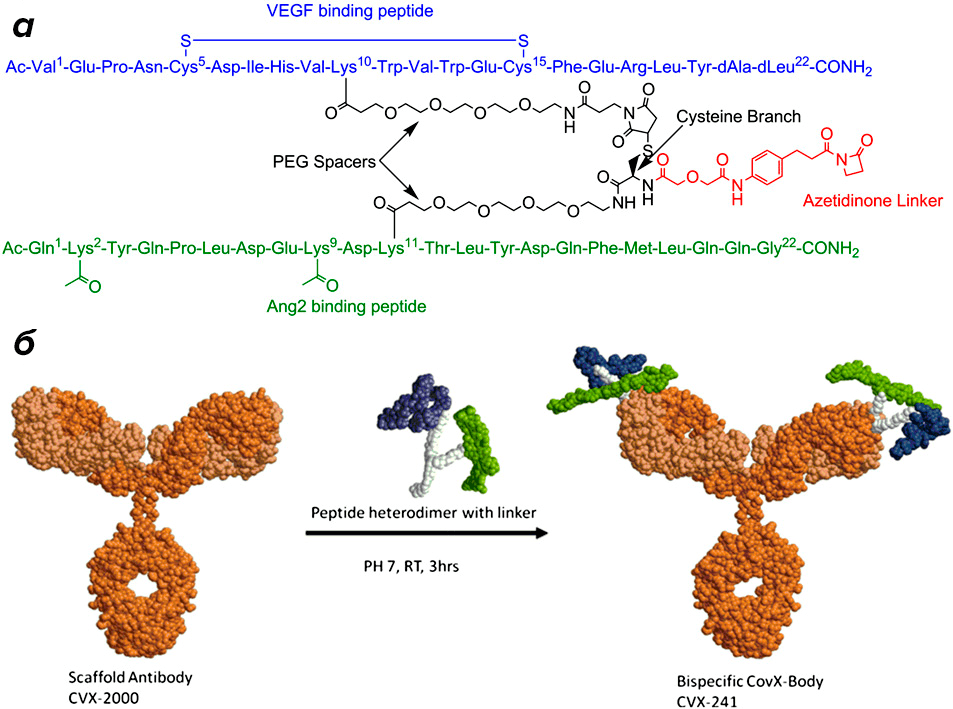
Рисунок 6. Биспецифическое антитело формата Covx-body. а — Структура пептидного гетеродимера с азетидиноновым линкером. б — Схема реакции конъюгации.
Далее мы будем в основном говорить о первых двух типах биспецификов — IgG и фрагментных, так как оба продукта, дошедшие до рынка, и большинство находящихся в разработке относятся именно к ним.
Проблема ошибочного спаривания
IgG-биспецифики
Как уже говорилось, если в одной клетке произвести две половинки разных антител, биспецифик не получится. Результатом станет ошибочное спаривание (mispairing) тяжелых и легких цепей, поскольку каждая тяжелая цепь может объединяться с любой другой, а легкие цепи могут присоединяться в двух положениях к димеру тяжелой цепи.
Ранее для решения этой проблемы использовали гибридомы двух разных видов животных (мышей и крыс), которые сливали для получения так называемой квадромы. Поскольку объединение цепей из животных одного вида идет эффективнее, чем межвидовое, в основном образуются антитела, состоящие наполовину из мышиных, наполовину из крысиных цепей. Вдобавок, крысиные IgG хуже связываются с Protein A — белком, который используется для аффинной очистки антител (об этом процессе рассказано в статье «Биотехнология антител» [4]), поэтому биспецифики легко отделяются от примеси. Именно так был получен катумаксомаб (биспецифик против CD3 и EpCAM). Однако у гибридных мышино-крысиных антител есть минимум две проблемы: они могут быть иммуногенны для человека, а их получение гибридомным методом не позволяет использовать всю мощь дисплейных методов, о которых мы рассказывали в статье «Биотехнология антител» [4]. Поэтому нужны были другие подходы для решения проблемы ошибочного спаривания цепей.
Поскольку гомодимеризация тяжелых цепей обусловлена исключительно взаимодействием константных доменов CH3, в середине 1990-х годов возникла идея внести мутации в эти домены, что привело к разработке подхода «выступы во впадины» (knobs-into-holes). Выступы создаются заменой аминокислот с небольшим боковым остатком на более объемные, например, треонина на триптофан. Впадины, наоборот, получают введением менее объемного бокового остатка, например, валина вместо тирозина (рис. 7). Замены выбираются не вручную, а методом фагового дисплея, так, чтобы одновременно избежать гомодимеризации и сделать спаривание между разными цепями наиболее эффективным.
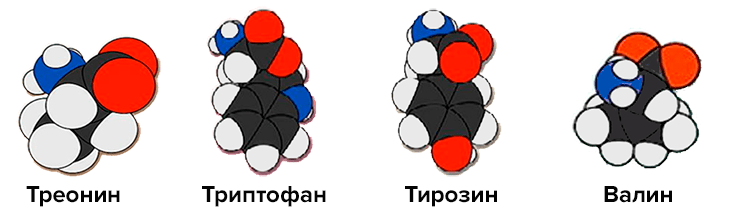
Рисунок 7. Замена треонина на триптофан приводит к введению в белковую цепь более объемной боковой группы, а тирозина на валин — менее объемной
Еще один способ избежать ошибочного спаривания тяжелых цепей — введение в CH3-домен одной из тяжелых цепей положительно заряженной аминокислоты (лизина, аргинина), а другой — отрицательно заряженной (аспарагиновой или глутаминовой кислоты). Тогда гомодимеризация будет исключена из-за отталкивания одноименных зарядов.
Отдельно приходится решать проблему ошибочного спаривания легких цепей. Можно подобрать такие легкие цепи, чтобы они были идентичны для обеих специфичностей биспецифика. Однако так удается сделать далеко не всегда, так как антигены могут быть слишком различны, и аффинность антигенраспознающих участков окажется недостаточной. Другой способ — получать половинки антитела в двух разных клеточных культурах и смешивать их уже после того, как произошло правильное объединение тяжелых и легких цепей. Его недостаток — в повышении стоимости и усложнении процесса производства.
Технология CrossMab — наиболее универсальный способ решить проблему легких цепей. Напомним, что Fab-фрагмент антитела состоит из двух симметричных «ветвей», каждая из которых содержит четыре домена (рис. 8): константный домен тяжелой цепи CH1, вариабельный домен тяжелой цепи VH, константный домен легкой цепи CL и вариабельный домен легкой цепи VL. По технологии CrossMab в структуру антитела вносится асимметрия путем обмена доменами в Fab-фрагменте между легкими и тяжелыми цепями в одной из половин антитела. Такой обмен сохраняет первоначальную аффинность, но делает две части Fab-фрагмента настолько непохожими, что появление побочных продуктов практически исключается. Как показано на рисунке 8, существует три способа обмена доменов, приводящих к нужному результату. CrossMabCH1—CL — лучший из них, так как даже теоретически в нем исключено образование побочных продуктов. Два домена СH1 не взаимодействуют между собой, так же как и два домена CL. Поэтому единственным вариантом будет образование нужного биспецифика [14], [15].
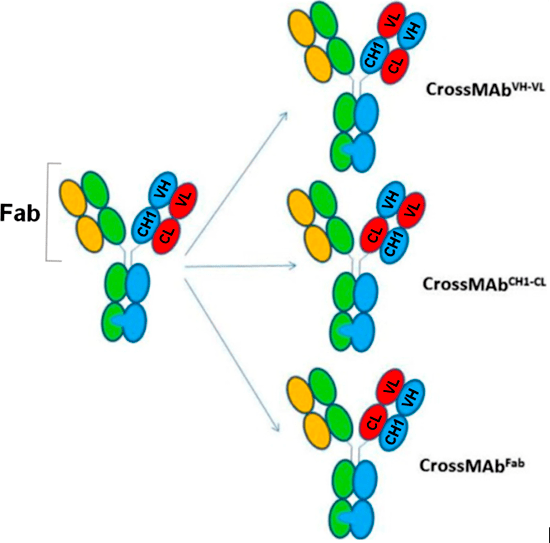
Рисунок 8. Три способа получения биспецифика, решающего проблему ошибочного спаривания легких цепей
Варианты линкеров
Некоторые биспецифики вообще не требуют линкеров, например, состоящие из одного домена nanobodies, о которых говорилось ранее. В остальных случаях разработчику приходится задумываться над тем, какой линкер использовать.
При дизайне линкера приходится искать компромисс между стабильностью, функциональностью биспецифика (аффинностью, специфичностью) и фармакокинетическими параметрами. Длинный линкер позволяет фрагментам свободно сворачиваться и связываться со своими мишенями без пространственных затруднений, однако делает биспецифик более уязвимым для протеаз. К тому же длинный линкер сам может стать иммуногенным эпитопом, а если он еще и гидрофобный — привести к агрегации биспецифика. Агрегация же сильно снижает шансы на то, что удастся получить растворимый белок, пригодный для введения пациентам. Увеличение массы биспецифика удлинит период его полувыведения, но сделает менее доступным для некоторых тканей и опухолей. Также приходится думать об эффективной экспрессии получаемой конструкции в клетках, где ее планируется производить. Поэтому в каждом случае используют сочетание биоинформатических и экспериментальных подходов для выбора оптимальной конструкции [16].
При конструкции фрагментных биспецификов на основе двух scFv чаще всего используют последовательность VLA—linker1—VHA—linker2—VHB—linker3—VLB, где VL и VH — вариабельные фрагменты исходных антител А и В. Длина линкеров 1 и 3 определяет строение антигенсвязывающего участка, а линкера 2 — гибкость связи между двумя scFv. Обычно линкеры состоят из участков GGGGS (четыре остатка глицина и серин), которые обеспечивают необходимую гибкость и гидрофильность. У блинатумомаба линкеры 1 и 3 состоят из трех таких участков (итого 15 аминокислот), а линкер 2 — из одного. В данном случае линкеры не должны быть слишком длинными, чтобы не происходило нежелательного взаимодействия доменов VH и VL и образования менее функциональных димерных форм вместо мономерных (рис. 9а).
В случае антител формата DART линкер между тяжелой и легкой цепью короткий — всего пять аминокислот, а последовательность доменов чаще всего VHA—linker—VHB, VHB—linker—VHA (здесь, как и выше, буквы «А» и «В» означают специфичности исходных антител). Наличие короткого линкера между доменами одного scFv не позволяет им взаимодействовать, и они гомодимеризуются со своим гомологичным партнером в другом scFv, то есть VHA не может образовать пару с VLB, а образует ее с VLA. Добавление остатков цистеина на конце VHA и VHB позволяет дополнительно стабилизировать молекулу с помощью дисульфидной связи (рис. 9б).
В формате TandAb домены соединены между собой так: VHA—linker1—VLB—linker2—VHB—linker3—VLA. Линкеры состоят из двух–трех повторов GGS, конкретный состав линкеров подбирается экспериментально [17]. Такая конструкция легко димеризуется, и получившийся достаточно большой размер молекулы (150 кДа) не дает ей фильтроваться в почках, что удлиняет период полувыведения по сравнению, например, с BiTE. TandAb бивалентны по каждому из антигенов, что приводит к более сильному связыванию с антигеном (рис. 9в).
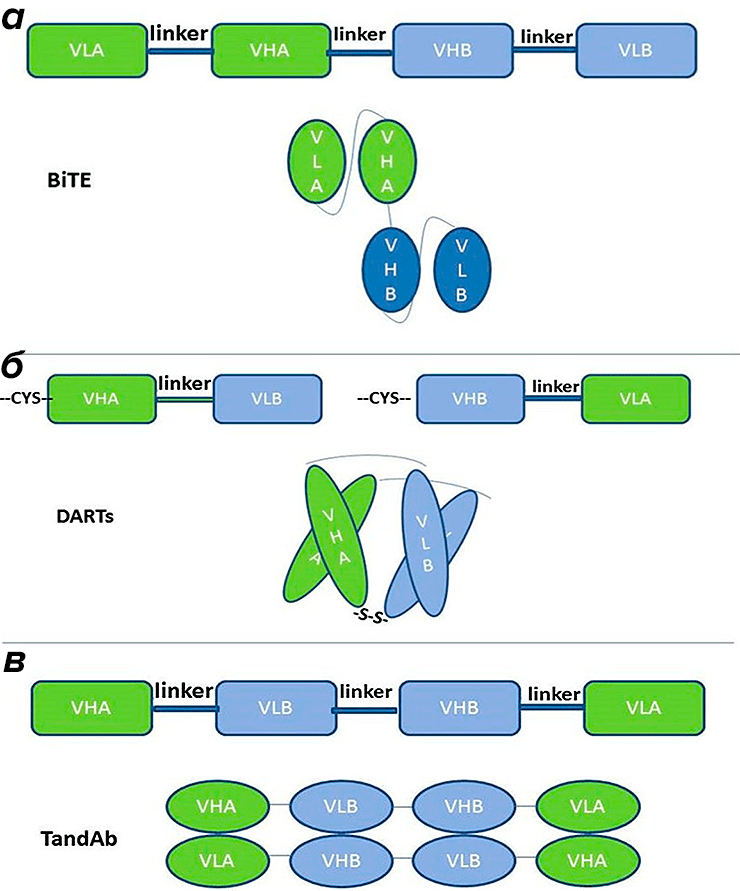
Рисунок 9. Взаимное расположение линкерных последовательностей и доменов в структуре фрагментных биспецифических антител. а — Структура BiTE. б — Структура DART. в — Структура TandAb.
Выбор формата биспецифического антитела
Допустим, исследователи решили, что им нужно создать биспецифик против двух определенных мишеней. Как им определить, какой из многочисленных форматов выбрать? Первое, с чем нужно определиться — должен ли продукт обладать эффекторными функциями (например, антителозависимой клеточной цитотоксичностью, ADCC), о которых говорилось в первой статье цикла. Если должен, то необходимо использовать форматы, содержащие Fc-фрагмент, так как именно он отвечает за эффекторные функции [18]. Второй вопрос: как долго антитело должно циркулировать в кровотоке? Если долго, необходимо выбирать форматы с бóльшей массой, например, IgG. Если выбран фрагментный формат без IgG, необходимо, чтобы он был с жесткими линкерами, устойчивыми к расщеплению протеазами.
Рассмотрим на примере одного из антител, какими соображениями руководствуются разработчики. В одной из работ [20] ученые задались целью обойти ограничения обычных моноклональных антител, связанные с Fc-фрагментом. Как было рассказано в статье «Биотехнология антител» [4], Fc-фрагмент связывается с Fcγ-рецепторами на поверхности клеток иммунной системы, среди которых есть как активирующие (FcγRI, FcγRIIIa), так и ингибирующие (FcγRIIb). Связывание с ингибирующим рецептором отрицательно влияет на терапевтическую активность антител. Сила связывания с активирующим рецептором зависит от мутаций конкретного человека. Кроме того, Fc-фрагмент конкурирует с сывороточными иммуноглобулинами за связывание с рецепторами, из-за чего антитела приходится вводить в достаточно высоких концентрациях, несмотря на их высокую аффинность к мишени. Наконец, Fc-фрагмент содержит остатки фукозы, снижающие сродство к активирующему рецептору FcγRIIIa. Для того чтобы одним махом обойти эти ограничения, можно использовать биспецифические антитела, которые будут специфичны с одной стороны к терапевтической мишени, а с другой — к FcγRIIIa, активирующему рецептору.
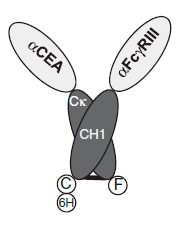
Рисунок 10. Схема биспецифического антитела на основе доменов антител ламы
Исследователи взяли однодоменные антитела на основе антител ламы, поскольку такие белки хорошо синтезируются в бактериях. Из полученных ранее доменов, специфичных к CEA (cancer embryonic antigen, раковый эмбриональный антиген — белок на поверхности раковых клеток) и к FcγRIIIa, создали биспецифическое антитело, не содержащее линкеров. Фрагменты в нем объединяются за счет сродства между константными доменами антител человека CH1 и Cκ (рис. 10).
Этот биспецифик оказался стабилен в плазме в течение семи суток, что очень много для фрагментного биспецифика. Обычный период полувыведения сравнительно небольшой молекулы формата DART или BiTE — несколько часов. Для сравнения, у антител он составляет, как правило, 21 день. Новый биспецифик связывался с FcγRIIIa более эффективно, чем IgG, и был способен привлекать NK-клетки для уничтожения раковых клеток (механизм, аналогичный ADCC для антител), причем на порядок эффективнее обычных антител. В мышиных моделях опухолевого роста он снижал скорость роста опухоли по сравнению с контролем. Таким образом, грамотный выбор формата биспецифика позволил получить лекарственного кандидата с подходящими свойствами.
Заключение
Всего за два десятилетия ученые разработали огромное количество биспецифических антительных конструкций, и возникает закономерный вопрос: нужно ли нам столько форматов, и если да, то зачем?
Понятно, что такое количество типов биспецификов появилось, с одной стороны, в поисках лучших технологических решений, а с другой — как результат конкуренции, когда компаниям и исследовательским группам хотелось создать что-то похожее на существующие продукты, но закрытое своим патентом.
В итоге изобилие имеющихся сейчас форматов, с одной стороны, ставит в тупик тех, кто хочет сделать новый продукт рациональным способом и не имеет возможности сравнить все опции между собой. С другой стороны, «лучшего формата» для всех применений не может существовать: в каждом случае выбирается наиболее подходящее решение, и разнообразие имеющихся подходов позволяет сделать оптимальный выбор [22]. В следующих статьях спецпроекта мы рассмотрим, как полученные биспецифические антитела нарабатываются для применения в клинике, а также какие существуют этапы контроля их качества.
Словарик
- Fab-фрагмент
- (от англ. fragment antigen binding) фрагмент антитела, связывающий антиген. У антител IgG по два Fab-фрагмента.
- Fc-фрагмент
- фрагмент антитела, отвечающий за его взаимодействие с рецепторами на поверхности клеток иммунной системы.
- IgG
- иммуноглобулин G, обозначение самого распространенного типа антител Y-образной формы. Это наиболее специфичный и высокоаффинный к белковым антигенам тип.
- NK-клетки
- (natural killers) клетки врожденной иммунной системы, отвечающие за уничтожение чужеродных клеток и аномальных клеток своего организма, например, раковых.
- scFv-фрагмент
- (от англ. single-chain fragment variable) синтетический белок, полученный слиянием вариабельных фрагментов тяжелой (VH) и легкой (VL) цепей антитела с помощью соединяющего (линкерного) пептида, как правило, длиной 10–25 аминокислот.
- VH-домен
- вариабельный домен тяжелой цепи антитела.
- VL-домен
- вариабельный домен легкой цепи антитела.
- Агрегация
- объединение множества молекул белка в неупорядоченные комплексы — агрегаты. Чаще всего агрегируют белки с гидрофобной поверхностью.
- Антиген
- молекула, которая вызывает в организме антительный иммунный ответ. Как правило, антиген — макромолекула белковой, полисахаридной или нуклеотидной природы, хотя иммунный ответ может возникнуть и на малую молекулу, если она присоединена к макромолекуле.
- Антигенсвязывающий участок
- те аминокислоты антитела, которые принимают участие в связывании антигена.
- Антитело
- молекула, обеспечивающая, с одной стороны, связывание антигена, а с другой — взаимодействие с клетками иммунной системы.
- Аффинная очистка
- метод очистки белков, использующий высокоспецифичные взаимодействия: белок—белок, белок—металл и другие.
- Аффинность
- (сродство) характеристика силы связывания антитела с антигеном.
- Бивалентный
- способный связывать две молекулы (в случае антител, антигенов).
- Вариабельные фрагменты антител
- участки молекулы, которые отвечают за связывание антигенов, и поэтому сильно различаются даже у одного организма. Вариабельный фрагмент несет антигенсвязывающий участок.
- Вектор
- средство доставки в клетку гена белка для экспрессии. Для продукции антител используются векторы на основе плазмид.
- В-клетки
- (В-лимфоциты) клетки иммунной системы, производящие антитела после встречи с антигеном.
- Время полувыведения
- время, прошедшее с момента введение лекарства в организм, за которое концентрация введенного вещества в плазме крови падает в два раза.
- Гексавалентный
- способный связывать шесть молекул (в случае антител, антигенов).
- Гибридома
- клеточная линия, полученная слиянием В-лимфоцитов, способных производить антитела, и клеток миеломы, обеспечивающих неограниченное деление.
- Главный комплекс гистосовместимости
- (major histocompatibility complex, MHC; в случае человека используется также сокращение HLA — human leukocyte antigen, то есть человеческий лейкоцитарный антиген) набор белков на поверхности клеток, несущих пептиды антигенов. Пептиды получены расщеплением своих и чужих белков внутри клетки.
- Гомодимеризация
- связывание двух одинаковых молекул между собой.
- Дисульфидная связь
- ковалентная связь внутри молекулы белка или между двумя белками, образованная двумя атомами серы в составе двух остатков аминокислоты цистеина.
- Иммунный синапс
- область взаимодействия Т-клетки с клеткой, несущей молекулы главного комплекса гистосовместимости. Образуется в результате взаимодействия Т-клеточного рецептора с белком главного комплекса гистосовместимости.
- Иммуногенность
- способность молекулы вызывать антительный иммунный ответ.
- Иммуноглобулин
- то же, что антитело.
- Клеточная линия
- хорошо охарактеризованная генетически однородная популяция клеток, полученная от многоклеточного организма или из первичной культуры путем отбора и клонирования клеток, имеющих определенные свойства или маркеры, которые должны сохраняться в течение последующего культивирования.
- Клон-продуцент
- клеточный клон, в который с помощью вектора введен ген белка и достигнут достаточно высокий уровень его экспрессии.
- Ковалентная связь
- химическая связь между атомами, образованная перекрытием электронных облаков. Это наиболее распространенный тип связи между атомами внутри молекулы. Ковалентная связь намного сильнее нековалентной (например, водородной, гидрофобной, ионной).
- Константная часть антитела
- участок молекулы, который одинаков у всех антител одного изотипа и отвечает за распознавание антитела иммунными клетками.
- Конъюгация
- «сшивание» двух молекул ковалентной связью.
- Лейкемии
- (лейкозы) группа злокачественных заболеваний кроветворной системы. Вместе с лимфомами относятся к онкогематологическим заболеваниям.
- Лимфомы
- группа злокачественных заболеваний лимфатической системы. Вместе с лейкемиями и миеломами относятся к онкогематологическим заболеваниям.
- Линкерная последовательность
- (линкер) цепочка аминокислот, соединяющая два белка.
- Миелома
- злокачественная опухоль, состоящая из плазматических клеток, то есть зрелых В-лимфоцитов, производящих антитела.
- Пептид
- цепочка, состоящая из нескольких аминокислот. Длинные пептиды — это белки.
- Рекомбинантный белок
- белок, полученный в клетках другого вида методом клонирования гена.
- Рецептор
- белковая молекула, которая после связывания сигнальной молекулы (лиганда) запускает каскад событий внутри клетки: это может быть изменение концентраций определенных веществ или переключение состояния каких-либо белков, в конце концов приводящее к изменению экспрессии генов. Рецептор часто находится на поверхности клетки.
- Скрининг
- процесс выбора нужного варианта из множества, например, поиск клона клеток, обладающего нужными свойствами среди множества похожих.
- Специфичность антитела
- способность связываться с нужной мишенью.
- Т-клеточный рецептор
- рецептор, с помощью которого Т-клетка «узнает» антиген, к которому она специфична. Каждая Т-клетка несет только один тип Т-клеточного рецептора. Он связывается с белком главного комплекса гистосовместимости, на поверхности которого находится антигенный пептид.
- Тетравалентный
- способный связывать четыре молекулы (в случае антител, антигенов).
- Фармакокинетика
- поведение молекулы в организме человека: всасывание, распределение в органах и тканях, метаболизм, выведение.
- Цитокин
- растворимый белок, служащий сигналом для клеток иммунной системы. Как правило, действует на клетку через соответствующий рецептор.
- Экспрессия
- процесс реализации генетической информации в клетке, состоящий из этапов транскрипции гена, в результате которой образуется мРНК, и трансляции, в ходе которой рибосомы синтезируют белок в соответствии с информацией, записанной в последовательности мРНК.
- Эффекторы, клетки-эффекторы
- клетки иммунной системы, выполняющие функции уничтожения чужеродных агентов, например, макрофаги, нейтрофилы, цитотоксические Т-лимфоциты, натуральные киллеры (NK-клетки).
Литература
- Биспецифические антитела, их мишени и перспективы применения в современной медицине;
- 12 методов в картинках: иммунологические технологии;
- Антитело: лучший способ распознать чужого;
- Биотехнология антител;
- Christoph Spiess, Qianting Zhai, Paul J. Carter. (2015). Alternative molecular formats and therapeutic applications for bispecific antibodies. Molecular Immunology. 67, 95-106;
- F. Le Gall, U. Reusch, M. Little, S. M. Kipriyanov. (2004). Effect of linker sequences between the antibody variable domains on the formation, stability and biological activity of a bispecific tandem diabody. Protein Engineering Design and Selection. 17, 357-366;
- Jin Hong Kim, Dong Hyun Song, Suk-Jun Youn, Ji Won Kim, Geunyoung Cho, et. al.. (2016). Crystal structures of mono- and bi-specific diabodies and reduction of their structural flexibility by introduction of disulfide bridges at the Fv interface. Sci Rep. 6;
- Roland E. Kontermann, Ulrich Brinkmann. (2015). Bispecific antibodies. Drug Discovery Today. 20, 838-847;
- Julia Stieglmaier, Jonathan Benjamin, Dirk Nagorsen. (2015). Utilizing the BiTE (bispecific T-cell engager) platform for immunotherapy of cancer. Expert Opinion on Biological Therapy. 15, 1093-1099;
- От рака вылечит... верблюд!;
- Gaowei Fan, Zujian Wang, Mingju Hao, Jinming Li. (2015). Bispecific antibodies and their applications. J Hematol Oncol. 8;
- E. A. Rossi, D. M. Goldenberg, T. M. Cardillo, R. Stein, C.-H. Chang. (2009). Hexavalent bispecific antibodies represent a new class of anticancer therapeutics: 1. Properties of anti-CD20/CD22 antibodies in lymphoma. Blood. 113, 6161-6171;
- Chetan Rathi, Bernd Meibohm. (2015). Clinical pharmacology of bispecific antibody constructs. The Journal of Clinical Pharmacology. 55, S21-S28;
- W. Schaefer, J. T. Regula, M. Bahner, J. Schanzer, R. Croasdale, et. al.. (2011). Immunoglobulin domain crossover as a generic approach for the production of bispecific IgG antibodies. Proceedings of the National Academy of Sciences. 108, 11187-11192;
- Christian Klein, Wolfgang Schaefer, Jörg T. Regula. (2016). The use of CrossMAb technology for the generation of bi- and multispecific antibodies. mAbs. 8, 1010-1020;
- Chao-hui Hao, Qian-he Han, Zhong-jie Shan, Jian-ting Hu, Nan Zhang, Xue-pei Zhang. (2015). Effects of different interchain linkers on biological activity of an anti-prostate cancer single-chain bispecific antibody. Theor Biol Med Model. 12;
- U. Reusch, K. H. Harrington, C. J. Gudgeon, I. Fucek, K. Ellwanger, et. al.. (2016). Characterization of CD33/CD3 Tetravalent Bispecific Tandem Diabodies (TandAbs) for the Treatment of Acute Myeloid Leukemia. Clinical Cancer Research. 22, 5829-5838;
- Roeland Lameris, Renée C.G. de Bruin, Famke L. Schneiders, Paul M.P. van Bergen en Henegouwen, Henk M.W. Verheul, et. al.. (2014). Bispecific antibody platforms for cancer immunotherapy. Critical Reviews in Oncology/Hematology. 92, 153-165;
- Nina Jendreyko, Mikhail Popkov, Roger R. Beerli, Junho Chung, Dorian B. McGavern, et. al.. (2003). Intradiabodies, Bispecific, Tetravalent Antibodies for the Simultaneous Functional Knockout of Two Cell Surface Receptors. J. Biol. Chem.. 278, 47812-47819;
- C. Rozan, A. Cornillon, C. Petiard, M. Chartier, G. Behar, et. al.. (2013). Single-Domain Antibody-Based and Linker-Free Bispecific Antibodies Targeting Fc RIII Induce Potent Antitumor Activity without Recruiting Regulatory T Cells. Molecular Cancer Therapeutics. 12, 1481-1491;
- Zu-Jun Sun, Yi Wu, Wei-Hua Hou, Yu-Xiong Wang, Qing-Yun Yuan, et. al.. (2017). A novel bispecific c-MET/PD-1 antibody with therapeutic potential in solid cancer. Oncotarget. 8;
- Ulrich Brinkmann, Roland E. Kontermann. (2017). The making of bispecific antibodies. mAbs. 9, 182-212;
- Clarissa G. Jakob, Rohinton Edalji, Russell A. Judge, Enrico DiGiammarino, Yingchun Li, et. al.. (2013). Structure reveals function of the dual variable domain immunoglobulin (DVD-Ig™) molecule. mAbs. 5, 358-363;
- Maneesh Jain, Neel Kamal, Surinder K. Batra. (2007). Engineering antibodies for clinical applications. Trends in Biotechnology. 25, 307-316;
- Joanne Oates, Namir J. Hassan, Bent K. Jakobsen. (2015). ImmTACs for targeted cancer therapy: Why, what, how, and which. Molecular Immunology. 67, 67-74;
- V. R. Doppalapudi, J. Huang, D. Liu, P. Jin, B. Liu, et. al.. (2010). Chemical generation of bispecific antibodies. Proceedings of the National Academy of Sciences. 107, 22611-22616;
- Fa Yang, Weihong Wen, Weijun Qin. (2016). Bispecific Antibodies as a Development Platform for New Concepts and Treatment Strategies. IJMS. 18, 48.







