Регенеративные войска организма, или сломать нельзя регенерировать
20 марта 2025
Регенеративные войска организма, или сломать нельзя регенерировать
- 527
- 0
- 1
Мезенхимальная стволовая клетка, выпускающая во внеклеточную среду везикулы, восстанавливающие кости.
Рисунок в полном размере.
сгенерировано с помощью нейросети recraft.ai
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Перелом кости — это серьезный стресс и настоящий вызов для организма. В эти трудные для него моменты наши кости способны на настоящие чудеса самовосстановления. Однако силы организма не безграничны в случае особенно серьезных повреждений. Мы задались вопросом: а как «прокачать» мощь регенерации, используя его собственные ресурсы? В этой статье мы расскажем о том, как этот процесс происходит, и сфокусируемся на новом, недавно появившемся подходе к восстановлению костей, его преимуществах и модификациях и надеемся, что наша работа поможет приблизить человечество к моменту в будущем, когда кости будут заживать так же быстро и надежно, как и у супергероев.
Конкурс «Био/Мол/Текст»-2024/2025
 Эта работа заняла второе место в номинации «Своя работа» конкурса «Био/Мол/Текст»-2024/2025.
Эта работа заняла второе место в номинации «Своя работа» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Что такое кости?
Кости — это динамичный каркас организма: в отличие от статичных металлических или деревянных каркасов зданий, они живут, растут и восстанавливаются, адаптируясь к нагрузкам и условиям жизни. Иногда этот каркас может ломаться. В таких случаях запускается регенерация (самовосстановление) — важный процесс, который позволяет «заделать брешь» в нашем организме. Однако кости обладают низкой способностью к самовосстановлению, из-за чего и возникает множество проблем при починке их крупных поломок [1]. Существует понятие критический костный дефект — повреждение, которое не заживает самопроизвольно, если не применить дополнительное воздействие [2]. Лечение таких травм имеет исключительную важность.
Сейчас одним из основных методов лечения костей является остеосинтез — хирургическая операция, которая позволяет добавить новые фрагменты вместо утраченных, например, в результате оскольчатого перелома, и фиксировать оставшиеся отломки в анатомически правильном положении для корректного сращивания кости. В качестве фиксаторов обычно используются механические конструкции, изготавливаемые из биосовместимых материалов.
На данный момент время полного восстановления после перелома при использовании остеосинтеза составляет несколько месяцев и больше, поскольку в силу возраста или других причин темпы заживления могут снижаться (рис. 1), поэтому возникает вопрос: а можем ли мы повлиять на скорость этого процесса, не вызывая отторжения и других побочных эффектов?
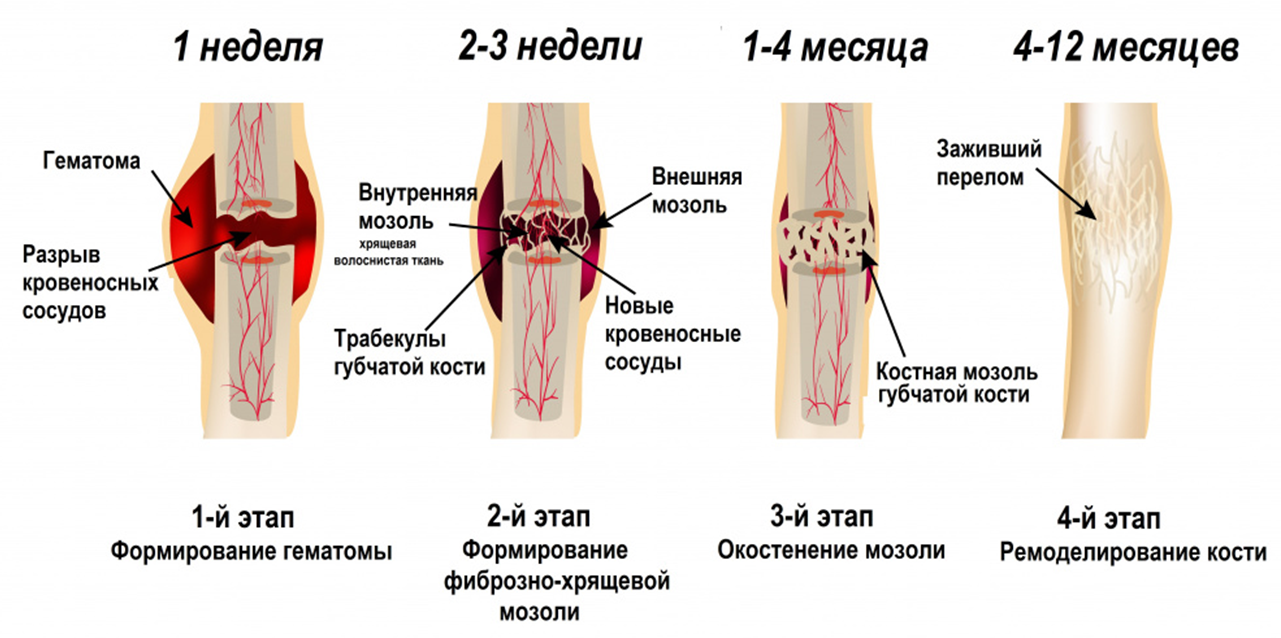
Рисунок 1. Этапы заживления сломанной кости. Воспалительный этап: заживление начинается сразу после перелома. Иммунные клетки выделяют вещества, привлекающие дополнительные клетки и усиливающие приток крови к поврежденной области. Это приводит к воспалению, проявляющемуся в покраснении, отеке и болезненности. Этап восстановления: через несколько дней после травмы начинается формирование костной мозоли, которая вначале мягкая и эластичная, что делает ее уязвимой для повреждений. Этап ремоделирования: сформировавшаяся мозоль кальцифицируется, кость восстанавливается и возвращается к нормальной структуре.
О регенерации
В нашей статье мы расскажем о методе улучшения регенерации костной ткани при остеосинтезе за счет предобработки имплантов (замещающих кость фрагментов) модифицированным децеллюляризированным внеклеточным матриксом мезенхимальных стволовых клеток (чтобы узнать, что значат эти страшные слова, нужно почитать чуть дальше).
Естественные процессы регенерации в нашем организме нацелены на восстановление небольших повреждений, но им трудно справляться с критическими дефектами, поэтому нам стоит подумать над тем, как мы можем им помочь. В организме самовосстановление происходит за счет выделения различными типами клеток определенных биомолекул, которые попадают во внеклеточную среду (матрикс) и подают остальным клеткам сигнал к регенерации.
Применение децеллюляризированного (избавленного от клеток) матрикса мезенхимальных стволовых клеток (дцВКМ МСК) и связанных с ним внеклеточных везикул в качестве покрытия для биосовместимых имплантов костей, хрящей и сухожилий является привлекательной перспективой [1]. Существует множество работ, исследующих и другие вариации на тему покрытий на основе МСК, например, покрытия из самих мезенхимальных клеток [3], из смеси МСК и ВКМ [4], из отдельных белковых компонентов матрикса [5], [6], а также многие авторы заняты поиском оптимального аналога ВКМ [7]. Но дцВКМ имеет ряд преимуществ перед описанными выше вариантами. Он не является клеточным препаратом, что важно с этической точки зрения, не вызывает иммунный ответ при трансплантации и биологически безопасен. А в сравнении с отдельными белками и «заменами», ВКМ, как единая целостная структура, является более природной «подложкой» для регенеративных клеток и обеспечивает эффективное воздействие компонентов МСК на поврежденный участок.
В нашей работе мы хотим понятно и интересно рассказать о свойствах покрытия имплантов децеллюляризированным внеклеточным матриксом для ускорения восстановления костных тканей и улучшения интеграции имплантов, добавить несколько штрихов на картину общего представления читателей о происходящих при этом процессах, а также предложить использование различных модификаций: «омоложения» ВКМ и связывания внеклеточного матрикса с BMP [2], [8–11] — белками, играющими важную роль в костеобразовании. Теперь поговорим подробнее о теоретической составляющей самовосстановления.
Что же такое ВКМ МСК и как он способствует регенерации?
Начнем с того, что такое мезенхимальные стволовые клетки и почему все сейчас их изучают.
Стволовые клетки
Стволовые клетки (СК) — особые клетки организма, обладающие несколькими интересными свойствами. Во-первых, такие клетки способны развиваться в разных направлениях за счет того, что они еще не выбрали свой жизненный путь (не прошли дифференцировку). Во-вторых, СК обладают большим потенциалом к делению, после которого дочерние клетки могут либо оставаться стволовыми, как их родитель, либо сразу же выбирать «профессию» [8].
Выделяют несколько типов стволовых клеток, каждый из которых обладает собственным потенциалом к дифференцировке. Во взрослом организме нет СК, способных сформировать целый организм, но имеются мультипотентные клетки, которые имеют возможность выбрать свою судьбу из нескольких разновидностей клеток, ограниченных одним зародышевым листком, к примеру, мезенхимальным [8].
Мезенхимальные стволовые клетки (МСК) — мультипотентные клетки, обладающие способностью дифференцироваться в клетки костной, хрящевой и жировой тканей (рис. 2). Их называют «биологическими фабриками» из-за их способности продуцировать уникальную комбинацию цитокинов (передатчиков сообщений между клетками), хемокинов (отвечающих за направленное движение и перемещение лейкоцитов), факторов роста (стимуляторов дифференцировки, деления и роста) и других биологически активных веществ (рис. 3). Все это множество сигнальных молекул, производимое клеткой и выделяемое во внеклеточную среду в растворимом виде и во внеклеточных везикулах, и называется секретомом. Именно он занимает центральное место в процессах восстановления тканей, и именно из-за него мезенхимальным стволовым клеткам сейчас достается столько внимания.
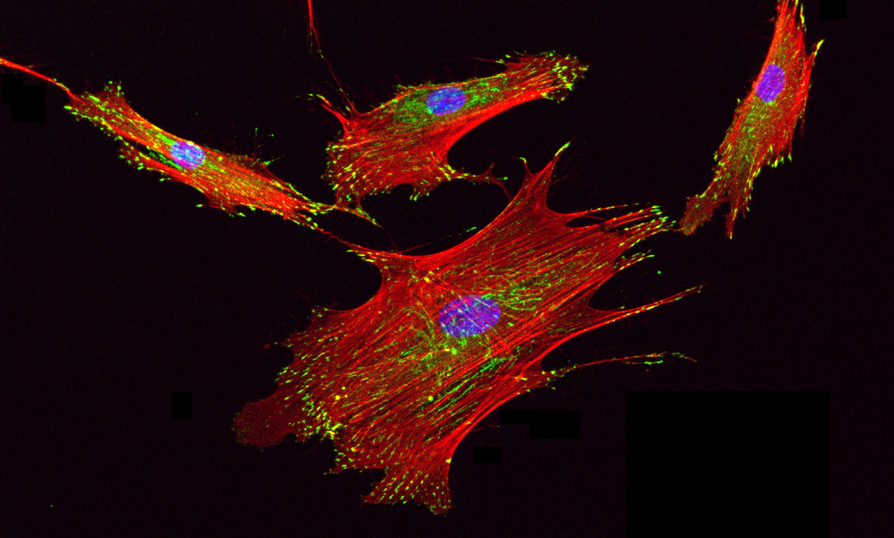
Рисунок 2. Изображение мезенхимальных стволовых клеток человека, полученное на конфокальном микроскопе. Для визуализации произведено иммуноокрашивание: паксиллин (белок клеточной мембраны) — зеленый цвет, обеспечивает прочное соединение клеток с окружающей средой и играют ключевую роль в передаче механических сигналов внутри клеток; ядро — синий цвет; F-актин — красный цвет, основная составляющая актинового цитоскелета, обеспечивающего механическую поддержку клеток, их подвижность и участие в различных клеточных процессах.
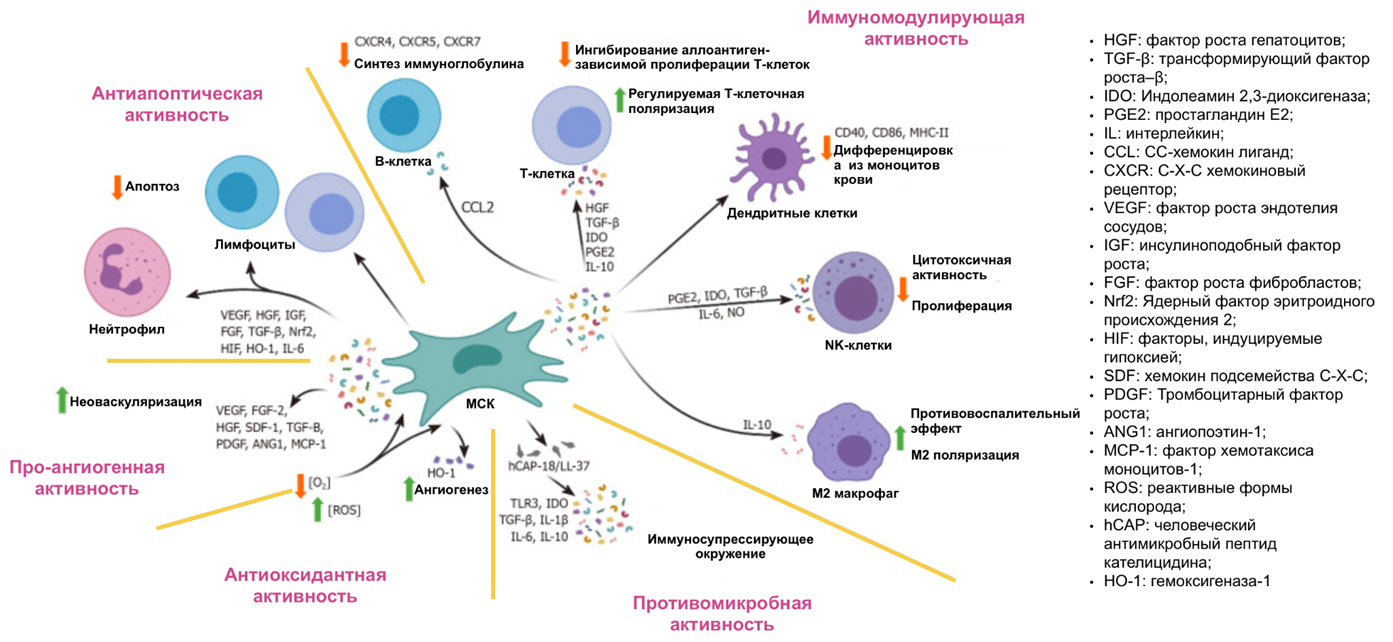
Рисунок 3. Краткое изложение различных растворимых факторов, выделяемых мезенхимальными стволовыми клетками, и их функций. Здесь представлены механизмы, по которым МСК осуществляют активацию процессов в организме: 1) антиапоптическая активность (предотвращение программируемой смерти клеток — апоптоза; 2) про-ангиогенная активность (образование кровеносных сосудов); 3) антиоксидантная активность (замедление окисления); 4) противомикробная активность; 5) иммуномодулирующая активность.
Что их окружает?
Теперь обсудим понятие «внеклеточный матрикс» (ВКМ) — это совокупность большого числа молекул, окружающая клетки в тканях организма и выполняющая опорные, структурные и сигнальные функции (рис. 4). Он состоит из различных белков, полисахаридов и гликопротеинов, которые вместе создают трехмерную структуру, обеспечивающую тканям прочность, упругость и возможность сопротивляться механическим нагрузкам. Подробнее о нем можно прочитать в другой статье на «Биомолекуле» [10].
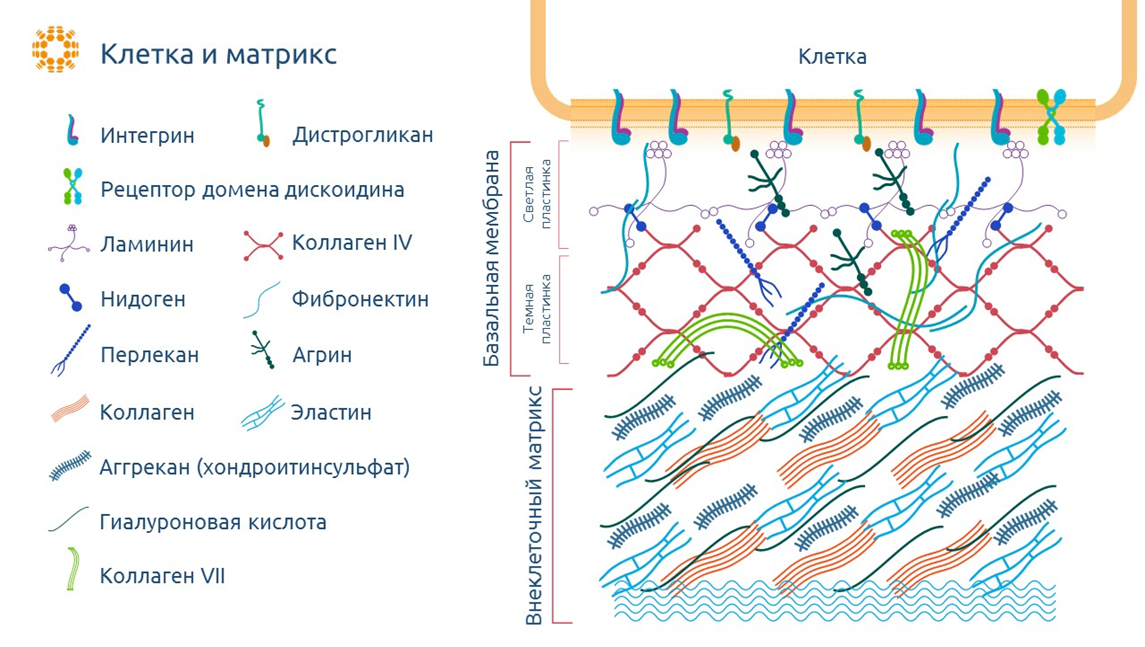
Рисунок 4. Устройство внеклеточного матрикса. Интегрины, дистрогликаны и рецепторы домена дискоидина DDR: клеточные рецепторы, взаимодействующие с внешней средой и передающие различные межклеточные сигналы; ламинин и коллаген 4 типа: белки, формирующие базальную мембрану, обеспечивая механическую поддержку и защиту клеток, связаны белком нидогеном, создают пространственную структуру; фибронектин: участвует в адгезии клеток и формирует мультимерные цепочки, поддерживающие структуру тканей; перлекан: поддерживает эндотелиальный барьер — физиологический барьер между кровеносной системой и ЦНС, защищая нервную ткань от токсинов и вредных микроорганизмов; агрин: ключевой протеогликан в нейромышечном соединении, отвечает за передачу нервных импульсов к мышечным клеткам; коллаген: основной компонент соединительной ткани (сухожилия, кости, хрящи), обеспечивающий прочность и эластичность; эластин: образует белковую сеть, обеспечивающую механическую прочность ткани, формирует пути миграции клеток и изолирует разные ткани друг от друга; аггрекан: связывает воду, гиалуроновую кислоту и белки и формирует осмос, наделяя соединительную ткань устойчивостью к большим нагрузкам; гиалуроновая кислота: участвует в регенерации и обеспечивает вязкость соединительной ткани; коллаген 7 типа: структурный элемент, связывающий дерму и эпидермис в коже, образуя якорные фибриллы.
Внеклеточный матрикс постоянно меняется в течение жизни человека, начиная с эмбрионального периода и далее по мере старения организма. Важно, что со временем процессы перестройки организма уже не происходят, и обновление внеклеточного матрикса значительно замедляется [12]. Это сопровождает старение организма, когда старый матрикс не перестраивается, теряет свои биологические свойства. Накопление необратимых изменений в матриксе делает его неспособным к обновлению.
Напротив, внеклеточный матрикс у эмбрионов или детей раннего возраста помогает клеткам заниматься морфогенезом и формировать сложные структуры, что способствует развитию и росту как всего организма, так и отдельных органов. Есть ряд исследований, в которых было показано, что за счет некоторых уникальных компонентов матрикса у эмбрионов могут восстанавливаться крупные повреждения, которые никогда не восстанавливаются у взрослых [13], [14].
Важной составляющей внеклеточного матрикса являются сигнальные молекулы, выделяемые окружающими клетками. И спектр этих сигнальных молекул напрямую зависит от степени дифференцировки и типа клеток, которые их экспрессируют. Например, некоторые исследования показали, что внеклеточный матрикс задает направление дифференцировки стволовых клеток в специализированные клетки органа, из которого он был взят [11]. Изменение состава ВКМ на имплантах позволит сделать тонкую настройку для конкретного пациента и клинического случая [15].
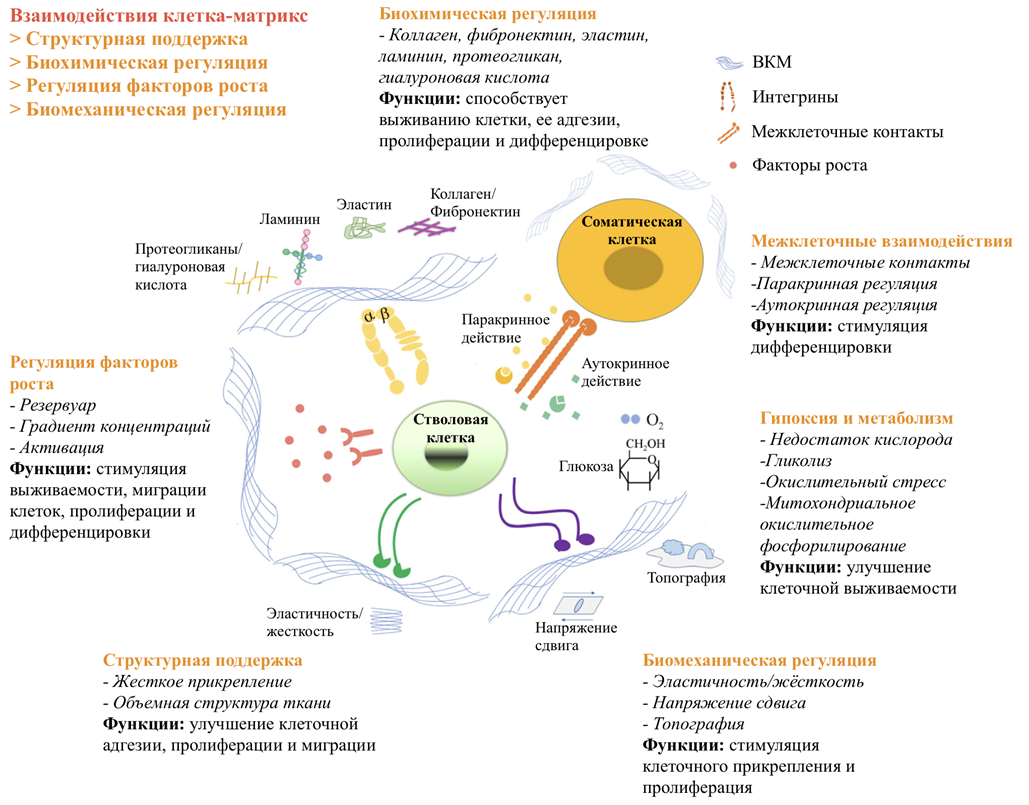
Рисунок 5. Взаимодействие стволовых клеток со своим окружением. При повреждении ткани окружающее микроокружение активно сигнализирует стволовым клеткам о необходимости самообновления или дифференцировки для формирования новых тканей. Методы воздействия СК на свое окружение включают в себя клеточно-матричные, клеточно-белковые, белково-матричные, клеточно-клеточные взаимодействия, гипоксию и метаболизм. Среди них клеточно-матриксные взаимодействия играют ключевую роль в стимулировании клеточной адгезии, миграции, пролиферации и дифференцировки для регенерации тканей. Матрикс регулирует поведение стволовых клеток через структурные белки, биохимическую сигнализацию, индукцию факторов роста и биомеханическую регуляцию во время восстановления тканей.
В большинстве исследований выбор МСК в качестве производителя ВКМ обусловлен тем, что ВКМ взрослых клеток накапливает признаки старения: он становится менее эластичным и более жестким, не обновляется с достаточной регулярностью, хуже передает информацию от клетки к клетке и теряет регенеративную способность, в отличие от ВКМ стволовых клеток [16].
Кроме того, в организме МСК выступают в роли командиров: решают, что, кому и когда следует делать. Их внеклеточный матрикс уникален по своему составу: он содержит в себе растворимые (цитокины, хемокины, факторы роста) и нерастворимые (фибриллы и связанные с ними внеклеточные везикулы) компоненты, способные влиять на состояние и поведение окружающих их клеток. Благодаря связыванию этих биомолекул с рецепторами на поверхности клеток реализуется активация сигнальных путей. Изменение микроокружения МСК может индуцировать их переход в активированное состояние, в котором они или выделяют множество молекул для воздействия на свое окружение, или запускают собственную дифференцировку, способствуя восстановлению тканей (рис. 5).
Что они производят?
Везикулы как компоненты внеклеточного матрикса и их происхождение
Одним из важных компонентов ВКМ являются внеклеточные везикулы (ВВ) [11]. Они представляют собой частицы, окруженные двуслойной мембраной из липидов и содержащие в себе небольшое количество цитозоля без органелл и различные биологические молекулы, в том числе, необходимые для процесса регенерации [17]. Они производятся всеми видами клеток в межклеточное пространство как в здоровом состоянии, так и во время воспалительных процессов [1]. Существуют различные виды внеклеточных везикул в зависимости от их способа образования, размера, содержимого и назначения: экзосомы, микровезикулы, апоптотические тельца (образуются при программируемой смерти клетки) и онкосомы (при раковых заболеваниях) [11]. Для нас интерес представляют именно микровезикулы и экзосомы, и в дальнейшем под внеклеточными везикулами мы будем подразумевать именно их.
Поверхность везикул выполняет не только функцию отделения внутреннего содержимого от матрикса, но и способна содержать обладающие специфическими свойствами молекулы, которые могут быть приобретены от клеток в процессе образования ВВ либо же в результате дальнейших воздействий со стороны ВКМ и клеток. ВВ участвуют во множестве различных биологических процессов и представляют существенный интерес для биомедицины [17].
Процесс образования экзосом состоит из нескольких этапов (рис. 6) [18]. В результате эндоцитоза и впячивания клеточной мембраны внутрь клетки жидкость и внеклеточные компоненты, включая белки, липиды, метаболиты, мелкие молекулы, ионы и, в том числе, везикулы. Далее они могут быть поглощены другой «почкой» плазматической мембраны или аппарата Гольджи, в результате чего образуется ранняя эндосома. Претерпевая некоторые модификации, ранняя эндосома становится поздней эндосомой и мультивезикулярным тельцем. У него есть два пути: слиться либо с лизосомой для дальнейшего разрушения содержимого, либо же с клеточной мембраной для выделения везикул во внеклеточное пространство [1].
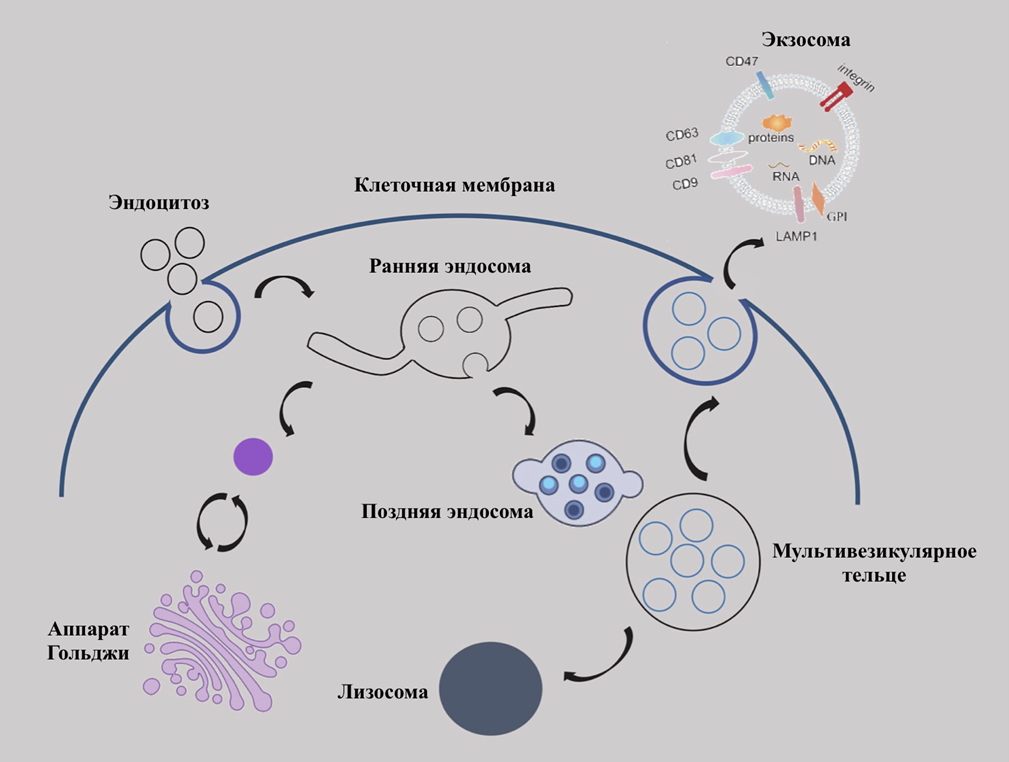
Рисунок 6. Процесс образования внеклеточных везикул. Последовательные этапы: внутриклеточная везикула, ранняя эндосома, поздняя эндосома, мультивезикулярное тельце с последующим высвобождением везикул во внеклеточную среду или разрушением лизосомой.
Изначально предполагалось, что экзосомы служат лишь для удаления метаболитов клетки, однако теперь известно, что они играют различные физиологические и патофизиологические роли [19]. Ключевое знание имеет межклеточный сигналинг. Более подробно о ВВ, их происхождении, классификации можно прочитать в статье [20]. В нашей работе наибольший интерес представляет применение ВКМ МСК и связанных с ним внеклеточных везикул для регенерации костной ткани.
Взаимодействие с клетками и ВКМ
Поверхностные взаимодействия ВВ и клеток имеют исключительное значение: они обеспечивают связывание ВВ с клетками, после чего или осуществляется передача сигнала, или же происходит поглощение везикул клетками. Они могут реализовываться различными способами, в том числе за счет специфического и неспецифического узнавания молекул лигандов рецепторами на поверхности клеток: фосфатидилсерина (важного компонента билипидного слоя) различными клеточными рецепторами (TIM4, RAGE, Bai-1, stabilin-2), а также целого ряда молекул посредством семейства белков интегринов (подробнее в статье [21]) и других рецепторов (рис. 7a) [1].
Многие интегрины способны связывать фибронектин — один из наиболее изучаемых белков, участвующих во взаимодействии везикул и клеток. Он располагается и в ВКМ, и на поверхности везикул, тем самым стабилизируя нахождение ВВ в ВКМ (рис. 7в), и на поверхности клеток, обеспечивая адгезию ВВ к клеткам посредством гепарансульфата (рис. 7г), что важно при использовании имплантов. Механизм непосредственного слияния мембран везикулы и клетки хорошо и подробно описан в статье [22].
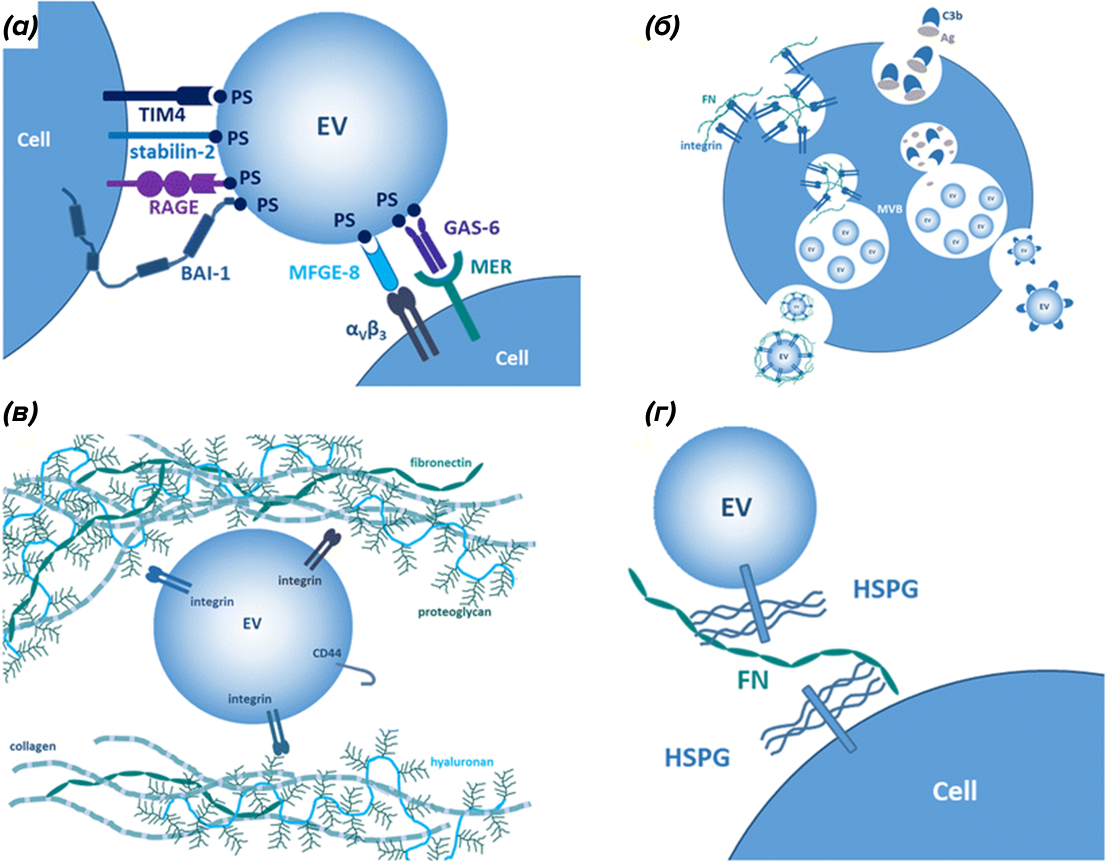
Рисунок 7. Взаимодействие поверхностных молекул везикул с рецепторами клеток и другими молекулами ВКМ. (а) — взаимодействие ВВ (EV) c клетками посредством прямого узнавания фосфатидилсерина (PS) рецепторами (TIM4, stabilin-2, RAGE, BAI-1) и посредством вспомогательных белков — интегрина α5β3 и белков MFGE-8, MER и GAS-6 ; (б) — цикличный процесс адгезии фибронектина (FN) на интегрины и их необходимая ориентация на будущих ВВ с последующим высвобождением везикул; (в) — взаимодействие ВВ посредством интегринов с компонентами ВКМ — фибронектином, протеогликанами, коллагеном, гиалуронаном; (г) — взаимодействие ВВ с гепарансульфатом (HSPG) на поверхности клеток посредством фибронектина (FN).
Содержимое везикул
В процессе образования ВВ внутрь них попадает цитозоль (внутриклеточная жидкость), поэтому внутренний груз имеет состав, характерный для типа клетки, которая производит эти везикулы. Основными компонентами груза являются различные белки (факторы роста и дифференцировки, цитокины, ферменты), липиды, небольшие ионы и нуклеиновые кислоты, которые могут выполнять функцию регуляции экспрессии генов. Например, недавно было показано, что переносимая ВВ miR-126 способствует восстановлению при переломе кости [23]. Однако помимо внутреннего груза, ВВ могут переносить и существенный поверхностный груз, например, компоненты ВКМ, как было сказано выше, а также различные ферменты. Внутренний и поверхностный состав определяет судьбу везикулы: попасть внутрь клетки или же остаться на поверхности.
Хотя ВВ различных типов клеток похожи между собой, все же существуют определенные особенности, отличающие ВВ МСК от ВВ других клеток. Исследование отличий ВВ проводится за счет определения наличия тех или иных белков тетраспанинов(мембранных белков, отвечающих за клеточную адгезию, подвижность и пролиферацию) на поверхности ВВ. К примеру, наличие CD81 и CD63 является общей чертой ВВ. Однако наличие других тетраспанинов может позволить идентифицировать ВВ как везикулы МСК гемопоэтического ряда (CD34 и CD45), либо же МСК костного мозга (CD90, CD44 и CD73), что является наиболее интересным для нас [11], [24].
Внеклеточные везикулы производятся как здоровыми клетками, так и при заболеваниях, при этом их размеры и содержимое варьируются. In vivo клетки производят мало ВВ, которые также содержат относительно мало белковых молекул. Напротив, в условиях in vitro представляется возможным регулировать параметры окружающей среды, стимулировать производство везикул и получать в большом количестве однородные по своим размерам и внутреннему содержанию экзосомы для дальнейшего применения в терапевтических целях [25]. Например, было показано, что создание условий гипоксии in vitro способно увеличивать количество необходимых для терапии веществ (miR-126 для заживления перелома кости) [23].
Применение ВКМ, содержащего ВВ, в регенеративной медицине
Были проведены исследования, в которых продемонстрировано, что ВВ имеют многообещающий потенциал в лечении сердечно-сосудистой недостаточности, неврологических нарушениях и заживлении ран. Для нашего исследования наибольший интерес представляет применение ВВ для лечения костных травм (рис. 8). Например, полученные из остеобластов ВВ способны стимулировать МСК костного мозга дифференцироваться в остеобласты и тем самым улучшать минерализацию кости. На данный момент было продемонстрировано, что децеллюляризованная кость крупных животных обладает остеоиндуктивными свойствами и стимулирует остеогенез в МСК человека [1].
Наконец, мы подошли к рассказу о применении. Как было отмечено ранее, «правильный» состав ВКМ регулирует фенотип окружающих имплант клеток. Такой ВКМ может уменьшать миофибробластный фенотип соседних клеток, определять микроокружение вокруг импланта, чтобы он не воспринимался организмом как что-то инородное. Основная задача покрытия импланта ВКМ заключается в том, чтобы он мог эффективно интегрироваться в организм пациента и замещать критические дефекты без побочных эффектов.
Наше решение заключается в следующем: для каждого отдельного пациента, в зависимости от причины повреждения и его размеров (а также многих дополнительных параметров) создается уникальная модель импланта из титанового сплава (наиболее подходящего и распространенного материала для имплантов на сегодняшний день). Затем эта модель целиком покрывается МСК самого пациента или же клетками из банка клеток внутри биореактора.
Далее возможны две модификации. Первая: после покрытия импланта клетками поверхность обрабатывается составом для «омоложения» и происходит децеллюляризация, или же вторая: сначала имплант избавляется от клеток, а потом происходит сшивка ВКМ с морфогенетическими костными белками (2–7). Готовый имплант с модифицированным покрытием из дцВКМ МСК транспортируется в клинику и посредством операции устанавливается в место дефекта.
Пока что такая технология не применялась на практике, и ей необходимо пройти лабораторные и клинические испытания, но мы считаем, что она позволит значительно ускорить и упростить процессы восстановления.
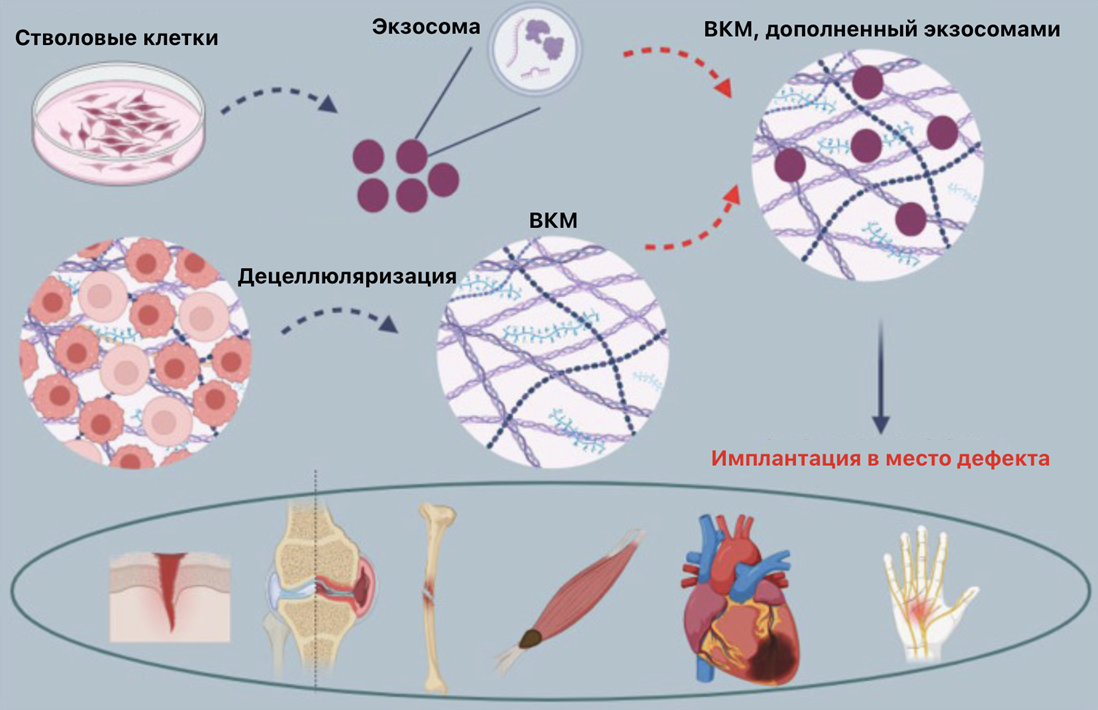
Рисунок 8. Применение дцВКМ в лечении повреждений различных органов. Поэтапно, сверху, выращивание МСК in vitro, сбор ВВ ВКМ, нанесение на дцВКМ и имплантация.
Преимущества использования ВКМ
Все этические и биологические правила регулируют использование клеток в терапии заболеваний. Использование эмбрионов для восстановления организма официально запрещено во многих странах, а использование взрослых стволовых клеток очень ограничено.
Что не скажешь про внеклеточный матрикс, которым можно покрывать импланты, их применение никак не регулируется законодательством. Возможно «программировать» и «омолаживать» окружающие клетки через «молодой» внеклеточный матрикс. Если использовать внеклеточный матрикс стволовых клеток эмбриона, можно увеличить способность к восстановлению в разы, причем ни один эмбрион при этом не пострадает [26].
У использования внеклеточного матрикса как материала для покрытия имплантов есть несколько ключевых преимуществ:
- Такие импланты не будут содержать клетки, а значит, биобезопасны и не регулируются законом по БМКП (биомедицинский клеточный продукт).
- Возможно найти универсальных доноров с усиленными прорегенеративными свойствами внеклеточного матрикса и использовать их как фабрики для покрытия имплантов.
- Возможно длительное хранение таких покрытий в лиофилизированном или замороженном виде. Для кратковременного хранения и транспортировки возможно использование специальных стабилизирующих жидкостей.
- Биосовместимые компоненты внеклеточного матрикса и связанные с ним экзосомы обеспечивают ускорение и улучшение интеграции импланта, снижают формирование фиброзной капсул в вокруг.
- Возможность накопления готовых покрытых имплантов в биологических банках дает возможность при необходимости использовать любое нужное количество материала для реконструкции повреждения.
- Процедура покрытия имплантов не требует высокой квалификации к сотрудникам лаборатории и может проводиться в любой биомедицинской лаборатории, работающей с клетками человека.
- Покрытие внеклеточным матриксом устойчиво к механическим воздействиям и не теряется в ходе процедуры имплантации пациенту.
В зависимости от происхождения ВКМ и способа его обработки возможно сохранение связанных с ним внеклеточных везикул (экзосом). Такие экзосомы могут связывать молекулы фибронектина, через интегрины на своей поверхности. Биологически активные компоненты экзосом способны регулировать процессы регенерации в области имплантации и локально омолаживать клетки.
Наши предварительные результаты
Сейчас мы находимся в начале пути нашего исследования, и было сделано несколько первых шагов в направлении конечного результата. Самое интересное и увлекательное еще предстоит осуществить, но давайте скажем пару слов о том, что уже получилось.
Чтобы проверить работоспособность вышеописанного метода, мы должны провести эксперимент по оценке регенеративной способности, а для этого нужно покрыть имплантат из биосовместимого материала (сплава Ti6Al4V, который является распространенным материалом для имплантов и протезов) внеклеточным матриксом МСК.
Прежде всего необходимо посадить стволовые клетки на поверхность имплантата, чтобы обеспечить их адгезию и пролиферацию. Затем, после достижения необходимой плотности клеток и степени их прикрепления, имплант перемещается в новую неадгезивную чашку Петри. Это способствует предотвращению роста клеток на поверхности чашки и не дает им «сбегать» с импланта.
Далее производится окрашивание ядер живых клеток флуоресцентным красителем Hoechst 33342, что позволяет визуализировать их под флуоресцентным микроскопом и убедиться в их наличии и равномерном распределении по поверхности импланта (рис. 9).
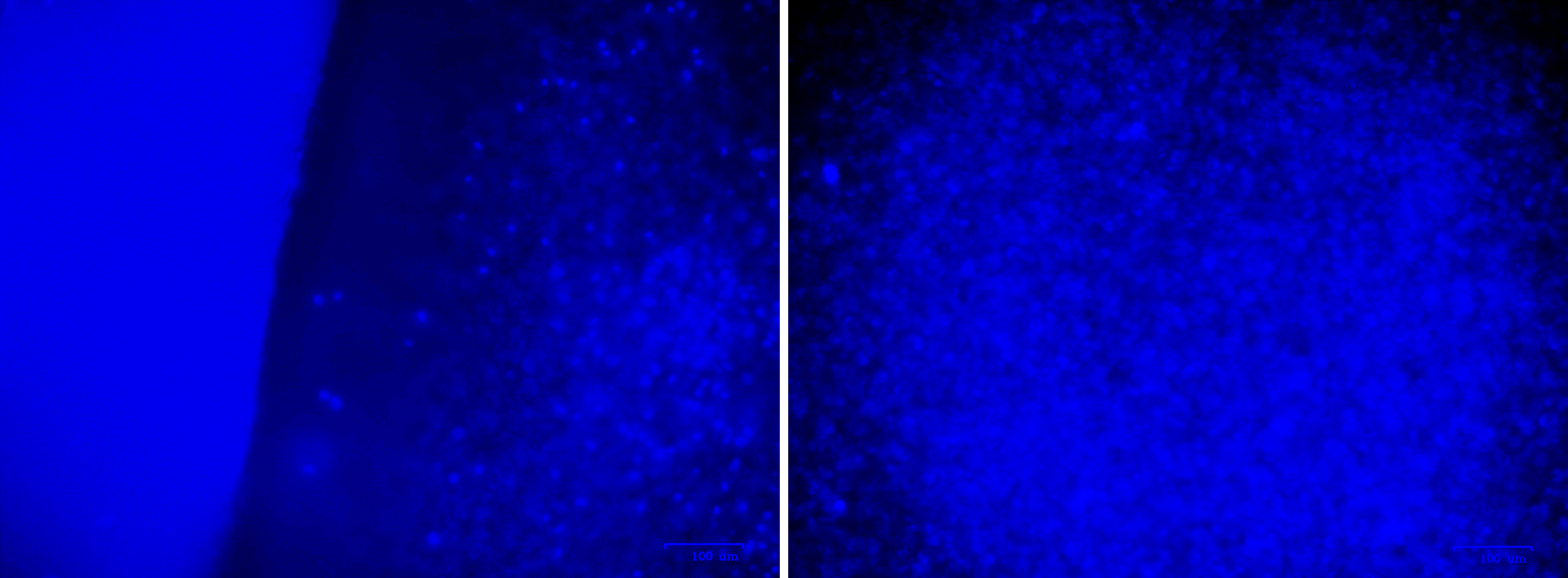
Рисунок 9. Поверхность костного импланта из сплава Ti6Al4V, покрытая культурой МСК 174H (синие точки). Ядра живых клеток окрашены Hoechst 33342 по протоколу производителя. Фотографии сделаны на флуоресцентном микроскопе ZOE. На левой фотографии можно наблюдать границу импланта.
фото автора
Следующим этапом является децеллюляризация — удаление клеточных элементов с имплантата, после которой в качестве покрытия остается только внеклеточный матрикс. Затем, чтобы более точно и детально оценить характеристики покрытия ВКМ на микроуровне, образец был исследован с помощью сканирующей электронной микроскопии (СЭМ) (рис. 10). Чистая поверхность импланта образована гладкой пористой структурой (сплав), к которой прикрепляется ВКМ, представленный агрегатами белков (зеленый круг). Видно, что далеко не вся поверхность импланта покрыта ВКМ. Скорее всего, это связано с особенностью данного протокола децеллюляризации и недостаточным количеством ВКМ. Сейчас в работе находятся новые импланты с клетками, в питательную среду которых добавлена аскорбиновая кислота, улучшающая выработку коллагена.

Рисунок 10. Изображения поверхности импланта из сплава Ti6Al4V, полученные с помощью СЭМ при разном увеличении. (а), (б) — фотографии контроля (чистого импланта без покрытий). (в), (г) — фотографии импланта, покрытого внеклеточным матриксом МСК 174Н. Зеленый круг — элементы ВКМ, представленные агрегатами белков.
фото автора
Планы на будущее
Процедура покрытия импланта внеклеточным матриксом не так сложна в осуществлении, но ее еще предстоит отработать для повышения количества белковых агрегатов на имплантах. Также в дальнейшем будет реализована проверка эффективности возможных модификаций такого покрытия. Как было отмечено ранее, ВКМ каждого пациента различен, и с возрастом его регенеративный потенциал теряется [27]. Существует возможность восстановления регенеративной способности матрикса за счет его предобработки специальными составами, запускающих «омоложение» [28]. Для этого используются различные коктейли из малых молекул.
Чтобы понять, действительно ли в составах обычного и омоложенного ВКМ есть какие-то различия, будет проведен следующий эксперимент: возьмем два импланта, покрытых МСК от одной клеточной линии, и обработаем один из них «эликсиром молодости», а после проведем децеллюляризацию. Затем посадим МСК на ВКМ и спустя некоторое время посмотрим на изменение в активности генов этих клеток, проведя ПЦР в реальном времени на экспрессию ключевых генов, связанных с процессами фиброза и остеогенеза [29].
Помимо проверки регенеративного потенциала «омоложенного» ВКМ МСК, мы хотим реализовать еще несколько усовершенствований такого покрытия: связывать компоненты внеклеточного матрикса со слитыми белками BMP (bone marrow proteins) [2], [8–11], которые являются одной из основных групп морфогенетических сигнальных белков, воздействующих на образование костных и хрящевых тканей. Присутствие этих белков будет способствовать улучшению остеоинтеграции и остеогенеза прилегающих тканей [30].
Сейчас уже существует несколько лекарственных препаратов на основе BMP (OP-1 Implant, InFUSE, InductOs, Novosis), преимущественно используемых в стоматологии [31]. Активация восстановления этим белком занимает достаточно много времени, поэтому обычно его локализуют в месте дефекта посредством интеграции в имплант, откуда BMP постепенно поступает к месту перелома для улучшения остеогенеза. При таком подходе могут возникать побочные эффекты: раздражение кожи и мышечной ткани. Мы предполагаем, что использование сочетания BMP и ВКМ может преодолеть эту проблему и демонстрировать более действенный и безопасный результат.
Мы видим большие перспективы в использовании дцВКМ МСК в качестве покрытия костных имплантов. Этот подход уже доказал свою эффективность, и исследование его модификаций может оказать значительное влияние на успехи в регенеративной медицине. Поэтому мы продолжим думать и экспериментировать, чтобы обеспечить человечеству лучшее, более светлое и здоровое будущее!
Литература
- Shima Rahmati, Mozafar Khazaei, Zahra Abpeikar, Arghavan Soleimanizadeh, Leila Rezakhani. (2024). Exosome-loaded decellularized tissue: Opening a new window for regenerative medicine. Journal of Tissue Viability. 33, 332-344;
- Schmitz J., Hollinger J. (1986). The critical size defect as an experimental model for craniomandibulofacial nonunions. Clin Orthop Relat Res. 205, 299–308;
- Yi Wu, Xuan Li, Shaopeng Liu, Ruichen Ma, Peng Liu, Kaiyong Cai. (2024). Modified implant with dual functions of antioxidant and extracellular matrix reconstruction for regulating MSCs senescence. Applied Materials Today. 40, 102420;
- Asha Shekaran, Alan Lam, Eileen Sim, Lee Jialing, Li Jian, et. al.. (2016). Biodegradable ECM-coated PCL microcarriers support scalable human early MSC expansion and in vivo bone formation. Cytotherapy. 18, 1332-1344;
- Fei Tan, Mohamed Al-Rubeai. (2019). Customizable Implant-specific and Tissue-Specific Extracellular Matrix Protein Coatings Fabricated Using Atmospheric Plasma. Front. Bioeng. Biotechnol.. 7;
- Bill Zhang, Damian Myers, Gordon Wallace, Milan Brandt, Peter Choong. (2014). Bioactive Coatings for Orthopaedic Implants—Recent Trends in Development of Implant Coatings. IJMS. 15, 11878-11921;
- Yvonne Förster, Sabine Schulze, Anja Penk, Christin Neuber, Stephanie Möller, et. al.. (2020). The influence of different artificial extracellular matrix implant coatings on the regeneration of a critical size femur defect in rats. Materials Science and Engineering: C. 116, 111157;
- Ствол и ветки: стволовые клетки;
- Alberto González-González, Daniel García-Sánchez, Monica Dotta, José C Rodríguez-Rey, Flor M Pérez-Campo. (2020). Mesenchymal stem cells secretome: The cornerstone of cell-free regenerative medicine. WJSC. 12, 1529-1552;
- Что такое внеклеточный матрикс и почему его все изучают;
- Edit I. Buzás, Eszter Á. Tóth, Barbara W. Sódar, Katalin É. Szabó-Taylor. (2018). Molecular interactions at the surface of extracellular vesicles. Semin Immunopathol. 40, 453-464;
- Maryam Rahmati, Giovanna Nalesso, Ali Mobasheri, Masoud Mozafari. (2017). Aging and osteoarthritis: Central role of the extracellular matrix. Ageing Research Reviews. 40, 20-30;
- Madalena Lopes Natário Pinto Gomes, Paul A.J. Krijnen, Esther Middelkoop, Hans W.M. Niessen, Bouke K.H.L. Boekema. (2025). Fetal Skin Wound Healing: Key Extracellular Matrix Components and Regulators in Scarless Healing. Journal of Investigative Dermatology. 145, 280-302;
- Iris Ribitsch, Andrea Bileck, Monika Egerbacher, Simone Gabner, Rupert L. Mayer, et. al.. (2021). Fetal Immunomodulatory Environment Following Cartilage Injury—The Key to CARTILAGE Regeneration?. IJMS. 22, 12969;
- Chuanqi Liu, Ming Pei, Qingfeng Li, Yuanyuan Zhang. (2022). Decellularized extracellular matrix mediates tissue construction and regeneration. Front. Med.. 16, 56-82;
- Agnieszka J Turlo, Dean E Hammond, Kerry A Ramsbottom, Jamie Soul, Alexandra Gillen, et. al.. (2023). Mesenchymal Stromal Cell Secretome Is Affected by Tissue Source and Donor Age. Stem Cells. 41, 1047-1059;
- Laura Ann Mulcahy, Ryan Charles Pink, David Raul Francisco Carter. (2014). Routes and mechanisms of extracellular vesicle uptake. J of Extracellular Vesicle. 3;
- Shima Rahmati, Mozafar Khazaei, Zahra Abpeikar, Arghavan Soleimanizadeh, Leila Rezakhani. (2024). Exosome-loaded decellularized tissue: Opening a new window for regenerative medicine. Journal of Tissue Viability. 33, 332-344;
- Douglas D. Taylor, Cicek Gercel-Taylor. (2013). The origin, function, and diagnostic potential of RNA within extracellular vesicles present in human biological fluids. Front. Genet.. 4;
- Экзосома — механизм координации и взаимопомощи клеток организма;
- Клетки под давлением;
- Преодолевая барьеры (как объединить необъединимое);
- Wei Liu, Linwei Li, Yuluo Rong, Dingfei Qian, Jian Chen, et. al.. (2020). Hypoxic mesenchymal stem cell-derived exosomes promote bone fracture healing by the transfer of miR-126. Acta Biomaterialia. 103, 196-212;
- Teresa L. Ramos, Luis Ignacio Sánchez-Abarca, Sandra Muntión, Silvia Preciado, Noemí Puig, et. al.. (2016). MSC surface markers (CD44, CD73, and CD90) can identify human MSC-derived extracellular vesicles by conventional flow cytometry. Cell Commun Signal. 14;
- Valeriia Syromiatnikova, Angelina Prokopeva, Marina Gomzikova. (2022). Methods of the Large-Scale Production of Extracellular Vesicles. IJMS. 23, 10522;
- Щадящие стволовые клетки;
- Olivia S. Beane, Vera C. Fonseca, Leroy L. Cooper, Gideon Koren, Eric M. Darling. (2014). Impact of Aging on the Regenerative Properties of Bone Marrow-, Muscle-, and Adipose-Derived Mesenchymal Stem/Stromal Cells. PLoS ONE. 9, e115963;
- Jae-Hyun Yang, Christopher A. Petty, Thomas Dixon-McDougall, Maria Vina Lopez, Alexander Tyshkovskiy, et. al.. (2023). Chemically induced reprogramming to reverse cellular aging. Aging. 15, 5966-5989;
- 12 методов в картинках: полимеразная цепная реакция;
- Liwei Zhu, Yuzhe Liu, Ao Wang, Zhengqing Zhu, Youbin Li, et. al.. (2022). Application of BMP in Bone Tissue Engineering. Front. Bioeng. Biotechnol.. 10;
- V. S. Kuznetsova, A. V. Vasilyev, T. B. Buharova, D. V. Goldshtein, A. A. Kulakov. (2019). Safety and efficacy of BMP-2 and BMP-7 use in dentistry. Stomat.. 98, 64.